一类对糖尿病具有潜在治疗活性的化合物的制作方法
本发明涉及药物化学和药物治疗学领域,具体涉及单独或组合用于治疗和/或预防糖尿病及相关性疾病。更具体涉及一系列下式所示化合物及其制备方法和药物学上可接受的盐或药物学上可接受的溶剂化物等。
背景技术:
糖尿病(Diabetes Mellitus)是一种由多种病因引起的以失控的慢性高血糖为主要特征,并伴随多种并发症的代谢性疾病,主要是由于胰岛素分泌不足和(或)作用功能缺陷所引起。糖尿病严重威胁着人类的生命健康,目前尚无根治糖尿病的方法,所以糖尿病患者只能选择通过持续药物治疗以稳定体内的血糖水平,这就给患者的家庭以及社会带来了沉重的经济负担。
糖尿病主要可分为I型糖尿病、II型糖尿病、妊娠期糖尿病以及其他类型的糖尿病,其中II型糖尿病患者占了90%以上。目前治疗II型糖尿病除了注射胰岛素外,主要靠口服药物治疗。传统的口服降糖药物有:(1)胰岛素增敏剂,如吡格列酮;(2)磺酰脲类,如格列美脲;(3)双胍类,如二甲双胍;(4)a-葡萄糖苷酶抑制剂,如阿卡波糖;(5)餐时血糖调节剂,如瑞格列奈。由于传统降糖药物副作用较多,其中低血糖反应和体重增加这两方面尤为明显,因此限制了患者长期用药。人们通过大量试验研发出了疗效更好,副作用更少的新型降糖药物-肠促胰岛素增效剂,包含胰高血糖素样肽-1(Glucagon-1ike peptide 1,GLP-1)类似物以及二肽基肽酶-4(Dipeptidyl peptidase IV,DPP-4)抑制剂。目前肠促胰岛素增效剂已成为全球II型糖尿病治疗药物研发的热点之一。
本发明基于上述口服抗糖尿病药物基础上,为了进一步提高疗效,降低副作用,寻找更好的药物,提出以下的发明。
技术实现要素:
本发明的目的是下式所示的化合物及其制备方法与在糖尿病及其相关性疾病方面的治疗应用。
在上式结构中,其中X可为:氢、烃基、卤素、羟基、烃氧基、酰氧基、醛基、酰基、硝基、氨基、烃氨基、羧基、酰卤基、酰氧酰基、酯基、酰胺基、氰基、胍基、脒基、叠氮基、无机酸酯基等基团(其中n大于或等于0)。Y可是:杂原子、1、2-亚乙烯基、亚甲基或无原子等。Z:可取代在金刚烷环的2、3、4位上,Z可以为氢、烃基、卤素、羟基、烃氧基、酰氧基、醛基、酰基、硝基、氨基、烃氨基、羧基、酰卤基、酰氧酰基、酯基、酰胺基、氰基等常见有机基团。
进一步,X具体可以是卤素、羟基、烃氧基、酰氧基、酰基、氨基、烃氨基、羧基、酯基、酰胺基、氰基、叠氮基、无机酸酯基等基团。Y具体可以是杂原子、亚甲基等。Z可取代在金刚烷环的3位上,Z具体可以是卤素、羟基、烃氧基、酰氧基、酰基、硝基、氨基、烃氨基、羧基、酯基、酰胺基、氰基等。
再进一步,X更具体是卤素、羟基、氨基、羧基、氰基、叠氮基、无机酸酯基等基团。Y具体可以是杂原子等。Z可取代在金刚烷环的3位上,Z具体可以是卤素、羟基、硝基、氨基、羧基、氰基等。
更进一步,X更具体是卤素、叠氮基等基团。Y具体可以是氧、氮原子等。Z可取代在金刚烷环的3位上,Z具体可以是羟基、硝基、羧基等。
一个具体的化合物实例CMD-05-151013可描述为,但并不是局限于该实例,其中Z取代在金刚烷环的3位上,Z是OH,X是氯(其中n等于3),Y是亚甲基。
关于该类化合物的制备方法,以金刚烷胺为起始原料,与(S)-1-氯乙酰基-2-氰基吡咯烷反应,制备得到氨基单取代的金刚烷胺,然后对金刚烷环取代并继续与相应酰氯或活化酯反应,制备得到目标化合物。以及本专业技术人员所具有的专业知识能够完成的其它相应的可替代的制备方法。这里提出一个制备方法实例,但并不是局限于该实例。
以盐酸金刚烷胺为起始原料,用混酸及氢氧化钾为试剂,对金刚烷胺环的3位进行羟基化,得到金刚烷氨醇;金刚烷氨醇再与(S)-1-氯乙酰基-2-氰基吡咯烷反应,制备得到氨基单取代的金刚烷氨醇,然后继续与5-氯戊酰氯反应,制备得到目标化合物CMD-05-151013。以及其它相应可替代的制备方法。
本发明研究发现上述化合物可以用于高脂饮食联合STZ腹腔注射诱导的SD大鼠2型糖尿病的治疗。
作用机制可能涉及多个靶点,包括①抑制DPPIV酶活性,减少DPPIV酶对GLP-1的分解,增加血浆GLP-1的浓度;②直接促进GLP-1的释放,增加血浆GLP-1的浓度;③通过增加GLP-1浓度,改善胰岛细胞形态和功能,促进胰岛素的释放,从而发挥降低血糖的作用。
本发明研究显示上述化合物在体外试验:可显著抑制STZ诱导的体外培养大鼠胰岛细胞株INS-1的凋亡,促进INS-1细胞的增殖,同时该化合物能够有效促进人肠道内分泌细胞株NCI-H716中GLP-1的释放。
本发明研究显示上述化合物体内试验包括:①通过大鼠口服糖耐量试验可知,该化合物能有效降低大鼠口服葡萄糖后的曲线下面积,口服4.5mg/kg该化合物AUC降低幅度为51.35%,相同摩尔浓度对应的维格列汀剂量为3mg/kg,AUC降低幅度为47.59%,得出该化合物略优于维格列汀(见图1)。
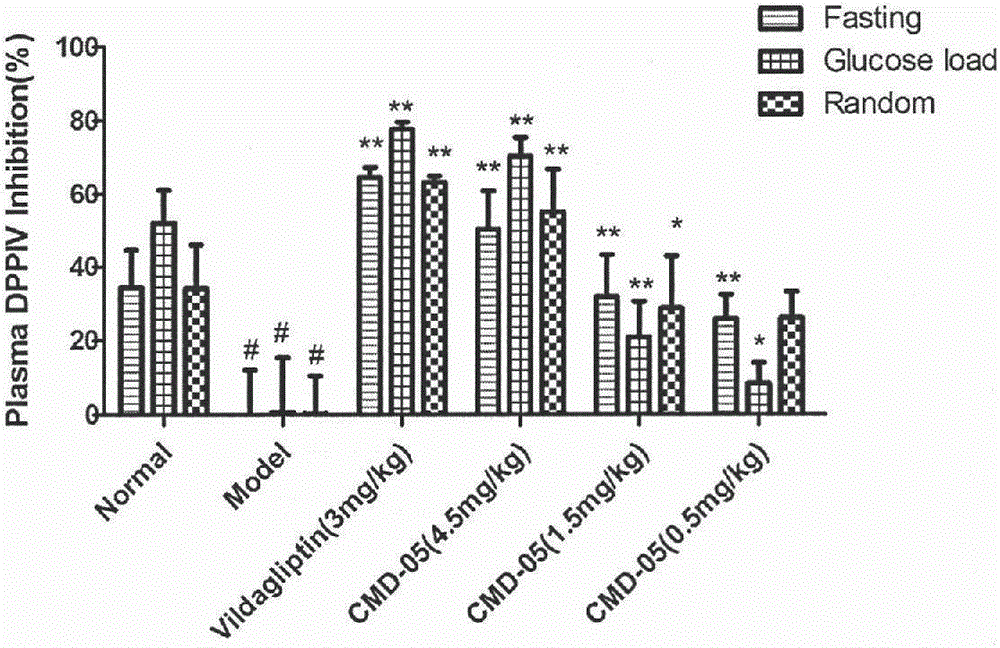
②通过检测大鼠空腹血浆,糖负荷血浆和随机血浆中的DPPIV活性可知,该化合物能有效抑制血浆中DPPIV酶活性,口服4.5mg/kg后空腹血浆,糖负荷血浆,随机血浆中的抑制率分别为50%,70%,55%,相应的3mg/kg的维格列汀的抑制率分别为65%,75%,60%,两者相比不具有统计学差异(见图2)。
③通过检测大鼠空腹血浆,糖负荷血浆和随机血浆中的GLP-1浓度和胰岛素浓度可知,该化合物能提高血浆中GLP-1的含量和胰岛素的浓度,并具有统计学意义(见图3)。
④通过检测大鼠随机血浆中的糖化血红蛋白含量可知,该化合物能降低大鼠血浆中的糖化血红蛋白含量,能降低1.5%-2%,维格列汀能降低1%-2%(见图4)。
⑤通过检测大鼠血浆中总胆固醇,甘油三脂,低密度脂蛋白含量可知,该化合物能有效降低大鼠血浆中的甘油三酯,低密度脂蛋白含量,且具有统计学差异(见图5)。
⑥通过HE染色,免疫荧光染色,Tunnel染色观察,该化合物能明显改善T2DM模型鼠的胰岛破坏,修复胰岛细胞,降低胰高血糖素的表达,减少模型组胰岛细胞的凋亡。
而且,毒性试验显示293细胞株的活力抑制率为10%时,CMD-05的浓度大于1*10-4M,维格列汀的浓度大于1*10-4M;HT22细胞株的活力抑制率为10%时,CMD-05的浓度大于等于3*10-5M,维格列汀的浓度大于1*10-5M;LO-2细胞株的活力抑制率为10%时,CMD-05的浓度大于等于1*10-4M,维格列汀的浓度大于1*10-5M。以上结果提示该化合物具有较小的细胞毒性,且相比于维格列汀,细胞毒性小于维格列汀。在给予昆明小鼠单剂量口服2g/kg该化合物后,15天内小鼠无任何不良反应,无死亡现象。
上述结果说明我们发现的该类化合物有显著的抗糖尿病作用,且毒性低。
本发明的目的,在于提供一种药物及其组合物其特征在于,含有有效量的上述化合物,以及药学上可接受的载体或赋形剂等制成的各种剂型及其与其它相关药物的组合物。
附图说明
图1是各组大鼠在第1天,第19天和第29天OGTT曲线下的面积图
图2是各组大鼠空腹,糖负荷和随机血浆中DPPIV的抑制率图
图3是各组大鼠空腹,糖负荷和随机血浆中GLP-1的含量(A)和胰岛素的水平(B)图
图4是各组大鼠空腹,糖负荷和随机血浆中的糖化血红蛋白含量图
图5是各组大鼠随机血浆中的总胆固醇(A),甘油三脂(B),低密度脂蛋白含量(C)图
具体实施方式
通过下列的具体实施例可进一步理解本发明,但它们不构成对本发明内容的限制。在本发明的上述前提下对本发明属于本专业技术人员的专业知识可获得的延伸扩展内容应该都在本发明要求保护的范围中。
实施例1
CMD-05-151013的制备:
38ml的98%浓硫酸与4ml的65%浓硝酸在冰浴下混合冷却,向该混酸中分次加入3.75克盐酸金刚烷胺,冰浴下搅拌反应3小时;加入碎冰60克,搅拌0.5小时;再加入适量氢氧化钾固体,调节pH值至12-13,冰浴下搅拌反应2小时;抽滤,滤液用浓盐酸调节pH值至8-9,浓缩至干;加入80ml无水乙醇回流1小时,放冷,抽滤,滤液浓缩至干;再加入10ml混合液(丙酮∶乙酸乙酯=3∶1)回流1小时,冰浴下放置,抽滤,得3-氨基金刚烷醇固体3.2克,熔点大于256℃。
将3克3-氨基金刚烷醇、0.25克碘化钾、10克碳酸钾加入到30ml四氢呋喃中搅拌升温至40℃,保持该温度下缓慢滴加3克(S)-1-氯乙酰基-2-氰基吡咯烷溶解在30ml四氢呋喃的溶液,约1.5小时滴完。滴毕,保温40℃反应1小时后,升温至回流反应2小时。回流结束,趁热过滤,滤饼用少量四氢呋喃洗涤,合并滤液,浓缩至油状物。油状物加入适量丁酮溶解,放置析晶,过滤,干燥得氨基单取代的金刚烷氨醇固体4克,熔点147-149℃。HPLC归一化法测定纯度为98.1%,IR、NMR等结构表征符合要求的结构。
在反应瓶中加入5g上述氨基单取代的金刚烷氨醇、0.2克DMAP、15g碳酸钾加入100ml无水四氢呋喃搅拌。将5ml 5-氯戊酰氯溶于50ml四氢呋喃,冰浴下缓慢滴加到反应液中,滴加完毕后升温搅拌回流,TLC监控(展开剂:乙酸乙酯∶甲醇=10∶1)。反应完毕后趁热过滤,滤饼用适量四氢呋喃洗涤,合并滤液,减压浓缩后得到油状液,向油状液中加入甲醇重结晶得到CMD-05-151013白色固体。mp:158-161℃。HPLC归一化法测定纯度为95%,IR、NMR等结构表征符合要求的结构。
实施例2
CMD-05-151013的体外细胞实验:①该化合物对肠系L细胞释放GLP-1的影响:培养人肠系L细胞株NCI-716,实验前两天,细胞以1*106个/ml铺在基质胶包被的12孔板中,加入含有10%FBS的DMEM进行培养。48h后,将细胞上清液吸出,用含0.2%BSA的KRB缓冲液清洗后,加入含药KRB缓冲液(PH7.2)1ml,于37℃孵育2h,吸取上清加50ug/ml的PMSF,存于-80℃。采用ELISA试剂盒检测培养基中GLP-1的浓度;②该化合物对大鼠胰岛细胞的增殖作用:接种大鼠胰岛细胞INS-1于96孔板中,铺板密度为1*105个/ml,孵育24h后替换培养基,加入终浓度为3*10-4,1*10-4,3*10-5,1*10-5,3*10-6,1*10-6,3*10-7,1*10-7,3*10-8,1*10-8的含药培养基继续孵育24h,然后每孔加入CCK-810ul,继续培养2h,水平摇床震荡10s,在450nm处测定OD值;③该化合物对STZ诱导大鼠胰岛细胞的抗凋亡作用:将INS-1细胞按3*104个/ml接种到6孔板上培养24h后同时加入终浓度为10-5,10-6,10-7M的该化合物和3mM的STZ缓冲液,继续培养36h后收集细胞,PBS重悬,流式细胞分析仪分析细胞凋亡。
实施例3
CMD-05-151013的体内实验:①对正常大鼠的作用:选取200g左右SD雄性大鼠25只,随机分为5组:维格列汀组(3mg/kg),CMD-05(4.5mg/kg),CMD-05(1.5mg/kg),CMD-05(0.5mg/kg),溶剂对照组。做口服糖耐量实验时,测空腹血糖后灌胃给予药物,30min后测血糖并灌胃给予25%的葡萄糖水溶液,在灌胃给予葡萄糖水溶液后30min,60min,120min测血糖。测定糖负荷血浆中的GLP-1,Insulin,DPPIV时,灌胃给予各组药物30min后灌胃给予25%葡萄糖水溶液,30min后通过眼睛静脉丛取血,3000rpm离心5min,分离血浆,采用ELISA试剂盒检测血浆中GLP-1和Insulin的含量,荧光法测定DPPIV活性。②对模型大鼠的作用:选取100g左右雄性SD大鼠70只,随机选取6只作为正常对照,其余64只高脂高糖饲料喂养30天后腹腔注射小剂量STZ(35mg/kg),继续高脂饲料喂养30天,选取连续三天空腹血糖大于16.7mmol/L的大鼠30只,分为五个组:维格列汀组(3mg/kg),CMD-05(4.5mg/kg),CMD-05(1.5mg/kg),CMD-05(0.5mg/kg),溶剂对照组。连续给药一个月,给药第1天,第19天,第29天作口服糖耐量试验(具体步骤如前所述),取30天左右大鼠空腹,糖负荷,随机血浆,采用ELISA检测胰岛素含量,GLP-1含量,糖化血红蛋白含量,DPPIV活性,采用试剂盒检测随机血浆中总胆固醇,低密度脂蛋白,甘油三脂的含量。给药结束后,分离胰腺组织,做HE染色,观察胰腺组织形态,做免疫荧光染色,观察胰腺组织胰岛素,胰高血糖素的表达,做Tunnel染色,观察胰岛组织的凋亡,做透射电镜,观察胰岛微结构中分泌颗粒的变化。
实施例4
CMD-05-151013的毒性实验:①细胞毒性:分别培养人胚胎肾细胞293,正常人肝细胞LO-2,小鼠海马神经元HT22,待细胞生长状态良好,接种于96孔板中,种板密度为1*105个/ml。种板4h后,加入不同浓度的维格列汀和该化合物,使其终浓度为3*10-4,1*10-4,3*10-5,1*10-5,3*10-6,1*10-6,3*10-7,1*10-7,3*10-8,1*10-8,培养24h后加入MTT溶液20ul,继续培养4h,吸出培养基,加入150ulDMSO,水平摇床上振摇5min,于450nm处测定OD值,计算细胞抑制率。②动物毒性:随机选取昆明小鼠雄性10只,雌性10只,禁食不禁水过夜,灌胃给予该化合物2g/kg,灌胃容积为0.4ml/10g,给药后观察15天。
- 还没有人留言评论。精彩留言会获得点赞!