一种蛹虫草凝集素蛋白Lectin‑ccm4及其制备方法和应用与流程
本发明属于凝集素领域,特别涉及一种蛹虫草凝集素蛋白Lectin-ccm4及其制备方法和应用。
背景技术:
凝集素(lectin)是一类能选择性地识别糖并与之非共价可逆结合的非抗体蛋白质。因其能凝集红细胞,故名凝集素(Barcmdes,1988)。1995年Peumans和Van Damme提出了植物凝集素的新定义,即凝集素蛋白含有至少一个可与专一性单糖或低聚(寡)糖可逆性结合的、非催化结构域(Peumans,1995)。
细胞凝集是最容易直观表征凝集素与细胞结合的现象。凝集素一般具有两个或两个以上的糖结合位点,因此可以与多个特异性细胞同时结合,从而使游离的细胞聚集成团而产生凝集效应。研究表明,凝集素不仅可以与红细胞结合,还可以与细菌、淋巴细胞、生殖细胞等其它细胞结合。
蘑菇凝集素可凝集各种血红细胞,肿瘤细胞,淋巴细胞等。凝集素的细胞凝集作用是凝集素分子的一个亚基与一个细胞表面的凝集素专一识别的糖基结合,另一个亚基与另一个细胞上的糖基结合,从而通过凝集素的架桥作用而导致的(刘艳如,2003)。
糙皮侧耳凝集素对肝细胞瘤H-22(Wang,2000)、薄盖灵芝凝集素对白血病L1210和M1细胞和肝癌(HepG2)细胞(Ngai,2004)、牛舌菌凝集素FHL对HeLa细胞等均具有明显的抑制作用(林玉满,2004)。植物凝集素在植物的防御反应中起重要作用,具有抗细菌、真菌、昆虫,甚至阻止被动物猎食的功能(Peumans,1995)。有研究结果显示大型真菌凝集素在真菌体内可能与植物凝集素相似,在真菌的防御反应中具有重要的作用(孙慧,2003)。
对蛹虫草中凝集素的分子生物学研究还未见报道,蛹虫草基因组已经测序完成,将注释为凝集素合成基因进行原核表达,构建凝集素高效表达的菌株,明确蛹虫草凝集素的生物活性,为蛹虫草里的凝集素的开发利用奠定基础。
技术实现要素:
本发明所要解决的技术问题是提供一种蛹虫草凝集素蛋白Lectin-ccm4及其制备方法和应用,该蛋白能够抑制金黄色葡萄球菌的生长、抑制人宫颈癌细胞HeLa的增殖等生物活性,因此,在抗菌抗癌方面具有应用潜力。
本发明提供了一种蛹虫草凝集素蛋白Lectin-ccm4,所述蛋白的氨基酸序列如SEQ ID NO.1所示。
本发明又提供了一种编码蛹虫草凝集素蛋白Lectin-ccm4的基因,所述基因的序列如SEQ ID NO.2所示。
该蛋白属于一种新型的真菌凝集素蛋白。将其cDNA序列在GenBank中进行BLAST比对,没有发现与其相似的基因序列,而将其氨基酸序列在NCBI的无冗余蛋白序列数据库(nr)中进行BLAST比对发现,该蛋白与来源于布氏虫草(Cordyceps brongniartii)凝集素蛋白的相似性达到83.42%,与来自于镰刀菌(Fusarium langsethiae)凝集素蛋白的相似性为55.64%,与来自于绿僵菌(Metarhizium brunneum)凝集素蛋白的相似性为58.25%。说明Lectin-ccm4是一种新的真菌凝集素蛋白,其编码的基因是一个新的基因。
本发明又提供了一种蛹虫草凝集素蛋白Lectin-ccm4基因的载体。
优选的,所述载体为pET-32a。
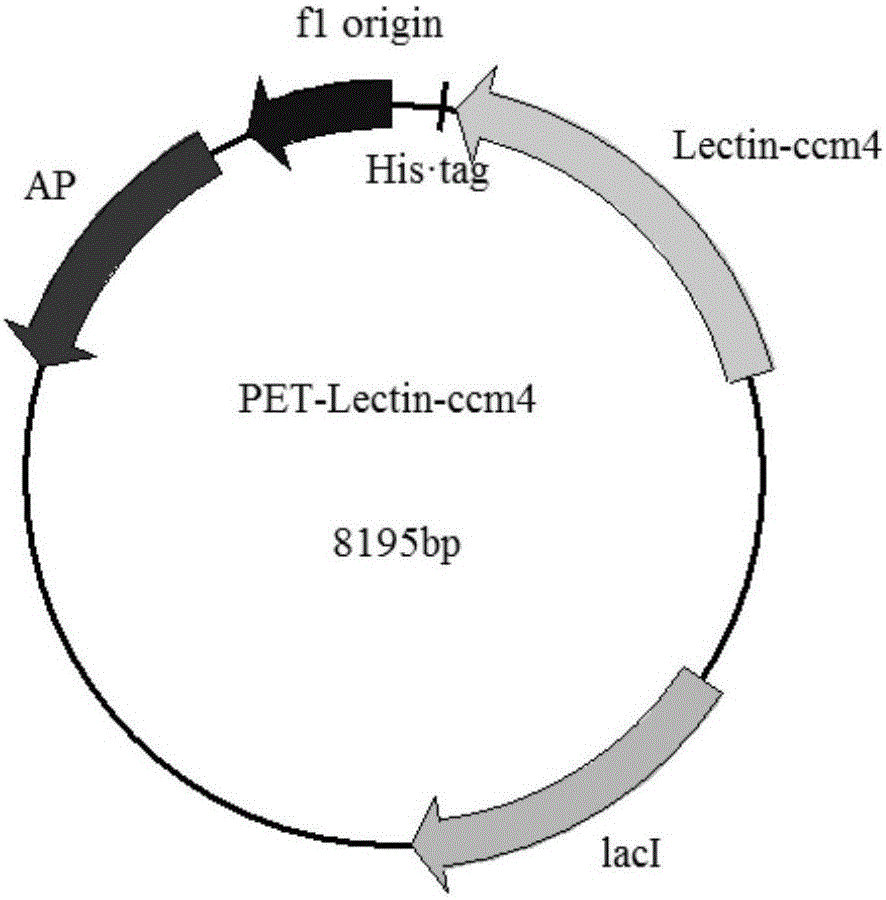
最优选的,将蛹虫草凝集素蛋白Lectin-ccm4基因插入到pET-32a上的EcoRI限制性酶切位点上,得到重组载体pET-Lectin-ccm4。
本发明又提供了一种含蛹虫草凝集素蛋白Lectin-ccm4基因的重组菌株。
优选的,所述重组菌株为BL21-Lectin-ccm4。
本发明的一种蛹虫草凝集素蛋白Lectin-ccm4的制备方法,包括:
(1)将蛹虫草凝集素蛋白的cDNA序列连入载体中,得到重组载体;
(2)将上述重组载体转化宿主细胞,得到重组菌株;
(3)培养上述重组菌株,诱导重组蛹虫草凝集素蛋白Lectin-ccm4的表达;
(4)纯化、透析分离获取所表达的蛹虫草凝集素蛋白Lectin-ccm4。
所述步骤(2)中的宿主细胞为大肠杆菌BL21细胞。
本发明的一种蛹虫草凝集素蛋白Lectin-ccm4的应用,所述蛹虫草凝集素蛋白Lectin-ccm4用于制备抗菌抗癌药物。
有益效果
本发明通过体外重组得到的蛹虫草凝集素蛋白Lectin-ccm4能够抑制金黄色葡萄球菌的生长、抑制人宫颈癌细胞HeLa的增殖等生物活性,因此,在抗菌抗癌方面具有应用潜力。
附图说明
图1为本发明蛹虫草凝集素蛋白Lectin-ccm4氨基酸序列与其它真菌凝集素蛋白氨基酸序列比对结果;
图2为本发明pET-Lectin-ccm4质粒图谱;
图3为本发明蛹虫草凝集素蛋白Lectin-ccm4表达的SDS-PAGE分析;其中,1为空载体,2为未添加诱导剂菌体,3为菌体破碎沉淀,4为Lectin-ccm4蛋白,M为分子量标准;
图4为本发明蛹虫草凝集素蛋白Lectin-ccm4抑制金黄色葡萄球菌生长实验;其中,Amp为阳性对照,抑菌圈直径2.1cm;1为空载体,2为Lectin-ccm4蛋白,抑菌圈直径1.4cm;
图5为本发明蛹虫草凝集素蛋白Lectin-ccm4抑制HeLa细胞增殖实验。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述是实例中所用的试验材料,如无特殊说明,均为常规生化试剂公司买得。以下实施例中的定量实验,均设置三次重复实验,结果取平均值。
1.细胞株:BL21感受态,Top10感受态。
2.试剂盒、酶类、生化试剂和仪器:
试剂盒:天根质粒提取试剂盒,天根蛋白定量检测试剂盒,上海生工PCR产物回收试剂盒,PCR引物合成和基因测序均由上海生工完成。
酶类:Takara常规内切酶,Takara DNA T4连接酶,TaqDNA聚合酶
仪器:艾本德微量加样器、赛默飞世尔离心机、上海天能凝胶成像仪、水平电泳槽、垂直电泳槽,江阴诺源恒温培养摇床,新芝超声破碎仪,ABI PCR仪,伯乐酶联免疫检测仪。
生化试剂:
国药冰乙酸、丙三醇(甘油)、无水乙醇、异丙醇、甲醇、甘氨酸、Tris、氢氧化钠、EDTA、氯化钠、氯化钾、十二水合磷酸二氢钠、磷酸二氢钾;
丙烯酰胺、N,N-亚甲叉丙烯酰胺、IPTG;Oxdine胰蛋白胨、酵母提取物;Solarbio氨苄青霉素、卡那抗生素;SDS、β-巯基乙醇、考马斯亮蓝R-250、AP。
3.培养基:生工LB培养基。
实施例1
蛹虫草凝集素蛋白Lectin-ccm4基因序列信息与同源性分析
本发明蛹虫草凝集素蛋白Lectin-ccm4序列为2295bp,详细序列见SEQ ID NO.2。根据cDNA序列推导出Lectin-ccm4氨基酸序列,共764个氨基酸残基,分子量83.35kDa,理论等电点(pI)为8.76,不稳定系数为46.57,脂肪族系数为71.69,详细序列见SEQ ID NO.1所示序列。
将蛹虫草凝集素蛋白Lectin-ccm4氨基酸序列用BLAST程序在Non-redundant GenBank数据库中进行蛋白质同源性检索,结果发现它与来源于布氏虫草(Cordyceps brongniartii)凝集素蛋白的相似性达到83.42%,与来自于镰刀菌(Fusarium langsethiae)凝集素蛋白的相似性为55.64%,与来自于绿僵菌(Metarhizium brunneum)凝集素蛋白的相似性为58.25%。如图1所示。由此可见,蛹虫草凝集素蛋白Lectin-ccm4与真菌凝集素蛋白家族在蛋白水平上存在较高的同源性,是一种新的真菌凝集素蛋白。
实施例2
蛹虫草凝集素蛋白Lectin-ccm4基因的扩增与表达
以蛹虫草mRNA为模板反转录成cDNA,再以上述cDNA为模板扩增出凝集素基因Lectin-ccm4,经EcoRI酶切,纯化后用连接酶(T4ligase)连接到以经EcoRI消化的pET32a载体上,表达载体pET-Lectin-ccm4转化到表达菌株BL21。挑取单克隆,LB液体培养基培养,次日,菌种以1:50扩大培养200mL,37℃培养至OD600=0.4-0.6,加入0.2mM的IPTG,16℃诱导表达12h。
实施例3
重组蛹虫草凝集素蛋白Lectin-ccm4的提取
8000rpm、4℃离心5min,收集诱导表达的菌株,加1mL破碎液重悬,用液氮速冻后进行研磨。12000rpm、4℃离心15min,收集上清和沉淀。SDS-PAGE检测目的蛋白的表达情况。目的蛋白Lectin-ccm4以可溶性蛋白形式存在,经细菌过滤器除菌后-20℃保存。
实施例4
重组蛹虫草凝集素蛋白Lectin-ccm4抑制金黄色葡萄球菌增殖试验
固体LB培养基融化后,待温度降至50℃时,以1%的接种量加入过夜培养的金黄色葡萄球菌菌液,混匀后立即倒平板,待平板凝固后在表面滴加2ul上述粗蛋白提取液,以空载体表达产物作为阴性对照,用氨苄作为阳性对照。将平板置于37℃培养10小时,观察结果。
如图4所示,纯化蛋白对金黄色葡糖球菌有抑制作用。
实施例5
重组蛹虫草凝集素蛋白Lectin-ccm4抑制人宫颈癌细胞HeLa增殖试验
收集生长至对数期的HeLa细胞,调整细胞悬液浓度至5*104个/mL,加入96孔板,每孔加入100ul。5%CO2,37℃孵育至细胞单层铺满孔底,加入上述粗蛋白提取液,每孔加入100ul。5%CO2,37℃孵育24小时,倒置显微镜下观察细胞长势。每孔加入20ul MTT溶液(5mg/ml,即0.5%MTT),继续培养4h。小心吸去孔内培养液,每孔加入150ul DMSO,置摇床上低速振荡10min,使结晶物充分溶解。在酶联免疫检测仪测量OD570nm处各孔的吸光值。
如图5所示,蛋白粗提取液浓度为1.8mg/ml时,抑制率为11.7%。
- 还没有人留言评论。精彩留言会获得点赞!