酰腙钒配合物及其制备方法及酰腙钒配合物在催化环氧化反应中的应用与流程
本发明涉及催化技术领域,是一个酰腙钒配合物及其制备方法及其在催化苯乙烯氧化反应中的应用。
背景技术:
酰腙是一类特殊的席夫碱化合物,含有–CH=N–NH–C(O)–官能团,它是由酰肼和醛或酮发生缩合反应而形成的产物。酰腙具有O、N等给体原子,易于与各种过渡金属离子形成配合物。酰腙配合物能够催化多种类型的有机反应,如催化一氧化碳加氢反应,催化酰胺化反应,催化烯烃、烷烃、芳香烃和醇的氧化反应等。
钒配合物具有良好的催化性能,比如在过氧化氢或有机过氧化物存在条件下,钒配合物能够加速有机化合物的氧化卤化和脂肪族的氧化以及有机硫化物氧化成亚砜等。
酰腙与钒很容易形成配合物。基于此, 本发明制备了一个酰腙钒配合物,具有良好的催化苯乙烯氧化反应的性能。
技术实现要素:
本发明的目的是提供一种对苯乙烯催化氧化有较高的活性、苯乙烯的转化率高、具有较高的苯乙烯催化氧化性能的催化剂酰腙钒配合物及其制备方法以及酰腙钒配合物在催化环氧化反应中的应用。
本发明的酰腙钒配合物,具有下式X所示的结构:
。
本发明的酰腙钒配合物的制备方法,所述的酰腙钒配合物具有下式X所示的结构:
;
酰腙钒配合物合成过程如下:
;
酰腙钒配合物合成步骤为:
1)、在20±10 ˚C搅拌作用下,将3-溴-5-氯水杨醛和2-溴苯甲酰肼分别溶于无水甲醇中,然后混合搅拌,制得下式1所示结构的化合物;
2)、在20±10 ˚C搅拌作用下,向装有1)步所得化合物的反应容器中加入乙酰丙酮氧钒的甲醇溶液,提取得到下式2所示结构的酰腙钒配合物;
所述步骤1)进一步为:在20±10 ˚C搅拌作用下,将3-溴-5-氯水杨醛和2-溴苯甲酰肼分别溶于圆底烧瓶内的无水甲醇中,然后在20±10 ˚C下混合搅拌, TLC跟踪反应,反应1 h后,减压蒸馏除去溶剂,将得到的固体粗产物用冷的甲醇洗涤,干燥,得到的固体粗产物溶于甲醇重结晶得到式1结构的化合物。
所述步骤2)进一步为:在20±10 ˚C搅拌作用下,向圆底烧瓶中加入乙酰丙酮氧钒的甲醇溶液,反应1 h后,减压蒸馏除去溶剂,将得到的固体用冷的甲醇洗涤,干燥,得到的固体粗产物溶于甲醇重结晶得到式2结构的化合物。
本发明的酰腙钒配合物在催化环氧化反应中的应用,所述的酰腙钒配合物的结构式为下式X所示:
本制备方法有效整合了氯、溴取代基这些吸电子基团,实验可重复性强,稳定性好,实验反应所需条件简单,且实验环境温和,产率高,可在较小投入情况下进行大量生产。
有益效果:本发明的配合物对苯乙烯催化氧化有较高的活性,当体系中无催化剂存在时,苯乙烯的转化率仅为12%,而苯甲醛的选择性和产物的TON值几乎为零,说明目标反应几乎没有发生。以制备的酰腙钒配合物为催化剂时,苯乙烯的转化率为53%,苯甲醛的选择性和TON值分别达到25%和490,说明其具有较高的苯乙烯催化氧化性能。
附图说明
图1是催化苯乙烯氧化反应示意图;
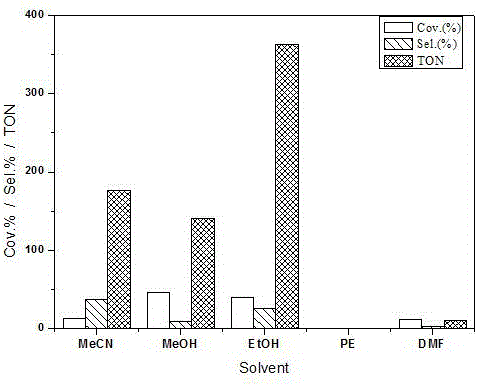
图2是不同溶剂对苯乙烯氧化反应的影响示意图;
图3是H2O2量对苯乙烯氧化反应的影响示意图;
图4是反应时间对苯乙烯氧化反应的影响示意图;
图5是温度对苯乙烯氧化反应的影响示意图。
具体实施方式
本发明的酰腙钒配合物,其具有式X所示的结构,
酰腙钒配合物的合成过程:
上述的酰腙钒配合物的合成包括下列步骤:
步骤1:在20±10 ˚C搅拌作用下,将3-溴-5-氯水杨醛和2-溴苯甲酰肼分别溶于圆底烧瓶内的无水甲醇中,然后在20±10 ˚C下混合搅拌, TLC跟踪反应,反应1 h后,减压蒸馏除去溶剂,将得到的固体粗产物用冷的甲醇洗涤,干燥,将得到的固体粗产物溶于甲醇重结晶得到结构如上式1所示的化合物;各物质的摩尔比为3-溴-5-氯水杨醛 : 2-溴苯甲酰肼=1 :1,反应时间为1 h;进一步优选的温度分别为10˚C、30 ˚C,优选的反应时间30 min。
步骤2:在20±10 ˚C搅拌作用下,向圆底烧瓶中加入乙酰丙酮氧钒的甲醇溶液,反应1 h后,减压蒸馏除去溶剂,将得到的固体用冷的甲醇洗涤,干燥,将得到的固体粗产物溶于甲醇重结晶得到结构如上式2所示的化合物;各物质的摩尔比为1:乙酰丙酮氧钒 = 1:1,反应时间1 h;进一步优选的温度为20 ˚C,优选的反应时间为30 min。
步骤3:在20±10 ˚C下,将如式2所示的化合物溶于甲醇,通过缓慢挥发溶剂的方法制得其单晶,时间是7天,单晶结构如下式3所示:具体说是在20±10 ˚C下,将该酰腙钒配合物溶于甲醇中,通过缓慢挥发溶剂的方法得到深褐色块状单晶。将单晶过滤出来,干燥,经单晶X-射线衍射分析得到如式3所示的结构。
3。
本发明的一个详细实施方式如下:
步骤1:在20±10 ˚C搅拌作用下,将3-溴-5-氯水杨醛和2-溴苯甲酰肼分别溶于圆底烧瓶内的无水甲醇中,然后在20±10 ˚C下混合搅拌, TLC跟踪反应,反应1 h后,减压蒸馏除去溶剂,将得到的固体粗产物用冷的甲醇洗涤,干燥,将得到的固体粗产物溶于甲醇重结晶得到结构如式1所示的无色晶体状化合物。产率92.1%。1H NMR (DMSO-d6, 300 MHz) δ: 12.59 (s, 1H, OH), 12.43 (s, 1H, NH), 8.42 (s, 1H, CH=N), 7.80–7.70 (m, 2H, ArH), 7.66–7.46 (m, 4H, ArH). 13C NMR (DMSO-d6, 75 MHz) δ: 163.34, 153.21, 147.47, 136.28, 133.26, 132.95, 131.95, 129.42, 129.27, 127.79, 123.41, 120.34, 119.42, 110.94. IR data (KBr, cm-1): 3439w, 1658s, 1609m, 1550m, 1436s, 1343m, 1297s, 1214w, 1164m, 1113w, 1032w, 952w, 883w, 733m. UV data (nm): 286, 296, 340.
步骤2:在20±10 ˚C搅拌作用下,向圆底烧瓶中加入乙酰丙酮氧钒的甲醇溶液,反应1 h后,减压蒸馏除去溶剂,将得到的固体用冷的甲醇洗涤,干燥,将得到的固体粗产物溶于甲醇重结晶得到结构如式2所示的褐色晶体状化合物。产率67.3%。IR data (KBr, cm-1): 3453w, 1603s, 1503m, 1423s, 1382m, 1281w, 1164s, 1115s, 1062s, 973m, 858s, 761w, 733w, 636w, 547s, 519s, 463w. UV data (nm): 272, 323, 401.
步骤3:将如式2所示的褐色晶体状化合物溶于甲醇,通过缓慢挥发溶剂,得到深褐色块状单晶。
产率82.2%。分子式:C16H14Br2ClN2O5V;分子量:560.5;单斜晶系,P21/n空间群;晶胞参数:a = 7.8918(6) Å,b = 23.336(2) Å,c = 10.7752(8) Å,β = 101.392(1)°,V = 1945.3(3) Å3,Z = 4,R1 = 0.0376,ωR2 = 0.0870。
步骤4:酰腙钒配合物催化苯乙烯氧化反应的研究
将0.0008g (0.0015 mmol) 配合物催化剂溶于3 mL乙醇中,依次加入0.52 g (5 mmol) 苯乙烯和一定量的30 % H2O2。一定温度下搅拌一定时间后,加入1.5 mL乙醚搅拌10 min后静置分层。取0.2 μL上层溶液,注入气相色谱仪进行产物分析 (甲苯为内标物)。
以该配合物为催化剂时,苯乙烯催化氧化的主产物是苯甲醛 (如图1所示)。为了使催化剂的催化活性达到最高,我们对其中几个重要的条件因素进行了探讨。
(1) 溶剂的影响:溶剂的选择对配合物催化的苯乙烯氧化有很大的影响。这是因为,整个反应体系在反应过程中是分为油水两项的:苯乙烯在油相,而配合物和H2O2在水相。而只有反应物、催化剂以及氧化剂均处于同一相中、三者充分接触时,反应才有可能进行。因此,溶剂在均相催化氧化中的作用就显得尤为重要了。苯乙烯氧化中常用到的溶剂主要有乙腈、乙醇、甲苯和丙酮等。
在催化剂0.0008 g,苯乙烯 (0.520 g, 5 mmol)和H2O2 (0.57 g, 5 mmol)的反应体系中,分别以3 mL甲醇、乙醇、DMF、石油醚和乙腈为溶剂,考察了该配合物的苯乙烯催化氧化性能,如图2所示。其中,以石油醚为溶剂时,配合物无催化性能,反应体系仍分为油水两相。以DMF为溶剂时,配合物具有较低的催化性能,苯乙烯的转化率为12%,产物的TON值为11,而对主产物苯甲醛的选择性仅为3%。以乙腈为溶剂时,虽然苯乙烯的转化率为13%,同样不高,但目标产物的TON值却有了很大的提升,可以达到176,并且苯甲醛的选择性也升高到38%。以甲醇为溶剂时,虽然目标产物的TON值也能达到141,可以与乙腈溶剂媲美,苯乙烯的转化率也有很大提高,为46%,但对苯甲醛的选择性却不高,仅有9%。以乙醇为溶剂时,配合物表现出了最好的催化性能,不仅苯乙烯的转化率可以达到40%,而且对苯甲醛的选择性也达到了26%,产物的TON值大幅度提高到363。
(2) H2O2用量的影响:
在底物苯乙烯用量不变的情况下,改变H2O2的用量,考察了苯乙烯与H2O2摩尔比为3:1, 2:1, 1:1以及无H2O2存在时,该配合物催化剂的催化性能,结果如图3所示。当反应体系中无氧化剂存在时,催化剂不存在苯乙烯催化活性。随着H2O2用量的增加,苯乙烯的转化率和产物的TON值均先升高,当苯乙烯与H2O2摩尔比为2:1时达到最大,分别为48%和501,而后降低。而主产物苯甲醛的选择性则在整个浓度区间内略有降低,当苯乙烯与H2O2摩尔比为2:1时为32%。这说明,适量的H2O2可以促进苯乙烯的氧化,而过量的H2O2由于能过度氧化底物而不利于目标产物的生成,导致产物的总TON值降低,苯甲醛的选择性下降。由此看出,当苯乙烯与H2O2摩尔比为2:1时,配合物在H2O2的氧化下表现出了较高的催化活性。
(3) 反应时间的影响:
在以苯乙烯 (0.520 g, 5 mmol),H2O2 (0.28 g, 0.25 mmol),催化剂 (0.0008 g),温度 (60 °C),溶剂乙醇 (3 mL)的条件下,考察了反应时间对催化活性的影响,如图4所示。可以看到,在3~8小时反应时间范围内,苯乙烯的转化率和产物的TON值均逐渐升高,与反应时间成正比。当反应8小时后,苯乙烯的转化率为64%,TON值能达到629。然而,反应时间却对苯甲醛的选择性几乎没有任何影响,选择性始终保持在28%附近。
(4) 反应温度的影响:
在以苯乙烯(0.520 g, 5 mmol),H2O2 (0.57 g, 5 mmol),催化剂 (0.0008 g),反应时间(4 h)和乙醇(3 mL)的条件下,考察了反应温度对催化活性的影响,如图5所示。可以看到,在40, 60和80 °C条件下,苯乙烯的转化率均逐渐升高:40 °C时最低;60 °C最高;80 °C时反而下降。而产物TON值则40 °C和60 °C相差不大,80 °C时也同样降低。综上所述,60 °C为该反应的最佳条件。
(5) 配合物的苯乙烯催化氧化活性:
在以苯乙烯(0.520 g, 5 mmol),H2O2 (0.57 g, 5 mmol),催化剂 (0.0008 g),反应时间 (4 h ),温度 (60 °C)和乙醇 (3 mL)的条件下,考察了钒配合物的苯乙烯催化氧化性能。当体系中无催化剂存在时,苯乙烯的转化率仅为12%,而苯甲醛的选择性和产物的TON值几乎为零,说明目标反应几乎没有发生。以钒配合物为催化剂时,苯乙烯的转化率为53%,苯甲醛的选择性和TON值则分别达到25%和490,说明其均具有较高的苯乙烯催化氧化活性。
因此,本发明的钒配合物可以应用于催化苯乙烯氧化反应。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种等同变换,这些等同变换均属于本发明的保护范围。另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合。为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
- 还没有人留言评论。精彩留言会获得点赞!