一种与大豆光周期调控相关基因GmRAV1的应用的制作方法
本发明涉及一种与大豆光周期调控相关基因GmRAV1的应用,属于植物基因工程技术领域。
背景技术:
一般来说,属于短日照植物像大豆、水稻等植物其生长发育对光周期反应非常敏感,这一特性严重阻碍大豆品种的适应性,限制大豆播种范围,影响产量水平的有效发挥。通常缩短日照时间促进大豆、水稻等植物开花,生育期缩短。相反增加日照时间抑制大豆开花,生育期延长。因此,由北向南(生育期间日照时间由长变短)引种会加速成熟,生育期变短,产量降低,限制产量性状的发挥。相反,由南向北引种,会延长生育期,不能正常成熟。这一特性严重阻碍大豆品种及其他对光周期反应敏感的植物品种的跨区种植,如大豆品种的适应范围较窄,南北不宜大幅度调种,需要众多光周期反应各不相同的品种类型,分别适应各种不同的生态条件,因此改变像大豆这样的植物的光周期敏感性对这些植物品种改良十分重要。
据已报道至少有7个基因座位影响大豆的开花和成熟时间,将这些基因座位称为E系列,大豆中大多数显性E等位基因对长日照光周期敏感且抑制开花,在自然光照长度下,显性等位基因不同程度地推迟开花(Cober et al.,1996a)。大豆的E等位基因似乎与拟南芥中参与短日照条件下开花抑制途径的光稳定的光敏色素基因phyB、phyD和phyE功能相似(Devlin et al.,1998)。大豆的光周期敏感性控制开花时间和成熟的性状可能由主效QTL控制和几个微效QTL所修饰。有10个大豆开花时间基因已定位在连锁图谱上(Tasma and Shoemaker,2003),其中包括4个光周期相关基因(PHYA、PHYB、CRY2和CCA1),5个开花时间基因(FCA、DET1、COL1、COL2和LD)和1个花分生组织特性基因(AP2)。
在现有常规育种中,通过杂交选择早熟品种或晚熟品种,或通过辐射和化学试剂进行诱变等常规方法进行品种改良所需时间较长,并且不能预计后代中突变的程度或方向的弱点,用这些基因进行品种改良是一种相对于传统方法而言特别有效并且简单可靠的方法。
另一方面,大豆的遗传转化研究受到世界各国的普遍重视,大豆组织培养有一定的难度,是公认的难转化的作物,其主要原因是从转化的细胞或组织分化再生植株困难,尽管许多研究者致力于优化大豆的转化系统,但是大豆转化的频率仍然很低,受基因型限制,重复性很差。建立良好的受体系统是实现基因转化的先决条件。因此,鉴定新的大豆芽再生相关基因,通过转基因方法提高不同基因型大豆品种的转化效率,创制高再生的大豆品种,从而提高大豆的遗传转化效率是育种的另一个重要目标。同时,控制植株的株型也是大豆育种中设计产量的关键因素。但现有技术中缺少能够有效控制植株株型的方法。
技术实现要素:
为解决上述问题,本发明提供了一种大豆GmRAV1基因在控制植物生育期和生长过程的应用,所采取的技术方案如下:
本发明所提供的基因和蛋白质,命名为GmRAV1,来源于大豆(Glycine max(L.)Merrill.)东农42。将该基因序列(GmRAV1)转入要改良的大豆或其他双子叶植物和单子叶植物中,进行基因沉默,使植物表现出植株高大,分枝多,叶色浓绿,茎间距增大,早花,早熟,光周期不敏感或光周期敏感性降低的特征;或使基因过量表达表现出不定芽再生能力增强的特征,并将这种方法用于培育和改良植物的广适性或再生能力的新品种。
本发明的目的在于提供大豆GmRAV1基因在控制植物生育期和生长过程中的应用。
所述GmRAV1基因,核苷酸序列如SEQ ID NO.1所示,编码区编码蛋白的氨基酸序列如SEQ ID NO.2所示。
优选地,所述应用具体是在在控制植物光周期敏感性过程中的应用。
优选地,所述应用是将GmRAV1基因转入植物细胞后,通过沉默GmRAV1基因的表达来调节控制植物的光周期敏感性。
所述应用的步骤如下:
1)将含有GmRAV1基因的编码区或启动子序列的片段与植物RNAi干涉表达载体进行连接,构建植物RNAi表达载体;
2)将步骤1)所得的植物RNAi表达载体转入到植物细胞中,获得植物RNAi表达载体的细胞;
3)筛选步骤2)中所得植物RNAi表达载体的细胞中的表达沉默的转化细胞,培育并获得转GmRAV1基因的植株。
优选地,步骤1)所述GmRAV1基因的编码区,核苷酸序序列为SEQ ID NO.1中第270-1421位;所述启动子,是CaMSV35启动子。
优选地,另外一种应用方法是在增强植物不定芽再生能力过程中的应用。
优选地,上述应用是将GmRAV1基因转入植物细胞,通过过表达GmRAV1基因来增强植物的不定芽生长能力。
所述应用的步骤如下:
1)将含有GmRAV1基因的编码区序列与表达载体进行连接,构建植物表达载体;
2)将步骤1)所得的植物表达载体转入到植物细胞中,获得含有植物表达载体的植物细胞;
3)筛选步骤2)所得的植物细胞,培育并获得过表达GmRAV1基因的植物。
优选地,所述过表达,是在外加细胞分裂素和在长日照条件下促进GmRAV1基因的过表达。
优选地,另外一种应用方法是在控制植株株型过程中的应用。
优选地,上述应用方法的步骤如下:
1)将GmRAV1基因转入到植株中获得,转GmRAV1基因植株;
2)通过调节GmRAV1基因的表达量和表油菜素内脂epiBL的使用量调节植株的株型。
更优选地,所述表油菜素内脂epiBL的使用量,在MS固体培养基中的添加量为10mmol/L。
在本发明的方法中,可利用GmRAV1基因作为目的基因构建植物表达载体,其中可以任何一种启动子例如花椰菜花叶病毒(CaMV)35S启动子、Ubiquitin启动子或其它启动子,该表达载体中必要时可包括增强子,不论是转录增强子或翻译增强子。所用的表达载体可使用Ti质粒,Ri质粒,植物病毒载体等。转化方法可包括农杆菌介导法、基因枪法、花粉管通道法或其它方法。
在本发明的方法中,可利用GmRAV1基因作为目的基因构建植物RNAi载体,所用的表达载体可使用Ti质粒,Ri质粒,植物病毒载体等。转化方法可包括农杆菌介导法、基因枪法、花粉管通道法或其它方法。
本发明的GmRAV1基因的受体植物包括单子叶和双子叶植物,例如水稻、小麦、玉米、大豆、棉花、蔬菜等,用于抑制表达提高作物产量和加速作物成熟,或用于RNAi基因沉默降低植物光周期敏感性。
本发明提供了鉴定大豆中光周期控制开花时间和成熟的性状相关的GmRAV1基因并同时确定该基因在大豆根、茎和叶的生长发育过程中起何种作用的方法。
本发明获得的有益效果如下:
本发明提供的GmRAV1基因(植物基因组数据库phytozome(网址为:https://phytozome.jgi.doe.gov/pz/portal.html)的登录号为Glyma01g22260.1)及蛋白不但可以在调节植物光周期过程中进行应用,同时发明人还首次发现,通过过表达该基因可以增强植物的芽再生能力,提高植物的分裂再生能力。在LD和SD下GmRAV-i(GmRAV基因沉默)大豆植株与对照相比植株明显高大,茎细弱,节间距大,节数相差不大,根短,叶片小,说明该基因对茎的发育有抑制作用,在LD和SD下拟南芥rav突变体植株与对照相比植株对光周期敏感性明显降低,在SD和LD下开花时间相似,拟南芥rav突变体植株与对照相比在LD和SD下开花早。
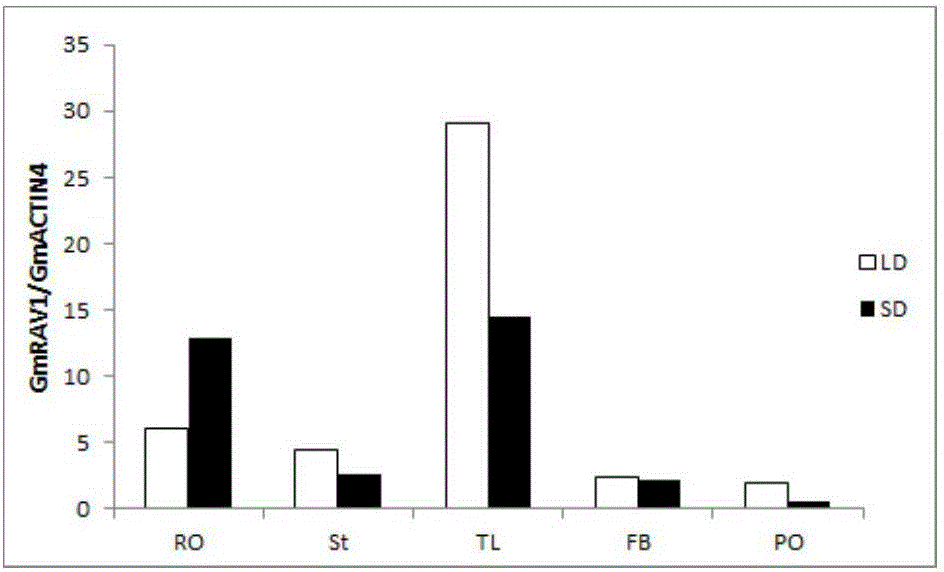
本发明提供了与SD相比LD诱导该基因在大豆叶片中的表达,从而使得大豆在长日照下这些营养器官中该基因丰度的上调抑制了其叶和茎的生长,使得大豆呈现叶片浓绿且大,根长的特征,由于叶片中GmRAV1的表达对日长作出反应,GmRAV1mRNA的丰度在LD下比SD下高,LD促进GmRAV1的表达而抑制大豆开花,SD抑制GmRAV1的表达而促进大豆开花。
本发明提供了该基因是细胞分裂素(6-BA、2-ip等)促进细胞分裂、抑制根和下胚轴伸长途径中的促进因子,细胞分裂素促进该基因表达,添加细胞分裂素,转GmRAV1基因植株下胚轴和根缩短的幅度比对照大,生长比对照慢,叶片浓绿,分枝多,表明GmRAV1的表达增强了细胞分裂素的效应,外源施加细胞分裂素使得GmRAV-i转基因大豆对细胞分裂素的响应不敏感,转基因大豆株高增高的幅度显著低于对照大豆株高增高的幅度。
附图说明
图1为利用ClustalX(1.83)软件进行多重序列比对将GmRAV1基因与植物中同源基因氨基酸序列比较结果。
图2 Real-time RT-PCR分析GmRAV1基因组织特异性表达变化;
(其中,黑柱代表短日照,白柱代表长日照)。
图3 Real-time RT-PCR分析长日照(16h/8h光/暗)(LD)、短日照(8h/16h光/暗)(SD)下DN42大豆中GmRAV1基因的生物钟昼夜节律表达规律;
(图中,a)为大豆GmRAV1基因在LD和SD下基因的表达分析,b)GmRAV1基因的LD48h后转移至LL(连续光照)节律表达,c)GmRAV1基因的LD48h后转移至DD(连续黑暗)节律表达,d)GmRAV1基因的SD48h后转移至LL(连续光照)节律表达,e)GmRAV1基因的SD48h后转移至DD(连续黑暗)节律表达)。
图4植物表达载体pCAMBIA3301-GmRAV1的质粒图谱。
图5植物表达载体pJawoh18-GmRAV1的质粒图谱。
图6长日照(16h/8h光/暗)(LD)下种于土中45天的DN50、GmRAV1-ox、GmRAV-i大豆苗。
图7不同日照条件下DN42、GmRAV-i和X DN42大豆苗的生长情况;
(a)长日照(16h/8h光/暗)(LD)和短日照(8h/16h光/暗)(SD)下种于土中1个月的DN50和GmRAV-i大豆苗;(b)长日照(16h/8h光/暗)(LD)和短日照(8h/16h光/暗)(SD)下种于土中1个月的DN42和GmRAV-i、X DN42大豆苗。
图8哈尔滨市东北农业大学转基因基地种植的大豆苗。
图9施加不同浓度生长分离素后不同植物细胞的再生情况;
(a)向B5培养基中外源施加不同浓度的细胞分裂素6-BA后3种大豆的再生情况;(b)向MS培养基中外源施加不同浓度的细胞分裂素2-ip后4种拟南芥的再生情况。
图10添加不同细胞分离素植物根的生长情况;
(a)向B5培养基中外源施加不同浓度的细胞分裂素6-BA后3种大豆根和下胚轴的生长情况;(b)向B5培养基中外源施加不同浓度的细胞分裂素6-BA后3种大豆根和下胚轴的长度图;;(c)向MS培养基中外源施加不同浓度的细胞分裂素6-BA后4种垂直培养的拟南芥的根长情况;(d)向MS培养基中外源施加不同浓度的细胞分裂素6-BA后4种垂直培养的拟南芥的根长统计图。
图11 Real-time RT-PCR分析外源施加6-BA(100μmol 6-BA)和未施加6-BA(0μmol 6-BA)的DN42大豆中GmRAV1基因的表达规律。
图12施加不同浓度epiBL对植株胚轴长度的影响;
(a)长日照(16h/8h光/暗)(LD)下向MS培养基中施加不同浓度的epiBL后的Col-0、rav、GmRAV1-ox拟南芥的实际生长情况;(b)长日照(16h/8h光/暗)(LD)下向MS培养基中施加不同浓度的epiBL后的Col-0、rav、GmRAV1-ox拟南芥的下胚轴长度柱形图。
具体实施方式
下面结合具体实施例对本发明做进一步说明,但本发明不受实施例的限制。
以下实施例中所用材料、试剂、仪器和方法,未经特殊说明,均为本领域中的常规材料、试剂、仪器和方法,均可通过商业渠道获得。
实施例1:GmRAV1基因的克隆和序列分析
以大豆叶片转录RNA为模板反转录得到cDNA,以该cDNA为PCR反应模板,获得全长ORF区的基因DNA序列。该大豆推测的GmRAV1转录因子DNA全序列为1757bp,ORF为1155bp,编码384个氨基酸,含有AP2/B3结构域(见序列表SEQ ID NO.1中第270-1421位),序列在植物基因组数据库phytozome(网址为:https://phytozome.jgi.doe.gov/pz/portal.html)的登录号为Glyma01g22260.1。同源序列比较发现(图1),该序列与菜豆(Phaseolus vulgaris)(XM_007143739)、蒺藜苜蓿(Medicago truncatula)(XM_003591774)RAV1同源性分别为50.20%和42.34%,与玉米(Zea mays)(NM_001148270)同源性为47.07%。
实施例2:Real-time RT-PCR分析日长和生物钟昼夜节律对GmRAV1基因表达的影响
大豆DN42培养于光照培养箱25℃,250mol m-2sec-1白光,长日照(16h/8h光/暗)(LD)条件下生长出苗后第20天(定为0d),一部分转移到短日照(SD)光周期下(8h/16h光/暗)生长,待转移后的0、3、6、9、12、15、18、21、24d,同时对LD和SD叶片取材,液氮速冻,-80℃保存,提取RNA,按照SYBR(R)ExScriptTM RT-PCR Kit的程序进行荧光定量PCR反应。GmRAV1扩增片断为144bp,大豆看家基因Actin4(AF049106)扩增片断为214bp,其引物如下:GmRAV1正义引物:GGTGTAGTGGCATAGTGGC,反义引物:
TAAGAAGGGGAGAAGCTAGA;Actin4正义引物:GTGTCAGCCATACTGTCCCCATTT,反义引物:GTTTCAAGCTCTTGCTCGTAATCA。结果如图2和图3所示。
实施例3:植物表达载体pCAMBIA3301-GmRAV1的构建、农杆菌介导法转化大豆子叶节和花絮侵染法转化拟南芥
以大豆叶片转录RNA为模板反转录得到cDNA,以该cDNA为PCR反应模板,获得全长ORF区的基因DNA序列。该大豆推测的GmRAV1转录因子DNA全序列为1757bp,ORF为1155bp,以Bgl II和BstE II为酶切位点,设计克隆引物,进行PCR反应,条件为94℃5min;38个循环:94℃30s,58℃30s,72℃1min;72℃10min;将PCR产物进行1%琼脂糖凝胶电泳,按照OMEGA Gel Extraction Kit的说明进行回收DNA片断,连接用TaKaRa的pMD18-T载体,根据连接时插入的基因和连接载体的摩尔比为3:1,计算插入基因片段和连接载体的用量,16℃温浴16h。将连接产物5ul转化50ul某公司的大肠杆菌感受态TOP10中,37℃倒置培养12-16h,挑取单克隆,用LB液体培养基(50mg/L Kan)摇菌、保存菌种,将单克隆培养出来的菌液送交到华大生物公司测序,鉴定阳性克隆。将包含阳性克隆的大肠杆菌菌种摇菌,用OMEGA Plasmid Mini Kit提取质粒,用Fermentas公司的限制性内切酶Bgl II和BstE II按照1:1的比例,在Fermentas公司的Buffer O的环境中酶切质粒,同时用Fermentas公司的限制性内切酶Bgl II和BstE II按照1:1的比例,在Fermentas公司的Buffer O的环境中酶切pCAMBIA3301质粒,将酶切片段进行1%琼脂糖凝胶电泳,按照OMEGA Gel Extraction Kit的说明进行回收DNA片断,连接用TaKaRa的T4连接酶和相对应的T4连接10X Buffer,按插入DNA的目标片段与载体的DNA片段摩尔比为3:1或1:1的比例建立连接体系,16℃温浴16h,连接产物转化大肠杆菌。将连接产物5ul转化50ul某公司的大肠杆菌感受态TOP10中,37℃倒置培养12-16h,挑取单克隆,用LB液体培养基(50mg/L Kan)摇菌、保存菌种,用Fermentas公司的限制性内切酶Bgl II和BstE II按照1:1的比例,在Fermentas公司的Buffer O的环境中双酶切鉴定和PCR鉴定两种方法阳性克隆。其克隆引物如下:GmRAV1正义引物:AGATCTATGGATGCAATTAGTTGCC;反义引物:GGTCACCCTACAAAGCACCAATAAT。制备农杆菌EHA105感受态细胞:从YEP平板(25mg/L Rif、50mg/L Str)上挑取新鲜的EHA105单菌落接种于含50mg/L Str和25mg/L Rif的YEP液体培养基中,28℃,220rpm振荡培养过夜24~36h,取2mL过夜活化的对数生长期的菌液,接种于50mL液体YEP中,继续培养OD600至0.4~0.6左右,转入冰预冷无菌离心管,冰浴30min,4℃,4000rpm离心10min,弃上清液,用10mL冰预冷0.05M CaCl2悬浮菌体,冰浴30分钟,4℃,4000rpm离心10min,弃上清液,用2mL冰预冷0.05M CaCl2重悬菌体,将制备好的感受态细胞放置于冰上,24~48h内使用转化效率最高,也可按每管100μL分装于无菌管中,加入甘油使终浓度为15%后置于-70℃保存。冻融法转化农杆菌:取2μL纯化的质粒DNA,加入到含有100μL根癌农杆菌感受态细胞的离心管中,轻轻混匀,冰浴30min,于液氮中速冻2min,迅速置37℃水浴热激5min,再迅速冰浴2min,加入500μL YEP无抗生素的液体培养基于28℃,100rpm轻轻振荡培养3~5h复苏,从该培养物中取50-200μL菌液均匀涂布在含有适当抗生素的YEP固体培养基(50mg/L Str,25mg/L Rif和50mg/L Kan)表面,28℃倒置培养1~2d,挑取白色单菌落在含有适当抗生素的YEP液体培养基(50mg/L Str,25mg/L Rif和50mg/L Kan)中培养,PCR鉴定阳性克隆。得到的农杆菌pCAMBIA3301-GmRAV1(图4)载体转化子即可用于植物的转化。
农杆菌菌液制备:挑取含有pCAMBIA3301-GmRAV1重组质粒的农杆菌单菌落接种于含利福平50mg/L、链霉素25mg/L、卡纳霉素50mg/L的5mL YEB液体培养基中,28℃,180rpm培养48h。吸取1ml菌液接种于50ml新鲜的上述YEB液体培养基中震荡培养至OD600为0.6-0.8,将菌液于5000rpm的离心机中离心15min,富集菌体后用等量的液体CCM培养基重悬。
大豆种子灭菌:氯气灭菌法。选取饱满无菌斑的种子,放入通风厨的干燥器内,在干燥器的小烧杯内倒入96ml次氯酸钠,快速加入4ml浓盐酸后迅速盖紧。大豆在其反映产生的氯气中灭菌16h后置于超净台内通风30min,密封备用。
大豆种子萌发:将灭菌后的种子种脐向下种于萌发培养基(GM)中,每瓶种8-10粒,在23℃、16h光照/8h黑暗条件下萌发4-5天。
大豆子叶节的制备:取出无菌苗,选取萌发充分的植株,去掉种皮,于子叶下端5mm处将下胚轴切掉,沿下胚轴中线将两片子夜切开,去除真叶,得到子叶节外植体。,用解剖刀在子叶与胚轴交接处直径约3mm的范围内划3-5刀。经过此番操作,每棵无菌苗可得到2个用于转化的子叶节外植体。
大豆侵染与共培养:将制备好的外植体放入侵染液中100rpm,震荡培养30min后取出用无菌纸将外植体表面多余的侵染液吸干,倒置于共培养培养基上,暗培养3天。
大豆丛生芽的诱导及筛选:将暗培养完的子叶节外植体用清水与液体芽诱导培养基各清洗3遍,用无菌纸将子叶节表面的液体吸干,以与培养基表面45度角斜插在恢复培养基上进行芽诱导。将诱导7天的丛生芽转移至含有8mg/LPPT的筛选培养基中,每7天继代一次,筛选20天。
大豆砧木的准备:提前5天将东农50种于蛭石中,待其子叶微微展开真叶,选取真叶不超过子叶2/3的幼苗,用解剖刀将其真叶完全去掉然后沿茎轴线将下胚轴切出一条0.8mm-10mm的创口。
大豆接穗的准备:经过筛选的丛生芽,去掉周围死去组织,垂直于丛生芽表面切下,将丛生芽切成上部为3-7mm,下部长约5-8mm具有完整维管束的楔子形。
大豆的嫁接:将接穗竖直放入砧木切口中,丛生芽面与子叶节齐平,用封口膜包好,栽移到塑料钵中。将嫁接好的植株放入一较深的盒中,外套保鲜膜,适当密封,保持低温高湿的生长环境,一周后待幼苗完全恢复可揭膜炼苗。
大豆转化子的鉴定:将嫁接大豆收取的种子种植于土壤中,观察其生长状态与对照相比是否有差异,并采用小量法提取其新鲜叶片的DNA,根据重组质粒的DNA序列,最后选取该重组质粒上的35S启动子序列和GmRAV1基因序列,设计特异性引物,以DNA为模板,按照EasyTaq DNA Polymerase说明书进行PCR扩增,引物序列如下:正义引物:5'TATCCTTCGCAAGACCCTTCCTC 3',反义引物:5'ACGACGAAGCCATAGTGGTTTGC3',产物大小为740bp。
农杆菌菌液制备:挑取含有pCAMBIA3301-GmRAV1重组质粒的农杆菌单菌落接种于含利福平50mg/L、链霉素25mg/L、卡纳霉素50mg/L的5mL YEB液体培养基中,28℃,180rpm培养48h。吸取1ml菌液接种于50ml新鲜的上述YEB液体培养基中震荡培养至OD600为0.6-0.8,将菌液于5000rpm的离心机中离心10min,弃上清,沉淀悬浮于二分之一体积的渗透培养基(0.22%MS,5%蔗糖,0.02%silwet L-77)中。
拟南芥种子灭菌:10%NaClO灭菌法:选取饱满的拟南芥种子4℃春化3d后,放于1.5EP管中,向其中加入10%的NaClO溶液,涡旋震荡7-10min,使种子充分与溶液接触,充分消毒,再用无菌水冲洗3~4次。
拟南芥种子萌发:将灭菌后的种子种于含2%蔗糖的萌发培养基(MS)中,每板种约100粒种子,在22℃、8h光照/16h黑暗条件下萌发7天。
拟南芥的移苗:将土与蛭石按照1:1混合后,装盆,从下方浇水使其充分浸湿,将培养基中的苗移入其中,注意不要伤根。用保鲜膜包住拟南芥苗,放置在在22℃、16h光照/8h黑暗条件下生长7天,揭去保鲜膜。
拟南芥的侵染与转化:花絮侵染法:将重悬的含有pCAMBIA3301-GmRAV1重组质粒的农杆菌菌液倒在小瓷盘中。将培养拟南芥的钵体横倒在瓷盘边,将刚露白且未开放的花浸泡在悬浮液中浸泡30s。取出植株,横放在塑料膜上,用保鲜膜盖在上面以保持湿度,并在保鲜膜上再覆盖一层不透光的纸。放在恒温室暗培养24h。第二天揭开纸和保鲜膜,竖直培养。4~5d后,根据拟南芥的生长情况继续浸染一到二次。培养3~4周,待种子成熟后,收取种子,干燥器中存放。
拟南芥转化子的鉴定:将侵染后的拟南芥收取的种子4℃春化3d后种植于萌发培养基MS(5mg/L Kan)中,22℃±2℃光照培养7d-10d后,选取生长状态良好,叶色浓绿的拟南芥,移于土中,22℃±2℃长日照光照培养,待其长大后,采用小量法提取其新鲜叶片的DNA,根据重组质粒的DNA序列,最后选取该重组质粒上的35S启动子序列和GmRAV1基因序列,设计特异性引物,以DNA为模板,按照EasyTaq DNA Polymerase说明书进行PCR扩增,引物序列如下:正义引物:5'TATCCTTCGCAAGACCCTTCCTC 3',反义引物:5'ACGACGAAGCCATAGTGGTTTGC 3',产物大小为740bp。选取部分转基因大豆进行半定量RT-PCR分析,结果表明GmRAV1-ox株系中外源基因GmRAV1基因已经整合到大豆基因组中,在转录水平上转GmRAV1基因大豆与非转基因大豆相比GmRAV1过量表达,信号非常强。
实施例4:植物RNAi表达载体pJawoh l8-GmRAV1的构建和农杆菌介导法转化大豆子叶节
根据NCBI上公布的GmRAV1基因序列,选择ORF内的基因序列设计干涉目的片段,以GmRAV1基因的全长序列为模板,设计引物。根据Gateway技术说明书,扩增333bp的特异性干涉片段,通过BP反应,重组构建入门载体(entry clone),然后入门载体再与RNAi表达载体pJawohl8通过LR反应,得到含有目的基因的RNAi载体(destination vector)。PCR扩增片段的条件为94℃5min;38个循环:94℃30s,55℃30s,72℃1min;72℃10min;将PCR产物进行1%琼脂糖凝胶电泳,按照OMEGA Gel Extraction Kit的说明进行回收DNA片断,根据Gateway技术说明书确定BP反应体系,进行BP反应,取2μL BP反应产物至一离心管中,置于冰上,小心向其中加入100μL感受态细胞,轻弹管底混匀,冰浴30min,42℃水浴热激90s(不要摇动),立即置于冰上2min,向离心管中加入200μL LB液,37℃,150rpm振荡培养45min,置于冰上,分别取菌液涂布于含有Amp(100mg/L)的LB平板上,37℃正放1h待菌液完全被平板吸收后倒置过夜培养12h-16h,挑取白色单菌落,接种于5mL含有Amp(100mg/L)的LB液体培养基,37℃,220rpm振荡培养12-16h,培养基明显变浑浊后,取0.5mL菌液加入0.5mL无菌30%甘油至终浓度为15%,-80℃保存菌种。取2μL菌液做PCR扩增,将有扩增产物且片段大小正确的克隆进行测序。取测序结果正确的阳性克隆菌液提取质粒作为入门载体克隆,紫外分光光度计和琼脂糖凝胶电泳检测质粒的浓度和纯度。以GmRAV-attB-Fi和GmRAV-attB-Ri为引物,经过BP反应后的转化菌液为模板,进行PCR反应,.取5μL扩增产物进行琼脂糖电泳检测。根据Gateway技术说明书确定LR反应体系,进行LR反应,将反应产物按照BP反应后转化大肠杆菌的方法转化,将全部转化细胞均匀涂布在含有50mg/mL氨苄青霉素的LB固体培养基上,37℃培养12-16h后,挑取单菌落接种于含有50mg/mL氨苄青霉素的LB液体培养基培养过夜,然后取2μL菌液做PCR扩增,将有扩增产物且片段大小正确的克隆进行测序。并进行菌液PCR检测。将植物入门载体pDONR201-GmRAV质粒用SmaI单酶切,植物表达载体pJawoh18-GmRAV质粒(图5)用HindIII单酶切,取6-10μL产物电泳检测。检测阳性克隆送交上海英骏公司测序。扩增干涉片段的引物序列如下:正义引物:GmRAV-attB-Fi 5’-GGGGACAAGTTTGTACAAAAAAGCAGGCTACGCCGTCACCAACTTCA-3’,反义引物:GmRAV-attB-Ri
5’-GGGGACCACTTTGTACAAGAAAGCTGGGTGTGCTGCTTCGGTATCACTAA-3’。制备农杆菌EHA105感受态细胞:从YEP平板(50mg/L Str和25mg/L Rif)上挑取新鲜的EHA105单菌落接种于含50mg/L Str和25mg/L Rif的YEP液体培养基中,28℃,220rpm振荡培养过夜24~36h,取2mL过夜活化的对数生长期的菌液,接种于50mL液体YEP中,继续培养OD600至0.4~0.6左右,转入冰预冷无菌离心管,冰浴30min,4℃,4000rpm离心10min,弃上清液,用10mL冰预冷0.05M CaCl2悬浮菌体,冰浴30分钟,4℃,4000rpm离心10min,弃上清液,用2mL冰预冷0.05M CaCl2重悬菌体,将制备好的感受态细胞放置于冰上,24~48h内使用转化效率最高,也可按每管100μL分装于无菌管中,加入甘油使终浓度为15%后置于-70℃保存。冻融法转化农杆菌:取2μL纯化的质粒DNA,加入到含有100μL根癌农杆菌感受态细胞的离心管中,轻轻混匀,冰浴30min,于液氮中速冻2min,迅速置37℃水浴热激5min,再迅速冰浴2min,加入500μL YEP无抗生素的液体培养基于28℃,100rpm轻轻振荡培养3~5h复苏,从该培养物中取50-200μL菌液均匀涂布在含有适当抗生素的YEP固体培养基(50mg/L Str,25mg/L Rif和100mg/L Amp)表面,28℃倒置培养1~2d,挑取白色单菌落在含有适当抗生素的YEP液体培养基(50mg/L Str,25mg/L Rif和100mg/L Amp)中培养,PCR鉴定阳性克隆。得到的农杆菌pJawoh18-GmRAV1载体转化子即可用于植物的转化。
农杆菌菌液制备::挑取含有pJawoh18-GmRAV1重组质粒的农杆菌单菌落接种于含利福平50mg/L、链霉素25mg/L、氨苄霉素100mg/L的5mL YEB液体培养基中,28℃,180rpm培养48h。吸取1ml菌液接种于50ml新鲜的上述YEB液体培养基中震荡培养至OD600为0.6-0.8,将菌液于5000rpm的离心机中离心15min,富集菌体后用等量的液体CCM培养基重悬。
大豆转化方法具体见实施例3
大豆转化子的鉴定:将嫁接大豆收取的种子种植于土壤中,观察其生长状态与对照相比是否有差异,并采用小量法提取其新鲜叶片的DNA,根据重组质粒的DNA序列,设计特异性引物,以DNA为模板,按照EasyTaq DNA Polymerase说明书进行PCR扩增,引物序列如下:Pat正义引物:5′-GCACCATCGTCAACCACTAC-3′,反义引物:5′-TGAAGTCCAGCTGCCAGAAAC-3′,产物大小为440bp。选取部分转基因大豆进行半定量RT-PCR分析,结果表明GmRAV-i株系中外源基因GmRAV1已经整合到大豆基因组中,在转录水平上RNAi转基因与非转基因大豆相比GmRAV1表达受到抑制,信号非常弱。
实施例5:转GmRAV1基因过量表达大豆及转GmRAV-i干涉大豆的表型观察和功能分析
蛭石与土1:1混合后,将转GmRAV1基因过量表达大豆、转GmRAV-i干涉大豆和对照大豆DN50种植于其中,16h光/8h暗,25℃条件下生长,观察转基因大豆与对照大豆相比,植株的株高,叶片颜色,节数,荚数,节间距和开花时间的差异(图6)。
实施例6:转GmRAV1基因拟南芥、突变体拟南芥rav、GmRAV1基因恢复拟南芥GmRAV1-ox rav T4代功能分析
1GmRAV1基因增强了细胞分裂素(2-ip)的效应
种子的消毒与萌发:Columbia-0、rav、GmRAV1-ox、GmRAV1-ox rav 4种拟南芥种子于4℃春化3d后,用10%NaClO涡旋振荡消毒6-8min后,用无菌水洗5次,种在含2%蔗糖的MS培养基上,每个平皿约种100粒,在22℃和16h光照/8h黑暗的光周期下垂直培养,等待发芽。
愈伤组织的培养:向含有B5的培养基中加入2.2μmol/L 2,4-D,0.2μmol/L KT,2%蔗糖,0.59g/L MES,0.8%琼脂,pH5.5。将苗龄8d的4种拟南芥的根分别去掉头部和尾部大约5mm的区域,将剩余部分切成大约5mm的段,接种于愈伤组织培养基中,每个平皿接入越40段外植体,每种拟南芥3次重复,在22℃和16h光照/8h黑暗的光周期下培养3d。
不定芽的诱导:3d后将愈伤组织转移至含有B5的不定芽诱导培养基中,其中添加不同浓度的2-ip(0、1、5、10μmol/L),0.75μmol/L IAA,2%蔗糖,0.59g/L MES,0.8%琼脂,pH5.6。每种拟南芥接种10个外植体于每个平皿中,4种拟南芥的外植体均同时接种于每个平皿中,每个处理5个重复,在22℃和16h光照/8h黑暗的光周期下培养,等待外植体的发芽,观察其分化情况,确定最适2-ip浓度并统计在最适浓度下4种拟南芥的再生效率。当芽诱导培养基中不含有2-ip时,愈伤组织不会分化生成芽组织,当2-ip浓度为1μmol/L时有不定芽出现,当2-ip浓度小于5μmol/L时,拟南芥WT的不定芽数随着2-ip浓度的增加而增加,颜色逐渐加绿,当2-ip浓度为5μmol/L时不定芽的诱导情况最好,当2-ip浓度为10μmol/L时拟南芥WT不定芽生长情况呈下降趋势,确定了5μmol/L的2-ip浓度为诱导不定芽发生的最适浓度。选取4种不同2-ip浓度进行拟南芥的跟外植体不定芽再生实验,观察不定芽的再生图9a,并统计其再生率(表1)。
表1向B5培养基中外源施加不同浓度的细胞分裂素6-BA后3种大豆的再生率
2.GmRAV1基因增强了细胞分裂素(6-BA)的效应
Columbia-0、rav、GmRAV1-ox、GmRAV1-ox rav 4种拟南芥种子于4℃春化3d后,用10%NaClO涡旋振荡消毒6-8min后,用无菌水洗5次,种在含2%蔗糖的MS培养基上,每个平皿约种100粒,在22℃和16h光照/8h黑暗的光周期下垂直培养,等待发芽。发芽后将拟南芥移于含有0、0.5、1mg/L 6-BA的MS固体培养基上,22℃和16h光照/8h黑暗的光周期下垂直培养,6d后统计根长,并照相(图10a和b)。在0.5mg/L和1.0mg/L的6-BA处理下,rav根抑制与对照相比均不显著,RAV1ox根抑制与对照相比显著,GmRAV1-ox rav根抑制与对照相比不显著;说明突变体rav对6-BA抑制根伸长不敏感,进而说明GmRAV1基因是6-BA抑制根伸长的正调节因子。
3.GmRAV1-ox基因对表油菜素内酯epiBL的效应不敏感
Columbia-0、rav、GmRAV1-ox 3种拟南芥种子于4℃春化3d后,用10%NaClO涡旋振荡消毒6-8min后,用无菌水洗5次,种在含2%蔗糖的MS培养基上,每个平皿约种100粒,在22℃和16h光照/8h黑暗的光周期下培养,等待发芽。将发芽后拟南芥移于含有0、5、10、50mmol/L epiBL的MS固体培养基上,一半放在22℃和16h光照/8h黑暗的光周期下垂直培养,另一半放在暗下生长,10d后统计下胚轴,并照相(图12(a))。随着epiBL浓度的适量增加,WT拟南芥的下胚轴伸长与不加BR相比更长,10mmol/L达到最适浓度,当浓度再升高达到50mmol/L的时候拟南芥的伸长效果变差(图12(b))。在10mmol/L的epiBL处理下,rav下胚轴促进与对照相比显著,GmRAV1-ox下胚轴促进与对照相比不显著;说明突变体rav对6-BA抑制根伸长敏感而过表达GmRAV1-ox则超不敏感。即可通过表达GmRAV1使植株的株型向矮小方向生长,通过抑制或干扰GmRAV1基因的表达,同时使用10mmol/L的表油菜素内酯epiBL促进植株的株型向高大方向生长。
实施例7:转T2代GmRAV1基因大豆、转GmRAV-i基因干涉大豆、DN50对照大豆的功能分析
1GmRAV1基因增强了细胞分裂素(6-BA)促进再生的效应
大豆种子灭菌,将灭菌后的种子种脐向下种于萌发培养基(GM)中,每瓶种8-10粒,在23℃、16h光照/8h黑暗条件下萌发4-5天。
大豆子叶节的制备:取出无菌苗,选取萌发充分的植株,去掉种皮,于子叶下端5mm处将下胚轴切掉,沿下胚轴中线将两片子夜切开,去除真叶,得到子叶节外植体。,用解剖刀在子叶与胚轴交接处直径约3mm的范围内划3-5刀。经过此番操作,每棵无菌苗可得到2个用于转化的子叶节外植体。
不定芽的培养:切萌发7d后的大豆子叶节,将其直接转至芽诱导培养基上,进行生芽培养,观察其分化情况。芽诱导培养基以B5为基本培养基,添加5种不同浓度的6-BA(0、0.0835、0.167、1.67、3.34mg·L-1),3%蔗糖,0.59g·L-1MES,8%琼脂,pH 5.6。每个处理3次重复,每次重复接种10块愈伤组织。取再生7-10天后的大豆愈伤组织,观察其不定芽再生情况,并统计其再生效率(图9(b)和表2)。
表2向MS培养基中外源施加不同浓度的细胞分裂素2-ip后4种拟南芥的再生率
2GmRAV1基因增强了细胞分裂素(6-BA)抑制根和下胚轴的效应
种子的消毒与播种:选取饱满无菌斑的种子,放入通风厨的干燥器内,在干燥器的小烧杯内倒入96ml次氯酸钠,快速加入4ml浓盐酸后迅速盖紧。大豆在其反映产生的氯气中灭菌16h后置于超净台内通风30min,密封备用。将灭菌后的种子种脐向下种于萌发培养基(GM)中,每瓶种8-10粒,在23℃、16h光照/8h黑暗条件下萌发1-2天。
萌发大豆移至含有不同浓度6-BA培养基中:取出无菌苗,选取萌发充分的植株,转移至含有不同浓度的6-BA的培养基上,观察其生长情况。培养基以B5为基本培养基,添加3种不同浓度的6-BA(0、0.5、1.0mg·L-1),3%蔗糖,0.59g·L-1MES,8%琼脂,pH 5.6。每个处理3次重复,每次重复接种20颗大豆。
根和下胚轴生长情况的观察:观察生长7d后的大豆根和下胚轴生长情况,统计其下胚轴和根长(图10(c),(d)和(e)。
实施例8:Real-time RT-PCR分析外源施加6-BA(100μmol 6-BA)和未施加6-BA(0μmol 6-BA)的DN42大豆中GmRAV1基因的表达规律
大豆DN42培养于光照培养箱25℃,250μmol m-2sec-1白光,长日照(16h/8h光/暗)(LD)条件下于蛭石中生长,待其第一个三出复叶全展时进行处理,快速去除大豆根部的残留蛭石,将一部分大豆的根放置在含有100μmol 6-BA的1/4MS水溶液中,另一部分大豆的根放置在不含有6-BA的1/4MS水溶液中,待转移后的0、0.5、1、2、4、6、8、12、24、48h,同时对其叶片进行取材,液氮速冻,-80℃保存,提取RNA,按照SYBR(R)ExScriptTM RT-PCR Kit的程序进行荧光定量PCR反应。GmRAV1扩增片断长度为144bp,大豆看家基因Actin4(AF049106)扩增片断长度为214bp,其引物如下:GmRAV1正义引物:GGTGTAGTGGCATAGTGGC,反义引物:TAAGAAGGGGAGAAGCTAGA;Actin4正义引物:GTGTCAGCCATACTGTCCCCATTT,反义引物:GTTTCAAGCTCTTGCTCGTAATCA。
Real-time RT-PCR分析外源施加6-BA(100μmol 6-BA)和未施加6-BA(0μmol 6-BA)的DN42大豆中GmRAV1基因的表达规律如图11所示。
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明精神和范围内,都可以做各种的改动与修饰,因此,本发明的保护范围应该以权利要求书所界定的为准。
序列表
<110> 东北农业大学
<120> 一种与大豆光周期调控相关基因GmRAV1的应用
<130> 1
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 1757
<212> DNA
<213> GmRAV1
<400> 1
tcacctcatc attaataaat tgtcccaact aagcatattt ccttttccac ttaggataat 60
attaaaataa cacatttact agggactgtt tccttctata tatattccct cctcaaacaa 120
cccctattcc cacccaaact catctatctt tgcttcccct tagtcaaaca aagtaacaca 180
ccatccatcc tctctctctt ctcttcttct gttctctagt ttcctgctct tgtttcttag 240
aatccgtacg gtctaatcaa cacaacaaaa tggatgcaat tagttgcctg gatgagagca 300
ccaccaccga gtcactctcc ataagtcagg cgaagccttc ttcgacgatt atgtcgtccg 360
agaaggcttc tccttccccg ccgccgccga acaggctgtg ccgcgtcggt agcggtgcta 420
gcgcagtcgt ggattccgac ggcggcggcg ggggtggcag caccgaggtg gagtcgcgga 480
agctcccctc gtccaagtat aagggcgtcg tgccccagcc caacggccgc tggggctcgc 540
agatttacga gaagcaccag cgcgtgtggc tgggaacgtt caacgaggaa gacgaggcgg 600
cgcgtgcgta cgacgtcgcc gtgcagcgat tccgcggcaa ggacgccgtc acaaacttca 660
agccgctctc cggcaccgac gacgacgacg gggaatcgga gtttctcaac tcgcattcga 720
aatccgagat cgtcgacatg ctgcgtaagc atacgtacaa tgacgagctg gaacaaagca 780
agcgcagccg cggcttcgta cgtcggcgcg gctccgccgc cggcgccgga aacggaaact 840
caatctccgg cgcgtgtgtt atgaaggcgc gtgagcagct attccagaag gccgttacgc 900
cgagcgacgt tgggaaactg aaccgtttgg tgataccgaa gcagcacgcg gagaagcact 960
ttcctttaca gagcgctgct aacggcgtta gcgcgacggc gacggcggcg aagggcgttt 1020
tgttgaactt cgaagacgtt ggagggaaag tgtggcggtt tcgttactcg tattggaaca 1080
gtagccagag ttacgtcttg accaaaggtt ggagccggtt cgttaaggag aagaatctga 1140
aagccggtga cacggtttgt tttcaacggt ccactggacc ggacaggcag ctttacatcg 1200
attggaagac gaggaatgtt gttaacgagg tcgcgttgtt cggaccggtt gtcgaaccga 1260
tccagatggt tcggctcttt ggtgttaaca ttttgaaact acccggttca gattctatcg 1320
ccaataacaa taatgcaagt gggtgctgca atggcaagag aagagaaatg gaactctttt 1380
cattagagtg tagcaagaaa cctaagatta ttggtgcttt gtagcgttac gttacttttt 1440
ttgagttttt tttttttttg agttttgtga ctgatgaaag aaagaaggta caagaagaac 1500
ggcggtgtag tggcatagtg gcatcgcaag ttgctgcaaa aggtgaattg tatattactt 1560
aatattagat gctgaaatat taggtgtaat gtaacaaaaa actgtacaag gagaagaaaa 1620
aaggttctaa gaaggggaga agctagaaga aaaaaaatga tgtcatcatg ggataactgt 1680
ttaattgtat atgttgataa tattgttgaa tgttgattat tatgttcacg gcatctgatg 1740
ttttttttct gtttttt 1757
<210> 2
<211> 384
<212> PRT
<213> GmRAV1编码区蛋白
<400> 2
Met Asp Ala Ile Ser Cys Leu Asp Glu Ser Thr Thr Thr Glu Ser Leu
1 5 10 15
Ser Ile Ser Gln Ala Lys Pro Ser Ser Thr Ile Met Ser Ser Glu Lys
20 25 30
Ala Ser Pro Ser Pro Pro Pro Pro Asn Arg Leu Cys Arg Val Gly Ser
35 40 45
Gly Ala Ser Ala Val Val Asp Ser Asp Gly Gly Gly Gly Gly Gly Ser
50 55 60
Thr Glu Val Glu Ser Arg Lys Leu Pro Ser Ser Lys Tyr Lys Gly Val
65 70 75 80
Val Pro Gln Pro Asn Gly Arg Trp Gly Ser Gln Ile Tyr Glu Lys His
85 90 95
Gln Arg Val Trp Leu Gly Thr Phe Asn Glu Glu Asp Glu Ala Ala Arg
100 105 110
Ala Tyr Asp Val Ala Val Gln Arg Phe Arg Gly Lys Asp Ala Val Thr
115 120 125
Asn Phe Lys Pro Leu Ser Gly Thr Asp Asp Asp Asp Gly Glu Ser Glu
130 135 140
Phe Leu Asn Ser His Ser Lys Ser Glu Ile Val Asp Met Leu Arg Lys
145 150 155 160
His Thr Tyr Asn Asp Glu Leu Glu Gln Ser Lys Arg Ser Arg Gly Phe
165 170 175
Val Arg Arg Arg Gly Ser Ala Ala Gly Ala Gly Asn Gly Asn Ser Ile
180 185 190
Ser Gly Ala Cys Val Met Lys Ala Arg Glu Gln Leu Phe Gln Lys Ala
195 200 205
Val Thr Pro Ser Asp Val Gly Lys Leu Asn Arg Leu Val Ile Pro Lys
210 215 220
Gln His Ala Glu Lys His Phe Pro Leu Gln Ser Ala Ala Asn Gly Val
225 230 235 240
Ser Ala Thr Ala Thr Ala Ala Lys Gly Val Leu Leu Asn Phe Glu Asp
245 250 255
Val Gly Gly Lys Val Trp Arg Phe Arg Tyr Ser Tyr Trp Asn Ser Ser
260 265 270
Gln Ser Tyr Val Leu Thr Lys Gly Trp Ser Arg Phe Val Lys Glu Lys
275 280 285
Asn Leu Lys Ala Gly Asp Thr Val Cys Phe Gln Arg Ser Thr Gly Pro
290 295 300
Asp Arg Gln Leu Tyr Ile Asp Trp Lys Thr Arg Asn Val Val Asn Glu
305 310 315 320
Val Ala Leu Phe Gly Pro Val Val Glu Pro Ile Gln Met Val Arg Leu
325 330 335
Phe Gly Val Asn Ile Leu Lys Leu Pro Gly Ser Asp Ser Ile Ala Asn
340 345 350
Asn Asn Asn Ala Ser Gly Cys Cys Asn Gly Lys Arg Arg Glu Met Glu
355 360 365
Leu Phe Ser Leu Glu Cys Ser Lys Lys Pro Lys Ile Ile Gly Ala Leu
370 375 380
- 还没有人留言评论。精彩留言会获得点赞!