体外检测人细胞有丝分裂染色体不稳定性的方法与流程
本发明涉及生命科学技术领域,具体来说是一种体外检测人细胞有丝分裂染色体不稳定性的方法。
背景技术:
有丝分裂是细胞周期中最脆弱的时期,因为这一时期细胞会受到来自外源性或内源性化学物质的影响,造成染色体不稳定性。染色体不稳定性会进一步导致细胞的基因组不稳定,而后者是众多人类遗传-环境疾病的基础诱因,其与出生缺陷、发育异常、免疫缺陷和退行性疾病(如老年性痴呆、帕金森氏病、高血压、心血管疾病、糖尿病、骨质疏松症、肿瘤等)危险度增加高度相关。由于染色体不稳定性的指标较多,目前使用的大部分检测方法只能针对其中的少数几项,缺乏可以系统性和全方位地检测染色体不稳定的方法。体外检测人细胞有丝分裂染色体不稳定性方法的发明可以用于系统、全面地检测有丝分裂时期的染色体不稳定性现象。该技术可用于;①评价个体基因组稳定性;②评估肿瘤患者细胞的染色体不稳定性水平,从而帮助医生针对该患者选择合适的治疗手段;③评价化合物(包含药物)暴露或营养不良时(营养物缺乏或过量)的遗传毒性。
间期细胞的染色体是以一种去凝缩的方式、相对无序地分布在整个细胞核内。而当细胞进入有丝分裂时,染色体的构象发生了明显变化(图1)。首先,染色体逐渐凝缩(前期),显现出染色体雏形;第二,染色体进一步凝缩,并通过自身的一对动粒分别与两极的中心体发出的纺锤丝结合(前中期);第三,染色体被最大限度地凝缩,并均匀地排布在细胞中期板上(中期);第四,染色体被纺锤丝均匀地拉向细胞两极(后期);最后,染色体在到达细胞两极之后开始去凝缩(末期)。
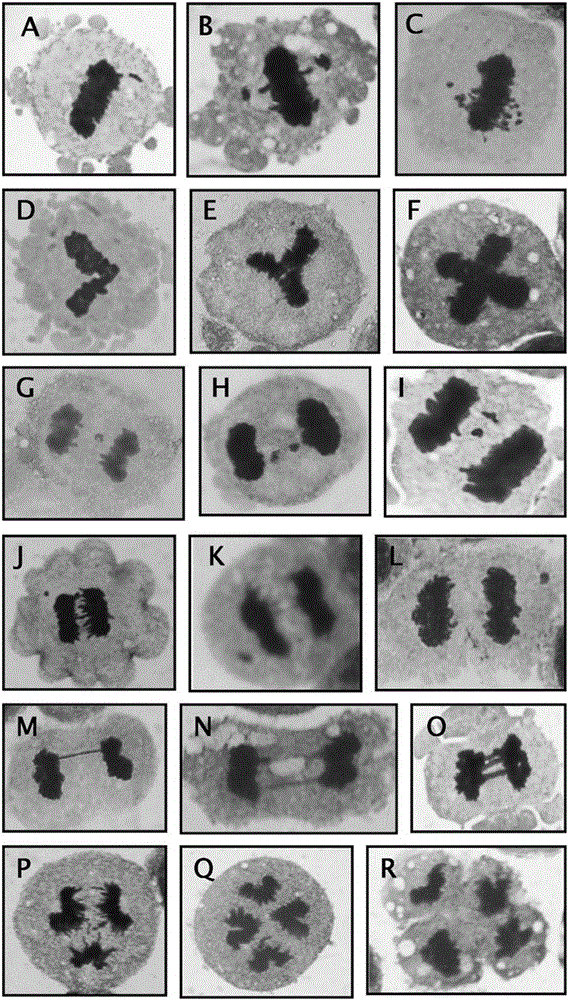
在有丝分裂时,因为失去的核膜的保护,细胞质内的化合物很容易靠近染色体并对染色体的结构和数量造成影响。染色体不稳定性主要体现在两个时期:中期(图2,A-F)和后/末期(图2,G-R)。中期时的染色体不稳定性表型特征包括染色体错误排布(chromosome misalignment,CMA)和染色体多极排布(chromosome multipolar alignment,CMPA)。CMA的主要诱因是染色体地动粒和纺锤丝没有结合或者错误地结合,导致该染色体不能及时地排布到中期板上。CMA的表现特征是一条或多条染色体脱离染色体团,游离在细胞质中(图2,A-C)。CMTA的主要诱因是因为中心体的异常扩增或片段化,形成了多极纺锤丝,从而导致染色体在中期板上形成多级排布现象。CMTA的表现特征是形成一些异常的中期染色体团构象,包括“L型”、“Y型”和“+型”等(图2,D-F)。后/末期时的染色体不稳定性表型特征包括染色体滞后(chromosome lagging,CL)、极化染色体(polar chromosome,PC)、染色质桥(chromatin bridge,CB)和染色体多极分离(chromosome multipolar segregation,CMPS)。CL的主要诱因是染色体动粒和纺锤丝的异常结合,如同一动粒同时和来自两极的纺锤丝结合(又称merotely结合),导致了该染色体同时受到两个相反方向的拉力,阻断了染色体的正常分离。CL的主要表现特征是一条或多条染色体滞后于其他主染色体团的分离,而被夹在两个被拉向两极的子代染色体团之间(图2,G-I)。
PC的主要诱因是染色体的一对动粒和来自同一极的纺锤丝结合(又称syntelic结合),导致该染色体在分离时因缺少反方向的作用力,而更快地被纺锤丝拉向中心体。PC的主要表现特征是一条或多条染色体先于其他染色体形成的子代染色体团到达细胞极(图2,J-L)。CB的主要诱因包括:①两条染色体相互融合或经错误修复而形成双着丝粒染色体,从而导致该染色体得姐妹单体无法正常分离;②染色体的姐妹单体出现不解离现象,从而导致姐妹单体在后/末期仍然黏附在一起。CB的表现特征是两个子代染色体团之间由一条或几条染色质丝相连(图2,M-O)。CMPS的主要诱因是中期的CMPA细胞成功地进入了后/末期。其表现特征是子代染色体团同时被拉向三极、四极或者更多极(图2,P-R)。
目前,用于评价染色体稳定性的黄金标准方法是中期染色体分散法(metaphase chromosome spreading)。虽然该方法可以对大部分的染色体不稳定性现象进行分析和统计,但是,该方法的缺点是:①劳动力密集。染色体分散法对于染色体分离的状态要求很高,而人细胞染色体数量多且大小差异很大,这些因素限制了染色体分散法的有效观察次数,进而增加了统计学上的误差、降低了其灵敏度。②可能会存在因人为因素造成的假阳性结果。因为使用外力(一般是滴片法和蒸汽破裂法)来破裂细胞质的和分散中期染色体可能会导致其他细胞的一条或几条染色体因外力作用而被“溅”到该细胞的染色体分散区域内。而其它一些用于检测染色体不稳定性的方法都面临着检测指标单一或者经济成本过高的缺点。因此,需要一种代替性的方法,用以弥补上述方法的不足。
技术实现要素:
本发明的目的是针对上述技术存在的不足,提供一种体外检测人细胞有丝分裂染色体不稳定性的方法。
为实现上述目的,本发明采用的技术方案是:一种体外检测人细胞有丝分裂染色体不稳定性的方法,步骤包括:
(1)细胞培养:NCM460细胞使用RPMI-1640培养基,添加10%的新生牛血清、2mM的1%的谷氨酰胺以及5000IU/mL的0.1%的青霉素和5mg/mL链霉素,NCM460细胞培养在75cm2的玻璃或聚苯乙烯培养瓶中,放置CO2含量为5%、温度为37℃的湿润培养箱中;
(2)细胞处理:按5×105个/mL的密度将处于指数生长期的NCM460细胞接种到24孔板中,并分别加入0.05μg/mL和0.1μg/mL的丝裂霉素C处理24h,阴性对照组为不加丝裂霉素C的非处理组;
(3)细胞收集:处理结束后,将培养基上清收集到离心管中,并用磷酸缓冲盐溶液缓慢地清洗贴壁细胞2-3次,然后加入质量浓度为0.25%的胰蛋白酶,在37℃环境下对细胞进行短暂的消化,加入培养基上清将细胞吹打成单细胞悬液;
(4)细胞浓缩:将细胞悬液重新转移到离心管中,在1000转/分的条件下离心5分钟,弃上清加入少量的新鲜培养基并将细胞团块吹打成单细胞悬液;
(5)细胞涂片:将浓缩的细胞转移到涂片离心机中,在800转/分的条件下离心5分钟;
(6)细胞固定:取出载玻片,在室温下干燥5-10分钟,待完全干燥后将载玻片置于冰甲醇中、置于-40℃的环境下固定15分钟;
(7)细胞染色:将固定后的载玻片置于10%的吉姆萨染液中染色10分钟,之后将载玻片取出,在蒸馏水中缓慢地清洗3遍以上,并置于避光条件下室温干燥;
(8)细胞封片:带载玻片充分干燥后,使用中性树脂和大小为18mm×18mm的盖玻片对载玻片进行封片,封片完的载玻片在待计数之前应严格避光保存;
(9)染色体不稳定统计:使用光学显微镜对有丝分裂细胞进行观察,并对其中染色体不稳定指标进行频率统计。
进一步的,步骤(9)中,所述不稳定指标包括染色体错误排布、染色体多极排布、染色体滞后、极化染色体、染色质桥和染色体多极分离。
进一步的,所述染色体错误排布和染色体多极排布统计时,中期细胞统计数≥200个;所述染色体滞后、极化染色体、染色质桥和染色体多极分离,后/期细胞统计数≥100个。
本发明中,染色体错误排布(CMA)、染色体多极排布(CMPA)、染色体滞后(CL)、极化染色体(PC)、染色质桥(CB)和染色体多极分离(CMPS)的认定标准如下:
1、染色体错误排布(CMA)的认定标准(图2,A-C):①、细胞需处于中期;②、主染色体团的构象应该是两极分裂时的长直条状;③、未排布染色体与主染色体团之间存在明显的界限。
2、染色体多极排布(CMPA)的认定标准(图2,D-F):①、细胞需处于中期;②、主染色体团的构象应该是除二极排布的长直条状外的其他形状,主要包括“L型”、“Y型”和“+型”等。
3、染色体滞后(CL)的认定标准(图2,G-I):①、细胞应处于晚后期或者末期,因为在早后期时,子代染色体团之间分离的距离太短,无法认清染色体是否滞后;②、细胞需进行二极分裂,且两个子代染色体团大小应当相同或相近;③、滞后的染色体应当处于两个子代染色体团的包裹之中;④、处于两个子代染色体团之间的染色体应当不与其中任何一方有接触。
4、极化染色体(PC)的认定标准(图2,J-L):①、细胞应处于后期或者末期;②、细胞需进行二极分裂,且两个子代染色体团的大小应当相同或相近;③、极化的染色体在分离上应当快于子代染色体团,即更靠近两极;④、极化的染色体与同一极的子代染色体团之间需存在明显的间隔。
5、染色质桥(CB)的认定标准(图2,M-O):①、细胞应处于晚后期或者末期,因为在早后期时,子代染色体团之间分离的距离太短,无法认清是否存在染色质桥;②、细胞需进行二极分裂,且两个子代染色体团大小应当相同或相近;③、两个子代染色体团之间应该由一条或多条连续的染色质丝相连。
6、染色体多极分离(CMPS)的认定标准(图2,P-R):①、细胞应处于后期或者末期;②、各子代染色体团应当被拉向明显不同的方向,但是,如有两个或以上的子代染色体团被拉向同一方向,只要它们之间有明显的界限,仍可被看作是多极分离;③、因为多极分离时,染色体动粒和纺锤丝的结合基本上是随机的,所以对各子代染色体团之间的大小差异没有严格的要求。
本发明的有益技术效果是:本方法是一种系统性、全方位检测有丝分裂染色体不稳定性的方法,和其他方法相比,本方法的优点在于:①、可同时检测多类染色体不稳定现象,分析某一化合物是染色体毒物和/或有丝分裂毒物;②、具有很强的灵敏度,可检测极低剂量的遗传毒性物质;③、可以极大地减小因人为原因而造成的假阳性现象;④、具有简单、易操作的特点,可以有效地节省劳动力,具有高通量应用的潜能;⑤、经济成本较低,适用于大部分实验室开展实施。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1:染色体在细胞间期和有丝分裂期时的构象变化过程;其中,上排为示意图,下排为显微图,示意图中染色体为棕色,中心体为淡绿色,纺锤丝为深绿色,下排显微图中被吉姆萨染液染成红色部分为染色体,蓝色部分为细胞膜和细胞质(100×油镜下拍摄);
图2:染色体不稳定(CIN)的分类,CIN可分为中期CIN(A-F)和后/末期CIN(G-R),中期CIN包括染色体异常排布(CMA;A-C)和染色体多极排布(CMPA;D-F)。后/末期CIN包括染色体滞后(CL;G-I)、极化染色体(PC;J-L)、染色质桥(CB;M-O)和染色体多极分离(CMPS;P-R),各显微图中被吉姆萨染液染成红色部分为染色体,蓝色部分为细胞膜和细胞质(100×油镜下拍摄)。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
一种体外检测人细胞有丝分裂染色体不稳定性的方法,步骤包括:
1、细胞处理流程
(1)细胞培养:NCM460细胞使用RPMI-1640培养基,添加10%的新生牛血清、2mM的1%的谷氨酰胺以及5000IU/mL的0.1%的青霉素和5mg/mL链霉素,NCM460细胞培养在75cm2的玻璃或聚苯乙烯培养瓶中,放置CO2含量为5%、温度为37℃的湿润培养箱中;
(2)细胞处理:按5×105细胞/mL的密度将传代中的NCM460细胞接种到24孔板中,并分别加入0.05μg/mL和0.1μg/mL的丝裂霉素C处理24h,阴性对照组为不加丝裂霉素C的非处理组;
(3)细胞收集:处理结束后,将培养基上清收集到离心管中,并用磷酸缓冲盐溶液缓慢地清洗贴壁细胞2-3次,然后加入质量浓度为0.25%的胰蛋白酶,在37℃环境下对细胞进行短暂的消化,加入培养基上清将细胞吹打成单细胞悬液;
(4)细胞浓缩:将细胞悬液重新转移到离心管中,在1000转/分的条件下离心5分钟,弃上清加入少量的新鲜培养基并将细胞团块吹打成单细胞悬液;
(5)细胞涂片:将浓缩的细胞转移到涂片离心机中,在800转/分的条件下离心5分钟;
(6)细胞固定:取出载玻片,在室温下干燥5-10分钟,待完全干燥后将载玻片置于冰甲醇中、置于-40℃的环境下固定15分钟;
(7)细胞染色:将固定后的载玻片置于10%的吉姆萨染液中染色10分钟,之后将载玻片取出,在蒸馏水中缓慢地清洗3遍以上,并置于避光条件下室温干燥;
(8)细胞封片:带载玻片充分干燥后,使用中性树脂和大小为18mm×18mm的盖玻片对载玻片进行封片,封片完的载玻片在待计数之前应严格避光保存;
2、染色体不稳定性指标的计数和认定标准
有丝分裂细胞计数,使用光学显微镜(10×目镜和100×物镜)对有丝分裂细胞进行观察,并对其中染色体不稳定指标进行频率统计,对于染色体异常排布和染色体多极排布,应当至少统计200个中期细胞;而对于染色体滞后,极化染色体、染色质桥和染色体多极分离,应当至少统计100个后/期细胞。
(1)、染色体错误排布(CMA)的认定标准(图2,A-C):
①、细胞需处于中期;
②、主染色体团的构象应该是两极分裂时的长直条状;
③、未排布染色体与主染色体团之间存在明显的界限。
(2)、染色体多极排布(CMPA)的认定标准(图2,D-F):
①、细胞需处于中期;
②、主染色体团的构象应该是除二极排布的长直条状外的其他形状,主要包括“L型”、“Y型”和“+型”等。
(3)、染色体滞后(CL)的认定标准(图2,G-I):
①、细胞应处于晚后期或者末期,因为在早后期时,子代染色体团之间分离的距离太短,无法认清染色体是否滞后;
②、细胞需进行二极分裂,且两个子代染色体团大小应当相同或相近;
③、滞后的染色体应当处于两个子代染色体团的包裹之中;
④、处于两个子代染色体团之间的染色体应当不与其中任何一方有接触。
(4)、极化染色体(PC)的认定标准(图2,J-L):
①、细胞应处于后期或者末期;
②、细胞需进行二极分裂,且两个子代染色体团的大小应当相同或相近;
③、极化的染色体在分离上应当快于子代染色体团,即更靠近两极;
④、极化的染色体与同一极的子代染色体团之间需存在明显的间隔。
(5)、染色质桥(CB)的认定标准(图2,M-O):
①、细胞应处于晚后期或者末期,因为在早后期时,子代染色体团之间分离的距离太短,无法认清是否存在染色质桥;
②、细胞需进行二极分裂,且两个子代染色体团大小应当相同或相近;
③、两个子代染色体团之间应该由一条或多条连续的染色质丝相连。
(6)、染色体多极分离(CMPS)的认定标准(图2,P-R):
①、细胞应处于后期或者末期;
②、各子代染色体团应当被拉向明显不同的方向。但是,如有两个或以上的子代染色体团被拉向同一方向,只要它们之间有明显的界限,仍可被看作是多极分离。
③、因为多极分离时,染色体动粒和纺锤丝的结合基本上是随机的,所以对各子代染色体团之间的大小差异没有严格的要求。
本技术领域技术人员可以理解,除非另外定义,这里使用的所有术语(包括技术术语和科学术语)具有与本发明所属领域中的普通技术人员的一般理解相同的意义。还应该理解的是,诸如通用字典中定义的那些术语应该被理解为具有与现有技术的上下文中的意义一致的意义,并且除非像这里一样定义,不会用理想化或过于正式的含义来解释。
最后所应说明的是:以上实施例仅用以说明而非限制本发明的技术方案,尽管参照上述实施例对本发明进行了详细说明,本领域的普通技术人员应该理解:依然可以对本发明进行修改或者等同替换,而不脱离本发明的精神和范围的任何修改或局部替换,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!