鉴定恶性疟原虫Pfmspdbl2基因多态性的引物及方法与流程
本发明属于生物检测领域,具体涉及鉴定Pfmspdbl2基因多态性的引物及方法。
背景技术:
疟疾是一种严重危害人类健康的虫媒传播寄生虫病。据世界卫生组织统计,目前全球有102个国家和地区流行疟疾,约34亿人受威胁,每年约有2亿病例,近60万人死亡,其中恶性疟原虫(Plasmodium falciparum)对人类造成的致死率最高。疟原虫生活史包含人和按蚊两个宿主,在人体内先后寄生于肝脏细胞和红细胞中,称为红内期和红外期。恶性疟原虫裂殖子入侵红细胞是疟疾感染并致病的关键性步骤,入侵红细胞相关的蛋白主要分布在裂殖子表膜和棒状体,微线体,致密颗粒等细胞器,通常具有裂殖体期特异性表达,确定相关入侵蛋白并阐明裂殖子入侵红细胞机制是阻断入侵的前提,更是防治疟疾的重要手段。裂殖子表膜蛋白(Merozoite surface protein,MSP)家族是参与疟原虫入侵红细胞的重要蛋白,被认为是红内期疫苗研究潜在的靶抗原,是当前疟疾研究的热点。
恶性疟原虫的基因分型是近年来国际上的研究热点。不同基因型的恶性疟原虫虫株可能与其致病性、抗原性及对药物的敏感性有一定的关系。MSP3家族成员MSPDBL2是恶性疟原虫入侵红细胞的重要蛋白,以Pfmspdbl2为标靶研制相关疫苗之前必须考虑并分析其基因多态性特点,评估其在不同地理区域和不同人群中的多态性变异水平十分重要。
技术实现要素:
本发明要解决的技术问题之一是提供一种鉴定恶性疟原虫Pfmspdbl2基因多态性的特异性引物。
本发明要解决的技术问题之二是提供一种鉴定恶性疟原虫Pfmspdbl2基因多态性的方法。
本发明首先提取待测恶性疟原虫基因组DNA,然后通过对恶性疟原虫Pfmspdbl2基因进行PCR扩增,将所获得的扩增产物送测序,经序列比对后,得到多态性鉴定结果。
为了解决上述技术问题,本发明通过如下技术方案实现:
本发明第一个方面是提供了一对用于恶性疟原虫Pfmspdbl2基因PCR扩增的特异性引物,其序列为:
上游:5′-GCATTCGATATATGTAATAATTATTAT-3′(如SEQ ID NO:1所示);
下游:5′-GCTTTATAAGAAACACATATCTAA-3′(如SEQ ID NO:2所示)。
本发明第二个方面提供了一种鉴定恶性疟原虫Pfmspdbl2基因多态性的方法,包括如下步骤:
1)提取待测恶性疟原虫基因组DNA;
2)恶性疟原虫Pfmspdbl2基因序列的扩增(用PCR技术从含有目的基因的恶性疟原虫基因组DNA中获取恶性疟原虫Pfmspdbl2的DNA片段);
3)分别将扩增产物送测序,经序列比对后,得到多态性鉴定结果。
步骤1)具体为:用打孔器将血滤纸片剪裁成直径约3cm的小片,3枚,放入1.5ml离心管中,按照试剂盒的操作手册,提取待测恶性疟原虫基因组DNA。
步骤2)具体为:以恶性疟原虫基因组DNA作为模板,设计SEQ ID NO:1和SEQ ID NO:2所示的核苷酸序列为引物,进行PCR扩增。所述PCR扩增的反应条件为98℃预变性3.0min,98℃变性10sec,55℃退火15sec,68℃延伸3.0min,35个循环;68℃延伸10min,最后保存于4℃。
步骤3)具体为:分别将扩增产物送测序,经序列比对后,得到多态性鉴定结果。
附图说明
图1是实施例1中恶性疟原虫Pfmspdbl2基因扩增结果示意图。图1中,M:DNA分子量标准;1-10:PCR产物。
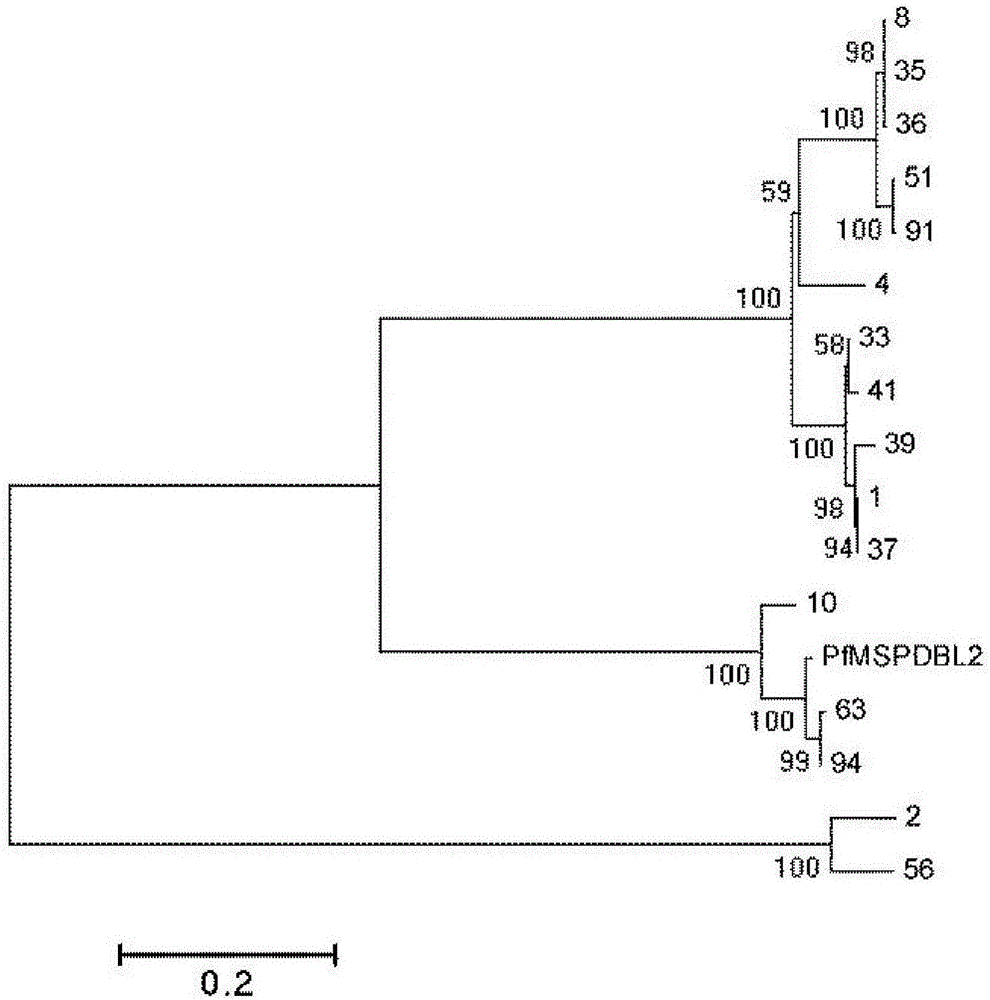
图2是实施例1中恶性疟原虫Pfmspdbl2基因NJ进化树分析图。
图3是实施例1中恶性疟原虫Pfmspdbl2基因多态性π值分析图。
图4是实施例1中恶性疟原虫Pfmspdbl2基因多态性Tajima’s D值的分析图。
具体实施方式
下面将结合附图对本发明的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
实施例1恶性疟原虫Pfmspdbl2基因多态性的鉴定
1材料
1.1恶性疟原虫基因组DNA
来自于被恶性疟原虫感染的病人的滤纸血,从云南省疟疾流行区采集。
1.2主要试剂
2方法
2.1恶性疟原虫Pfmspdbl2基因的扩增
根据恶性疟原虫标准株3D7株Pfmspdbl2基因为目的扩增片段,利用上海英骏生物技术有限公司引物设计软件设计一对特异性引物,该特异性引物由上海英骏生物技术有限公司合成。引物序列如下:
上游:5′-GCATTCGATATATGTAATAATTATTAT-3′(如SEQ ID NO:1所示);
下游:5′-GCTTTATAAGAAACACATATCTAA-3′(如SEQ ID NO:2所示)。
以恶性疟原虫基因组DNA作为模板,进行PCR扩增。反应条件
为98℃预变性3.0min,98℃变性10sec,55℃退火15sec,68℃延伸3.0min,35个循环;68℃延伸10min,最后保存于4℃。DNA聚合酶购自TaKaRa。反应体系为25.0μl,具体为5x PrimeSTAR GXL Buffer(缓冲液)5.0μl;dNTP Mixture(2.5mM each)2.0μl;Primer F(上游引物)(10μM each)1.0μl;Primer R(下游引物)(10μM each)1.0μl;Template DNA(DNA模板)3.0μl;PrimeSTAR GXL DNA Polymerase(聚合酶)0.5μl;Nuclease-free water(无核酸酶水)12.5μl。
2.2恶性疟原虫Pfmspdbl2基因扩增产物的测序和序列分析
将PCR扩增成功的产物送上海华大基因公司进行测序,选用标准株3D7作为参照。利用BioEdit软件对所获得的基因序列进行排序分析,利用MEGA4.1评估序列多态性。
3结果
3.1恶性疟原虫Pfmspdbl2基因的扩增
以恶性疟原虫基因组DNA作为模板,进行PCR扩增,扩增出2043bp与预期长度一致的目的片段(见图1),表明成功扩增出Pfmspdbl2基因。
3.2恶性疟原虫Pfmspdbl2基因扩增产物的测序和序列分析
3.2.1测序分型结果
PCR产物送北京六合华大基因科技股份有限公司上海分公司测序。测序结果显示,Pfmspdbl2基因16样本中,野生型占81.25%(13/16),突变型占18.75%(3/16),NJ进化树见图2。
3.2.2π和dn/ds比值分析
以MEGA4.1软件分析中缅边境16样本Pfmspdbl2核苷酸序列多态性结果显示π值为0.04461,利用DnaSP软件统计16个序列,Pfmspdbl2的dn/ds值为1.50934(dn/ds>1比值分析显示该多态性可能整体上受到正向选择的影响(见图3)。
3.2.3Tajima检验
Pfmspdbl2的Tajimas’s D值为0.24087,p>0.05没有统计学意义,但是Tajima’s D大于0,说明Pfmspdbl2是受平衡选择的影响(见图4)。
4讨论
疟疾的流行除受社会、自然和文化环境影响之外,其本身复杂多样的遗传结构亦是影响疟疾流行的重要原因。不同地理株恶性疟原虫存在表型差异,多表现在药物抗性及毒力、生长繁殖、基因表达、入侵红细胞和配子体产生等方面。在恶性疟原虫中,裂殖子表面蛋白MSP1和裂殖子表面蛋白MSP2在序列和大小上具有显著多态性,裂殖子表面蛋白MSP3的多态性则相对局限。MSP3家族成员MSPDBL2是恶性疟原虫入侵红细胞的重要蛋白,以MSPDBL2为标靶研制相关疫苗之前必须考虑并分析其基因多态性特点,评估其在不同地理区域和不同人群中的多态性变化水平十分重要。
本发明公开了一种鉴定恶性疟原虫Pfmspdbl2基因多态性的引物及方法,Pfmspdbl2多态性的影响因素分析,可为以Pfmspdbl2为基础建立有效传播阻断疫苗的研究提供一定的线索。同时对基因型序列的了解,对于判断传染来源,了解病例是输入感染还是当地感染具有重要的作用。
综上所述,上述各实施例及附图仅为本发明的较佳实施例而已,并不用以限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,皆应包含在本发明的保护范围内。
序列表
<110>中国疾病预防控制中心寄生虫病预防控制所
<120>鉴定恶性疟原虫Pfmspdbl2基因多态性的引物及方法
<130> CPC-NP-16-100346-1
<160> 2
<170> PatentIn version 3.4
<210> 1
<211> 27
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> 引物
<400> 1
GCATTCGATATATGTAATAATTATTAT 27
<210> 2
<211> 24
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> 引物
<400> 2
GCTTTATAAGAAACACATATCTAA 24
- 还没有人留言评论。精彩留言会获得点赞!