中介素相关多肽及其在脓毒症预防和治疗中的用途的制作方法
本发明属于生物医药领域,涉及一种来源于中介素(Intermedin,IMD;又名Adrenomedullin2,ADM2)的多肽及其在脓毒症预防和治疗中的用途。
背景技术:
脓毒症(sepsis),其英语单词来源于希腊语“sepo”(意为“腐烂”)(1),其定义为感染引起的全身炎性反应综合征(systemic inflammatory response syndrome,SIRS)(2)。脓毒症也临床ICU患者中最常见的危重症(2-4)。脓毒症的总体发病率约为0.3%,全球每年发生的例数约1800万,我国据推算不少于400万例/年,且发病率以每年1.5%的速度继续增长。有数据显示,美国在过去30年内,临床ICU患者的脓毒症发病率从8.7%上升到了30%,每年有21.5万人死于脓毒症及其后续并发症,其医疗费用超过200亿美元(4)。脓毒症若不及时治疗,可进一步发展为严重脓毒症(severe sepsis),即sepsis合并多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),或经过充分容量复苏后仍然持续的低血压状态和组织灌注不足,即进展为脓毒症休克(septic shock),最终导致患者死亡(5,6)。
2008年的拯救脓毒症运动(surviving sepsis campaign,SSC)提出了早期目标导向性治疗(early goal-directed therapy,EGDT)的理念(7)。EGDT的核心是确诊感染和控制控制,血流动力学的复苏以及组织氧供/氧需平衡的恢复。据此将脓毒症的治疗归纳为以下四个方面:控制感染,血流动力学的稳定和支持治疗,代谢/内分泌的支持治疗,以及其他支持治疗(8)。然而,虽然抗感染治疗和器官功能支持技术的不断进步使得sepsis的预后有一定改善,但其临床死亡率仍然超过30%(5,9)。其主要原因之一是除了抗感染和对症支持治疗外,缺少特异性针对脓毒症的治疗性药物。因此,亟需对脓毒症发生的机制进行更深入的研究,并寻找更有效治疗手段。
在很长一段时间内,研究者都认为sepsis代表了一类由感染性病原体引起的超出机体控制的恶性炎性反应,主要特征为“细胞因子风暴(cytokine storm)”,即机体免疫系统为应对侵入机体的病原体在短时间内产生大量的细胞和炎症因子,包括肿瘤坏死因子-α(TNF-α)、白介素-1(IL-1)、白介素-6(IL-6)、白介素-12(IL-12)、干扰素-α(IFN-α)、干扰素-β(IFN-β)、干扰素-γ(IFN-γ)、单核细胞趋化蛋白-1(MCP-1)等(10-13)。细胞因子风暴被认为是一种超出机体控制的免疫反应,破坏了机体的正常生理机制,对机体造成的二次炎性损伤往往超过引起疾病本身的病原体(14,15)。因此,到目前为止,针对脓毒症的治疗研究和药物开发,主要集中于抗细胞因子和炎症因子方面。然而,数十年来以抗炎治疗为主的临床研究,包括皮质类固醇疗法(16)、TNF-α拮抗剂(17)、IL-1受体抑制剂(18)及其他抗炎症反应级联效应物的药物(19),以及针对引发炎性反应的细菌内毒素的抗内毒素抗体(20,21)等,均未能有效提高脓毒症病人的生存率(12,22)。重组人活化蛋白C(activated protein C,APC)是首个在临床试验中发现对脓毒症治疗有效的抗炎类药物(23,24),也是唯一通过临床III期实验的抗脓毒症药物。然而,由于在更大样本的多中心临床随机对照研究中未能证实APC可有效提高脓毒症患者生存率,最终在2013年从市场被撤回(25)。也就是说,虽然已经过数十年的研究,目前除抗感染和对症支持治疗外,仍未能开发出一种特异性针对脓毒症的治疗性药物(6,22,26)。这引发了人们对以抗炎症因子为主的研究方案的质疑,也提示了目前对脓毒症发病机制的理解仍存在许多不足。
近年来研究发现,除感染和全身炎性反应外,血管和内皮细胞功能也是影响脓毒症疾病进程的关键因素(27,28)。脓毒症最重要的病理改变之一就是内皮屏障破坏引起血管通透性增高,导致炎性渗出增加和组织水肿(27)。在脓毒症发生过程中,细胞因子风暴首要的攻击对象就是血管内皮屏障(endothelial barrier)。VE-cadherin(VEC)是形成血管内皮屏障的关键分子,机体分泌的主要炎症介质TNF-α和血管因子VEGF等可促使VEC分子之间相互解离,导致内皮细胞连接(endothelial junction)松解,引起血管内皮屏障破坏和血管通透性增高(29),使细胞因子和炎症因子更易透过细胞膜;而全身循环系统处于高凝状态,机体分泌的主要促凝血因子之一凝血酶(thrombin)也可诱导血管通透性增加(30)。这样,炎性介质和促凝血因子的释放引起了血管通透性增高,导致液体渗出、血容量降低和组织水肿,反过来又进一步加重了机体损伤(15)。由于血管内皮屏障破坏是导致脓毒症进一步恶化的关键因素,因此保护血管内皮、改善微循环状态就成为了抗脓毒症的一个可能的治疗策略。
中介素(intermedin,IMD)是2004年发现的一种内源性多肽,隶属于降钙素基因相关肽家族(calcitonin gene related peptide,CGRP),该家族包括降钙素(calcitonin,CT)、前降钙素(pro-calcitonin,PCT)、胰淀粉酶(amylin)、降钙素基因相关肽(CGRP)以及肾上腺髓质素(adrenomedullin,ADM)等,是一类在体内广泛表达、具有多种生物学活性的内源性激素样肽(31-33)。研究发现,IMD在垂体、下丘脑、心、肺、肾、乳腺、胰腺、卵巢、胃、大肠、小肠、唾液腺、下颌腺、结缔组织、淋巴样组织内均有表达,从其分布的广泛程度来看,IMD很可能具有重要的生物学活性(31-33)。从2004年被发现开始,对IMD的研究主要集中在对心肌的直接作用(正性(34)或负性(35,36)肌力作用)、对肾脏的保护作用(促进肾血管灌流和尿钠排泄等作用(37,38)、抗氧化应激作用(39-42)、以及对心、肾缺血再灌注损伤的保护作用(43-45)等方面。近年来的研究还发现,IMD具有调控新生血管形成,维持微血管内皮屏障的完整性、减轻血管渗漏等作用(46-49)。重要的是,IMD能够调控VEGF和VEC这两个影响内皮屏障和血管通透性的关键分子的活性,提示IMD可能在脓毒症发生发展过程中起重要作用。
目前,本领域还很缺乏在脓毒症发生发展过程有良好预防或者治疗作用的药物,这是长期以来困扰本领域的技术难题。
技术实现要素:
本发明要解决的技术问题是为脓毒症的预防和治疗提供一种新的手段。本发明解决技术问题的技术方案是提供了一种多肽。该多肽的的氨基酸序列如下式所示:
VGCVLGTCQVQNLSHRLWQLX1X2PX3GRX4DSAPVDPSSPHSY,其中的X1=M或V或I;X2=G或R;X3=A或S或N;X4=Q或R或E或D。
其中,上述多肽的两个C残基之间形成二硫键。
进一步的,上述多肽的碳端酪氨酸进行了α位酰胺化修饰。
更进一步的,上述氨基酸多肽的序列如SEQ ID No.1、SEQ ID No.2或SEQ ID No.3所示。
本发明还提供了编码上述多肽的基因。
本发明也提供了含有上述的基因的载体。所述载体可为质粒载体、病毒载体等本领域常用基因载体。
本发明还提供了含有上述基因载体的宿主细胞。
同时,本发明还提供了上述的多肽、基因、基因载体或宿主细胞在制备预防或治疗脓毒症的药物中的用途。
其中,上述的脓毒症为脓毒症的急性炎性反应综合征(SIRS)、单纯脓毒症(sepsis)、重症脓毒症(severe sepsis)或脓毒症休克(septic shock)中的至少一种。
在此基础上,本发明还提供了一种预防或治疗脓毒症的药物。该药物是由上述的多肽、核基因、基因载体或宿主细胞添加药学上可接受的辅助性成分制备而成。
其中,上述的脓毒症为包括脓毒症的急性炎性反应综合征(SIRS)、单纯脓毒症(sepsis)、重症脓毒症(severe sepsis)或脓毒症休克(septic shock)中的至少一种。
各种脓毒症的简要划分或诊断标准:单纯脓毒症(Sepsis)=SIRS+确诊感染;重症脓毒症(severe sepsis)=单纯脓毒症(Sepsis)+一个或多个器官功能衰竭;脓毒症休克(septic shock)=单纯脓毒症(Sepsis)+休克。
进一步的,上述的药物的剂型为注射剂。
本发明的有益效果在于:本发明创造性提供了一种IMD相关多肽,该多肽氨基酸序列更短,但是实验证明能在脓毒症进展过程中有效保护血管内皮屏障、减轻液体渗漏和组织水肿、显著减轻脓毒症小鼠血清中TNF-α、IL-1β、IL-6和MCP等主要炎症因子的水平、从而对机体产生明显的保护作用,注射该多肽可显著改善脓毒症小鼠的生存率和生存时间。而对该IMD相关多肽进行酰胺化修饰,则能得到更好疗效。综合看来,本发明所涉及的IMD相关多肽,在脓毒症预防和治疗方面具有很好的应用前景。
附图说明
图1、展示人、小鼠和大鼠IMD1-53,IMD1-47和IMD1-40等多肽的异同。
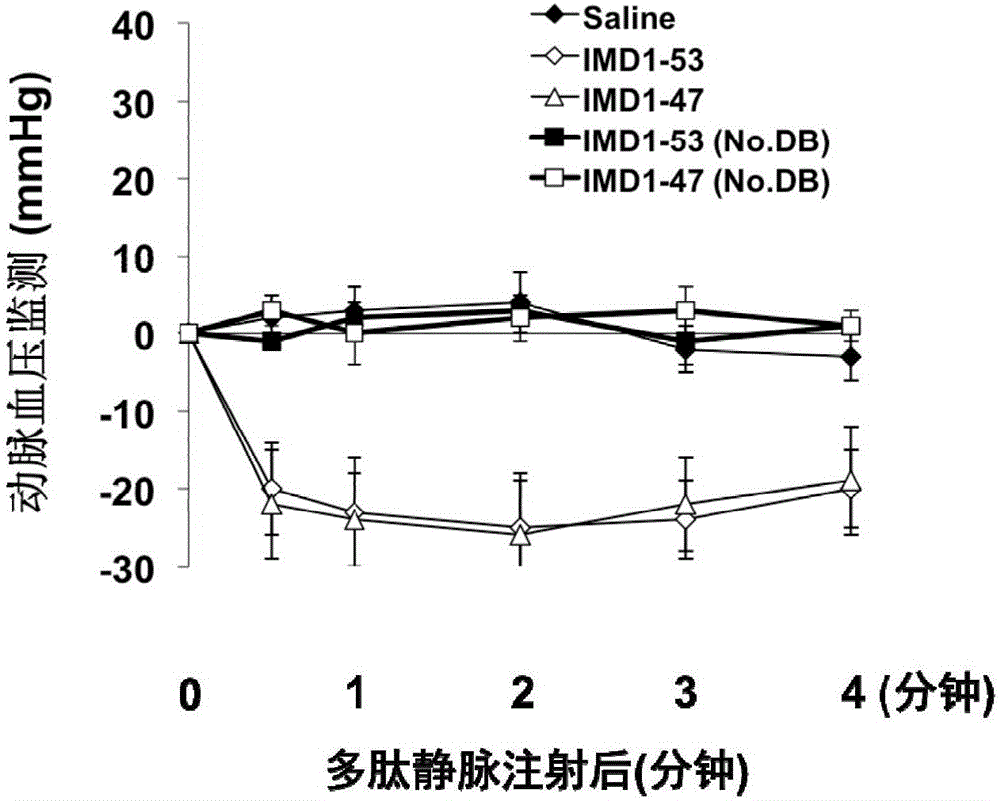
图2、有无二硫键对IMD1-53和IMD1-47的降血压作用的影响实验结果。
图3、IMD1-40与IMD1-47、IMD1-53对颈动脉血压的影响实验结果
图4、体内血管渗漏实验。表明MD1-40与IMD1-47、IMD1-53相比,其血管保护作用更强。
图5、IMD1-40与IMD1-31对颈动脉血压的影响实验结果。
图6、IMD1-40与IMD1-31及体内血管渗漏实验结果。
图7、IMD1-40对脓毒症短期生存模型小鼠的保护实验结果。
图8、C末端酰胺化的IMD1-40的血管保护实验结果。
图9、C末端酰胺化的IMD1-40对脓毒症短期生存模型小鼠的保护实验结果,表明能减轻细胞因子风暴。
图10、C末端酰胺化的IMD1-40对脓毒症长期生存模型小鼠的保护实验结果。
图11、IMD1-40在使用野生型或IMD敲除鼠建立的脓毒症模型中保护实验结果。
具体实施方式
以下结合附图通过具体实施方式的描述以详细说明但不限制本发明。
本发明创造性提供了一种IMD相关多肽IMD1-40,来自于中介素(英文名Intermedin,IMD;或Adrenomedullin2,ADM2;是一种内源性钙调素家族多肽),该多肽全长(包括信号肽)为147 个氨基酸,IMD1-40为其剪切后多肽片段,为第108到第147个氨基酸。本发明研究了人、小鼠和大鼠IMD1-53,IMD1-47和IMD1-40这些多肽的异同(参见图1)。其中IMD1-53为第95到第147个氨基酸的肽段,IMD1-47为第101到第147个氨基酸的肽段,IMD1-40为第108到第147个氨基酸的肽段。
如图1所示,在IMD多肽的羧基末端(C端),有13个氨基酸(图1中下划线标注部分)在人、小鼠、大鼠间的跨物种比较中完全相同。本发明通过研究发现,这段序列与IMD和受体CRLR之间的结合有关键作用,去掉这段序列,IMD多肽既不能与CRLR结合、也无降血压等生物学活性。在前期研究中发现使用针对这13个氨基酸序列的单克隆抗体,可对人和小鼠这两个物种的IMD多肽均产生抗原抗体结合反应,同时不与IMD的另一家族成员ADM(adrenomedullin)产生交叉反应。因此,本发明认为这段序列与IMD的受体结合能力密切相关。并且这一段序列在各物种间极为保守,因此如要制备具有生物学活性的IMD多肽,那么这13个氨基酸必须保留。
而从N端开始第13位到第29位之间(本发明中均是以人类IMD1-53片段序列的氨基端为基准定义各个氨基酸的序号)的22个氨基酸(斜体标注)则也为高度保守序列,在人、小鼠、大鼠之间完全相同。我们还发现,在这段保守序列中,在第15位和第20位的两个半胱氨酸之间形成一个二硫键,该二硫键可将IMD多肽变为环肽。本发明的研究表明,这个二级结构与IMD的生物学功能可能更为关键:在IMD1-53和IMD1-47的一级结构(氨基酸序列)保持不变,但如果没有第15位和第20位半胱氨酸之间的二硫键,则这两条多肽均无生物学活性(参见图2)。
本发明通过进一步的分析发现,由于第12位存在精氨酸会形成侧链,因此IMD1-53和IMD1-47的侧链长度不同,我们猜测这种差异可能会影响这两条多肽的活性。我们大胆假设,只要包含第15位和第20位之间的二硫键这个结构,IMD即能形成环肽并具有生物学活性。因此,我们进一步将多肽缩短,去掉了第12位的精氨酸,将IMD多肽进一步缩短为仅有40个氨基酸的IMD1-40。我们在实验中发现,IMD1-40虽然不含第12位的精氨酸,但具有与IMD1-53和IMD1-47类似的心血管活性,即静脉注射后血压短暂下降、在2min后达到峰值,之后血压缓慢回升(图3)。同时,IMD1-40的作用还更加稳定,在皮下注射时,对TNF-α诱导的血管渗漏也具有更好和更持久的保护作用(图4)。
但是,如果将IMD1-40进一步截短,去掉第15位和第20位之间的二硫键的结构,可得到一个更短的多肽IMD1-31(为IMD全长肽的第137到第147个氨基酸)。我们发现,IMD1-31不仅仅不具有IMD的心血管保护活性,甚至具有相反的作用(图5)。我们分析认为这可能是因为IMD1-31包含C末端13个氨基酸的保守序列、因此具有与受体CRLR结合的能力,但无第15至第20位之间的二硫键空间结构,因此无心血管保护活性,反而与正常的IMD多肽互为竞争配体,因此类似于IMD的竞争性拮抗剂。进一步的,本发明通过血管渗漏实验实验发现,IMD1-31确实可以阻断IMD1-40的保护血管内皮屏障的作用(图6);在脓毒症的治疗实验中也发现,IMD1-40可显著提升脓毒症小鼠的生存率,但IMD1-31反而使脓毒症的生存情况恶化(图7)。
本发明的更进一步的研究还发现,在合成多肽时将最后一位酪氨酸做α位酰胺化,可进显著IMD多肽增强保护血管内皮屏障(参见图8)和减轻细胞因子风暴的作用(参见图9)。
上述研究提示,IMD1-40可能是具有生物学活性的IMD多肽的最短形式,同时,由于不含第12位的精氨酸侧链,因此与IMD1-53和IMD1-47相比,具有更好的稳定性和功效,同时也最易合成,具有较好的实用性。我们在脓毒症的治疗实验中发现,在0.25mg/kg的给药剂量下,IMD1-40对小鼠生存率的提升更明显,具有更好的治疗效果(图10)。
随后,本发明使用IMD基因敲除鼠和正常野生型小鼠建立脓毒症模型,用IMD1-40进行治疗,并使用IMD1-31多肽则用做拮抗剂(IMDinh)。结果显示:在IMD基因敲除的小鼠模型中,脓毒症导致肺和肾的血管渗漏程度加重,远端肾小管刷状缘上皮的破坏也加重;皮下注射IMD1-40多肽则可显著减轻脓毒症发生过程中肺和肾的渗漏程度,并减轻远端肾小管刷状缘上皮的破坏程度;而使用IMD1-31(IMDinh)则加重了肺和肾的损伤(Fig.11)。
本发明由此提供了一系列具有共通结构的多肽,具有预防和治疗各阶段脓毒症作用。这些多肽的的氨基酸序列如下式所示:
VGCVLGTCQVQNLSHRLWQLX1X2PX3GRX4DSAPVDPSSPHSY;
其中的X1=M或V或I;X2=G或R;X3=A或S或N;X4=Q或R或E或D。上述多肽的两个C残基之间形成二硫键。
具体的,上述多肽的氨基酸序列如SEQ ID No.1、SEQ ID No.2、SEQ ID No.3或SEQ ID No.4所示。
为了获得更好的活性,在上述多肽的C端酪氨酸进行α位酰胺化修饰是一种经本发明证明可行的方案。
显然,本领域技术人员在上述多肽序列的基础上,能够容易地得到编码上述多肽的基因、所述基因的载体以及含有上述基因载体的宿主细胞。所述载体可为质粒载体、病毒载体等本领域常用基因载体。
本发明还上述的多肽、基因、基因载体或宿主细胞具有制备预防或治疗脓毒症的药物的用途。进一步的,上述的脓毒症为脓毒症的急性炎性反应综合征(SIRS)、单纯脓毒症(sepsis)、重症脓毒症(severe sepsis)或脓毒症休克(septic shock)中的至少一种。
显然,本领域技术人员能将上述的多肽、核基因、基因载体或宿主细胞添加药学上可接受的辅助性成分制备而成预防或治疗脓毒症的药物。其中,上述的脓毒症为包括脓毒症的急性炎性反应综合征(SIRS)、单纯脓毒症(sepsis)、重症脓毒症(severe sepsis)或脓毒症休克(septic shock)中的至少一种。进一步的,上述的药物的剂型可为注射剂等各种常规剂型。
本领域一般对脓毒症有一个简要划分或诊断标准:单纯脓毒症(Sepsis)=SIRS+确诊感染;重症脓毒症(severe sepsis)=单纯脓毒症(Sepsis)+一个或多个器官功能衰竭;脓毒症休克(septic shock)=单纯脓毒症(Sepsis)+休克。本发明药物就其表现的作用来看,是能用于上述各个脓毒症的预防或治疗中并取得好的效果的。
以下通过实施例对本发明进行更进一步的说明。
实施例一有无二硫键对IMD1-53和IMD1-47的降血压作用的影响
分别合成人类IMD1-53和IMD1-47,同时合成未二硫键化的IMD1-53(No.DB)和IMD1-47(No.DB)多肽(本发明各实施例使用的多肽均委托上海闪晶生物公司合成并验证正确。若无特殊说明,除IMD1-31外,均有二硫键,以下同)。将6-8周龄Balb/c小鼠麻醉后,经颈动脉插管、连接生理多导仪检测小鼠动脉血压。从颈静脉分别注射IMD1-53、IMD1-47、IMD1-53(No.DB)、IMD1-47(No.DB),剂量均为0.5mg/kg。可见IMD1-53和IMD1-47具有显著的瞬时降血压作用,其作用在注射1~2min后达到峰值,此后血压缓慢恢复至基线;而不含二硫键的IMD1-53(No.DB)和IMD1-47(No.DB)多肽未见降血压作用。该结果提示若没有第15位和第20位半胱氨酸之间的二硫键,则IMD多肽不具备生物学活性。从上结果,我们合理推断IMD1-40也需要有这半胱氨酸之间的二硫键,否则无法保持其生物学活性。
实施例二IMD1-40与IMD1-47、IMD1-53对颈动脉血压的影响实验
分别合成人类IMD1-40、IMD1-47及IMD1-53多肽(多肽均合成第10和第15位半胱氨酸之间的二硫键)。将6-8周龄Balb/c小鼠麻醉后(每组5只),经颈动脉插管、连接生理多导仪,动态监测小鼠动脉血压。经尾静脉推注0.5mg/kg IMD多肽(稀释在100μl生理盐水中),结果显示:IMD1-40在瞬时降低血压方面与IMD1-47和IMD1-53有类似的活性,活性略强。
实施例三用体内血管渗漏实验考察IMD1-40与IMD1-47、IMD1-53的血管保护活性
行Miles实验(体内血管渗漏实验):6-8周龄Balb/c小鼠分别皮下注射实施例二所述的人类IMD1-53、IMD1-47及IMD1-40多肽(0.5mg/kg),同时经尾静脉注射伊文思蓝染料。在注射IMD多肽0.5h或2h后,分别皮下注射20ng TNF-α,以诱导局部皮肤血管渗漏;在注射TNF-α0.5h后,以注射点为圆心手术切取直径8mm左右皮肤组织,将其置入福尔马林液中,56℃过夜,最后测试其吸光度。每只小鼠取2块皮肤组织,每组5只小鼠。
实验结果显示(参见图4):IMD1-40与IMD1-53、IMD1-47多肽相比,其抑制血管渗漏作用明显更强,并且在2h以后仍然还保持更强的血管保护活性。
实施例四IMD1-40与IMD1-31对颈动脉血压的影响实验及体内血管渗漏实验
按实施例二相同的实验条件,进行IMD1-40多肽与IMD1-31多肽对颈动脉血压的影响实验。其中使用的IMD1-31多肽由于不具有两个半胱氨酸残基,因此没有二硫键。
实验结果见图5,可见IMD1-31多肽与IMD1-40多肽具有相反的作用,静脉注射IMD1-31多肽反而导致瞬时血压升高,而IMD1-40多肽则会使血压明显下降。
此外还按实施例三方法用MD1-31与IMD1-40进行了Miles实验(体内血管渗漏实验),结果见图6,结果表明IMD1-31可作为拮抗剂,阻断IMD1-40抑制血管渗漏的作用。
实施例五IMD1-40对脓毒症短期生存模型小鼠的保护实验
用6-8周龄Balb/c小鼠行盲肠结扎穿孔(CLP)手术,建立脓毒症小鼠短期生存模型:用戊巴比妥钠麻醉小鼠后,打开腹腔,暴露盲肠,从盲肠末端至回盲部方向0.75cm处结扎,结扎后用18-G(gauge)针头穿通两次,造成盲肠内容物泄漏,分为三组,一组为CLP组(10只);一组为皮下注射IMD1-40组(10只),皮下注射多肽0.5mg/kg/只,手术后半小时注射;此后每天注射以相同剂量注射一次);一组为皮下注射IMD1-31组(10只),皮下注射1mg/kg/只,手术后半小时注射;此后每天注射以相同剂量注射一次)。而另取5只小鼠打开腹腔,分离暴露盲肠,但不进行结扎穿孔操作,直接缝合皮肤,作为对照(Sham假手术组)。在此短期生存模型中,不使用补液和抗生素等支持治疗。
结果显示(参见图7):单纯CLP手术组(10只)的小鼠从术后20h左右开始死亡,在50h后全部死亡;皮下注射IMD1-40组(10只)可显著改善小鼠生存,到50h中止观察时,仍有约40%小鼠存活;而皮下注射IMD1-31组(10只)则使小鼠生存情况显著恶化,在24h内小鼠即全部死亡。
实施例六C末端酰胺化的IMD1-40的血管保护作用
行Miles实验(体内血管渗漏实验):6-8周龄Balb/c小鼠皮下注射有C末端酰胺化的IMD1-40(NH2),或C末端无酰胺化的IMD1-40(No-NH2),分组为4组:1组为对照;2组为单独使用TNF;3组为TNF+IMD1-40(NH2);4组为TNF+IMD1-40(No-NH2)剂量均为0.5mg/kg,同时经尾静脉注射伊文思蓝染料。0.5h后,皮下注射20ng TNF-α,以注射点为圆心手术切取直径8mm左右皮肤组织,将其置入福尔马林液中,560C过夜,最后测试其吸光度。每只小鼠取2块皮肤组织,每组5只小鼠。
实验结果显示参见图8:C末端酰胺化的IMD1-40与无酰胺化的IMD1-40相比,其抑制血管渗漏作用明显更强。
实施例七C末端酰胺化的IMD1-40对脓毒症短期生存模型小鼠的保护实验
行盲肠结扎穿孔手术(CLP):6-8周龄Balb/c小鼠每组各6只,戊巴比妥钠麻醉,打开腹腔,暴露盲肠,从盲肠末端至回盲瓣方向结扎0.75cm,用18-gauge针头穿通结扎后的盲肠2次;打开腹腔,分离暴露盲肠,但不进行结扎穿孔操作,直接缝合皮肤,作为对照(Sham假手术组);在CLP手术前1h注射IMD1-40(NH2)或IMD1-40(No-NH2),皮下注射0.25mg/kg/只),在CLP手术后9h处死小鼠,收集小鼠血清,ELISA检测IL-1β和TNF-α的血清水平。
结果参见图9,结果表明:若IMD1-40的C末端有酰胺化,其抑制细胞因子风暴的作用明显更强。
实施例八C末端酰胺化的IMD1-40对脓毒症长期生存模型小鼠的保护实验
行盲肠结扎穿孔手术(CLP),建立脓毒症小鼠长期生存模型:6-8周龄Balb/c小鼠,戊巴比妥钠麻醉,打开腹腔,暴露盲肠,从盲肠末端至回盲部方向0.5cm处结扎,结扎后用22-gauge针头仅穿通1次;C末端酰胺化的IMD1-53、IMD1-47、IMD1-40组(每组20只),0.25mg/kg/只;术后半小时皮下注射一次;此后每天注射一次。在此长期生存模型中,使用补液(在手术完成后,皮下注射800μl生理盐水)和抗生素(在手术完成后,肌肉注射环丙沙星(Ciprofloxacin,20mg/kg)一次)等支持治疗。长期生存模型用于更好的模拟临床脓毒症患者的疾病进展情况。
治疗试验结果显示(结果参见图10):单纯CLP组(20只)小鼠在7天后约有25%仍然存活,与临床脓毒症休克患者约30%的生存率类似。IMD1-53多肽和IMD1-47多肽组的存活率类似,均为50%;而IMD1-40多肽组的存活率最高,到第7天结束观察时,约60%的小鼠仍然存活,差异显著。
实施例九IMD1-40在使用野生型或IMD敲除鼠建立的脓毒症模型中保护作用
分别使用6-8周龄的IMD基因敲除鼠和野生型小鼠,行盲肠结扎穿孔手术(CLP),建立脓毒症小鼠长期模型模型。在CLP手术前1h分别给予IMD1-40(羧基端有酰胺化)或IMD1-31(IMDinh)(羧基端酰胺化),在CLP手术9h后处死小鼠,取出肺、肾,石蜡包埋、切片,用HE染色检测肺和肾的渗漏情况,用PHA-E染色检测肾远端小管刷状缘的破坏情况。
结果显示(参见图11):在IMD敲除鼠行CLP手术,造成的肺、肾血管渗漏以及远端肾小管刷破坏的程度均显著高于野生型小鼠;使用IMD1-40皮下注射,不管是在野生型或IMD敲除鼠的脓毒症模型中,均能显著减轻肺、肾的血管渗漏和远端肾小管损伤;而使用IMD1-31可进一步加重这些损伤。
以上结果显示:IMD1-40多肽与IMD1-47多肽和IMD1-53多肽相比较,其血管保护和抑制血管渗漏的作用更强,对脓毒症引起组织器官损伤具有更好的保护和修复作用,可更明显的提高生存率和生存时间,在脓毒症的预防和治疗方面具有很好的应用前景,而酰胺化的IMD1-40多肽效果更佳。
参考文献:
1.Russell JA.Management of sepsis.The New England journal of medicine 2006;355(16):1699-1713.
2.Levy MM,Fink MP,Marshall JC,et al.2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference.Critical care medicine 2003;31(4):1250-1256.
3.Bone RC,Balk RA,Cerra FB,et al.Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis.The ACCP/SCCM Consensus Conference Committee.American College of Chest Physicians/Society of Critical Care Medicine.Chest 1992;101(6):1644-1655.
4.Gaieski DF,Edwards JM,Kallan MJ,et al.Benchmarking the incidence and mortality of severe sepsis in the United States.Critical care medicine 2013;41(5):1167-1174.
5.Antonelli M,Bonten M,Cecconi M,et al.Year in review in Intensive Care Medicine 2012.II:Pneumonia and infection,sepsis,coagulation,hemodynamics,cardiovascular and microcirculation,critical care organization,imaging,ethics and legal issues.Intensive Care Med 2013;39(3):345-364.
6.Riedemann NC,Guo RF,Ward PA.Novel strategies for the treatment of sepsis.Nat Med 2003;9(5):517-524.
7.Dellinger RP,Levy MM,Carlet JM,et al.Surviving Sepsis Campaign:international guidelines for management of severe sepsis and septic shock:2008.Critical care medicine 2008;36(1):296-327.
8.Vincent JL.Clinical sepsis and septic shock--definition,diagnosis and management principles.Langenbeck's archives of surgery/Deutsche Gesellschaft fur Chirurgie 2008;393(6):817-824.
9.Opal SM,Laterre PF,Francois B,et al.Effect of eritoran,an antagonist of MD2-TLR4,on mortality in patients with severe sepsis:the ACCESS randomized trial.Jama 2013;309(11):1154-1162.
10.Stone R.Search for sepsis drugs goes on despite past failures.Science 1994;264(5157):365-367.
11.Warren HS.Strategies for the treatment of sepsis.N Engl J Med 1997;336(13):952-953.
12.Hotchkiss RS,Karl IE.The pathophysiology and treatment of sepsis.The New England journal of medicine 2003;348(2):138-150.
13.Thomas L.Germs.N Engl J Med 1972;287(11):553-555.
14.Nathan C.Points of control in inflammation.Nature 2002;420(6917):846-852.
15.London NR,Zhu W,Bozza FA,et al.Targeting Robo4-dependent Slit signaling to survive the cytokine storm in sepsis and influenza.Sci Transl Med 2010;2(23):23ra19.
16.Bone RC,Fisher CJ,Jr.,Clemmer TP,et al.A controlled clinical trial of high-dose methylprednisolone in the treatment of severe sepsis and septic shock.N Engl J Med 1987;317(11):653-658.
17.Fisher CJ,Jr.,Agosti JM,Opal SM,et al.Treatment of septic shock with the tumor necrosis factor receptor:Fc fusion protein.The Soluble TNF Receptor Sepsis Study Group.N Engl J Med 1996;334(26):1697-1702.
18.Fisher CJ,Jr.,Slotman GJ,Opal SM,et al.Initial evaluation of human recombinant interleukin-1 receptor antagonist in the treatment of sepsis syndrome:a randomized,open-label,placebo-controlled multicenter trial.Crit Care Med 1994;22(1):12-21.
19.Bernard GR,Wheeler AP,Russell JA,et al.The effects of ibuprofen on the physiology and survival of patients with sepsis.The Ibuprofen in Sepsis Study Group.N Engl J Med 1997;336(13):912-918.
20.Ziegler EJ,Fisher CJ,Jr.,Sprung CL,et al.Treatment of gram-negative bacteremia and septic shock with HA-1A human monoclonal antibody against endotoxin.A randomized,double-blind,placebo-controlled trial.The HA-1A Sepsis Study Group.N Engl J Med 1991;324(7):429-436.
21.Wolff SM.Monoclonal antibodies and the treatment of gram-negative bacteremia and shock.N Engl J Med 1991;324(7):486-488.
22.Riedemann NC,Guo RF,Ward PA.The enigma of sepsis.J Clin Invest 2003;112(4):460-467.
23.Bernard GR,Vincent JL,Laterre PF,et al.Efficacy and safety of recombinant human activated protein C for severe sepsis.N Engl J Med 2001;344(10):699-709.
24.Matthay MA.Severe sepsis--a new treatment with both anticoagulant and antiinflammatory properties.N Engl J Med 2001;344(10):759-762.
25.Opal SM,Dellinger RP,Vincent JL,et al.The next generation of sepsis clinical trial designs:what is next after the demise of recombinant human activated protein C.Critical care medicine 2014;42(7):1714-1721.
26.Lee WL,Slutsky AS.Sepsis and endothelial permeability.The New England journal of medicine 2010;363(7):689-691.
27.Aird WC.The role of the endothelium in severe sepsis and multiple organ dysfunction syndrome.Blood 2003;101(10):3765-3777.
28.Goodwin JE,Feng Y,Velazquez H,et al.Endothelial glucocorticoid receptor is required for protection against sepsis.Proc Natl Acad Sci U S A 2013;110(1):306-311.
29.Goldblum SE,Ding X,Campbell-Washington J.TNF-alpha induces endothelial cell F-actin depolymerization,new actin synthesis,and barrier dysfunction.The American journal of physiology 1993;264(4 Pt 1):C894-905.
30.Rabiet MJ,Plantier JL,Rival Y,et al.Thrombin-induced increase in endothelial permeability is associated with changes in cell-to-cell junction organization.Arterioscler Thromb Vasc Biol 1996;16(3):488-496.
31.Takei Y,Inoue K,Ogoshi M,et al.Identification of novel adrenomedullin in mammals:a potent cardiovascular and renal regulator.FEBS Lett 2004;556(1-3):53-58.
32.Roh J,Chang CL,Bhalla A,et al.Intermedin is a calcitonin/calcitonin gene-related peptide family peptide acting through the calcitonin receptor-like receptor/receptor activity-modifying protein receptor complexes.J Biol Chem 2004;279(8):7264-7274.
33.Chang CL,Roh J,Hsu SY.Intermedin,a novel calcitonin family peptide that exists in teleosts as well as in mammals:a comparison with other calcitonin/intermedin family peptides in vertebrates.Peptides 2004;25(10):1633-1642.
34.杨靖辉,齐永芬,马存根,et al.Intermedin1-53对大鼠心血管功能的影响及机制探讨.中国应用生理学杂志2009(03).
35.Pan CS,Yang JH,Cai DY,et al.Cardiovascular effects of newly discovered peptide intermedin/adrenomedullin 2.Peptides 2005;26(9):1640-1646.
36.Pires AL,Pinho M,Sena CM,et al.Intermedin elicits a negative inotropic effect in rat papillary muscles mediated by endothelial-derived nitric oxide.American journal of physiology Heart and circulatory physiology 2012;302(5):H1131-1137.
37.Takei Y,Inoue K,Ogoshi M,et al.Identification of novel adrenomedullin in mammals:a potent cardiovascular and renal regulator.FEBS Letters 2004;556(1-3):53-58.
38.Fujisawa Y,Nagai Y,Miyatake A,et al.Renal effects of a new member of adrenomedullin family,adrenomedullin2,in rats.European journal of pharmacology 2004;497(1):75-80.
39.Chen L,Kis B,Hashimoto H,et al.Adrenomedullin 2 protects rat cerebral endothelial cells from oxidative damage in vitro.Brain research 2006;1086(1):42-49.
40.Bell D,Campbell M,Ferguson M,et al.AM(1)-receptor-dependent protection by intermedin of human vascular and cardiac non-vascular cells from ischaemia-reperfusion injury.The Journal of physiology 2012;590(Pt 5):1181-1197.
41.Hagiwara M,Bledsoe G,Yang ZR,et al.Intermedin ameliorates vascular and renal injury by inhibition of oxidative stress.American journal of physiology Renal physiology 2008;295(6):F1735-1743.
42.Song JQ,Teng X,Cai Y,et al.Activation of Akt/GSK-3beta signaling pathway is involved in intermedin(1-53)protection against myocardial apoptosis induced by ischemia/reperfusion.Apoptosis:an international journal on programmed cell death 2009;14(11):1299-1307.
43.张艳玲周.细胞凋亡与心肌缺血-再灌注损伤及中医药研究.中国中西医结合急救杂志2005(03).
44.Yang JH,Jia YX,Pan CS,et al.Effects of intermedin(1-53)on cardiac function and ischemia/reperfusion injury in isolated rat hearts.Biochemical and biophysical research communications 2005;327(3):713-719.
45.Jia YX,Yang JH,Pan CS,et al.Intermedin1-53 protects the heart against isoproterenol-induced ischemic injury in rats.European journal of pharmacology 2006;549(1-3):117-123.
46.Aslam M,Pfeil U,Gunduz D,et al.Intermedin(adrenomedullin2)stabilizes the endothelial barrier and antagonizes thrombin-induced barrier failure in endothelial cell monolayers.Br J Pharmacol 2012;165(1):208-222.
47.Zhang W,Wang LJ,Xiao F,et al.Intermedin:a novel regulator for vascular remodeling and tumor vessel normalization by regulating vascular endothelial-cadherin and extracellular signal-regulated kinase.Arterioscler Thromb Vasc Biol 2012;32(11):2721-2732.
48.Xiao F,Wang LJ,Zhao H,et al.Intermedin restricts vessel sprouting by inhibiting the loosening of endothelial junction.Biochemical and biophysical research communications 2015;458(1):174-179.
49.Muller-Redetzky HC,Kummer W,Pfeil U,et al.Intermedin stabilized endothelial barrier function and attenuated ventilator-induced lung injury in mice.PloS one 2012;7(5):e35832。
SEQUENCE LISTING
<110> 四川大学华西医院
<120> 中介素相关多肽及其在脓毒症预防和治疗中的用途
<130> A170011K
<150> CN 201610898198.9
<151> 2016-10-14
<160> 12
<170> PatentIn version 3.3
<210> 1
<211> 40
<212> PRT
<213> Artificial
<220>
<223> 人的IMD1-40多肽
<400> 1
Val Gly Cys Val Leu Gly Thr Cys Gln Val Gln Asn Leu Ser His Arg
1 5 10 15
Leu Trp Gln Leu Met Gly Pro Ala Gly Arg Gln Asp Ser Ala Pro Val
20 25 30
Asp Pro Ser Ser Pro His Ser Tyr
35 40
<210> 2
<211> 40
<212> PRT
<213> Artificial
<220>
<223> 小鼠的IMD1-40多肽
<400> 2
Val Gly Cys Val Leu Gly Thr Cys Gln Val Gln Asn Leu Ser His Arg
1 5 10 15
Leu Trp Gln Leu Val Arg Pro Ala Gly Arg Arg Asp Ser Ala Pro Val
20 25 30
Asp Pro Ser Ser Pro His Ser Tyr
35 40
<210> 3
<211> 40
<212> PRT
<213> Artificial
<220>
<223> 大鼠的IMD1-40多肽
<400> 3
Val Gly Cys Val Leu Gly Thr Cys Gln Val Gln Asn Leu Ser His Arg
1 5 10 15
Leu Trp Gln Leu Val Arg Pro Ser Gly Arg Arg Asp Ser Ala Pro Val
20 25 30
Asp Pro Ser Ser Pro His Ser Tyr
35 40
<210> 4
<211> 53
<212> PRT
<213> Artificial
<220>
<223> 人的 IMD1-53多肽
<400> 4
His Ser Gly Pro Arg Arg Thr Gln Ala Gln Leu Leu Arg Val Gly Cys
1 5 10 15
Val Leu Gly Thr Cys Gln Val Gln Asn Leu Ser His Arg Leu Trp Gln
20 25 30
Leu Met Gly Pro Ala Gly Arg Gln Asp Ser Ala Pro Val Asp Pro Ser
35 40 45
Ser Pro His Ser Tyr
50
<210> 5
<211> 53
<212> PRT
<213> Artificial
<220>
<223> 小鼠的IMD1-53多肽
<400> 5
Pro Thr Gly Ser Arg Arg Pro His Ala Gln Leu Leu Arg Val Gly Cys
1 5 10 15
Val Leu Gly Thr Cys Gln Val Gln Asn Leu Ser His Arg Leu Trp Gln
20 25 30
Leu Val Arg Pro Ala Gly Arg Arg Asp Ser Ala Pro Val Asp Pro Ser
35 40 45
Ser Pro His Ser Tyr
50
<210> 6
<211> 53
<212> PRT
<213> Artificial
<220>
<223> 大鼠的IMD1-53多肽
<400> 6
His Val Gly Ser Arg Arg Pro His Ala Gln Leu Leu Arg Val Gly Cys
1 5 10 15
Val Leu Gly Thr Cys Gln Val Gln Asn Leu Ser His Arg Leu Trp Gln
20 25 30
Leu Val Arg Pro Ser Gly Arg Arg Asp Ser Ala Pro Val Asp Pro Ser
35 40 45
Ser Pro His Ser Tyr
50
<210> 7
<211> 47
<212> PRT
<213> Artificial
<220>
<223> 人的IMD1-47多肽
<400> 7
Thr Gln Ala Gln Leu Leu Arg Val Gly Cys Val Leu Gly Thr Cys Gln
1 5 10 15
Val Gln Asn Leu Ser His Arg Leu Trp Gln Leu Met Gly Pro Ala Gly
20 25 30
Arg Gln Asp Ser Ala Pro Val Asp Pro Ser Ser Pro His Ser Tyr
35 40 45
<210> 8
<211> 47
<212> PRT
<213> Artificial
<220>
<223> 小鼠的IMD1-47多肽
<400> 8
Pro His Ala Gln Leu Leu Arg Val Gly Cys Val Leu Gly Thr Cys Gln
1 5 10 15
Val Gln Asn Leu Ser His Arg Leu Trp Gln Leu Val Arg Pro Ala Gly
20 25 30
Arg Arg Asp Ser Ala Pro Val Asp Pro Ser Ser Pro His Ser Tyr
35 40 45
<210> 9
<211> 47
<212> PRT
<213> Artificial
<220>
<223> 大鼠的IMD1-47多肽
<400> 9
Pro His Ala Gln Leu Leu Arg Val Gly Cys Val Leu Gly Thr Cys Gln
1 5 10 15
Val Gln Asn Leu Ser His Arg Leu Trp Gln Leu Val Arg Pro Ser Gly
20 25 30
Arg Arg Asp Ser Ala Pro Val Asp Pro Ser Ser Pro His Ser Tyr
35 40 45
<210> 10
<211> 31
<212> PRT
<213> Artificial
<220>
<223> 人的IMD1-31多肽
<400> 10
Val Gln Asn Leu Ser His Arg Leu Trp Gln Leu Met Gly Pro Ala Gly
1 5 10 15
Arg Gln Asp Ser Ala Pro Val Asp Pro Ser Ser Pro His Ser Tyr
20 25 30
<210> 11
<211> 31
<212> PRT
<213> Artificial
<220>
<223> 小鼠的IMD1-31多肽
<400> 11
Val Gln Asn Leu Ser His Arg Leu Trp Gln Leu Val Arg Pro Ala Gly
1 5 10 15
Arg Arg Asp Ser Ala Pro Val Asp Pro Ser Ser Pro His Ser Tyr
20 25 30
<210> 12
<211> 31
<212> PRT
<213> Artificial
<220>
<223> 大鼠的IMD1-31多肽
<400> 12
Val Gln Asn Leu Ser His Arg Leu Trp Gln Leu Val Arg Pro Ser Gly
1 5 10 15
Arg Arg Asp Ser Ala Pro Val Asp Pro Ser Ser Pro His Ser Tyr
20 25 30
- 还没有人留言评论。精彩留言会获得点赞!