一种偶联核酸或蛋白质的温敏聚合物及其应用的制作方法
本发明涉及温度敏感聚合物材料技术领域,具体涉及一种偶联核酸或蛋白质的温敏聚合物及其应用。
背景技术:
温敏聚合物是一类具有温度敏感性质的聚合物,其中最具代表性的聚合物是聚n-异丙基丙烯酰胺,简称pnipaam,它的大分子侧链上同时具有亲水性酰胺基-conh-和疏水性异丙基-ch(ch3),从而使线型pnipaam的水溶液及交联后的pnipaam水凝胶呈现出温度敏感特性。pnipaam在水中的低临界相转变温度(lowercriticalsolutiontemperature,lcst)约为32℃,当温度低于lcst时,聚合物溶于水中形成均相的溶液,而当环境温度升高至lcst以上时,溶液发生相分离,聚合物从溶剂水中析出,溶液粘度变大。由于其特有的温度敏感性,使聚合物具有智能记忆效应,引起了人们的广泛关注,同时pnipaam32℃的低临界相转变温度与生物体温度相近,从而使该温敏性聚合物成为又一个研究热点。目前,温敏聚合物已被广泛应用于药物缓释、物料分离提纯、温敏薄膜、酶的固定以及免疫分析等领域。磁珠同样具有分离富集的功能,但是由于磁珠属非均相反应,分离后难以直接进行均相检测,从而影响检测结果的重现性和准确性。相反,温敏聚合物能够实现均相反应,异相分离,改变环境温度,就可进行均相检测,因而在生物分析方面具有明显的优势。
链霉亲和素(streptavidin,sa)是由链霉菌分泌的一种蛋白质,分子量为65kd。链霉亲和素分子由4条相同的肽链组成,其中每条肽链都能结合一个生物素,并且不带任何糖基,因此与亲和素一样,一个链霉亲和素分子能结合4个生物素分子,二者亲和常数(k)亦为10mol/l。
有课题组以pnipaam为载体结合抗体,与抗原和标记二抗形成免疫复合物,进行生物免疫分析检测(johnm.hoffmanetal,bioconjugatechem,2015,26,29-38),具有较好的选择性和较低的检出限。但是采用该方法,对不同抗原进行检测,必须合成结合有不同抗体的pnipaam,温敏材料通用性不强。
技术实现要素:
为解决上述现有技术存在的问题,本发明提供了一种偶联核酸或蛋白质的温敏聚合物及其应用,该温敏聚合物的合成方法简单,原料易得,操作方便,合成成本低。该温敏聚合物能够实现均相反应,异相分离,能用于生物分析检测,只需改变相应的核酸序列或者蛋白质,就能利用捕获物和目标物之间的特异性结合完成对不同生物样品的高效分离富集和分析检测。
实现本发明上述目的所采用的技术方案为:
一种偶联核酸或蛋白质的温敏聚合物,其合成方法包括如下步骤:
1)将被偶联物与偶联剂混合,所述的被偶联物为核酸或蛋白质,其中被偶联物中氨基与偶联剂中活性酯基的摩尔比小于1,混合均匀,在20-40℃下反应1-2小时,得到偶联产物;
2)将偶联产物和温敏聚合物单体加入溶解液中,加入的温敏聚合物单体与被偶联物中氨基的摩尔比为200-400:1,搅拌均匀,得到混合溶液,向混合溶液中加入过硫酸铵和四甲基乙二胺,在低于低临界相转变温度下反应聚合2-10小时,得到含偶联核酸或蛋白质的温敏聚合物的混合体系;
3)将混合体系在高于相变温度下进行相变,直至沉淀完全,离心去除上清液,将沉淀重新溶解于低于相变温度的溶解液中,重复以上操作多次,得到具有温度敏感性质的偶联核酸或蛋白质的温敏聚合物。
进一步,所述的被偶联物为链霉亲和素或5’端修饰有nh2-c6,3’端修饰有生物素的核酸序列,所述的5’端修饰有nh2-c6,3’端修饰有生物素的核酸序列为nh2-gggttgggcgggatgggttt-biotin。
进一步,所述的偶联剂为n-羟基琥珀酰亚胺丙烯酸酯。
进一步,所述的温敏聚合物单体至少包括n-异丙基丙烯酰胺。
进一步,所述的温敏聚合物单体为n-异丙基丙烯酰胺。
进一步,温敏聚合物单体、过硫酸铵和四甲基乙二胺的摩尔比为500:40:3。
进一步,所述的相变温度为32℃。
进一步,所述的溶解液为pbs缓冲液或三(羟甲基)氨基甲烷缓冲液。
一种偶联核酸或蛋白质的温敏聚合物在生物免疫分析检测中的应用。
利用偶联核酸或蛋白质的温敏聚合物进行生物免疫分析检测的方法为:
1)将偶联蛋白质的温敏聚合物和能与被偶联蛋白质特异性结合的物质标记的核酸序列或能与被偶联蛋白质特异性结合的蛋白质混合;或者将偶联核酸的温敏聚合物和序列互补的核酸或能与被偶联核酸特异性结合的蛋白质混合;
2)加入目标核酸序列或者蛋白质,利用碱基互补配对或者蛋白质之间的特异性结合捕获目标物;
3)加入标记有荧光染料且能与目标物特异性结合的核酸序列或者蛋白质进行反应,对产物进行荧光光谱分析。
与现有技术相比,本发明的优点和有益效果为:
1、该温敏聚合物的合成方法简单易操作,合成过程中不需要特殊保护,合成条件简单易控制,大大简化了操作步骤,节省了人力和物力(即节省了成本),提高了合成效率。
2、该温敏聚合物的合成方法所需的原料便宜易得,所需的设备均为常规设备,价格低廉,因而生产成本低廉。
3、与文献方法相比,该温敏聚合物由于引进了生物素-链霉亲和素系统,从而可以利用他们之间的高特异性结合实现不同被测物的分离富集以及检测。例如,文献方法中,如果要实现不同抗原的检测,需要合成结合有不同抗体的温敏聚合物材料,过程复杂繁琐;但是在本发明中,只需要提供生物素化的不同抗体,就能利用该材料实现不同抗原的检测,具有高适用性,理论上该温敏聚合物可应用于所有可被生物素化的目标物的分离富集和分析检测。
4、该温敏聚合物可以实现均相反应、异相分离,从而使被测物从复杂样品中分离富集出来,降低背景干扰,从而降低检出限。
附图说明
图1为实施例1合成的pnipaam-co-sa材料的差热分析谱图(dsc图谱)。
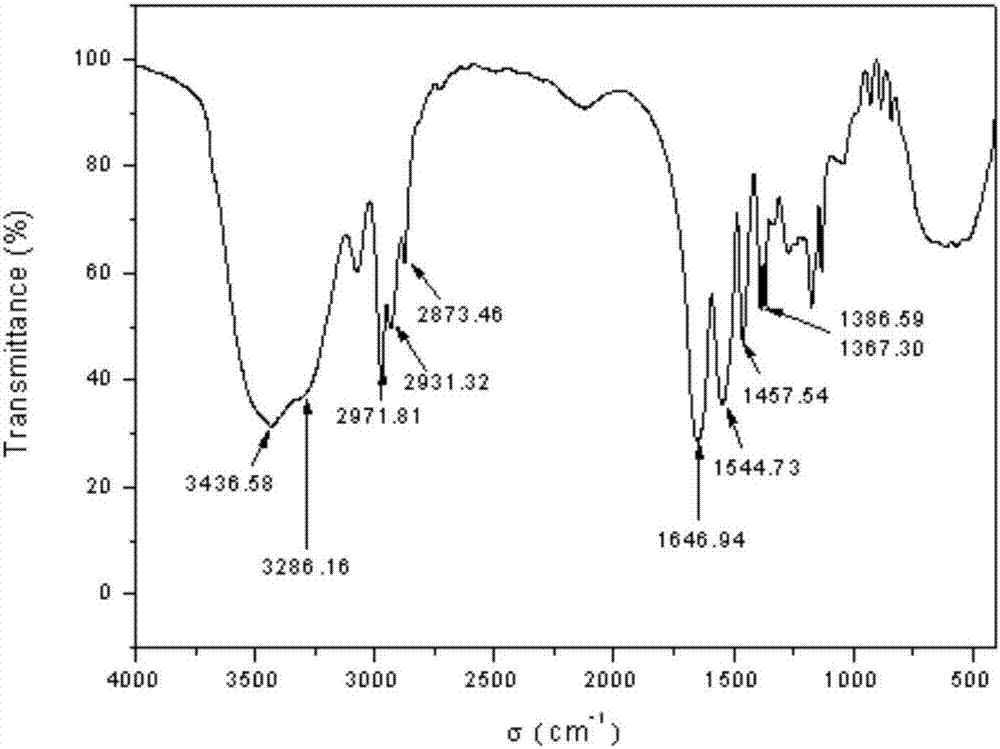
图2为实施例1合成的pnipaam-co-sa材料的的红外光谱图。
图3为实施例1合成的pnipaam-co-sa材料与pnipaam材料的紫外-可见吸收光谱对比图。
图4为实施例1合成的pnipaam-co-sa材料与pnipaam材料的荧光光谱对比图。
图5为实施例1合成的pnipaam-co-sa材料结合生物素的效果图。
图6为实施例1合成的pnipaam-co-sa材料在缓冲液和血清中捕获目标产物的效率图。
图7为实施例1合成的pnipaam-co-sa材料在缓冲液和血清中特异性结合与非特异性吸附对比图。
图8为实施例1合成的pnipaam-co-sa材料的时间稳定性对比图。
图9为实施例1合成的pnipaam-co-sa材料检测天花病毒核酸序列所得的标准工作曲线。
图10为实施例2合成的pnipaam-co-dna材料与pnipaam材料的化学发光对比图。
具体实施方式
下面结合具体实施方式对本发明进行详细说明。
实施例1
1、用移液枪取100μl链霉亲和素(2×10-3g/ml)与250μl偶联剂n-羟基琥珀酰亚胺丙烯酸酯(1×10-3g/ml)于离心管中,混合均匀后转移至恒温箱中,在37℃下震荡反应1小时,得到偶联产物;
2、向离心管中依次加入0.06gn-异丙基丙烯酰胺单体和4650μlpbs缓冲液(nacl的浓度为15nm),用旋涡混合仪混合至n-异丙基丙烯酰胺单体完全溶解,得到混合溶液,然后向混合溶液中依次加入10mg过硫酸铵和5μl四甲基乙二胺,混合均匀后移至恒温箱中,在25℃下反应聚合2小时,得到含偶联链霉亲和素的温敏聚合物的混合体系;
3、将含偶联链霉亲和素的温敏聚合物的混合体系移至水浴锅,在37℃下保温5min,从而使偶联温敏聚合物发生相变,离心弃上清液(离心条件:8000r/min,5min),将沉淀重新溶解于5ml冰冷的pbs缓冲液(nacl的浓度为15nm)中,重复以上操作两次以除去未反应的原料等杂质,得到具有温度敏感性质的偶联链霉亲和素的温敏聚合物,简称pnipaam-co-sa材料;
4、将pnipaam-co-sa材料重新溶解于5ml冰冷的pbs缓冲液中,得到pnipaam-co-sa溶液,取50μlpnipaam-co-sa溶液于离心管中,加入30μl5’端修饰有生物素,3’端修饰有6-羧基荧光素的核酸序列(biotin-aaaaaaaaaaaaaaaaaa-6-fam)(1×10-7mol/l),再加入420μl的pbs缓冲液(nacl的浓度为150nm),混合均匀后,转移至恒温箱,在25℃下反应30min,得到含与生物素特异性结合的温敏材料的混合产物;
5、将混合产物移至水浴锅中,在37℃下保温5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min),将沉淀重新溶解于500μl冰冷的pbs缓冲液(nacl的浓度为150nm)中,重复以上操作两次以除去未反应原料等杂质,得到最终产物,即为链霉亲和素与生物素特异性结合的温敏材料。
对本实施例合成的pnipaam-co-sa材料进行差示扫描量热分析,所得的差热分析谱图如图1所示,从图1中可以看出,在32℃处有一个明显的吸热峰,符合理论值。之所以产生吸热峰,是由于pnipaam-co-sa溶液在升到一定温度时,pnipaam-co-sa分子内及分子间的疏水作用作用大于其与水分子之间的亲水作用,从而导致pnipaam-co-sa产生沉淀从而发生相分离,这一过程是一个吸热过程,因此会在dsc图谱中产生吸热峰。
对本实施例合成的pnipaam-co-sa材料进行红外光谱分析,所得的红外光谱图如图2所示,参照相关文献及书籍,对红外光谱图做出如下分析:1646.94cm-1为酰胺的羰基峰;1544.73cm-1为酰胺氨基上氢的特征峰;3286.16cm-1和3436.58cm-1为n-h伸缩振动;2873.46cm-1、2931.32cm-1以及2971.81cm-1为c-h的伸缩振动;1457.54cm-1为ch3的不对称弯曲振动峰;1367.30cm-1及1386.59cm-1为异丙基上双甲基的对称变形振动耦合分裂而形成的双峰。从以上分析可以看出,所得的红外光谱图中的红外光谱特征峰与相关文献完全吻合,从而证实了nipaam-co-sa材料中pnipaam相应官能团的存在。
对本实施例合成的pnipaam-co-sa、pnipaam以及本实施例步骤3)相变分离所得的上清液进行紫外-可见吸收光谱分析,所得的紫外-可见吸收光谱图如图3所示,从图3a中可以看出,pnipaam-co-sa材料在280nm有一处明显的吸收峰,与图3b相比,该吸收峰可以证明目标材料中链霉亲和素的存在,同时从图3c中可以看出,相变分离后的上清液中不存在链霉亲和素的吸收峰,说明pnipaam-co-sa材料中的链霉亲和素是偶联在pnipaam上的,而不是夹杂在pnipaam中。
本实施例中得到的最终产物进行荧光光谱分析,其荧光光谱如图4a所示,从图4a中可以看出,在520nm处有较强的6-fam发射峰,表明nipaam-co-sa材料结合上了荧光标记的生物素化的核酸。
对比例1
1、用移液枪取100μl链霉亲和素(2×10-3g/ml)与250μl偶联剂n-羟基琥珀酰亚胺丙烯酸酯(1×10-3g/ml)于离心管中,混合均匀后转移至恒温箱中,在37℃下震荡反应1小时,得到偶联产物;
2、向离心管中依次加入0.06gn-异丙基丙烯酰胺单体和4650μlpbs缓冲液(nacl的浓度为15nm),用旋涡混合仪混合至n-异丙基丙烯酰胺单体完全溶解,得到混合溶液,然后向混合溶液中依次加入10mg过硫酸铵和5μl四甲基乙二胺,混合均匀后移至恒温箱中,在25℃下反应聚合2小时,得到含偶联链霉亲和素的温敏聚合物的混合体系;
3、将混合体系移至水浴锅,在37℃下保温5min,从而使偶联温敏聚合物发生相变,离心弃上清液(离心条件:8000r/min,5min),将沉淀重新溶解于5ml冰冷的pbs缓冲液(nacl的浓度为15nm)中,重复以上操作两次以除去未反应的原料等杂质,得到具有温度敏感性质的偶联链霉亲和素的温敏聚合物,简称pnipaam-co-sa材料;
4、将pnipaam-co-sa材料重新溶解于5ml冰冷的pbs缓冲液中,得到pnipaam-co-sa溶液,取50μlpnipaam-co-sa溶液于离心管中,加入30μl5’端无修饰,3’端修饰有6-羧基荧光素的核酸序列(aaaaaaaaaaaaaaaaaa-6-fam)(1×10-7mol/l),再加入420μl的pbs缓冲液(nacl的浓度为150nm),混合均匀后,转移至恒温箱,在25℃下反应30min,得到混合产物;
5、将混合产物移至水浴锅中,在37℃下保温5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min),将沉淀重新溶解于500μl冰冷的pbs缓冲液(nacl的浓度为150nm)中,重复以上操作两次以除去未反应原料等杂质,得到最终产物。
本对比例中得到的最终产物进行荧光光谱分析,所得的荧光光谱如图4b所示,从4b中可以看出,在520nm处没有6-fam发射峰。
对比例2
1、向离心管中依次加入0.06gn-异丙基丙烯酰胺单体和5000μlpbs缓冲液(nacl的浓度为15nm),用旋涡混合仪混合至n-异丙基丙烯酰胺单体完全溶解,得到混合溶液,然后向混合溶液中依次加入10mg过硫酸铵和5μl四甲基乙二胺,混合均匀后移至恒温箱中,在25℃下反应聚合2小时,得到含pnipaam的混合体系;
2、将混合体系移至水浴锅,在37℃下保温5min,从而使pnipaam发生相变,离心弃上清液(离心条件:8000r/min,5min),将沉淀重新溶解于5ml冰冷的pbs缓冲液(nacl的浓度为15nm)中,重复以上操作两次以除去未反应的原料等杂质,得到具有温度敏感性质的pnipaam材料;
3、将pnipaam材料重新溶解于5ml冰冷的pbs缓冲液中,得到pnipaam溶液,取50μlpnipaam溶液于离心管中,加入30μl5’端修饰生物素,3’端修饰有6-羧基荧光素的核酸序列(biotin-aaaaaaaaaaaaaaaaaa-6-fam)(1×10-7mol/l),再加入420μl的pbs缓冲液(nacl的浓度为150nm),混合均匀后,转移至恒温箱,在25℃下反应30min,得到混合产物;
4、将混合产物移至水浴锅中,在37℃下保温5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min),将沉淀重新溶解于500μl冰冷的pbs缓冲液(nacl的浓度为150nm)中,重复以上操作两次以除去未反应原料等杂质,得到最终产物。
本对比例中得到的最终产物进行荧光光谱分析,所得的荧光光谱如图4c所示,从4c中可以看出,在520nm处没有6-fam发射峰。
对比例3
1、向离心管中依次加入0.06gn-异丙基丙烯酰胺单体和5000μlpbs缓冲液(nacl的浓度为15nm),用旋涡混合仪混合至n-异丙基丙烯酰胺单体完全溶解,得到混合溶液,然后向混合溶液中依次加入10mg过硫酸铵和5μl四甲基乙二胺,混合均匀后移至恒温箱中,在25℃下反应聚合2小时,得到含pnipaam的混合体系;
2、将混合体系移至水浴锅,在37℃下保温5min,从而使pnipaam发生相变,离心弃上清液(离心条件:8000r/min,5min),将沉淀重新溶解于5ml冰冷的pbs缓冲液(nacl的浓度为15nm)中,重复以上操作两次以除去未反应的原料等杂质,得到具有温度敏感性质的pnipaam材料;
3、将pnipaam材料重新溶解于5ml冰冷的pbs缓冲液中,得到pnipaam溶液,取50μlpnipaam溶液于离心管中,加入30μl5’端无修饰,3’端修饰有6-羧基荧光素的核酸序列(aaaaaaaaaaaaaaaaaa-6-fam)(1×10-7mol/l),再加入420μl的pbs缓冲液(nacl的浓度为150nm),混合均匀后,转移至恒温箱,在25℃下反应30min,得到混合产物;
4、将混合产物移至水浴锅中,在37℃下保温5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min),将沉淀重新溶解于500μl冰冷的pbs缓冲液(nacl的浓度为150nm)中,重复以上操作两次以除去未反应原料等杂质,得到最终产物。
本对比例中得到的最终产物进行荧光光谱分析,所得的荧光光谱如图4d所示,从4d中可以看出,在520nm处没有6-fam发射峰。
试验一、本发明的pnipaam-co-sa材料与生物素结合效率实验
试验方法:取6个离心管,分别加入50μlpnipaam-co-sa溶液(将实施例1合成的pnipaam-co-sa材料重新溶解于冰冷的pbs缓冲液中即可得到pnipaam-co-sa溶液)于离心管中,接着分别加入6μl,10μl,20μl,50μl,100μl,200μl5’端修饰有生物素,3’端修饰有6-羧基荧光素的核酸序列(biontin-aaaaaaaaaaaaaaaaaa-6-fam)(1×10-6mol/l),再分别加入444μl,440μl,430μl,400μl,350μl,250μl的pbs缓冲液,混合均匀后,将6个离心管转移至恒温箱,在25℃下分别反应30min。将6个离心管分别移至水浴锅,在37℃下保温5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min),将沉淀重新溶解于500μl冰冷的pbs缓冲液,重复以上操作两次以除去未反应原料等杂质,得到6组最终产物,并对6组最终产物进行荧光光谱分析,其荧光光谱图如图5所示。
试验结果:
从图5中可以看出,随着标记有生物素和荧光染料的核酸序列的浓度的增加,最终产物的荧光强度逐渐增加。当pnipaam-co-sa中链霉亲和素投料浓度为6×10-8mol/l,核酸序列浓度达到2×10-7mol/l时,即接近sa/biontin的结合比为4时,荧光强度不再增加,说明此时pnipaam-co-sa中链霉亲和素与生物素的结合已经达到饱和,这符合一个链霉亲和素结合4个生物素的理论值。
通过试验得到的链霉亲和素的联接效率为:
可见链霉亲和素的4个结合位点并不一定完全饱和,实际联接效率大于等于83.3%。
试验二、本发明的pnipaam-co-sa材料在缓冲液和血清中捕获效率试验
试验方法:
1、取6个离心管,分别加入2.5μl,5μl,15μl,20μl,30μl,35μl5’端修饰有生物素,3’端修饰有6-羧基荧光素的核酸序列(biontin-aaaaaaaaaaaaaaaaaa-6-fam)(1×10-7mol/l),再分别加入497.5μl,495μl,485μl,480μl,470μl,465μl的pbs缓冲液,混合均匀后,将6个离心管转移至恒温箱,在25℃下反应30min。将6个离心管分别移至水浴锅,在37℃下保温5min,然后离心弃上清液(离心条件:13000r/min,3min),将沉淀重新溶解于500μl冰冷的pbs缓冲液,重复以上操作两次以除去未反应原料等杂质,得到6组最终产物,并对6组最终产物进行荧光光谱分析,其荧光光谱图如图6a所示。
2、取6个离心管,分别加入50μlpnipaam-co-sa溶液(将实施例1合成的pnipaam-co-sa材料重新溶解于冰冷的pbs缓冲液中即可得到pnipaam-co-sa溶液)于离心管中,接着向6个离心管中分别加入2.5μl,5μl,15μl,20μl,30μl,35μl5’端修饰有生物素,3’端修饰有6-羧基荧光素的核酸序列(biontin-aaaaaaaaaaaaaaaaaa-6-fam)(1×10-7mol/l),再分别加入447.5μl,445μl,435μl,430μl,420μl,415μl的pbs缓冲液,混合均匀后,将6个离心管分别转移至恒温箱,在25℃下反应30min。将6个离心管分别移至水浴锅,在37℃下保温5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min),将沉淀重新溶解于500μl冰冷的pbs缓冲液,重复以上操作两次以除去未反应原料等杂质,得到6组最终产物,并对6组最终产物进行荧光光谱分析,其荧光光谱图如图6b所示。
3、取6个离心管,分别加入50μlpnipaam-co-sa溶液(将实施例1合成的pnipaam-co-sa材料重新溶解于冰冷的pbs缓冲液中即可得到pnipaam-co-sa溶液)于离心管中,接着向离心管中分别加入2.5μl,5μl,15μl,20μl,30μl,35μl5’端修饰有生物素,3’端修饰有6-羧基荧光素的核酸序列(biontin-aaaaaaaaaaaaaaaaaa-6-fam)(1×10-7mol/l),再分别加入447.5μl,445μl,435μl,430μl,420μl,415μl的血清,混合均匀后,转移至恒温箱,在25℃下反应30min。将6个离心管分别移至水浴锅,在37℃下保存5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min),将沉淀重新溶解于500μl冰冷的pbs缓冲液,重复以上操作两次以除去未反应原料等杂质,得到6组最终产物,并对6组最终产物进行荧光光谱分析,其荧光光谱图如图6c所示。
三组试验同时进行,进一步减小误差。
试验结果:
如图6所示,图6a表示相同试验条件下,目标物的荧光强度,图6b表示在pbs缓冲液中进行捕获效率试验时,捕获分离的目标物的荧光强度,图6c表示在血清中进行捕获效率试验时,捕获分离的目标物的荧光强度。,
通过计算可得结果如表1所示:
表1
实验结果表明,该pnipaam-co-sa材料对于生物素修饰的目标物具有良好的捕获能力。
试验三、本发明的pnipaam-co-sa材料在缓冲液和血清中特异性结合与非特异性吸附对比试验。
试验方法:取4个离心管a、b、c、d,分别加入50μpnipaam-co-sa溶液(将实施例1合成的pnipaam-co-sa材料重新溶解于冰冷的pbs缓冲液中即可得到pnipaam-co-sa溶液),再向a、c离心管中分别加入30μl5’端修饰有生物素,3’端修饰有6-羧基荧光素的核酸序列(biontin-aaaaaaaaaaaaaaaaaa-6-fam)(1×10-7mol/l),向b、d离心管中分别加入30μl5’端无修饰,3’端修饰有6-羧基荧光素的核酸序列(aaaaaaaaaaaaaaaaaa-6-fam)(1×10-7mol/l),再分别向a、b离心管中加入420μl的pbs缓冲液,向c、d离心管中加入420μl的血清,混合均匀后,转移至恒温箱,在25℃下反应30min。将a、b、c、d离心管分别移至水浴锅,在37℃下保温5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min),将沉淀重新溶解于500μl冰冷的pbs缓冲液,重复以上操作两次以除去未反应原料等杂质,得到4组最终产物,并对4组最终产物进行荧光光谱分析,其荧光光谱图如图7所示。
试验结果:
从图7中可以看出,b、d中没有标记生物素的核酸序列几乎看不到标记染料6-fam的发射峰,而a、c中标记有生物素的核酸序列所标记染料6-fam的发射峰很强,通过对比可以证明目标物与该pnipaam-co-sa材料非特异性结合很低,这对于该生物材料的应用具有很大的意义。
试验四、本发明的pnipaam-co-sa材料时间稳定性试验。
试验方法:取2个离心管,分别加入50μlpnipaam-co-sa溶液a(实施例1新合成的pnipaam-co-sa材料重新溶解于冰冷的pbs缓冲液得到的pnipaam-co-sa溶液)和pnipaam-co-sa溶液b(实施例1合成的pnipaam-co-sa材料放置45天后再重新溶解于冰冷的pbs缓冲液得到的pnipaam-co-sa溶液),接着向2个离心管中分别加入30μl5’端修饰有生物素,3’端修饰有6-羧基荧光素的核酸序列(biontin-aaaaaaaaaaaaaaaaaa-6-fam)(1×10-7mol/l),再分别加入420μl的pbs缓冲液,混合均匀后,转移至恒温箱,在25℃下反应30min。将2个离心管分别移至水浴锅,在37℃下保温5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min),将沉淀重新溶解于500μl冰冷的pbs缓冲液,重复以上操作两次以除去未反应原料等杂质,得到2组最终产物,并对2组最终产物进行荧光光谱分析,其荧光光谱图如图8所示。
试验结果:
从图8中可以看出,合成后放置45天的pnipaam-co-sa材料对于目标物的捕获和分离能力几乎没有降低,说明该pnipaam-co-sa材料具有良好的时间稳定性。
试验五、本发明的pnipaam-co-sa材料检测天花病毒核酸试验。
试验方法:
1、取5个离心管,分别加入60μlpnipaam-co-sa溶液(将实施例1合成的pnipaam-co-sa材料重新溶解于冰冷的pbs缓冲液中即可得到pnipaam-co-sa溶液),接着分别加入40μl5’端修饰有生物素,3’端无修饰用于捕获目标物的核酸序列(biotin-tttaaactgattactattgca)(1×10-6mol/l),再分别加入400μl的pbs缓冲液,混合均匀后,转移至恒温箱,在25℃下反应30min,将5个离心管分别移至水浴锅,在37℃下保温5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min)。
2、向5个离心管中分别加入497.5μl,475μl,450μl,425μl,400μl冰冷的pbs缓冲液,然后分别加入2.5μl,25μl,50μl,75μl,100μl目标天花病毒核酸序列(agttgtaacggaagatgcaatagtaatcag)(1×10-7mol/l),混合均匀后,转移至恒温箱,在25℃下反应30min,将5个离心管分别移至水浴锅,在37℃下保温5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min),向5个离心管中分别加入460μl冰冷的pbs缓冲液重新溶解沉淀。
3、向5个离心管中分别加入40μl5’端无修饰,3’端修饰有罗丹明(rox)用于产生荧光信号的核酸序列(tcttccgttacaactaaattt-rox)(1×10-6mol/l),混合均匀后,转移至恒温箱,在25℃下反应30min。将5个离心管移至水浴锅,在37℃下保温5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min),将沉淀重新溶解于300μl冰冷的pbs缓冲液,重复以上操作两次以除去未反应原料等杂质,得到5组最终产物,并对5组最终产物进行荧光光谱分析,其荧光光谱图如图9所示。
试验结果:
从图9中可以看出所示,随着目标物天花病毒核酸浓度的增加,荧光信号强度随之增加。目标物天花病毒核酸浓度范围0.5nm至20nm之间时,荧光信号强度与目标物浓度成线性相关,通过对试验结果进行线性回归,得到回归方程为:y=30.6x+16.0(r2=0.99633),计算得到检出限为57.0pm,具有较高的灵敏度。
血清(20%)样品中加标回收结果:
为验证标准曲线法在实际样品检测过程中的可靠性和准确性,在血清样品中进行加标回收试验,在血清样品中加入不同浓度的天花病毒核酸标准品,所得加标回收率列于下表2中。从表2中可以看出,利用标准曲线法检测的加标回收率在98.70%到109.65%之间,测定结果与加标浓度能够很好的吻合,说明标准曲线法具有较好的准确性。
表2
实施例2
1、用移液枪取250μl5’端修饰有nh2,3’端修饰有生物素的核酸序列(nh2-gggttgggcgggatgggttt-biotin)(1×10-6mol/l)与50μl偶联剂n-羟基琥珀酰亚胺丙烯酸酯(1×10-3g/ml)于离心管中,混合均匀后转移至恒温箱中,在37℃下震荡反应1小时,得到偶联产物;
2、向离心管中依次加入0.02gn-异丙基丙烯酰胺单体和700μlpbs缓冲液(nacl的浓度为15nm),用旋涡混合仪混合至n-异丙基丙烯酰胺单体完全溶解,得到混合溶液,然后向混合溶液中依次加入2mg过硫酸铵和1μl四甲基乙二胺,混合均匀后移至恒温箱中,在25℃下反应聚合2小时,得到含偶联核酸的温敏聚合物的混合体系;
3、将混合体系移至水浴锅,在37℃下保温5min,从而使偶联温敏聚合物发生相变,离心弃上清液(离心条件:8000r/min,5min),将沉淀重新溶解于1ml冰冷的pbs缓冲液(nacl的浓度为15nm)中,重复以上操作两次以除去未反应的原料等杂质,得到具有温度敏感性质的偶联核酸的温敏聚合物,简称pnipaam-co-dna材料;
4、将pnipaam-co-dna材料重新溶解于5ml冰冷的pbs缓冲液中,得到pnipaam-co-dna溶液,取50μlpnipaam-co-dna溶液于离心管中,加入50μl修饰有链霉亲和素的辣根过氧化物酶(200ng/ml),混合均匀后,转移至恒温箱,在25℃下反应30min,得到混合产物;
5、将混合产物移至水浴锅中,在37℃下保温5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min),将沉淀重新溶解于100μl冰冷的pbs缓冲液(nacl的浓度为150nm)中,重复以上操作两次以除去未反应原料等杂质,得到最终产物。
向本实施例得到的最终产物中加入50μl化学发光底物,再进行化学发光强度分析,所得的化学发光图谱如图10所示,从图10a中可以看出,该实施例的最终产物具有很强的化学发光强度,说明核酸联接到聚合物上,核酸上修饰的生物素与辣根过氧化物酶上修饰的链霉亲和素特异性结合,从而使辣根过氧化物酶能够催化底物产生化学发光。
对比例4
1、向离心管中依次加入0.02gn-异丙基丙烯酰胺单体1000μlpbs缓冲液(nacl的浓度为15nm),用旋涡混合仪混合至n-异丙基丙烯酰胺单体完全溶解,得到混合溶液,然后向混合溶液中依次加入2mg过硫酸铵和1μl四甲基乙二胺,混合均匀后移至恒温箱中,在25℃下反应聚合2小时,得到含pnipaam的混合体系;
3、将混合体系移至水浴锅,在37℃下保温5min,从而使pnipaam发生相变,离心弃上清液(离心条件:8000r/min,5min),将沉淀重新溶解于1ml冰冷的pbs缓冲液(nacl的浓度为15nm)中,重复以上操作两次以除去未反应的原料等杂质,得到具有温度敏感性质的pnipaam材料;
4、将pnipaam材料重新溶解于5ml冰冷的pbs缓冲液中,得到pnipaam溶液,取50μlpnipaam溶液于离心管中,加入50μl修饰有链霉亲和素的辣根过氧化物酶(200ng/ml),混合均匀后,转移至恒温箱,在25℃下反应30min,得到混合产物;
5、将混合产物移至水浴锅中,在37℃下保温5min,从而使温敏材料发生相变,然后离心弃上清液(离心条件:13000r/min,3min),将沉淀重新溶解于100μl冰冷的pbs缓冲液(nacl的浓度为150nm)中,重复以上操作两次以除去未反应原料等杂质,再加入50μl化学发光底物,得到最终产物。
向本对比例得到的最终产物中50μl化学发光底物,再进行化学发光强度分析,从图10b中可以看出,该对比例的最终产物几乎无化学发光,说明无核酸联接到聚合物上时,不存在生物素,不能形成实施例2中结合修饰有链霉亲和素的辣根过氧化物酶的复合物,因此不能够催化底物产生化学发光。通过对比,说明该方法能够成功将核酸偶联在温敏聚合物pnipaam上。
- 还没有人留言评论。精彩留言会获得点赞!