利用数字PCR检测大麦条纹花叶病毒的方法及其专用成套试剂与流程
本发明涉及生物技术领域,具体涉及利用数字PCR检测大麦条纹花叶病毒的方法及其专用成套试剂。
背景技术:
大麦条纹花叶病毒(Barley stripe mosaic virus,BSMV)属于大麦条纹病毒属,该病毒所引起的大麦条纹花叶病是禾本科植物上一种重要的病毒性病害,曾给我国小麦生产造成巨大损失。大麦条纹花叶病毒的主要传播来源为种子,即使带毒率很低的种子,也会出现发病症状,而且每粒带毒种子产生后代种子都是带毒的。如又从病田留种,种子带毒率就会愈来愈高,再使用这类种子扩大种植,则带毒种子所到之处病害就蔓延开来。由于这种病害的症状表现在温度较低(12℃)时条纹不明显,并在小麦生长后期有些小麦品种有隐症现象,不易确定为条纹花叶病。考虑到大麦条纹花叶病毒的高度危害性,因此有必要开展该病毒的检测鉴定技术研究工作。
目前大麦条纹花叶病毒检测方法主要有生物学、血清学、病毒粒子观察及RT-PCR技术。生物学方法因操作繁琐,检测周期长,且需要隔离检疫温室等设施,难以应用于现场的快速检测。血清学方法中以酶联免疫法(ELISA)应用最广,ELISA虽然可以在短时间内检测大量样品,但该方法存在标准阳性对照较难获得,相对费用低的抗血清种类不全,检测灵敏度低及整个实验操作流程较复杂等因素的限制。RT-PCR技术相对于血清法不用制备抗体,而且省时又省力,已经用于BSMV的检测,但对种子中病毒浓度低的样品却不足以做出可靠的诊断。
数字PCR(Digital-PCR)是一种新型的PCR检测方法,其基本原理是通过将微量样品进行大倍数稀释和分液,直至每个样品中所含有的待测分子数不超过1个,再将所有样品在相同条件下进行PCR扩增,有PCR扩增荧光信号记为1,无荧光信号记为0,有荧光信号的反应单元中至少包含一个拷贝的目标分子,针对反应结果采用泊松分布(Poisson distribution)公式,便可计算出样本的最初拷贝数或浓度。
技术实现要素:
本发明所要解决的技术问题是如何检测大麦条纹花叶病毒。
为解决上述技术问题,本发明首先提供了一种检测大麦条纹花叶病毒的成套试剂。
本发明所提供的检测大麦条纹花叶病毒的成套试剂,可由引物对X1和探针BSMV-p组成;所述引物对X1可由引物BSMV-f和引物BSMV-r组成;所述引物对X1的靶序列含有特异DNA片段;所述特异DNA片段可为如下y1)或y2):
y1)序列表的序列4所示的单链DNA分子;
y2)将序列4经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列4具有相同功能的DNA分子;
所述探针BSMV-p可为20-30个核苷酸组成的单链DNA分子,与所述特异DNA片段中的部分区段相同。
上述成套试剂中,所述引物BSMV-f可为如下a1)或a2):
a1)序列表中序列1所示的单链DNA分子;
a2)将序列1经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列1具有相同功能的单链DNA分子。
上述成套试剂中,所述引物BSMV-r可为如下b1)或b2):
b1)序列表中序列2所示的单链DNA分子;
b2)将序列2经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列2具有相同功能的单链DNA分子。
上述成套试剂中,所述探针BSMV-p可为如下c1)或c2):
c1)序列表中序列3所示的单链DNA分子;
c2)将序列3经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列3具有相同功能的单链DNA分子。
上文中,所述y2)、所述a2)、所述b2)或所述c2)中,所述“经过一个或几个核苷酸的取代和/或缺失和/或添加”可为不超过10个氨基酸残基的取代和/或缺失和/或添加。
上述成套试剂中,所述探针BSMV-p的末端可具有荧光标记。
上述成套试剂中,所述探针BSMV-p的末端具有荧光标记具体可为所述探针BSMV-p的5′末端具有FAM荧光标记和/或3′末端具有TAMRA荧光标记。
上述成套试剂中,所述引物BSMV-f、所述引物BSMV-r和所述探针BSMV-p的摩尔比具体可为2:2:1。
上述成套试剂中,所述引物BSMV-f、所述引物BSMV-r和所述探针BSMV-p的量具体可如下:0.5μmol所述引物BSMV-f、0.5μmol所述引物BSMV-r和0.25μmol所述探针BSMV-p。
上述成套试剂中所述引物对X1也属于本发明的保护范围。
上述引物对X1中,所述引物BSMV-f和所述引物BSMV-r的摩尔比具体可为1:1。
上述引物对X1中,所述引物BSMV-f和所述引物BSMV-r的量具体可如下:0.5μmol所述引物BSMV-f和0.5μmol所述引物BSMV-r。
c1)或c2)也属于本发明的保护范围:
c1)上述成套试剂的制备方法,为将上述成套试剂中的所述引物BSMV-f、所述引物BSMV-r和所述探针BSMV-p分别单独包装;
c2)上述引物对X1的制备方法,为将上述引物对X1中各引物分别单独包装。
上述成套试剂或上述引物对X1的应用也属于本发明的保护范围。上述成套试剂或上述引物对X1的应用可为如下d1)或d2)或d3)或d4):
d1)制备用于检测或辅助检测大麦条纹花叶病毒的试剂盒;
d2)检测或辅助检测待测样品中是否含有或疑似含有大麦条纹花叶病毒;
d3)制备用于鉴定或辅助鉴定大麦条纹花叶病毒的试剂盒;
d4)鉴定或辅助鉴定待测病毒是否为候选的大麦条纹花叶病毒。
为解决上述技术问题,本发明还提供了含有上述成套试剂或上述引物对X1的试剂盒。
所述试剂盒的应用也属于本发明的保护范围。所述试剂盒的应用可为如下d2)或d4):
d2)检测或辅助检测待测样品中是否含有或疑似含有大麦条纹花叶病毒;
d4)鉴定或辅助鉴定待测病毒是否为候选的大麦条纹花叶病毒。
为解决上述技术问题,本发明还提供了一种检测待测样品是否含有大麦条纹花叶病毒的方法。
本发明所提供的检测待测样品是否含有大麦条纹花叶病毒的方法,为A1)或A2)或A3):
A1)以待测样品的cDNA为模板,以所述成套试剂进行数字PCR,然后进行如下评判:如果所述成套试剂可以实现对所述cDNA的数字PCR,则待测样品中含有或疑似含有大麦条纹花叶病毒;如果所述成套试剂不能实现对所述cDNA的数字PCR,则所述待测样品不含有或疑似不含有大麦条纹花叶病毒;
A2)以待测样品的cDNA为模板,以所述引物对X1进行PCR扩增,然后进行如下评判:如果所述引物对X1可以实现对所述cDNA的PCR扩增,则待测样品中含有或疑似含有大麦条纹花叶病毒;如果所述引物对X1不能实现对所述cDNA的PCR扩增,则所述待测样品不含有或疑似不含有大麦条纹花叶病毒;
A3)检测待测样品的cDNA中是否含有特异DNA片段,然后进行如下评判:如果待测样品的cDNA中含有特异DNA片段,则待测样品中含有或疑似含有大麦条纹花叶病毒;如果待测样品的cDNA中不含有特异DNA片段,则待测样品不含有或疑似不含有大麦条纹花叶病毒;
所述特异DNA片段为如下y1)或y2):
y1)序列表的序列4所示的单链DNA分子;
y2)将序列4经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列4具有相同功能的DNA分子。
上述方法中,所述待测样品可为植物样品。所述植物样品具体可为感染了大麦条纹花叶病毒的大麦叶片、感染了甘蔗花叶病毒的玉米叶片或感染了玉米褪绿斑驳病毒的玉米叶片。
为解决上述技术问题,本发明还提供了一种鉴定待测病毒是否为候选的大麦条纹花叶病毒的方法。
本发明所提供的鉴定待测病毒是否为候选的大麦条纹花叶病毒的方法,可为B1)或B2)或B3):
B1)以待测病毒的cDNA为模板,以所述成套试剂进行数字PCR,然后进行如下评判:如果所述成套试剂可以实现对所述cDNA的数字PCR,则待测病毒为候选的大麦条纹花叶病毒;如果所述成套试剂不能实现对所述cDNA的数字PCR,则待测病毒为候选的非大麦条纹花叶病毒;
B2)以待测病毒的cDNA为模板,以所述引物对X1进行PCR扩增,然后进行如下评判:如果所述引物对X1可以实现对所述cDNA的PCR扩增,则待测病毒为候选的大麦条纹花叶病毒;如果所述引物对X1不能实现对所述cDNA的PCR扩增,则待测病毒为候选的非大麦条纹花叶病毒;
B3)检测待测病毒的cDNA中是否含有特异DNA片段,然后进行如下评判:如果待测病毒的cDNA中含有特异DNA片段,则待测病毒为候选的大麦条纹花叶病毒;如果待测病毒的cDNA中不含有特异DNA片段,则待测病毒为候选的非大麦条纹花叶病毒;
所述特异DNA片段为如下y1)或y2):
y1)序列表的序列4所示的单链DNA分子;
y2)将序列4经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列4具有相同功能的DNA分子。
上述任一所述的方法中,所述“进行数字PCR”的反应体系可包括:2×SuperMix、所述引物BSMV-f、所述引物BSMV-r、所述探针BSMV-p和模板。所述模板可为将待测样品的总RNA反转录得到的cDNA或待测病毒的总RNA反转录得到的cDNA。
上述任一所述的方法中,所述“进行数字PCR”的反应体系具体可由2×SuperMix、所述引物BSMV-f、所述引物BSMV-r、所述探针BSMV-p、模板和水组成。所述模板可为将待测样品的总RNA反转录得到的cDNA或待测病毒的总RNA反转录得到的cDNA。
上述任一所述的方法中,所述“进行数字PCR”的反应体系具体可为体系1或体系2。
20μL所述体系1可由10μL 2×SuperMix、引物BSMV-f(浓度为0.4-0.6μM)、引物BSMV-r(浓度为0.4-0.6μM)、探针BSMV-p(浓度为0.2-0.3μM)、模板和无核酸酶水组成。所述模板可为将待测样品的总RNA反转录得到的cDNA或待测病毒的总RNA反转录得到的cDNA。
20μL所述体系1具体可由10μL 2×SuperMix、1μL引物BSMV-f(浓度为10μM)、1μL引物BSMV-r(浓度为10μM)、0.5μL探针BSMV-p(浓度为10μM)、2μL模板和5.5μL无核酸酶水组成。所述模板可为将待测样品的总RNA反转录得到的cDNA。
所述体系2可为向所述体系1中加入数字PCR反应用油得到的体系。
所述体系2可为20μL向所述体系1中加入70μL数字PCR反应用油得到的体系。
上文中,所述2×SuperMix和所述数字PCR反应用油均可为美国Bio-Rad公司的产品。
上述任一所述的方法中,所述“进行数字PCR”和所述“进行PCR扩增”的退火温度可为55-60℃(如58℃)。
上述任一所述的方法中,所述“进行数字PCR”的反应程序具体可为:50℃热激活5min;95℃预变性5min;95℃变性15s,58℃退火及延伸60s,40个循环。
上述任一所述的方法中,所述“进行数字PCR”可在数字PCR反应系统中进行。
上述任一所述的方法中,所述“进行数字PCR”具体可在Bio-Rad数字PCR反应系统(Bio-Rad QX200)中进行;Bio-Rad数字PCR反应系统(Bio-Rad QX200)为美国Bio-Rad公司的产品。
针对大麦条纹花叶病毒设计检测大麦条纹花叶病毒的成套试剂,并基于该成套试剂建立了利用数字PCR检测大麦条纹花叶病毒的方法。实验证明,采用本发明所提供的方法数字PCR检测大麦条纹花叶病毒,特异性好(可从大麦条纹花叶病毒、甘蔗花叶病毒、玉米褪绿斑驳病毒中准确鉴定出大麦条纹花叶病毒)且灵敏度高(在20μL反应体系中,灵敏度可达10拷贝/μL),适用于潜隐病症和病毒含量低的样品中大麦条纹花叶病毒的检测,具有重要的应用价值。
附图说明
图1为特异性实验结果。
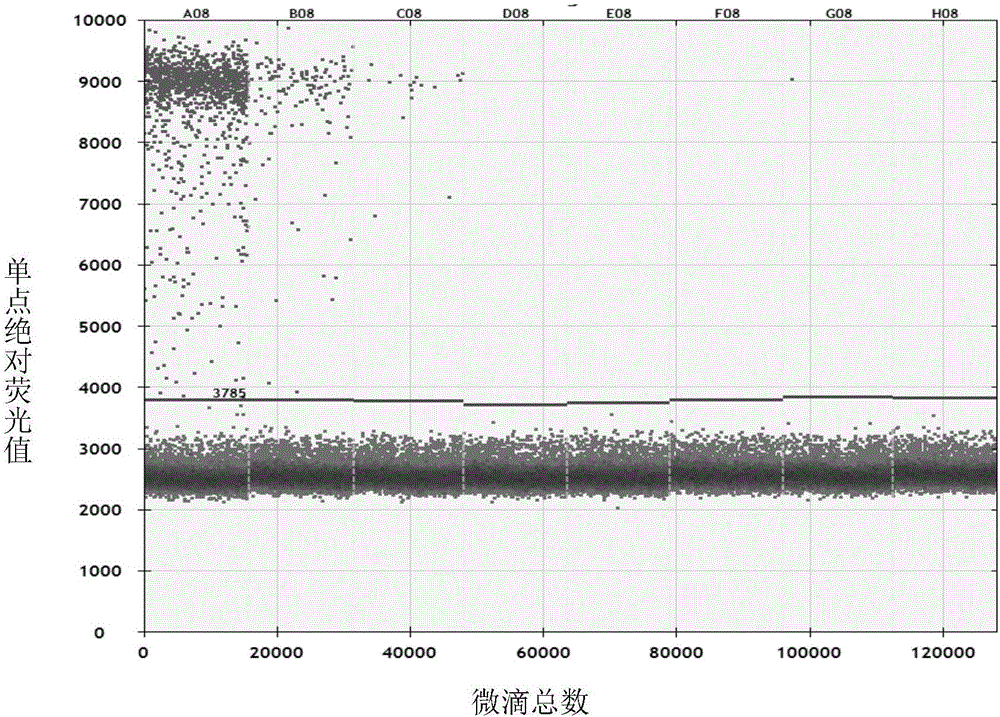
图2为灵敏度实验结果。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
One Step PrimeScriptTMRT-PCR Kit(Perfect Real Time)为Takara公司的产品,产品目录号为RR064A。One Step PrimeScriptTMRT-PCR Kit(Perfect Real Time)在下文中简称实时荧光一步RT-PCR试剂盒。
PrimeScriptTMRT reagent Kit(Perfect Real Time)为Takara公司的产品,产品目录号为RR037A。PrimeScriptTMRT reagent Kit(Perfect Real Time)在下文中简称反转录试剂盒。
植物总RNA提取试剂盒为天根生化科技(北京)有限公司的产品,货号为DP432。
数字PCR相关反应试剂耗材和Bio-Rad数字PCR反应系统(Bio-Rad QX200)均为美国Bio-Rad公司的产品;数字PCR相关反应试剂耗材包括2×SuperMix、数字PCR微滴生成卡和数字PCR反应用油;Bio-Rad数字PCR反应系统(Bio-Rad QX200)包括PCR仪、Droplet Generator微滴生成器和Droplet Reader微滴读取仪。
大麦条纹花叶病毒(Barley stripe mosaic virus,BSMV)记载于如下文献中:孙现超,赵文军,薛杨.大麦条纹花叶病毒中国株编码βC蛋白可以自身相互作用[J].植物病理学报,2010,40(6):593-600.,公众可从中国检验检疫科学研究院(即申请人)处获得。
甘蔗花叶病毒(Sugarcane mosaic virus,SMV)记载于如下文献中:龚海燕,朱水芳,张永江,杨碧,高必达.玉米叶片中甘蔗花叶病毒检测及其基因组3'端序列分析[J].湖南农业科学,2011,(11):8-10.,公众可从中国检验检疫科学研究院(即申请人)处获得。
玉米褪绿斑驳病毒(Maize chlorotic mottle virus,MCMV)记载于如下文献中:龚海燕,张永江,张治宇,陈洪俊,高必达,朱水芳.进境玉米种子携带玉米褪绿斑驳病毒的检测与鉴定[J].植物病理学报.2010,40(4):426-42.,公众可从中国检验检疫科学研究院(即申请人)处获得。
实施例1、检测大麦条纹花叶病毒的成套试剂的制备
检测大麦条纹花叶病毒的成套试剂由引物对X1和探针BSMV-p组成。引物对X1由引物BSMV-f:5′-CGGAATCGGTGTCGTTGGA-3′(序列表中序列1)和引物BSMV-r:5′-CTCTTTGACCCGTCTCTGTAACTACC-3′(序列表中序列2)组成。探针BSMV-p为:5′-FAM-AAATCAAAAACATTCTACGGAATCCGG-TAMRA-3′(序列表中序列3)。探针BSMV-p的5′末端具有FAM荧光标记,3′末端具有TAMRA荧光标记。
检测大麦条纹花叶病毒的成套试剂中,引物BSMV-f、引物BSMV-r和探针BSMV-p分别独立包装。成套试剂中,引物BSMV-f、引物BSMV-r和探针BSMV-p的摩尔比为2:2:1。
合成引物BSMV-f、引物BSMV-r和探针BSMV-p。
实施例2、利用数字PCR检测大麦条纹花叶病毒的方法的建立
1、待测样品的总RNA的提取
用植物总RNA提取试剂盒提取待测样品的总RNA,得到待测样品的总RNA。
2、待测样品的cDNA的获得
取待测样品的总RNA,按照反转录试剂盒说明书的步骤,采用实施例1合成的引物BSMV-r进行反转录,获得待测样品的cDNA。
3、数字PCR扩增反应
(1)配制反应体系
反应体系甲为20μL,由10μL 2×SuperMix、1μL引物BSMV-f、1μL引物BSMV-r、0.5μL探针BSMV-p、2μL待测样品的cDNA和5.5μL无核酸酶水组成;初始体系中,引物BSMV-f的浓度为0.5μM,引物BSMV-r的浓度为0.5μM,探针BSMV-p的浓度为0.25μM。
反应体系乙(作为阴性对照)为20μL,用等体积的健康大麦叶片的cDNA代替待测样品的cDNA,其它同反应体系甲。
健康大麦叶片的cDNA的制备方法如下:用植物总RNA提取试剂盒提取健康大麦叶片的总RNA,然后按照反转录试剂盒说明书的步骤,采用实施例1合成的引物BSMV-r进行反转录,得到健康大麦的cDNA。
反应体系丙(作为空白对照)为20μL,用等体积的无核酸酶水代替待测样品的cDNA,其它同反应体系甲。
(2)完成步骤(1)后,将反应体系(反应体系甲、反应体系乙或反应体系丙)转移至数字PCR微滴生成卡的体系加样孔中,并在反应用油加样孔中加入70μL的数字PCR反应用油(在加样过程中,应避免在孔底产生气泡)。
(3)完成步骤(2)后,将所述数字PCR微滴生成卡转移至Droplet Generator微滴生成器中,启动仪器,得到微滴体系。
(4)完成步骤(3)后,将所述微滴体系转移至96孔板中,封膜。
(5)完成步骤(4)后,将所述96孔板置于PCR仪中,进行PCR扩增反应,得到PCR扩增产物。反应程序:50℃热激活5min;95℃预变性5min;95℃变性15s,58℃退火及延伸60s,40个循环。
(6)完成步骤(5)后,将所述96孔板取出,置于Droplet Reader微滴读取仪中进行微滴荧光读取,然后通过FAM单通道荧光收集单个微滴荧光信号。
(7)完成步骤(6)后,仪器通过分析热点图确定荧光阈值限并自动确定阴性微滴和阳性微滴。然后进行如下判断:
如果待测样品产生阳性微滴信号,则待测样品含有大麦条纹花叶病毒;如果待测样品不产生阳性微滴信号,则待测样品不含有大麦条纹花叶病毒。
实施例3、特异性检测
按照实施例2的方法,进行特异性检测。待测样品为0.1g感染了大麦条纹花叶病毒的大麦叶片、0.1g感染了甘蔗花叶病毒的玉米叶片或0.1g感染了玉米褪绿斑驳病毒的玉米叶片。2μL待测样品的cDNA中,DNA含量均为147ng/μL。
实验结果见图1(A06和B06均为大麦条纹花叶病毒,C06和D06均为甘蔗花叶病毒,E06和F06均为玉米褪绿斑驳病毒,G06为阴性对照,H06为空白对照)。结果表明,仅感染了大麦条纹花叶病毒的大麦叶片产生阳性微滴,其它待测样品、阴性对照和空白对照均不产生阳性微滴(此时判定为阳性微滴的荧光阈值限为3329,低于3329的微滴仪器判断为阴性,高于3329的微滴仪器判断为阳性)。因此,仅感染了大麦条纹花叶病毒的大麦叶片含有大麦条纹花叶病毒,与预期结果完全一致。
上述结果表明,实施例1所提供的检测大麦条纹花叶病毒的成套试剂的特异性高。
实施例4、灵敏度检测
1、用植物总RNA提取试剂盒提取感染了BSMV的大麦叶片的总RNA,然后按照反转录试剂盒说明书的步骤,采用实施例1合成的引物BSMV-r进行反转录,获得感染了BSMV的大麦叶片的cDNA。将感染了BSMV的大麦叶片的cDNA命名为稀释液1(稀释度记为100)。
2、完成步骤1后,取1体积份稀释液1,加入9体积份的无核酸酶水,混合均匀,得到稀释液2(稀释度记为10-1);以此类推制成稀释液3(稀释度记为10-2)、稀释液4(稀释度记为10-3)、稀释液5(稀释度记为10-4)、稀释液6(稀释度记为10-5)、稀释液7(稀释度记为10-6)、稀释液8(稀释度记为10-7)、稀释液9(稀释度记为10-8)、稀释液10(稀释度记为10-9)、稀释液11(稀释度记为10-10)和稀释液12(稀释度记为10-11)。
3、完成步骤2后,按照实施例2步骤3的方法,进行灵敏度检测。待测样品的cDNA为步骤2制备的稀释液7、稀释液8、稀释液9、稀释液10、稀释液11或稀释液12。
实验结果见图2(A08为稀释液7,B08为稀释液8,C08为稀释液9,D08为稀释液10,E08为稀释液11,F08为稀释液12,G08为阴性对照,H08为空白对照。)结果表明,稀释液7、稀释液8和稀释液9中均产生阳性微滴,稀释液10、稀释液11、稀释液12、阴性对照和空白对照均不产生阳性微滴(此时判定为阳性微滴的的荧光阈值限为3785,低于3785的微滴仪器判断为阴性,高于3785的微滴仪器判断为阳性)。稀释液7、稀释液8、稀释液9、稀释液10、稀释液11和稀释液12中含有大麦条纹花叶病毒模板的拷贝数依次分别为1000拷贝/μL、100拷贝/μL、10拷贝/μL、1拷贝/μL、0.1拷贝/μL和0.01拷贝/μL,因此,实施例1所提供的检测大麦条纹花叶病毒的成套试剂在上述反应体系中的的灵敏度为10拷贝/μL。
<110> 中国检验检疫科学研究院
<120> 利用数字PCR检测大麦条纹花叶病毒的方法及其专用成套试剂
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 19
<212> DNA
<213> 人工序列
<220>
<223>
<400> 1
cggaatcggt gtcgttgga 19
<210> 2
<211> 26
<212> DNA
<213> 人工序列
<220>
<223>
<400> 2
ctctttgacc cgtctctgta actacc 26
<210> 3
<211> 27
<212> DNA
<213> 人工序列
<220>
<223>
<400> 3
aaatcaaaaa cattctacgg aatccgg 27
<210> 4
<211> 123
<212> DNA
<213> 人工序列
<220>
<223>
<400> 4
cggaatcggt gtcgttggat tgtttgcgta tttgatcttt tcaaatcaaa aacattctac 60
ggaatccggc gataatattc acaaattcgc caacggaggt agttacagag acgggtcaaa 120
gag 123
- 还没有人留言评论。精彩留言会获得点赞!