一种高活性漆酶突变体蛋白及其制备方法与流程
本发明属于医药学
技术领域:
,尤其涉及一种高活性漆酶突变体蛋白及其制备方法。
背景技术:
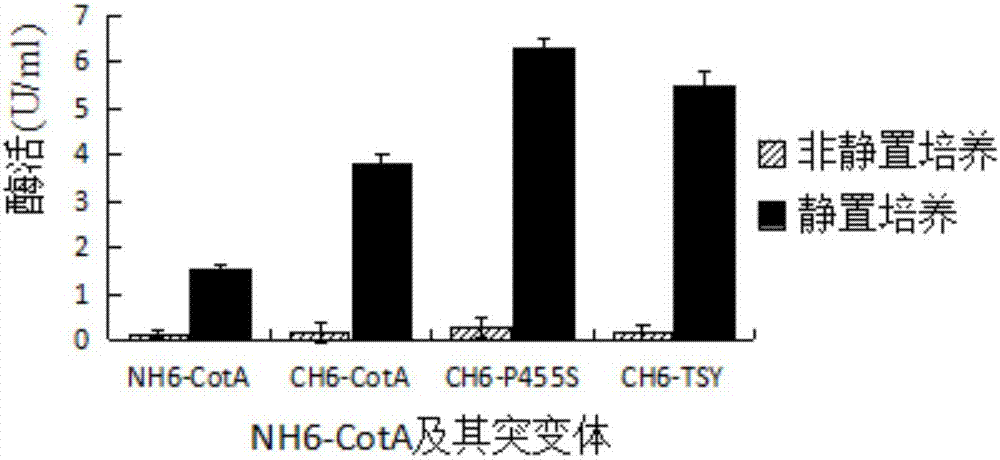
:漆酶(ec1.10.3.2)是一种多铜氧化酶,其是从底物吸收电子,传递给氧气生成水,具有环保和高效的特点。漆酶底物范围很广,包括邻苯二酚、对苯二酚、多酚、甲氧基替代酚、氮羟基化合物、苯胺和呈现还原性的有机化合物,因环保高效且具有广泛的底物谱,所以漆酶在很多领域都有巨大的应用潜力,如生物修复、生物合成、生成检测和生物质能源等等。尽管如此,野生型漆酶存在活性低的问题,因此,对野生型漆酶进行改造以筛选高活性漆酶突变体具有重要意义。发明目的本发明的首要目的是提供一种高活性漆酶突变体蛋白。为了实现上述目的,本发明采用了以下技术方案:一种高活性漆酶突变体蛋白,其突变体是由野生型漆酶的基因突变得到,所述突变体为ch6-cota,ch6-f207y,ch6-v403t,ch6-p455s,ch6-ts或ch6-tsy中的任意一种;ch6-cota、ch6-f207y、ch6-v403t、ch6-p455s、ch6-ts、ch6-tsy的核苷酸序列分别如seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6所示。具体的,ch6-cota、ch6-f207y、ch6-v403t、ch6-p455s、ch6-ts、ch6-tsy的氨基酸序列分别如seqidno.15、seqidno.16、seqidno.17、seqidno.18、seqidno.19、seqidno.20所示。本发明的另外一个目的是提供一种如上所述的高活性漆酶突变体蛋白的制备方法,其步骤如下:a)引物设计:ch6-cota的正、反向引物的核苷酸序列分别如seqidno.7、seqidno.8所示;ch6-f207y的正、反向引物的核苷酸序列分别如seqidno.9、seqidno.10所示;ch6-v403t的正、反向引物的核苷酸序列分别如seqidno.11、seqidno.12所示;ch6-p455s的正、反向引物的核苷酸序列分别如seqidno.13、seqidno.14所示;b)dpnⅰ酶切消化:分别用各对正、反向引物对pet22b/cota质粒(cota基因来自枯草芽孢杆菌bacillussubtilis168,经克隆后连接到pet22b载体上)进行扩增,将扩增产物用dpnⅰ酶在35-40℃下酶切4.5-5.5h,扩增条件:94℃,5min;94℃,1min;68℃,30s;72℃,1min,循环30次;72℃,5min;4℃保温;c)退火、纯化回收:将酶切产物混合,72℃反应10min后室温退火,将退火后的产物用试剂盒(universaldnapurificationkit,全式金生物技术公司)纯化回收;d)转化、测序:将回收产物转化到感受态dh5α大肠杆菌中,平板培养,挑取单菌落测序,得测序正确的高活性漆酶衍生物的突变体ch6-cota菌株、ch6-f207y菌株、ch6-v403t菌株、ch6-p455s菌株;e)以ch6-p455s的质粒为模板,seqidno.11、seqidno.12所示的核苷酸序列为正、反向引物对模板进行扩增,扩增产物按照步骤b)的条件dpnⅰ酶切消化,之后重复步骤c)、d),得双突变的突变体ch6-ts菌株;f)以ch6-ts的质粒为模板,seqidno.9、seqidno.10所示的核苷酸序列为正、反向引物对模板进行扩增,扩增产物按照步骤b)的条件dpnⅰ酶切消化,之后重复步骤c)、d),得三突变的突变体ch6-tsy菌株。实际上,以上突变体的构建原理是:以野生型漆酶nh6-cota为模板,扩增cota基因(cota是芽孢杆菌属的具有漆酶活性一种蛋白),然后将cota基因和pet22b载体分别双酶切,酶切产物通过连接、转化和测序构建his标签在c端的突变体ch6-cota菌株,然后再通过定点突变和组合突变得到高活性漆酶蛋白的突变体ch6-cota菌株、ch6-f207y菌株、ch6-v403t菌株、ch6-p455s菌株、ch6-ts菌株和ch6-tsy菌株。采用上述技术方案产生的有益效果在于:本发明通过dpnⅰ法构建突变体,最终获得cota的突变体ch6-cota、ch6-f207y、ch6-v403t、ch6-p455s、ch6-ts和ch6-tsy,这些突变体活性高,大体上来说:第一、突变体ch6-cota的体积活性、比活力分别是野生型漆酶nh6-cota的7倍和2.4倍;第二,与野生型漆酶nh6-cota相比,各突变体的kcat/km(即催化效率)均有显著提升,其中突变体ch6-p455s、ch6-ts的kcat/km是nh6-cota的3倍。具体的方案为,高活性漆酶突变体蛋白的纯化步骤如下:(1)往od600到达0.4-0.6的培养物中分别加入终浓度为0.2mmol/l的iptg和终浓度为0.25mmol/l的cuso4,在25℃、180rpm的条件下培养4-5h后,于25℃摇床中静置过夜,离心收集菌体后重悬浮于20mmna2hpo4-nah2po4,ph7.6,500mmnacl,20mm咪唑的buffer溶液中,超声破碎;(2)将破碎后的菌体于10000-12000rpm条件下离心30-35min,将上清液于68-72℃条件下加热13-17min;(3)将加热后的样品于10000-12000rpm条件下离心30-35min,将上清液进行镍株亲和层析,用咪唑浓度为50–300mm的缓冲液洗脱蛋白质。优选的,突变体蛋白在纯化前经过如下处理:1)将保存在-80℃条件下的突变体菌株划线到lb固体平板中,在37-40℃条件下过夜活化;2)挑起活化的单菌落于10ml有氨苄抗性的液体lb培养基中,在37-40℃、150-300rpm的条件下过夜活化做种子液;3)按0.4-0.6%的接种量将种子液接种于1l有氨苄抗性的液体lb培养基中,在37-40℃、150-300rpm的条件下培养;4)当od600为0.6时,向培养液中加入iptg至终浓度为0.2mm,加入硫酸铜至终浓度为0.25mm,然后置于25℃、150-180rpm的条件下诱导4h,之后在25℃的恒温摇床里静置过夜培养。静置过夜培养实际上是使得培养物在微厌氧环境中培养,也就是说,通过引入静置过夜培养,这样在微厌氧环境下有助于铜离子加载到蛋白上,申请人经试验证明,静置过夜培养的野生型漆酶的酶活是非静置过夜培养的野生型漆酶酶活的20倍,而静置过夜培养的突变体蛋白酶活是非静置过夜培养的突变体蛋白酶活的40倍以上,这些高活性漆酶突变体蛋白的获得为漆酶更加广泛地应用于工业生产中奠定了基础。附图说明图1是野生型漆酶nh6-cota及其突变体纯化后的sds-page电泳示意图;图2是野生型漆酶nh6-cota及其突变体在不同培养条件下的酶活柱状图。具体实施方式为了进一步说明本发明公开的技术方案,以下通过3个实施例来说明。实施例1:突变体的构建a)引物设计:ch6-cota的正、反向引物的核苷酸序列分别如seqidno.7、seqidno.8所示;ch6-f207y的正、反向引物的核苷酸序列分别如seqidno.9、seqidno.10所示;ch6-v403t的正、反向引物的核苷酸序列分别如seqidno.11、seqidno.12所示;ch6-p455s的正、反向引物的核苷酸序列分别如seqidno.13、seqidno.14所示;b)dpnⅰ酶切消化:分别用各对正、反向引物对pet22b/cota质粒进行扩增,将扩增产物用dpnⅰ酶在37℃下酶切5h,扩增条件:94℃,5min;94℃,1min;68℃,30s;72℃,1min,循环30次;72℃,5min;4℃保温;c)退火、纯化回收:将酶切产物混合,72℃反应10min后室温退火,将退火后的产物用试剂盒纯化回收;d)转化、测序:将回收产物转化到感受态dh5α大肠杆菌中,平板培养,挑取单菌落测序,得测序正确的高活性漆酶衍生物的突变体ch6-cota菌株、ch6-f207y菌株、ch6-v403t菌株、ch6-p455s菌株;e)以ch6-p455s的质粒为模板,seqidno.11、seqidno.12所示的核苷酸序列为正、反向引物对模板进行扩增,扩增产物按照步骤b)的条件dpnⅰ酶切消化,之后重复步骤c)、d),得双突变的突变体ch6-ts菌株;f)以ch6-ts的质粒为模板,seqidno.9、seqidno.10所示的核苷酸序列为正、反向引物对模板进行扩增,扩增产物按照步骤b)的条件dpnⅰ酶切消化,之后重复步骤c)、d),得三突变的突变体ch6-tsy菌株。实施例2:野生型漆酶nh6-cota及其突变体蛋白的纯化1、蛋白的培养1)将保存在-80℃条件下的野生型漆酶nh6-cota/突变体菌株划线到lb固体平板中,在37℃条件下过夜活化;2)挑起活化的单菌落于10ml有氨苄抗性的液体lb培养基中,在37℃、200rpm的条件下过夜活化做种子液;3)按0.5%的接种量将种子液接种于1l有氨苄抗性的液体lb培养基中,在37℃、200rpm的条件下培养;4)当od600为0.6时,向培养液中加入iptg至终浓度为0.2mm,加入硫酸铜至终浓度为0.25mm,然后置于25℃、180rpm的条件下诱导4h,之后在25℃的恒温摇床里静置过夜(微厌氧环境)培养。2、蛋白的纯化(1)往od600到达0.4-0.6的培养物中分别加入终浓度为0.2mmol/l的iptg和终浓度为0.25mmol/l的cuso4,25℃、180rpm培养4-5h后,于25℃摇床中静静过夜,离心收集菌体后重悬于20mmna2hpo4-nah2po4,ph7.6,500mmnacl,20mm咪唑的buffer溶液中,超声破碎;(2)将破碎后的菌体于12000rpm条件下离心30min,将上清液于70℃条件下加热15min;(3)将加热后的样品于12000rpm条件下离心30min,将上清液进行镍株亲和层析,用咪唑浓度为200mm的缓冲液洗脱蛋白质。3、蛋白纯化结果如图1所示为野生型漆酶nh6-cota及其突变体纯化后的sds-page电泳图,其中蛋白泳道1-7分别代表野生型漆酶nh6-cota及突变体ch6-cota、ch6-f207y、ch6-v403t、ch6-p455s、ch6-ts、ch6-tsy的电泳图。经sds-page电泳检测,野生型漆酶nh6-cota及其突变体ch6-cota、ch6-f207y、ch6-v403t、ch6-p455s、ch6-ts、ch6-tsy的纯度均达到95%以上,可以用于活性测试实验。实施例3:野生型漆酶nh6-cota及其突变体蛋白的酶活检测在酶标板中加入10ul浓度为20mm的abts底物和1-2ul的酶,最后加入0.1m磷酸氢二钠-柠檬酸缓冲液(ph4.0)构成200ul的反应体系,用酶标仪在40℃条件下每5s读取od420的吸光值,然后经过线性拟合算出最大反应速率vmax,单位为umol/min。如表1所示为nh6-cota和ch6-cota的蛋白产量和活性检测结果,从表中可以看出,突变体ch6-cota的蛋白产量是野生型漆酶nh6-cota的4倍多,突变体ch6-cota的体积活性、比活力分别是野生型漆酶nh6-cota的7倍和2.4倍。表1nh6-cota和ch6-cota的蛋白产量和活性比较对象蛋白产量(mg/l)体积活性(u/ml)比活力(u/mg)nh6-cota1.1±0.2528±2553±3ch6-cota4.7±0.83933±172127±5如表2所示为nh6-cota及其突变体的酶活测定结果,从表中可以看出,与野生型漆酶nh6-cota相比,各突变体的kcat/km均有显著提升,其中突变体ch6-p455s、ch6-ts的kcat/km是nh6-cota的3倍,说明与野生型漆酶相比,本发明公开的突变体蛋白的酶活具有显著的提升。表2nh6-cota及其突变体的动力学参数分析如图2所示为nh6-cota及其突变体蛋白在不同培养条件下的酶活测定,其中静止培养是将蛋白置于25℃、180rpm的条件下诱导4h后在静置过夜(微厌氧环境)培养,而非静止培养是诱导4h后未静置过夜。通过静置培养,这样在微厌氧环境下有助于铜离子加载到蛋白上,具体来说,结合图2及实验数据可知,静置过夜培养的野生型漆酶的酶活是非静置过夜培养的野生型漆酶酶活的20倍,而静置过夜培养的突变体蛋白酶活是非静置过夜培养的突变体蛋白酶活的40倍以上。核苷酸或氨基酸序列表当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1