一种重组腺相关病毒的制备方法及重组杆状病毒与流程
本发明属于生物工程领域,更具体地,涉及一种重组腺相关病毒的制备方法及重组杆状病毒。
背景技术:
重组腺相关病毒(raav)具有安全性高、免疫原性低、宿主范围广、能介导外源基因在动物体内长期稳定表达等特点,是基因治疗领域最具应用前景的载体之一。raav在神经科学研究以及疾病的基因治疗等领域具有重要作用和巨大需求。有研究数据表明,一次大型灵长类动物试验或临床基因治疗试验就需要约1015vg(vg,virusgenomes)的raav,是一般体外细胞试验或小鼠试验用量的成百上千倍(humgenether.2002nov1;13(16):1935-43.)。
目前利用杆状病毒表达系统大规模制备raav的方法主要有以下两种:两杆状病毒系统(twobacsystem)和依赖包装细胞系的一杆状病毒系统(onebacsystem)。两杆状病毒系统的主要流程是,将aav的rep基因和cap基因整合在一个杆状病毒基因组中,将itr核心表达元件整合到另外一个杆状病毒基因组中,然后将上述两种重组杆状病毒共同感染宿主细胞,产生出raav(molther.2008may;16(5):924-30,molther.2009nov;17(11):1888-96.)。依赖包装细胞系的一杆状病毒系统的主要流程是,先建立诱导表达rep基因和cap基因的包装细胞系,这种包装细胞系整合了rep基因和cap基因表达元件,rep基因和cap基因分别置于杆状病毒晚期基因表达强启动子ph调控下,在ph启动子的上游加入了hr2增强子序列和aav的rep蛋白结合序列。在感染整合了itr核心表达元件的重组杆状病毒后,包装细胞系中的rep基因和cap基因被诱导表达,进而产生raav(procnatlacadsciusa.2009mar31;106(13):5059-64,humgenether.2014mar;25(3):212-22.)。
然而,前者由于两种杆状病毒共同感染细胞效率较低,无法充分利用每个细胞的产能,而且感染是个随机的过程,容易产生不含核酸的空壳缺陷raav颗粒,制备工艺条件优化起来比较复杂,不同批次制备的raav质量不稳定。后者由于依赖诱导表达rep基因和cap基因的包装细胞系,构建复杂,优良包装细胞系的筛选难度大,制备不同血清型的raav,就需要建立表达相应血清型cap基因的包装细胞系,灵活性和通用性较差,难以推广。
技术实现要素:
针对现有技术的以上缺陷或改进需求,本发明提供了一种基因治疗用重组腺相关病毒的制备方法及重组杆状病毒,其目的在于通过将aav的rep基因、cap基因和itr核心表达元件进行优化整合,构建到杆状病毒基因组中或者整合到宿主包装细胞基因组中,实现利用一种重组杆状病毒感染宿主包装细胞系制备raav,由此解决现有的大规模制备raav方法存在的构建复杂、灵活性差、 通用性低的技术问题。
为实现上述目的,按照本发明的一个方面,提供了一种重组腺相关病毒的制备方法,包括以下步骤:
(1)将构建有重组腺相关病毒itr核心表达元件和cap基因或rep基因的重组型杆状病毒感染相应的宿主包装细胞系;
(2)将步骤(1)中感染了重组杆状病毒的宿主包装细胞系扩大培养,使产生重组腺相关病毒;
(3)将步骤(2)中获得的重组腺相关病毒分离并纯化。
优选地,所述制备方法,其步骤(1)利用pfast.bac.dual穿梭载体构建所述重组型杆状病毒。
优选地,所述制备方法,其所述步骤(1)具体操作方法如下:
a.将itr核心表达元件克隆到pfast.bac.dual穿梭载体的p10启动子和ph启动子间隔序列中;
b.将cap基因或rep基因克隆到pfast.bac.dual穿梭载体的p10启动子或ph启动子下游的多克隆位点中,得到相应的穿梭质粒。
优选地,所述制备方法,其所述构建有重组腺相关病毒itr核心表达元件和cap基因(或rep基因)的重组型杆状病毒其itr核心表达元件中携带有目标基因。
优选地,所述制备方法,其所述宿主包装细胞系用于辅助重组腺相关病毒的复制和组装。
优选地,所述制备方法,其所述宿主细胞基因组上相应整合有诱导表达腺相关病毒rep基因的表达框元件或诱导表达腺相关病毒cap基因的表达框元件。
按照本发明的另一方面,提供了一种重组杆状病毒,其基因组上构建有腺相关病毒itr核心表达元件和相应血清型的cap基因。
优选地,所述重组杆状病毒,其cap基因其序列为依据核糖体泄露扫描原理进行密码子优化的序列。
按照本发明的另一方面,提供了一种重组杆状病毒,其基因组上构建有腺相关病毒itr核心表达元件和相应血清型的rep基因。
优选地,所述重组杆状病毒,其rep基因其序列为依据核糖体泄露原理进行密码子优化的序列。
总体而言,通过本发明所构思的以上技术方案与现有技术相比,能取得以下有益效果:
由于将aav的cap基因(或rep基因)与itr核心表达元件放在一个重组杆状病毒中,相应的将rep基因(或cap基因)整合到宿主细胞基因组中,由宿主包装细胞系提供包装raav所需的部分辅助功能。相比现有的依赖包装细胞系的一杆状病毒系统将rep基因和cap基因全部都整合到宿主细胞系中,构建包装细胞系的难度大大降低;尤其是将cap基因与itr核心元件置于一个杆状病毒基因组中的方法,由于通常采用2型aav的rep基因就可以辅助各种血清型raav的包装,所以只需要建立一种诱导表达2型aav的rep基因就可以满足不同血清型raav的制备,灵活性和通用性也将大大增强。
附图说明
图1是raav的包装原理图(a)和杆状病毒表达系统(bactobac)中穿梭质粒pfast.bac.dual (pfbd)的结构示意图(b);
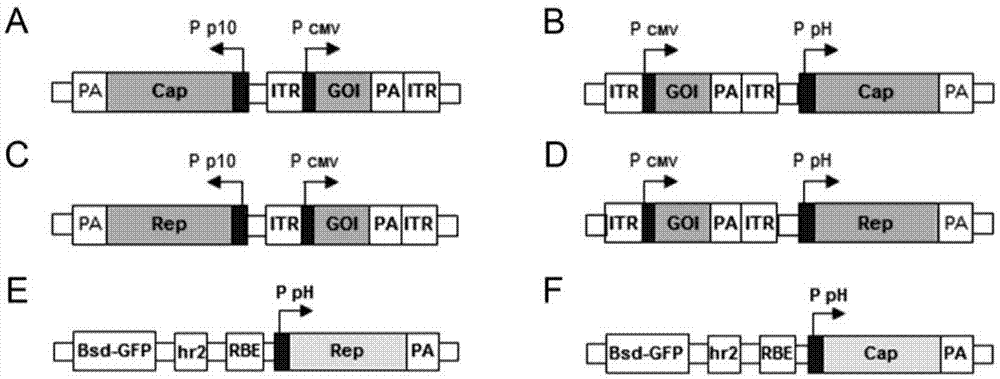
图2是实施例中整合了制备raav所需的重组杆状病毒和包装细胞系所需组件的结构示意图。其中,图2a是实例1中重组穿梭质粒pfd/cap-(itr-gfp)的结构图;图2b是实例2中重组穿梭质粒pfd/cap-(itr-gfp)的结构图;图2c是实例3中重组穿梭质粒pfd/rep-(itr-gfp)的结构图;图2d是实例4中重组穿梭质粒pfd/rep-(itr-gfp)的结构图;图2e是实例1和实例2中建立sf9/rep包装细胞系所用pir-rep78-hr2-rbe-bsd-gfp质粒的结构图;图2f是实例3和实例4中建立sf9/cap包装细胞系所用pir-vp-hr2-rbe-bsd-gfp质粒的结构图;
图3是实施例中利用重组杆状病毒感染宿主包装细胞系制备raav的过程示意图。其中,图3a是实施例1和实施例2的过程示意图;图3b是实施例3和实施例4的过程示意图;
图4是实施例1中重组杆状病毒感染包装细胞系制备raav以及raav细胞水平转导活性的验证图;其中,图4a是重组杆状病毒bev/cap-(itr-gfp)感染sf9细胞,筛选出的sf9/rep包装细胞系及其被重组bev感染后的荧光显微成像图;图4b是实例1制备的raav感染hek293和sf9细胞后的荧光显微成像图;图4c是实例1纯化的raav感染hek293细胞的荧光显微成像图;
图5是实施例2中制备纯化的raav感染hek293细胞的荧光显微成像图;
图6是实施例3中重组杆状病毒感染包装细胞系制备raav以及raav细胞水平转导活性的验证图。其中,图6a是重组杆状病毒bev/rep-(itr-gfp)感染sf9细胞,筛选出的sf9/cap包装细胞系及其被重组bev感染后的荧光显微成像图;图6b是实例4制备的raav感染hek293和sf9细胞后的荧光显微成像图;图6c是实例4纯化的raav感染hek293细胞的荧光显微成像图;
图7是实施例4中制备纯化的raav感染hek293细胞的荧光显微成像图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
本发明提供的重组腺相关病毒的制备方法,包括以下步骤:
(1)将构建有重组腺相关病毒itr核心表达元件和cap基因或rep基因的重组型杆状病毒感染相应的宿主包装细胞系。
所述重组杆状病毒用于提供制备raav所需的itr核心表达元件和cap基因或rep基因,并通过感染宿主包装细胞系激活杆状病毒特异性启动子ph或p10,诱导宿主包装细胞系表达rep基因或cap基因从而辅助raav的复制和组装。
所述重组杆状病毒优选利用bactobac系统的pfast.bac.dual(pfbd)穿梭载体(如图1b)构建,具体方法如下:
a.将itr核心表达元件克隆到pfbd载体的p10启动子和ph启动子间隔序列中。
b.将cap基因或rep基因克隆到pfbd载体的p10启动子或ph启动子下游的多克隆位点中, 得到相应的穿梭质粒。
c.然后按照bactobac系统的方法制备相应的重组杆状病毒。
所述itr核心表达元件通过5’端连接核酸片段或3’端连接核酸片段与所述cap基因或rep基因的表达框相连,itr核心表达元件包括位于两端的aav基因组中的一段末端反向重复序列(itr)以及位于中间的目标基因序列(goi)。itr核心表达元件在实例中选用含cmv启动子、gfp基因、sv40ploya组件的gfp基因表达框,便于技术方案的验证。
所述cap基因编码aav的三种结构蛋白vp1、vp2、vp3,构成病毒的衣壳。aav通过衣壳蛋白与细胞表面的受体结合吸附到宿主细胞表面,不同血清型的aav在感染不同类型组织或细胞时存在感染的范围和效率的差异,主要是由于不同血清型cap基因的差异造成的。因此,制备不同血清型的raav,就要使用相应血清型的cap基因。所述cap基因依据核糖体泄露扫描原理进行了密码子优化,通过p10启动子或ph启动子转录出一条mrna,实现vp1、vp2、vp3三种衣壳蛋白以接近天然比例(1:1:10)的功能性表达。
所述rep基因编码aav的四种非结构蛋白rep78、rep68、rep52和rep40,主要负责病毒基因组的复制,转录调控,位点特异性整合等。目前,通常使用2型aav的rep基因制备不同血清型的raav。所述rep基因依据核糖体泄露扫描原理进行了密码子优化,通过p10启动子或ph启动子转录出一条mrna,实现rep基因的功能性表达。
本发明提供的重组杆状病毒,可按照如下方法制备:
a、采用基因人工合成的方法获得密码子优化的cap基因、rep基因;
采用基因人工合成、pcr扩增和酶切连接的方法获得itr核心表达元件。
b、通过分子克隆的方法将步骤a中获得的itr核心表达元件以及cap基因或rep基因构建到pfast.bac.dual(pfbd)穿梭载体上,根据bactobac系统操作方法,获得重组杆状病毒。
所述宿主包装细胞,优选为sf9细胞,用于辅助raav的复制和组装。优选地,所述重组杆状病毒不含有rep基因时,所述宿主细胞其基因组上须整合诱导表达aav的rep基因表达框元件;所述重组杆状病毒不含有cap基因时,所述宿主细胞其基因组上须整合诱导表达aav的cap基因表达框元件,可通过将携带有相应基因表达元件的质粒转染宿主细胞后随机整合到宿主细胞的基因组中。
所述随机整合了诱导表达aav的rep基因表达框元件的宿主细胞,优选sf9细胞,具体制备方法如下:首先,在现有pir-rep78-hr2-rbe质粒(参考procnatlacadsciusa.2009mar31;106(13):5059-64)的基础上进行了改造,在杀稻瘟菌素(blasticidin,bsd)基因的c端通过fmdv自剪切多肽2a融合了绿色荧光蛋白(gfp)基因,如图2e所示。然后,将改造后的质粒转染sf9细胞,通过bsd抗生素筛选得到整合了诱导表达aav的rep基因表达元件的sf9/rep包装细胞系。该细胞系组成性表达gfp,可通过单克隆分离培养或流式细胞仪分选,进一步得到raav产量较高的sf9/rep包装细胞系。
所述随机整合了诱导表达aav的cap基因表达框元件的宿主细胞,优选为sf9细胞,具体制备 方法如下:首先,在现有pir-vp-hr2-rbe质粒(参考procnatlacadsciusa.2009mar31;106(13):5059-64)的基础上进行了改造,在杀稻瘟菌素(blasticidin,bsd)基因的c端通过fmdv自剪切多肽2a融合了绿色荧光蛋白(gfp)基因,如图2f所示。然后,将改造后的质粒转染sf9细胞,通过bsd抗生素筛选得到整合了诱导表达aav的cap基因表达元件的sf9/cap包装细胞系。该细胞系组成性表达gfp,可通过单克隆分离培养或流式细胞仪分选,进一步得到raav产量较高的sf9/cap包装细胞系。
由于基因整合是随机的,宿主细胞转染质粒后用抗生素筛选,只有基因整合拷贝数比较高的细胞抗性基因表达量高,报告基因gfp表达量也高,在被杆状病毒感染后诱导表达的辅助基因量也高。抗生素筛选后的细胞基因组上随机整合的诱导表达rep基因或cap基因的表达框至少有一个拷贝,也可能有多拷贝的。但宿主包装细胞系的优劣(raav产量高低)与拷贝数没有绝对的关系,表达量高须处于合适的范围之内,所以包装细胞系的优劣需要通过最终感染重组杆状病毒后制备raav的产量来做最终评价指标。
利用上述重组杆状病毒(bev)感染相应的宿主包装细胞系(如图3所示)。
(2)将步骤(1)中感染了重组杆状病毒的宿主包装细胞系扩大培养,使产生大量重组腺相关病毒。
具体可按照如下步骤操作:摇瓶培养所述宿主包装细胞至细胞密度达到3×106cells/ml,以感染复数(moi=5)感染重组杆状病毒(bev),27℃、120rpm/min摇床培养。感染3天后,将细胞悬液3000rpm离心5min,收集培养液上清和细胞沉淀。
(3)将步骤(2)中获得的重组腺相关病毒分离并纯化。
raav主要存在于细胞沉淀中。对制备出的raav进行分离纯化操作,
就能够得到进一步应用所需的raav。具体方法步骤可参考文献(jvirolmethods,2007.139(1):p.61-70,jvirolmethods,2012.179(1):p.276-80.)。
本发明提供的重组杆状病毒,其特征在于,其基因组上构建有腺相关病毒itr核心表达元件和相应血清型的cap基因或rep基因。所述cap基因或rep基因其序列为依据核糖体泄露扫描原理进行密码子优化的序列。
下面仅以二型腺相关病毒(aav2)为例,具体说明如下:
实施例1:重组杆状病毒bev/cap-(itr-gfp)感染sf9/rep包装细胞系制备raav
(1)将构建有重组腺相关病毒itr核心表达元件和相应血清型的cap基因的重组杆状病毒感染相应的宿主包装细胞系
所述构建有重组腺相关病毒itr核心表达元件和相应血清型的cap基因的重组杆状病毒,即重组杆状病毒bev/cap-(itr-gfp),按照如下方法制备并扩增:
为了将制备raav所需的itr核心表达元件以及cap基因置于一个重组杆状病毒中。我们利用了杆状病毒表达系统(bactobac)中的pfast.bac.dual(pfbd)穿梭载体(如图1b)。实例中基于2型aav的cap基因依据核糖体泄露扫描原理进行了密码子优化,并将cap基因置于p10启动子的 调控之下(如组合方案1,如图2a)或ph启动子(如组合方案2,如图2b)的调控之下,实现vp1、vp2、vp3三种衣壳蛋白以接近天然比例(1:1:10)的功能性表达。cap基因序列为如seqidno.1、seqidno.2(2种对应为capa、capb)所示的序列。实例中itr核心表达元件,itr选用2型aav的itr核酸序列,即如seqidno.3所示的序列,itr的核心表达元件采用了含有绿色荧光蛋白(gfp)的表达框,由cmv启动子控制gfp的表达,便于检测重组病毒的活性。itr核心表达元件通过5’端连接核酸片段或3’端连接核酸片段与cap基因表达框或载体相连。5’端或3’端连接核酸片段为如seqidno.4(linka)或seqidno.5(linkb)所示的序列。
在本实例中,重组杆状病毒中主要组件组合方案如下:
capa-linka-(itr-gfp)-linkb
利用常规分子克隆技术将itr核心表达元件(itr-gfp)通过连接核酸片段置于pfbd/cap载体的一侧,构建pfbd/cap-(itr-gfp)重组穿梭质粒。
参照bactobac系统操作说明,将该重组穿梭质粒转化含有acmnpv杆状病毒基因组的dh10bac菌。通过tn7转座子元件介导的重组得到重组杆状病毒基因组(bacmid)。通过蓝白斑筛选和pcr鉴定获得含有重组bacmid的阳性菌。抽提纯化重组bacmid,将其转染贴壁培养的sf9细胞。sf9细胞逐渐被转染后产生的重组杆状病毒完全感染并出现明显的bev感染sf9细胞的细胞病变(cpe)现象。将细胞培养液3000rpm离心5min,上清中就含有产生的重组杆状病毒。
将上清液感染贴壁培养的sf9细胞后继续培养3天,可以看到对照组未感染病毒的sf9细胞状态正常,没有gfp的表达;而在实验组感染了重组杆状病毒bev/cap-(itr-gfp)的sf9细胞都出现了明显的cpe现象和明显的gfp表达,结果如图4a所示。将转染sf9细胞后制备的bev感染贴壁或悬浮培养的sf9细胞,感染3天后细胞出现明显cpe,将细胞培养液3000rpm离心5min,收上清即可获得大量bev。病毒的滴度用荧光定量pcr的方法进行测定,参考文献(procnatlacadsciusa,2009.106(13):p.5059-64)中的方法。
所述相应的宿主包装细胞系,即诱导表达rep基因的sf9/rep包装细胞系,按照如下方法建立:
为了便于包装细胞系的筛选,在现有pir-rep78-hr2-rbe质粒(procnatlacadsciusa.2009mar31;106(13):5059-64)的基础上进行了改造,在杀稻瘟菌素(blasticidin,bsd)基因的c端通过fmdv自剪切多肽2a融合了绿色荧光蛋白(gfp)基因,得到pir-rep78-hr2-rbe-bsd-gfp质粒(如图2e)。然后,将该质粒转染sf9细胞,通过bsd抗生素筛选得到整合了诱导表达aav的rep基因表达元件的sf9/rep包装细胞系。该细胞系组成性表达gfp,可通过单克隆分离培养或流式细胞仪分选,进一步得到raav产量较高的sf9/rep包装细胞系,如图4a所示。
(2)利用bev/cap-(itr-gfp)感染sf9/rep细胞系制备raav并验证其感染活性
将制备的bev/cap-(itr-gfp)以感染复数(moi=5)感染培养的sf9/rep细胞系。感染72小时后,将细胞培养液3000rpm离心5min,分别收集培养上清和细胞沉淀。bev产生后,主要通过分泌释放到培养基上清中,在sf9/rep细胞中也有部分未释放的bev。raav产生后,主要存在于sf9/rep细胞核中,由于sf9/rep细胞感染后发生细胞病变(cpe),部分细胞会裂解,raav也会有部分释 放到上清中,如图4a所示。而因此上清和细胞沉淀中会同时存在bev和raav。
为了验证用重组杆状病毒bev/cap-(itr-gfp)感染sf9/rep细胞制备出了具有活性的raav。通过病毒感染hek293细胞和sf9细胞的实验方法证实该系统制备出了raav,实验结果如图4b。具体实施过程和结果分析如下:将细胞沉淀反复冻融3次裂解后,5000rpm离心5min收集细胞裂解上清液。因为raav无包膜,经60℃、30分钟处理,活性不受影响;而重组杆状病毒(bev)有包膜,经60℃、30分钟处理,失去活性。含有病毒的上清液感染hek293细胞2天后,利用传统的三质粒转染hek293细胞方法制备的raav对照组,在处理前后都有gfp表达,表明raav在处理前后都有感染活性。bev感染sf9细胞后的培养基上清组,未处理的有较强gfp表达,处理后仅有无gfp表达,表明bev可以感染hek293细胞,灭活处理后bev不感染。细胞沉淀裂解液上清实验组,未处理的有较强gfp表达,处理后gfp强度有降低但仍有较强荧光,表明灭活处理后bev不感染,但上清中大量的raav仍能够感染。用与感染hek293细胞组相同的样品感染sf9细胞2天后,结果显示:利用传统的三质粒转染hek293细胞方法制备的raav对照组,没有gfp荧光,表明raav对sf9细胞没有感染性。bev感染sf9细胞后的培养基上清组,灭活前有较强gfp表达,灭活后的没有gfp表达。细胞沉淀裂解液上清实验组,未处理的有较强gfp表达,处理后的没有gfp表达。
(3)将步骤(2)中获得的重组腺相关病毒分离并纯化。
raav的纯化、滴度测定与细胞水平转导活性验证:
将重组bev感染后收集得到约为1×108cells的sf9/rep细胞沉淀,加入10ml裂解缓冲液(50mmtris-cl,150mmnacl,2mmmgcl2,ph8.0),后反复冻融3次,5000rpm离心5min后收集上清,在上清中加入核酸酶benzonase至终浓度50u/ml,37℃水浴处理60min。处理后5000rpm离心10min收上清。上清用氯仿抽提,抽提后的上清再用含13.2%的(nh4)2so4和10%的peg8000的溶液进行两相沉淀的方法进一步纯化,方法参考文献(jvirolmethods,2007.139(1):p.61-70,jvirolmethods,2012.179(1):p.276-80.)。两相沉淀后的上清,用pbs溶液进行透析脱盐处理,用amiconultra-4(100kdcutoff)透析柱离心浓缩至终体积1ml,无菌分装后-80℃冻存。raav的滴度测定采用荧光定量pcr的方法,滴度单位用vg/ml(vg,virusgenomes)表示。
纯化过程的raav得率见表1。实验结果表明,单个sf9/rep包装细胞raav的产量可达8.62×104vg,经过本方法的纯化后,回收率达到36.9%左右。
表1raav纯化过程的得率分析
将hek293细胞以1×104cells/well接种到96孔板中,6h后感染相应浓度梯度含量的纯化的raav。感染48h后,用荧光显微镜观察gfp的表达情况,如图4c。结果表明,本发明的方法制备得到的raav具有较好的细胞水平转导活性。
实施例2:重组杆状病毒bev/cap-(itr-gfp)感染sf9/rep包装细胞系制备raav
本实施例与实施例1相似,区别仅在于所述重组杆状病毒,其主要组件组合方案如下:
linka-(itr-gfp)-linkb-capb
将本实例中的重组杆状病毒bev/cap-(itr-gfp)感染sf9/rep包装细胞系后,将制备得到的raav进行纯化。纯化过程的raav得率见表2。实验结果表明,单个sf9/rep包装细胞raav的产量可达7.20×104vg,经过本方法的纯化后,回收率达到31.3%左右。
表2raav纯化过程的得率分析
将hek293细胞以1×104cells/well接种到96孔板中,6h后感染相应浓度梯度含量的纯化的raav。感染48h后,用荧光显微镜观察gfp的表达情况,如图5。结果表明,本发明的方法制备得到的raav具有较好的细胞水平转导活性。
实施例3:重组杆状病毒bev/rep-(itr-gfp)感染sf9/cap包装细胞系制备raav
(1)将构建有重组腺相关病毒itr核心表达元件和rep基因的重组杆状病毒感染相应的宿主包装细胞系
所述构建有重组腺相关病毒itr核心表达元件和相rep基因的重组杆状病毒,即重组杆状病毒bev/rep-(itr-gfp),按照如下方法制备并扩增:
为了将制备raav所需的itr核心表达元件以及rep基因置于一个重组杆状病毒中。我们利用了杆状病毒表达系统(bactobac)中的pfast.bac.dual(pfbd)穿梭载体(如图1b)。实例中基于2型aav的rep基因依据核糖体泄露扫描原理进行了密码子优化,并将rep基因置于p10启动子的调控之下(如图2c)或ph启动子(如图2d)的调控之下,实现rep基因的功能性表达。rep基因序列为如seqidno.6、seqidno.7(2种对应为repa、repb)所示的序列。实例中itr核心表达元件,itr选用2型aav的itr核酸序列,即如seqidno.3所示的序列,itr的核心表达元件采用了含有绿色荧光蛋白(gfp)的表达框,由cmv启动子控制gfp的表达,便于检测重组病毒的活性。itr核心表达元件通过5’端连接核酸片段或3’端连接核酸片段与rep基因表达框或载体相连。5’端或3’端连接核酸片段为如seqidno.4(linka)或seqidno.5(linkb)所示的序列。
在本实例中,重组杆状病毒中主要组件组合方案如下:
repa-linka-(itr-gfp)-linkb
利用常规分子克隆技术将itr核心表达元件(itr-gfp)通过连接核酸片段置于pfbd/rep载体的一侧,构建pfbd/rep-(itr-gfp)重组穿梭质粒。
参照bactobac系统操作说明,将该重组穿梭质粒转化含有acmnpv杆状病毒基因组的dh10bac菌。通过tn7转座子元件介导的重组得到重组杆状病毒基因组(bacmid)。通过蓝白斑筛选和pcr鉴定获得含有重组bacmid的阳性菌。抽提纯化重组bacmid,将其转染贴壁培养的sf9细胞。sf9细胞逐渐被转染后产生的重组杆状病毒完全感染并出现明显的bev感染sf9细胞的细胞病变(cpe)现象。将细胞培养液3000rpm离心5min,上清中就含有产生的重组杆状病毒。
将上清液感染贴壁培养的sf9细胞后继续培养3天,可以看到对照组未感染病毒的sf9细胞状态正常,没有gfp的表达;而在实验组感染了重组杆状病毒bev/rep-(itr-gfp)的sf9细胞都出现了明显的cpe现象和明显的gfp表达,结果如图6a所示。将转染sf9细胞后制备的bev感染贴壁或悬浮培养的sf9细胞,感染3天后细胞出现明显cpe,将细胞培养液3000rpm离心5min,收上清即可获得大量bev。病毒的滴度用荧光定量pcr的方法进行测定,参考文献(procnatlacadsciusa,2009.106(13):p.5059-64)中的方法。
所述相应的宿主包装细胞系,即诱导表达cap基因的sf9/cap包装细胞系,按照如下方法建立:
为了便于包装细胞系的筛选,在pir-vp-hr2-rbe质粒(参考procnatlacadsciusa.2009mar31;106(13):5059-64)的基础上进行了改造,在杀稻瘟菌素(blasticidin,bsd)基因的c端通过fmdv自剪切多肽2a融合了绿色荧光蛋白(gfp)基因,得到pir-vp-hr2-rbe-bsd-gfp质粒(如图2f)。然后,将该质粒转染sf9细胞,通过bsd抗生素筛选得到整合了诱导表达aav的cap基因表达元件的sf9/cap包装细胞系。该细胞系组成性表达gfp,可通过单克隆分离培养或流式细胞仪分选,进一步得到raav产量较高的sf9/cap包装细胞系,如图6a所示。
(2)利用bev/rep-(itr-gfp)感染sf9/cap细胞系制备raav并验证其感染活性
将制备的bev/rep-(itr-gfp)以感染复数(moi=5)感染悬浮培养的获得的sf9/cap细胞系。感染72小时后,将细胞培养液3000rpm离心5min,分别收集培养上清和细胞沉淀。bev产生后,主要通过分泌释放到培养基上清中,在sf9/cap细胞中也有部分未释放的bev。raav产生后,主要存在于sf9/cap细胞核中,由于sf9/cap细胞感染后发生细胞病变(cpe),部分细胞会裂解,raav也会有部分释放到上清中,如图6a所示。而因此上清和细胞沉淀中会同时存在bev和raav。
为了验证用重组杆状病毒bev/rep-(itr-gfp)感染sf9/cap细胞制备出了具有活性的raav。通过病毒感染hek293细胞和sf9细胞的实验方法证实该系统制备出了raav,实验结果如图6b。具体实施过程和结果分析如下:将细胞沉淀反复冻融3次裂解后,5000rpm离心5min收集细胞裂解上清液。因为raav无包膜,经60℃、30分钟处理,活性不受影响;而重组杆状病毒(bev)有包膜,经60℃、30分钟处理,失去活性。含有病毒的上清液感染hek293细胞2天后,利用传统的三质粒转染hek293细胞方法制备的raav对照组,在处理前后都有gfp表达,表明raav在处理前后都有感染活性。bev感染sf9细胞后的培养基上清组,未处理的有较强gfp表达,处理后仅有 无gfp表达,表明bev可以感染hek293细胞,灭活处理后bev不感染。细胞沉淀裂解液上清实验组,未处理的有较强gfp表达,处理后gfp强度有降低但仍有较强荧光,表明灭活处理后bev不感染,但上清中大量的raav仍能够感染。用与感染hek293细胞组相同的样品感染sf9细胞2天后,结果显示:利用传统的三质粒转染hek293细胞方法制备的raav对照组,没有gfp荧光,表明raav对sf9细胞没有感染性。bev感染sf9细胞后的培养基上清组,灭活前有较强gfp表达,灭活后的没有gfp表达。细胞沉淀裂解液上清实验组,未处理的有较强gfp表达,处理后的没有gfp表达。
(3)将步骤(2)中获得的重组腺相关病毒分离并纯化。
raav的纯化、滴度测定与细胞水平转导活性验证
将重组bev感染后收集得到约为1×108cells的sf9/cap细胞沉淀,加入10ml裂解缓冲液(50mmtris-cl,150mmnacl,2mmmgcl2,ph8.0),后反复冻融3次,5000rpm离心5min后收集上清,在上清中加入核酸酶benzonase至终浓度50u/ml,37℃水浴处理60min。处理后5000rpm离心10min收上清。上清用氯仿抽提,抽提后的上清再用含13.2%的(nh4)2so4和10%的peg8000的溶液进行两相沉淀的方法进一步纯化,方法参考文献(jvirolmethods,2007.139(1):p.61-70.和jvirolmethods,2012.179(1):p.276-80.)。两相沉淀后的上清,用pbs溶液进行透析脱盐处理,用amiconultra-4(100kdcutoff)透析柱离心浓缩至终体积1ml,无菌分装后-80℃冻存。raav的滴度测定采用荧光定量pcr的方法,滴度单位用vg/ml(vg,virusgenomes)表示。
纯化过程的raav得率见表3。实验结果表明,单个sf9/cap细胞raav的产量可达6.84×104vg,经过本方法的纯化后,回收率达到28.8%左右。
表3raav纯化过程的得率分析
将hek293细胞以1×104cells/well接种到96孔板中,6h后感染相应浓度梯度含量的纯化的raav。感染48h后,用荧光显微镜观察gfp的表达情况,如图6c。结果表明,本发明的方法制备得到的raav具有较好的细胞水平转导活性。
实施例4:重组杆状病毒bev/rep-(itr-gfp)感染sf9/cap包装细胞系制备raav
本实施例与实施例3相似,区别仅在于所述重组杆状病毒,其主要组件组合方案如下:
linka-(itr-gfp)-linkb-repb
将本实例中的重组杆状病毒bev/rep-(itr-gfp)感染sf9/cap包装细胞系后,将制备得到的raav进行纯化。纯化过程的raav得率见表4。实验结果表明,单个sf9/cap包装细胞raav的产 量可达8.16×104vg,经过本方法的纯化后,回收率达到34.7%左右。
表4raav纯化过程的得率分析
将hek293细胞以1×104cells/well接种到96孔板中,6h后感染相应浓度梯度含量的纯化的raav。感染48h后,用荧光显微镜观察gfp的表达情况,如图7。结果表明,本发明的方法制备得到的raav具有较好的细胞水平转导活性。
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!