一种基于芳杂环并‑3‑S,S‑二氧二苯并噻吩单元的共轭聚合物及其制备方法与应用与流程
本发明属于有机光电技术领域,具体涉及一种基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物及其制备方法与应用。
背景技术:
在过去的三十年中,有机电子和光电子产业,包括有机/聚合物发光二极管,有机场效应晶体管,有机太阳能电池等领域得到了迅猛的发展,并逐渐实现产业化。有机电子产品具有价格低廉,体轻便携等优点。使其具有极大的市场潜力。因此开发具有市场吸引力的有机电子产品吸引了世界上众多研究机构和科研团队的关注,而在这其中,开发新型高效稳定的材料成为关键。
但是,目前有机发光器件技术在发展过程中遇到了瓶颈问题,就是发光器件的发光效率和使用寿命达不到实用化要求,这大大限制了OLED技术的发展,针对这一个问题,各个研究机构都在进行探索性的研究。
本发明所涉及到的基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物,因为具有较好的溶解性能,适用于溶液加工,以及较好的荧光量子产率,其发光器件不仅高效稳定,而且为更饱和蓝光,可以同时实现发光器件的发光效率和使用寿命的提高,可以满足全彩显示的要求,在有机电子显示领域有巨大的发展潜力和前景。所述聚合物(Polymer)包括均聚物(homopolymer)、共聚物(copolymer)或嵌段共聚物(blockcopolymer),包括树枝状(dendrimer)聚合物。所述共轭聚合物的主链(backbone)主要由C原子的SP2杂化轨道构成,著名的非限制性例子有包括聚乙炔等,其主链的碳原子可以被其他非C原子任选取代,共轭聚合物包含有至少一个主链结构单元。主链结构单元一般具有较大的能隙的∏-共轭结构单元,也称骨干单元(Backbone Unit),可选自单环或多环芳烃(aryl)或杂芳基(heteroaryl)。本发明中,共轭聚合物可以包含两个或以上的的主链结构单元。而且当主链上的SP2杂化被一些自然地缺陷打断时,仍被认为是共轭聚合物。另外本发明中的共轭聚合物也可以包括主链上包含芳香胺(arylamine)、芳基磷化氢(aryl phosphine)及其他杂环芳烃(heteroarmotics)等。
技术实现要素:
本发明的目的在于针对目前聚合物发光二极管(PLED)面临的问题,提供一种基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物;该共轭聚合物具有共轭的主链结构,具有电子和空穴传输特性,可用作发光材料,且具有较好的溶解性,较高的荧光量子产率,适合于溶液加工和喷墨打印,具有良好的发展前景,可以解决相关的有机电子器件稳定性及器件寿命的问题。
所述基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物的分子量Mw≥10000克/摩尔,较优选为≥50000克/摩尔,更优选为≥100000克/摩尔,最优选为≥20000克/摩尔。
本发明的目的还在于提供所述基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物的制备方法。
本发明的目的还在于提供所述基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物在制备有机发光二极管的发光层中的应用。
一种基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物,具有如下化学结构式:
式中,Ar1为芳杂环基团;R、R1-R8均选自-H、-F、-Cl、-Br、-I、-D、-CN、-NO2、-CF3、碳原子数1~20的直链烷烃基、碳原子数1~20的烷烃醚基团、碳原子1-10的烷烃硫醚基团、碳原子数1~20的支链烷烃基、碳原子数1~20的环烷烃基;0≤x≤1;聚合度n=1-300;
Ar为电子传输单元或者空穴传输单元,Ar选自如下结构式中的任意一种:
2,7-取代芴;
3,6-取代芴;
2,7-取代硅芴;
3,6-取代硅芴;
2,7-取代螺芴;
3,6-取代螺芴;
2,7-取代-9,9-二烷氧基苯基芴;3,6-取代-9,9-二烷氧基苯基芴;2,7-取代咔唑;
3,6-取代咔唑;
2,6-取代-二噻吩并噻咯;
2,6-取代-二噻吩并环戊二烯;
2,5-取代吡啶;
2,6-取代吡啶;
3,5-取代吡啶;
3,5-双(4-取代-苯基)-4-基-1,2,4-三唑;
3,5-双(4-取代-苯基)-1,2,4-噁二唑;
4,7-双(5-取代-4-烷基噻吩基)-2,1,3-苯并噻二唑;
4,7-双(5-取代-4-烷基噻吩基)2,1,3-苯并硒二唑;
4,7-取代-5,6-烷基-2,1,3-苯并噻二唑;
4,7-取代-5,6-烷基-2,1,3-苯并硒二唑;
2,5-取代-3,4-二烷基噻吩;
2,5-取代-3,4-二烷基硒吩;
5,5-取代-4,4-二烷基-联噻吩;
茚芴;
吲哚咔唑;
4,9-取代-6,7-烷基-萘并噻二唑;
4,9-取代-6,7-烷基-萘并硒二唑;
萘并茚芴;
其中,R为H、芳基、三苯胺、碳原子数1-20的直链或支链烷基,或为碳原子数1-20的烷氧基。
进一步地,所述R、R1~R8均选自氘、碳原子数1~20的烷基、碳原子数1~20的烷氧基、碳原子数1~20的氨基、碳原子数1~20的烯基、碳原子数1~20的炔基、碳原子数1~10的芳烷基、碳原子数1~10的芳基或碳原子数1~10的杂芳基。
所述的一种基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物的制备方法,包括如下步骤:
在氩气氛围下,将芳杂环并-3-S,S-二氧二苯并噻吩单体与含Ar结构的硼酸酯单体通过Suzuki聚合反应后,再依次采用苯硼酸和溴苯进行封端反应,得到所述基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物。
进一步地,所述芳杂环并-3-S,S-二氧二苯并噻吩单体与含Ar结构的硼酸酯单体的摩尔比为1:1。
进一步地,所述芳杂环并-3-S,S-二氧二苯并噻吩单体与苯硼酸的1.1:1。
进一步地,所述苯硼酸与溴苯的摩尔比为1:3.8。
进一步地,所述Suzuki聚合反应的温度为80~100℃,时间为24~48小时。
进一步地,所述苯硼酸和溴苯进行封端反应的温度为80~100℃,时间为12~24小时。
所述的一种基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物应用于制备发光二极管的发光层,将基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物用有机溶剂溶解,再通过旋涂、喷墨打印或印刷成膜,得到发光二极管的发光层;基于该发光层的发光二极管应用于制备有机电子发光器件;所述有机电子发光器件至少包含阴极、阳极及位于阳极与阴极之间的功能层,所述功能层中至少包含一种所述的基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物。
所述有机电子发光器件包括平板显示器、有机发光二极管(OLED)、有机光伏电池(OPV)、有机发光电池(OLEEC)、有机场效应管(OFET)、有机发光场效应管、有机激光和有机自旋电子器件的制备;制备的有机电子发光器件的发光波长在300~1000nm之间,优选为350~900nm之间,更优选为400~800nm之间。
所述的有机电子发光器件应用于包括显示设备、照明设备、光源或传感器。
进一步地,所述有机溶剂包括氯苯。
与现有技术相比,本发明具有如下优点和有益效果:
(1)本发明的共轭聚合物,共轭的主链结构赋予聚合物具有丰富的光学和电学等性能,包括光致发光、电致发光、光伏效应、半导体特性、载流子传输特性等;在制备复杂多层光电器件时,可利用共轭聚合物的溶液加工特性,通过喷墨打印、丝网印刷、旋涂等溶液加工工艺制备聚合物光电器件;
(2)本发明的基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物,由于具有较大的共轭长度,所以有较高的荧光量子产率,有利于提高材料的器件效率;
(3)本发明的基于芳杂环并-3-S,S-二氧二苯并噻吩单元的共轭聚合物,具有较好的溶解性,基于该聚合物的发光层在制备电致发光器件时不用退火处理,使得制备工艺更简单。
附图说明
图1为聚合物P1的热分析谱图;
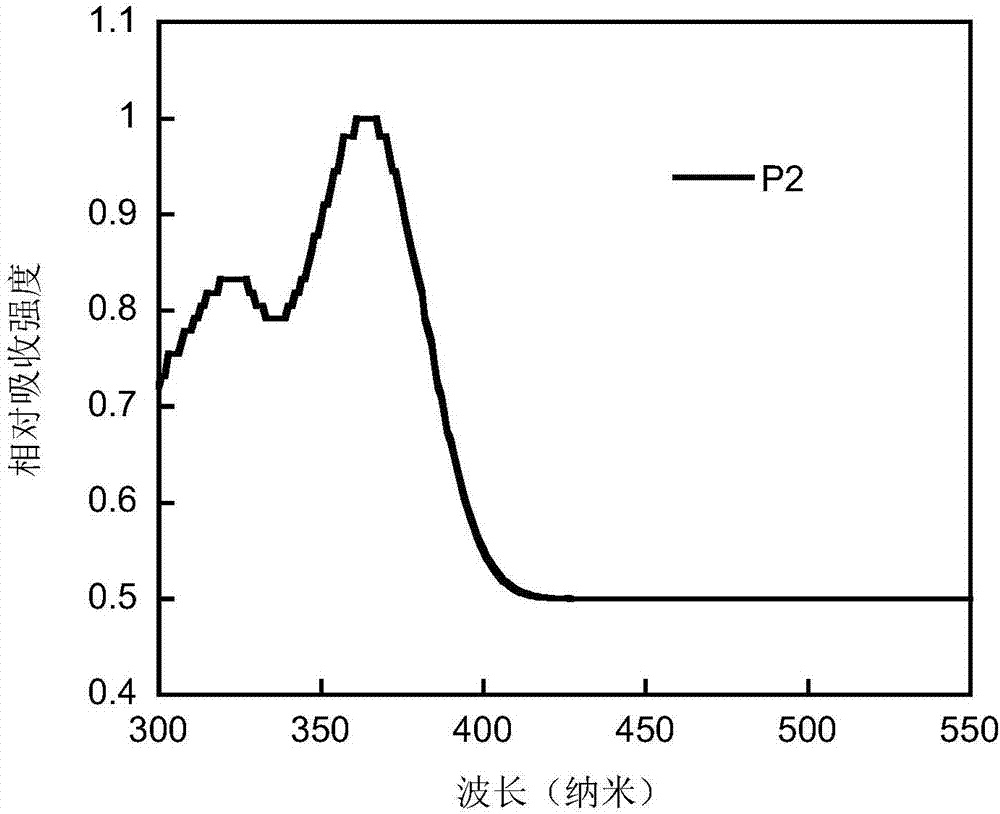
图2为聚合物P2在薄膜状态下的紫外-可见吸收光谱谱图;
图3为聚合物P3在薄膜状态下的光致发光谱图;
图4为基于聚合物P4的电致发光器件的电流密度-流明效率谱图。
具体实施例
下面结合优选实施例对本发明进行说明,但本发明并不局限于下述实施例。应当理解,在本发明构思的引导下,本领域的技术人员应意识到,对本发明的各实施例进行的改变,都将被本发明的权利要求书的精神和范围所覆盖。
实施例1
1-溴-2-喹喔啉甲酸甲酯
在氩气气氛下,将1-溴-2-喹喔啉甲酸(10g,39.83mmol)加入两口瓶中,再加入100mL甲醇,然后逐滴加入浓硫酸(39.06mg,398.29umol),加热到110℃,反应18h。将反应混合物倒入水中,用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥。溶液浓缩后,得到白色固体粗品,用硅胶柱层析提纯(洗脱剂选择石油醚/二氯甲烷=3/1,v/v),产物长时间放置冰箱中得到白色固体,产率85%。1H NMR、13CNMR、MS和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例2
1-硼酸酯-2-喹喔啉甲酸甲酯
在氩气氛围下,将化合物1-溴-2-喹喔啉甲酸甲酯(10g,37.72mmol)溶解于无水四氢呋喃(THF)中,在-78℃下搅拌20分钟,再加入正丁基锂(21.05g,113.16mmol),在-78℃下搅拌2小时,再加入异丙氧基频哪醇酯(9.66g,150.88mmol),在-78℃下搅拌1小时,室温下反应16小时。将反应混合物倒入水中,用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥。溶液浓缩后,得到白色固体粗品,用硅胶柱层析提纯(洗脱剂选择石油醚/二氯甲烷=2/1,v/v),产物长时间放置冰箱中得到白色固体,产率75%。1H NMR、13CNMR、MS和元素分析结果表明所得到的化合物为目标产物,其化学反应方程式如下所示:
实施例3
3-溴-S,S-二氧化硫芴的制备
(1)在150mL的圆底烧瓶中,将5g联苯溶解在80mL二氯甲烷中,在室温下加入11.8g溴代丁二酰亚胺,然后室温下反应48小时。反应结束后,将反应物倒入水中,用二氯甲烷萃取,然后用水洗涤,无水硫酸镁干燥,蒸除溶剂,然后用石油醚重结晶。得到白色固体5.65g,产率75%。
(2)在150mL三口烧瓶中加入20g 4,4’-二溴联苯,溶于50mL三氯甲烷中,滴加11.4mL氯磺酸,维持反应体系在50℃以下,反应3小时。反应结束后,将反应物倒入500mL碎冰中,冰融化后用Na2CO3溶液调至中性,过滤出不溶物,水洗干燥后用乙酸重结晶,得到白色针状固体6g,产率:12%。化学反应方程式如下所示:
实施例4
化合物M1的制备
在氩气氛围下,将化合物3-溴-S,S-二氧二苯并噻吩(5g,13.37mmol)和1-硼酸酯-2-萘甲酸甲酯(12.52g,40.10mmol)加入到两口瓶中,再加入100ml甲苯进行完全溶解,再加入碳酸钠(7.08g,66.84mmol)和四三苯基磷钯(308.93mg,267.35umol),油浴升温至110℃,反应16小时。将反应混合物倒入水中,用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥。溶液浓缩后,得到白色固体粗品,用硅胶柱层析提纯(洗脱剂选择石油醚/二氯甲烷=2/1,v/v),产物长时间放置冰箱中得到白色固体,产率75%。1H NMR、13CNMR、MS和元素分析结果表明所得到的化合物为目标产物,其化学反应方程式如下所示:
实施例5
化合物M2的制备
在氩气氛围下,将M1(10g,17.10mmol)加入单口瓶中,再加入50ml无水THF直到完全溶解。再将反应液在0℃下反应1h,再逐滴加入C8H17MgBr(正辛基溴化镁20.25g,116.15mmol),混合液在室温下反应18h。将水加入到反应液中来淬灭反应,用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥。溶液浓缩后,用硅胶柱层析提纯(洗脱剂选择石油醚/二氯甲烷=3/1,v/v),产物长时间放置冰箱中得到白色固体,产率80%。1H NMR、13CNMR、MS和元素分析结果表明所得到的化合物为目标产物,其化学反应方程式如下所示:
实施例6
化合物M3的制备
在氩气氛围下,将M2(5g,5.19mmol)溶于50ml二氯甲烷中,在室温下逐滴加入三氟化硼乙醚溶液(439.59mg,6.48mmol),反应18h。用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥。溶液浓缩后,用硅胶柱层析提纯(洗脱剂选择石油醚),产物长时间放置冰箱中得到白色固体,产率90%。1H NMR、13CNMR、MS和元素分析结果表明所得到的化合物为目标产物,其化学反应方程式如下所示:
实施例7
化合物M4的制备
在氩气氛围下,将M3(5g,5.50mmol)溶于50mL二氯甲烷中,再加入铁粉(185.35mg,3.32mmol),再逐滴加入液溴(1.93g,12.10mmol),在室温下反应18h。用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥。溶液浓缩后,用硅胶柱层析提纯(洗脱剂选择石油醚),产率70%。1H NMR、13CNMR、MS和元素分析结果表明所得到的化合物为目标产物,其化学反应方程式如下所示:
实施例8
2,7-二溴芴的制备
在250mL三口瓶中,加入芴(24.5g,0.1mol)、铁粉(88mg,1.57mmol)和三氯甲烷100mL。冰水浴冷却,滴加溴(17.6g,0.1mol)/三氯甲烷混合溶液35mL,滴加时瓶内温度不超过5℃。反应完毕,过滤、氯仿重结晶,得白色固体20.3g,产率83%。1HNMR、13CNMR、MS和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例9
2,7-二溴-9,9-二辛基芴的制备
在三口瓶中加入2,7-二溴芴(9.7g,0.03mol)、苄基三乙基氯化铵(0.07g,0.3mmol)、二甲基亚砜90mL、45mL氢氧化钠水溶液(50wt%)。室温下搅拌形成悬浮液。加入1-溴正辛烷(12.5g,65mmol),继续搅拌3小时后,用乙醚萃取。用饱和氯化钠水溶液洗涤乙醚相,无水硫酸镁干燥。蒸去溶剂,产物用石油醚作洗脱剂柱层析提纯,得白色固体。1H NMR、13CNMR、MS和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例10
2,7-二硼酸酯-9,9-二辛基芴的制备
在氩气气氛下,将2,7-二溴-9,9-二辛基芴(5g,9.12mmol)溶解于180mL精制的THF中,在-78℃下逐渐滴加1.6mol.L-1的正丁基锂28mL,反应2小时,然后加入2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂硼烷25mL,在-78℃下继续反应1小时,然后升温至室温反应24小时。将反应混合物倒入水中,用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥。溶液浓缩后,得到浅黄色粘稠状粗品,用硅胶柱层析提纯(洗脱剂选择石油醚/乙酸乙酯=15/1,v/v),产物长时间放置冰箱中得到白色固体,产率70%。1H NMR、13CNMR、MS和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例11
3,6-二溴咔唑的制备
在500mL两口瓶中加入咔唑(24.7g,0.1mol),二甲基甲酰胺200mL,搅拌至完全溶解,NBS(49.84g,0.28mol)用120ml N,N-二甲基甲酰胺溶解,冰浴至0℃,滴加NBS溶液,反应,避光,滴加完毕后,让温度自动上升至室温,反应6小时,将反应液滴加到水中沉淀,抽滤得到粗产物后,将抽滤物用无水乙醇进行重结晶,烘干,得到宝色针状固体,产率85%。1H NMR、13CNMR、MS和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例12
3,6-二溴-N-辛基咔唑
在250mL三口瓶中加入3,6-二溴咔唑(16.25g,0.05mmol),甲苯100mL,四丁基溴化铵(0.8g,3.5mmol)搅拌溶解,然后滴加50wt%KOH水溶液11mL,然后再加入溴辛烷(19.3g,0.1mol),在80℃下反应24小时,加水终止反应,水洗分离出来的有机相,水相用二氯甲烷萃取后,合并有机相,用无水MgSO4干燥,减压蒸馏除去溶剂后得到浅黄色固体,用石油醚重结晶得到白色粉末固体。产率90%。1H NMR、13CNMR、MS和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例13
3,6-二(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-二基)-N-辛基咔唑
在三口瓶中加入3,6-二溴-N-辛基咔唑(13.11g,30mmol)、新蒸的乙醚250mL,搅拌完全溶解至澄清透明后,将反应液冷却至-78℃,然后一次性加入2-异丙氧基-(4,4,5,5-四甲基)-1,3,2-乙二氧基硼酸酯(37mL,180mmol),在-78℃下搅拌2小时,再将温度升至室温反应24小时后结束反应。用乙醚萃取,饱和食盐水洗涤4次,再用无水硫酸镁干燥,过滤后,蒸馏除去溶剂,产物用石油醚/乙酸乙酯(10:1)为洗脱剂柱层析提纯,得到白色固体,产率45%。化学反应方程式如下所示:
实施例14
聚合物P1的制备
在氩气氛围下,将2,7-二硼酸酯-9,9-二辛基芴(300mg,272.92μmol)和M4(342.92mg,272.92μmol)加入100ml两口瓶内,再加入8ml甲苯进行完全溶解,抽换气三次,再加入醋酸钯(2.45mg,10.92μmol)和三环己基膦(6.12mg,21.83μmol),抽换气三次,然后加入2ml四乙基氢氧化铵,升温至80℃,反应24小时。然后加入30mg苯硼酸进行封端,12小时后,再用0.1ml溴苯进行封端。继续反应12小时之后,将产物滴加在甲醇中沉淀出来,搅拌,过滤,再将粗产物溶于20mL的甲苯中,以200~300目硅胶为固定相,用甲苯为洗脱剂进行柱层析,再将溶剂减压浓缩后,再一次在甲醇中沉析出来,搅拌,过滤,真空干燥后得到聚合物固体。最后再依次用甲醇、丙酮、四氢呋喃各抽提24小时,除去小分子。将浓缩后的四氢呋喃溶液滴入甲醇中沉析,真空干燥后得到的纤维状固体共轭聚合物P1。化学反应方程式如下所示:
得到的聚合物P1的热分析谱图如图1所示,从图中可以看出,聚合物P1的玻璃化转变温度为131℃。
实施例15
聚合物P2的制备
在氩气氛围下,将3,6-二(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-二基)-N-辛基咔唑(145.01mg,272.92μmol)和M4(300mg,272.92μmol)加入100ml两口瓶内,再加入8ml甲苯进行完全溶解,抽换气三次,再加入醋酸钯(2.45mg,10.92μmol)和三环己基膦(6.12mg,21.83μmol),抽换气三次,然后加入2ml四乙基氢氧化铵,升温至80℃,反应24小时。然后加入30mg苯硼酸进行封端,12小时后,再用0.1ml溴苯进行封端。继续反应12小时之后,将产物滴加在甲醇中沉淀出来,搅拌,过滤,再将粗产物溶于20mL的甲苯中,以200~300目硅胶为固定相,用甲苯为洗脱剂进行柱层析,再将溶剂减压浓缩后,再一次在甲醇中沉析出来,搅拌,过滤,真空干燥后得到聚合物固体。最后再依次用甲醇、丙酮、四氢呋喃各抽提24小时,除去小分子。将浓缩后的四氢呋喃溶液滴入甲醇中沉析,真空干燥后得到的纤维状固体共轭聚合物P2。化学反应方程式如下所示:
得到的聚合物P2在薄膜状态下的紫外-可见吸收光谱谱图如2所示,从图中可以看出,聚合物P2的最大吸收峰峰位于321nm和364nm。
实施例16
聚合物P3的制备
在氩气氛围下,将茚芴硼酸(260.66mg,272.92μmol)和M4(300mg,272.92μmol)加入100ml两口瓶内,再加入8ml甲苯进行完全溶解,抽换气三次,再加入醋酸钯(2.45mg,10.92μmol)和三环己基膦(6.12mg,21.83μmol),抽换气三次,然后加入2ml四乙基氢氧化铵,升温至80℃,反应24小时。然后加入30mg苯硼酸进行封端,12小时后,再用0.1ml溴苯进行封端。继续反应12小时之后,将产物滴加在甲醇中沉淀出来,搅拌,过滤,再将粗产物溶于20mL的甲苯中,以200~300目硅胶为固定相,用甲苯为洗脱剂进行柱层析,再将溶剂减压浓缩后,再一次在甲醇中沉析出来,搅拌,过滤,真空干燥后得到聚合物固体。最后再依次用甲醇、丙酮、四氢呋喃各抽提24小时,除去小分子。将浓缩后的四氢呋喃溶液滴入甲醇中沉析,真空干燥后得到的纤维状固体共轭聚合物P3。化学反应方程式如下所示:
得到的聚合物P3在薄膜状态下的光致发光谱图如图3所示,从图中可以看出,聚合物P3的最大发射峰位于527nm。
实施例17
聚合物P4的制备
在氩气氛围下,将萘并茚芴硼酸酯(274.33mg,272.92μmol)和M4(300mg,272.92μmol)加入100ml两口瓶内,再加入8ml甲苯进行完全溶解,抽换气三次,再加入醋酸钯(2.45mg,10.92μmol)和三环己基膦(6.12mg,21.83μmol),抽换气三次,然后加入2ml四乙基氢氧化铵,升温至80℃,反应24小时。然后加入30mg苯硼酸进行封端,12小时后,再用0.1ml溴苯进行封端。继续反应12小时之后,将产物滴加在甲醇中沉淀出来,搅拌,过滤,再将粗产物溶于20mL的甲苯中,以200~300目硅胶为固定相,用甲苯为洗脱剂进行柱层析,再将溶剂减压浓缩后,再一次在甲醇中沉析出来,搅拌,过滤,真空干燥后得到聚合物固体。最后再依次用甲醇、丙酮、四氢呋喃各抽提24小时,除去小分子。将浓缩后的四氢呋喃溶液滴入甲醇中沉析,真空干燥后得到的纤维状固体共轭聚合物P4。化学反应方程式如下所示:
实施例18
电致发光器件的制备
在预先做好的方块电阻为20Ω/□的氧化铟锡(ITO)玻璃上,先依次用丙酮,洗涤剂,去离子水和异丙醇超声清洗,等离子处理10分钟。在ITO上旋涂参杂有聚苯乙烯磺酸的聚乙氧基噻吩(质量比PEDOT:PSS=1:1)膜,厚度为150nm;PEDOT:PSS膜在真空烘箱里80℃下干燥8小时。随后分别将共轭聚合物P1、P2、P3和P4的氯苯溶液(1wt%)旋涂在PEDOT:PSS膜的表面,厚度为80nm,作为发光层;最后在发光层上依次蒸镀一薄层CsF(1.5nm)和120nm厚的金属Al层。
基于聚合物P4的电致发光器件的电流密度-流明效率谱图如图4所示,从图中可以看出,基于器件结构:ITO/PEDOT/EML/CsF/Al,器件的最大流明效率为0.94cd/A。
基于聚合物P1~P4的电致发光器件的光电性能测试结果如表1所示。
表1基于聚合物P1~P4的电致发光器件的光电性能
由表1可知,聚合物发光材料P1,P2,P3和P4,基于器件结构:ITO/PEDOT/EML/CsF/Al,最大流明效率为1.7cd/A,1.8cd/A,2.0cd/A,0.94cd/A。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种含有多取代基的杂环含硼芳香化合物及其合成方法及用途与流程
- 一种以芳杂环并茚芴单元为核的双极性小分子发光材料及其制备方法与应用与流程
- 芳杂环类衍生物及其在药物中的应用的制作方法与工艺
- 芳杂环类衍生物及其在药物中的应用的制作方法与工艺
- 一种含五元杂环的不对称芳香二硫醚类化合物在制备治疗SARS药物中的应用的制作方法与工艺
- 芳族杂环通过地球丰富的无过渡金属的催化剂的甲硅烷基化的制造方法与工艺
- 芳香族杂环衍生物、使用其的有机电致发光元件、照明装置及显示装置的制造方法
- 4-(芳杂环取代)氨基-1H-3-吡唑甲酰胺类FLT3抑制剂及其用途的制造方法与工艺
- 芳香族杂环衍生物、有机电致发光元件用材料以及有机电致发光元件的制造方法与工艺
- 一种芳杂环衍生物及其制备方法以及一种有机电致发光器件与制造工艺