用于检测结直肠癌相关基因多位点甲基化试剂盒及应用的制作方法
本发明涉及医疗技术领域,尤其涉及用于检测结直肠癌相关基因多位点甲基化试剂盒及应用。
背景技术:
结直肠癌是世界第三大恶性肿瘤。中国近年来结直肠癌发病率逐年上升,估计每年约有40万新发病例,在我国消化系统恶性肿瘤中位列第二。早期结直肠癌患者手术5年生存率可高达90%以上,中、晚期患者5年生存率仅10%左右,而临床诊断的结直肠癌约80%为中晚期,这是导致其死亡率居高不下的关键因素之一。而经有效治疗的早期结直肠癌患者其发病率降低60%,病死率降低80%,因此结直肠癌的早期发现、早期诊断及早期治疗显得尤为重要。
现有研究表明,结直肠癌的早期发生与结直肠癌相关基因启动子区域的甲基化存在很大关系。甲基化是一种表观遗传修饰,其异常变化可引起DNA构象及DNA与蛋白质相互作用方式等发生改变,从而控制基因表达,因此与结直肠癌的早期发生关系紧密。现有专利CN 105543354A通过用磁珠捕获人粪便DNA,再将其进行亚硫酸氢盐处理,最后用PCR检测SDC2基因启动子区域甲基化情况。
该方法存在的问题和缺点:
1.该法所检测的基因单一,虽然灵敏度比较高,但特异度不够。本发明发现多个基因启动子甲基化与结直肠癌发生相关,并且针对多个基因位点进行联合检测,提高了灵敏度和特异度,能够满足肿瘤早筛的要求。
2.该法对目的基因DNA片段的捕获有局限性,只能捕获磁珠特异片段的序列,无法对多个基因位点进行检测。本发明独创的粪便DNA提取技术和试剂盒,能够获得高纯度高质量的基因组DNA,方便进行后续检测。
因此,提出了用于检测结直肠癌相关基因多位点甲基化试剂盒及应用。
技术实现要素:
本发明提出了用于检测结直肠癌相关基因多位点甲基化试剂盒及应用,以解决上述背景技术中提出的问题。
用于检测结直肠癌相关基因多位点甲基化试剂盒及应用,将粪便样本置于基因组提取试剂盒中进行处理,其步骤如下:
A1、将样本加入核酸裂解液液中充分混匀,然后加入PVPP进行粗提,去除掉大量杂质,如色素、蛋白质;
A2、初步处理后得到的核酸样品中还有少量蛋白和RNA,再加入蛋白酶K和RNA酶完全除掉蛋白和RNA;
A3、将核酸样品加入带有吸附膜的离心柱中,用DNA漂洗液反复漂洗离心,再加入DNA洗脱液将DNA从吸附膜中洗脱下来,离心收集DNA溶液。
将所得纯化后的DNA用本发明公开的亚硫酸氢盐转换试剂盒进行CT转换,所述试剂盒包括溶解缓冲液、甲基化转换试剂、结合缓冲液、漂洗缓冲液。
针对结直肠癌相关基因NDRG4、SDC2、TFPI2、BMP3的启动子区域甲基化的特异性引物对、探针,针对多个基因启动子甲基化位点进行高通量合管检测。
本发明提供用于检测结直肠癌相关基因多位点甲基化试剂盒及应用,所述试剂盒包括引物组合,所述引物组合包括第一引物对、第二引物对、第三引物对、第四引物对和第五引物对,所述第一引物对的碱基序列如SEQ ID NO.1-2所示,所述第二引物对的碱基序列如SEQ ID NO.3-4所示,所述第三引物对的碱基序列如SEQ ID NO.5-6所示,所述第四引物对的碱基序列如SEQ ID NO.7-8所示,所述第五引物对的碱基序列如SEQ ID NO.9-10所示;所述试剂盒还包括探针,所述探针包括第一探针、第二探针、第三探针、第四探针和第五探针,所述第一探针的碱基序列如SEQ ID NO.11所示,所述第二探针的序列如SEQ ID NO.12所示,所述第三探针的序列如SEQ ID NO.13所示,所述第四探针的序列如SEQ ID NO.14所示,所述第五探针的序列如SEQ ID NO.15所示;所述探针的5'端标记有荧光基团,所述探针3'端标记有淬灭基团,所述荧光基团为FAM、VIC、TET、JOE、HEX、CY3、CY5、ROX、RED610、TEXASRED、RED670、NED中的一种,所述淬灭基团为6-TAMRA、BHQ-1~3、和结合分子沟的非荧光淬灭剂中的一种。
进一步,上述第一引物对为NDRG4检测引物,上游检测引物包括SEQ IDNO.1所示的核苷酸序列,所述SEQ IDNO.1所示的核苷酸序列为5’-TGTTTTTTAGGTTTC-3’。
进一步,所述NDRG4下游检测引物包括SEQ IDNO.2所示的核苷酸序列,所述SEQ IDNO.2所示的核苷酸序列为5’-GCGTAACTTCCGCCTTCTA-3’。
进一步,NDRG4探针包括SEQ IDNO.11所示的核苷酸序列,所述SEQ IDNO.11所示的核苷酸序列为5’-CGTTCGTTTTTTCGTTCGTTTATCGG-3’。
进一步,所述检测探针的5'端标记有荧光基团,所述检测探针的3'端标记有淬灭基团。
进一步,上述探针可选用下述任一荧光基团在其5'端标记:FAM、VIC、TET、JOE、HEX、CY3、CY5、ROX、RED610、TEXASRED、RED670、NED,选用下述任一淬灭基团在其3'端标记:6-TAMRA、BHQ-1~3、和结合分子沟的非荧光淬灭剂(Minor Groove Binder nonfluorescent quencher,MGB NFQ)。优选地,荧光标记物选择FAM,淬灭剂选择BHQ。
进一步,第二引物对和第二探针为SDC2引物对和SDC2探针。
进一步,所述的SDC2上游引物包括SEQ IDNO.3所示的核苷酸序列,所述SEQ IDNO.3所示的核苷酸序列为5’-TTAATAAGTGAGAGGGCGTCGC-3’。
进一步,所述的SDC2下游引物包括SEQ IDNO.4所示的核苷酸序列,所述SEQ IDNO.4所示的核苷酸序列为5’-CGACTCAAACTCGAAAACTC-3’。
进一步,SDC2探针包括SEQ IDNO.12所示的核苷酸序列,所述SEQ ID NO.12所示的核苷酸序列为5’-CGTAGTTGCGGGCGGCGGGAGTAGGC-3’。
进一步,上述探针可选用下述任一荧光基团在其5'端标记:FAM、VIC、TET、JOE、HEX、CY3、CY5、ROX、RED610、TEXASRED、RED670、NED,选用下述任一淬灭基团在其3'端标记:6-TAMRA、BHQ-1~3、和结合分子沟的非荧光淬灭剂(Minor Groove Binder nonfluorescent quencher,MGB NFQ)。优选地,荧光标记物选择VIC,淬灭剂选择MGB。
进一步,第三引物对和第三探针为TFPI2引物对和TFPI2探针。
进一步,所述的TFPI2上游引物包括SEQ IDNO.5所示的核苷酸序列,所述SEQ IDNO.5所示的核苷酸序列为5’-GGCGAAGTTGTTATTAGTCGTC-3’。
进一步,所述的TFPI2下游引物包括SEQ IDNO.6所示的核苷酸序列,所述SEQ IDNO.6所示的核苷酸序列为5’-ATAAATACCCTACGCGCA-3’。
进一步,TFPI2探针包括SEQ IDNO.13所示的核苷酸序列,所述SEQ IDNO.13所示的核苷酸序列为5’-AGCGCGAGAGTTTTGGGTGCGCG-3’。
上述探针可选用下述任一荧光基团在其5'端标记:FAM、VIC、TET、JOE、HEX、CY3、CY5、ROX、RED610、TEXASRED、RED670、NED,选用下述任一淬灭基团在其3'端标记:6-TAMRA、BHQ-1~3、和结合分子沟的非荧光淬灭剂(Minor Groove Binder nonfluorescent quencher,MGB NFQ)。优选地,荧光标记物选择FAM,淬灭剂选择BHQ。
进一步,第四引物对和第四探针为BMP3引物对和BMP3探针。
所述的BMP3上游引物包括SEQ IDNO.7所示的核苷酸序列,所述SEQ IDNO.7所示的核苷酸序列为5’-TTATTTCGTTGTATTCGGTC-3’。
所述的BMP3下游引物包括SEQ IDNO.8所示的核苷酸序列,所述SEQ IDNO.8所示的核苷酸序列为5’-ACCGAAAATTAAACTCCAA-3’。
进一步,BMP3探针包括SEQ IDNO.14所示的核苷酸序列,所述SEQ IDNO.14所示的核苷酸序列为5’-CGGGTTTCGTGCGTTTTCGTT-3’。
上述探针可选用下述任一荧光基团在其5'端标记:FAM、VIC、TET、JOE、HEX、CY3、CY5、ROX、RED610、TEXASRED、RED670、NED,选用下述任一淬灭基团在其3'端标记:6-TAMRA、BHQ-1~3、和结合分子沟的非荧光淬灭剂(Minor Groove Binder nonfluorescent quencher,MGB NFQ)。优选地,荧光标记物选择VIC,淬灭剂选择BHQ。
进一步,第五引物对和第五探针为内参(Internal reference,IR)引物对和内参探针。
所述内参引物对包括内参上游引物和内参下游引物,用于扩增人的actin基因。
所述的IR上游引物包括SEQ IDNO.9所示的核苷酸序列,所述SEQ IDNO.9所示的核苷酸序列为5’-TGGGATGGGGAGTTTGTTTAGATT-3’。
所述的IR下游引物包括SEQ IDNO.10所示的核苷酸序列,所述SEQ IDNO.10所示的核苷酸序列为5’-AATACTAACACTAACTCATATAAC-3’。
进一步IR探针包括SEQ IDNO.15所示的核苷酸序列,所述SEQ IDNO.15所示的核苷酸序列为5’-TGTATTTATTTAATATATATTTTAAGGTTG-3’。
上述探针可选用下述任一荧光基团在其5'端标记:FAM、VIC、TET、JOE、HEX、CY3、CY5、ROX、RED610、TEXASRED、RED670、NED,选用下述任一淬灭基团在其3'端标记:6-TAMRA、BHQ-1~3、和结合分子沟的非荧光淬灭剂(Minor Groove Binder nonfluorescent quencher,MGB NFQ)。优选地,荧光标记物选择NED,淬灭剂选择BHQ-2。
本发明还提供用于检测结直肠癌相关基因多位点甲基化试剂盒及应用,包括上述的用于检测NDRG4、SDC2、TFPI2、BMP3、actin的引物组合和探针,以及样品保存液、核酸提取液、PCR反应液、阳性对照品、阴性对照品、过程控制对照样品、标准品、溶解缓冲液、甲基化转换试剂、结合缓冲液、漂洗缓冲液中的一种或者多种。
本发明提出的用于检测结直肠癌相关基因多位点甲基化的试剂盒及应用,有益效果在于:
1、本发明发现多个基因启动子甲基化与结直肠癌发生相关,并且针对多个基因启动子甲基化位点进行高通量合管检测,提高了灵敏度和特异度,能够满足肿瘤早筛的要求;
2、本发明独创的粪便DNA提取技术和试剂盒,能够获得高纯度高质量的基因组DNA,方便进行后续检测。
附图说明
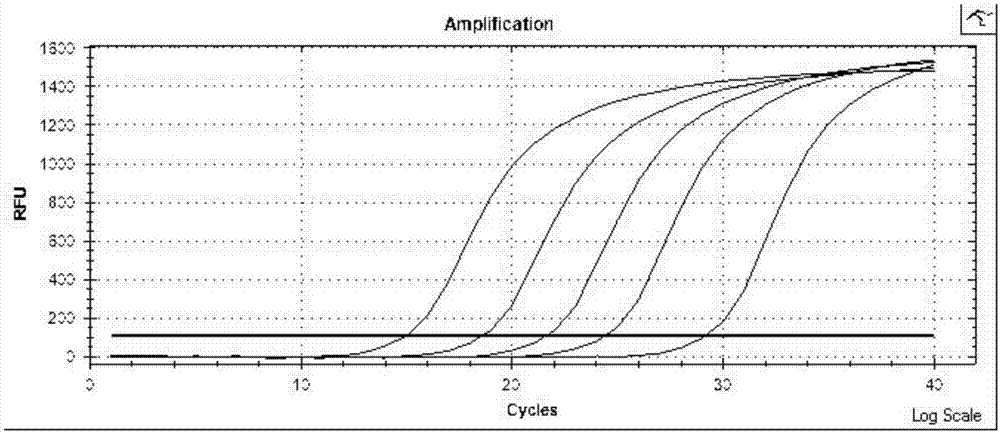
图1为NDRG4的线性图;
图2为BMP3的线性图;
图3为SDC2的线性图;
图4为TFPI2的线性图;
图5为Actin的线性关系图;
图6为NDRG4的样本检测结果图;
图7为BMP3的样本检测结果图;
图8为SDC2的样本检测图;
图9为TFPI2的样本检测图;
图10为actin的样本检测图。
具体实施方式
下面结合具体实施例来对本发明做进一步说明。
实施例1
本发明提出了用于检测结直肠癌相关基因多位点甲基化试剂盒及应用,使用粪便基因组提取试剂盒进行DNA分离提取,得到粪便基因组,其步骤如下:
1.利用特制的粪便收集盒收集医院患者粪便,其中含有粪便基因组保存液,且保存液内含有0.1mol/L的EDTA、0.5mol/L的TRIS,其作用是保护基因组DNA不被粪便中核酸酶降解。
2.本实施例中,将粪便样品于样本保存液中充分震荡混匀之后取1.5ml混合液到2.0mlEP管中,加入样品九分之一的40%SDS裂解液,加入8μL的proteinase K,震荡混匀后70℃裂解10min。
3. 12000rpm离心8min,转移900μL上清至新的EP管中。
4.加入一片PVPP片剂,充分震荡混匀后12000rpm离心5min。
5.转移上清至新的2.0mlEP管中.
6.按8M盐酸胍:异丙醇:上清质量体积比为1:1:1的比例分别加入8M盐酸胍、异丙醇,加入异丙醇前先适当的将上清和盐酸胍混匀,加入异丙醇后也应颠倒混匀。。
7.吸附柱柱纯化或磁珠纯化
柱纯化的步骤如下:
A1、将步骤11中所得的液体取750uLμL到有对应编号的吸附柱中。12000rpm离心30sec,倒掉收集柱中的废液。将吸附柱重新放回收集柱中。重复该步骤直至以上液体全部通过吸附柱。A2、取W1500uLμL到放在收集柱上的吸附柱中,12,000rpm离心30sec,倒掉收集柱中的废液,将吸附柱重新放回收集柱中。A3、取W2600uLμL到吸附柱中,12,000rpm离心30sec,倒掉收集柱中的废液,将吸附柱重新放回收集柱中。A4、重复步骤A3一次
A5、12,000rpm空管离心2min,倒掉收集柱中的废液,将吸附柱重新放回收集柱中,打开吸附柱盖子室温放置5-10min,待乙醇挥发。A6、将吸附柱转移至新的1.5mL收集管中,向吸附柱悬空加入50uLμLTB(勿接触吸附膜),盖上盖子静置5min。
A7、12,000rpm离心2min,收集DNA溶液。
磁珠法提取粪便基因组DNA步骤
B1、在等体积加入过盐酸胍和异丙醇的小量标本上清或粪便均液中加入20μL磁珠,充分振荡混匀后静置结合10分钟,期间混匀几次,避免磁珠沉降。
B2、将EP管短甩几秒,使附在管盖和壁上的液滴降至EP管底部,将EP管放入磁力架,待1分钟后磁珠充分附在EP管内壁一侧,用移液器吸出液体弃之。
B3、加入1mL漂洗液W1,能使磁珠浸没在洗涤液中,充分振荡混匀,将EP管短离几秒,使附在管盖和壁上的液滴降至EP管底部,将EP管放入磁力架,待1分钟后磁珠充分附在EP管内壁一侧,用移液器吸出液体弃之。
B4、加入1mL漂洗液W2,将磁珠浸没在洗涤液,充分振荡混匀,将EP管短离几秒,使附在管盖和壁上的液滴降至EP管底部,将EP管放入磁力架,待1分钟后磁珠充分附在EP管内壁一侧,用移液器吸出多余W2液体弃之。
B5、重复步骤4。
B6、晾干,使管内乙醇挥发干。
B7、加入50μL TB洗脱,充分振荡混匀,将EP管短离几秒,使附在管盖和壁上的液滴降至EP管底部,将EP管放入磁力架,待1分钟后磁珠充分附在EP管内壁一侧,用移液器吸出DNA溶液至新的1.5mL离心管待用。
实施例2
本实施例提供用于检测结直肠癌相关基因多位点甲基化试剂盒及应用,所述引物组合包括第一引物对、第二引物对、第三引物对、第四引物对和第五引物对,所述第一引物对的碱基序列如SEQ ID NO.1-2所示,所述第二引物对的碱基序列如SEQ ID NO.3-4所示,所述第三引物对的碱基序列如SEQ ID NO.5-6所示,所述第四引物对的碱基序列如SEQ ID NO.7-8所示,所述第五引物对的碱基序列如SEQ ID NO.9-10所示;所述探针包括第一探针、第二探针、第三探针、第四探针和第五探针,所述第一探针的碱基序列如SEQ ID NO.11所示,所述第二探针的序列如SEQ ID NO.12所示,所述第三探针的序列如SEQ ID NO.13所示,所述第四探针的序列如SEQ ID NO.14所示,所述第五探针的序列如SEQ ID NO.15所示;
所述引物组合包含五个引物对,所述引物对碱基序列分别如SEQ ID NO.1-10所示,所述探针碱基序列分别如SEQ ID NO.11-15所示。
NDRG4上游引物为:
SEQ ID NO.1:5’-TGTTTTTTAGGTTTCGCGTC-3’,
NDRG4下游引物为:
SEQ ID NO.2:5’-GCGTAACTTCCGCCTTCTA-3’,
SDC2上游引物为:
SEQ ID NO.3:5’-CGGGAGTAGGCGTAGGAG-3’,
SDC2下游引物为:
SEQ ID NO.4:5’-AAATACCGCAACGATTACGAC-3’,
TFPI2上游引物为:
SEQ ID NO.5:5’-GGCGAAGTTGTTATTAGTCGTC-3’,
TFPI2下游引物为:
SEQ ID NO.6:5’-AAATAAATACCCTACGCGCAC-3’,
BMP3上游引物为:
SEQ ID NO.7:5’-TTATTTCGTTGTATTCGGTC-3’,
BMP3下游引物为:
SEQ ID NO.8:5’-ACCGAAAATTAAACTCCAA-3’,
IR上游引物为:
SEQ ID NO.9:TGGGATGGGGAGTTTGTTTAGATT
IR下游引物为:
SEQ ID NO.10:AATACTAACACTAACTCATATAAC
探针为:
SEQ ID NO.11:CGTTCGTTTTTTCGTTCGTTTATCGG
SEQ ID NO.12:TCGCGTTTTCGGGGCG
SEQ ID NO.13:AGCGCGAGAGTTTTGGGTGCGCG
SEQ ID NO.14:CGGGTTTCGTGCGTTTTCGTT
SEQ ID NO.15:TGTATTTATTTAATATATATTTTAAGGTTG
将处理的引物进行扩增处理,其反应程序包括50℃UNG酶消化10min;95℃预变性2min;95℃变性10s,58-65℃退火延伸30s,收集荧光信号,40个循环。
细胞裂解液、PVPP、蛋白酶K、RNA酶、DNA漂洗液、DNA洗脱液与DNA保存液均保存在基因组提取试剂盒。
试剂盒的使用方法参考实施例2。
实施例3
本发明提供用于检测结直肠癌相关基因多位点甲基化试剂盒及应用,所述试剂盒还包括样品保存液、核酸提取液、PCR反应液、阳性质控品、阴性质控品、内标对照、标准品试剂中一种或多种。
所述试剂盒还包括溶解缓冲液、甲基化转换试剂、结合缓冲液、漂洗缓冲液中一种或多种,可将上述纯化后的DNA进行CT转换。
所述溶解缓冲液包括1-5mol/L的NaOH和5-20mmol/L的氢琨,优选的3mol/L的NaOH和10mmol/L的氢琨效果最佳。
所述甲基化转换试剂包括但不限于亚硫酸氢钠、亚硫酸钠、亚硫酸氢铵和亚硫酸铵等含有亚硫酸基团的盐,浓度为1-10mol/L,优选的为亚硫酸氢铵,浓度为9mol/L。
所述结合缓冲液包括但不限于盐酸胍、异硫氰酸胍等胍盐,浓度为1-10mol/L,优选的为盐酸胍,浓度为6mol/L。
所述漂洗缓冲液包括Tris-HCl浓度为20-100mol/L以及乙醇或异丙醇浓度为50%-80%,优选的浓度为80%。
实施例4
用于检测结直肠癌相关基因多位点甲基化试剂盒及应用,对上述检测引物组合、探针进行线性范围和灵敏度检测,内标IR为actin。分别将NDRG4、SDC2、TFPI2、BMP3的质粒按10倍梯度进行稀释,得到浓度分别为106、105、104、103、102个拷贝的浓度梯度溶液,分别以此为模板按照上述反应体系和反应程序进行扩增反应。
分别将NDRG4、SDC2、TFPI2、BMP3和actin的基因重组质粒进行定量,并定量为1010拷贝/μL,并梯度稀释,得到1×106拷贝/μL、1×105拷贝/μL、1×104拷贝/μL、1×103拷贝/μL、1×102拷贝/μL的不同浓度梯度稀释液,作为标准品DNA。
反应体系配制具体参见实施例2,每个反应管中加入1μL一种梯度稀释的质粒模版。
结果判断
结果如图1-5所示,各图分别代表了NDRG4、SDC2、TFPI2、BMP3和actin的质粒扩增曲线,各图中5条曲线分别表示对应质粒按十倍稀释为106、105、104、103、102个拷贝,扩增结果均有明显的S型扩增曲线,反应体系在106-102之间呈线性分布,R2≥0.99。根据扩增曲线Ct值判断,浓度与扩增循环数Ct结果具有很好的线性关系。
结果如图2所示,将IR质粒依次稀释为106、105、104、103、102个拷贝的浓度梯度溶液,扩增结果均有明显的S型扩增曲线,反应体系在106-102之间呈线性分布,最低检出100拷贝/μL的模板。以上结果说明该引物、探针具有较高的扩增灵敏度,并在最低检出限实验中表明反应体系最低检出100拷贝/μL的模板。
稳定性实验的描述,重复20次,CV<5%。
实施例5
本实施例使用实施例2提供的第一引物对、第二引物对、第三引物对、第四引物对和第五引物对检测结直肠癌患者粪便样本中的甲基化DNA。本实施例中设置85个结直肠癌病人样本,包括27例中分化腺癌、21例高分化腺癌、19例部分腺体高级别上皮内瘤变、18例低分化腺癌以及55个其他肿瘤样本,包括16例胃管状腺癌、22例胃腺鳞癌、11例胃溃疡癌变、6例胰小细胞癌和25例健康对照、一个阳性质控样本、一个阴性质控样本,内参IR为actin,进行PCR反应扩增,PCR反应扩增体系和反应程序参考实施例2。
结果显示,对于中分化腺癌,其检测敏感性为92.6%,特异性为88.2%。
对于高分化腺癌,其检测敏感性为90.4%,特异性为85.3%。
对于腺体高级别上皮内瘤变,其检测敏感性为84.2%,特异性为89.3%。
对于低分化腺癌,其检测敏感性为88.9%,特异性为87.7%。
部分结果如图6-9所示,图中结直肠癌病人样本Ct值都在35个扩增循环以内,其他肿瘤样本、正常人样本和空白对照中除有2例胰小细胞癌和1例胃管状腺癌的Ct值为39个循环,1例正常人样本为39个循环,其余样本Ct值均没有在给定扩增循环范围内达到Ct阈值。因此该引物组合、探针特异性很强、灵敏度很高。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!