一种喹唑啉酮及其衍生物的制备方法与流程
本发明属于医药化工中间体及相关化学技术领域,涉及到一种喹唑啉酮及其衍生物制备方法。
背景技术:
喹唑啉酮及其衍生物是一类重要的具有生物活性分子,其骨架结构频繁出现于天然分子和药物分子中,对高血压、肺癌以及焦虑症都有较好的治疗效果,在有机合成及药物化学等领域有着重要的应用。
关于喹唑啉酮类化合物的合成,通常采用如下两种方法:
(1)过渡金属催化的邻氯芳基酰胺与醛和氨水的成环反应
该方法的反应条件复杂,原子经济性差,产率较低,不适合工业化生产。[参见:(a)guo,s.;li,y.;tao,l.;zhang,w.;fan,x.rscadv.2014,4,59289-59296.(b)xu,w.;jin,y.;liu,h.;jiang,y.;fu,h.org.lett.2011,13,1274-1277.(c)xu,w.;fu,h.j.org.chem.2011,76,3846-3852.]
(2)邻氨基苯甲酰胺参与成环反应
该方法的反应条件非常苛刻,需高温操作,多步反应收率低,也不适合工业化生产[参见:(a)connolly,d.j.;cusack,d.;o’sullivan,t.p.;guiry,p.j.tetrahedron2005,61,10153-10202.(b)mitobe,y.;ito,s.;mizutani,t.;nagase,t.;sato,n.;tokita,s.bioorg.med.chem.lett.2009,19,4075-4078.(c)zhan,d.;li,t.;wei,h.;weng,w.;ghandi,k.;zeng,q.rscadv.2013,3,9325-9329.]
技术实现要素:
本发明提供了一种喹唑啉酮及其衍生物的制备方法,以2-卤代苯甲酰胺和腈类化合物为原料,以铜盐作为催化剂,在无机碱性条件作用下发生环合反应合成一系列喹唑啉酮及其衍生物。
本发明的技术方案:
一种喹唑啉酮及其衍生物的制备方法,步骤如下:
以2-卤代苯甲酰胺类化合物的和腈类化合物为原料,以铜盐作为催化剂,在无机碱性条件作用下发生环合反应,合成一系列喹唑啉酮及其衍生物;合成路线如下:
其中:x为溴或碘;
r1选自氢、烷基和烷氧基;
r2选自烷基、苯基、烷基苯基、烷氧基、苯基、氯和溴。
所述的铜盐催化剂为氧化亚铜、碘化亚铜、溴化亚铜、氯化亚铜、三氟甲基磺酸亚铜、氧化铜、溴化铜、氯化铜、三氟甲基磺酸铜、醋酸铜中的一种或两种以上混合,铜盐催化剂的加入量为2-卤代苯甲酰胺类化合物的1-50mol%。
所述的无机碱为叔丁醇钾、碳酸铯、氢氧化钠、叔丁醇钠、氢氧化钾、碳酸钠、碳酸钾中的一种或两种以上混合,无机碱的加入量为2-卤代苯甲酰胺类化合物的100-300mol%。
所述的有机溶剂为苯、甲苯、1,4-二氧六环、二甲基亚砜、n,n-二甲基甲酰胺、甲醇、乙醇、异丙醇、正丁醇、二氯甲烷、三氯甲烷、正丁醚、四氯化碳、乙酸乙酯、石油醚、甲基叔丁基醚、四氢呋喃、丙酮、乙腈中的一种或两种以上混合,有机溶剂的加入量为2-卤代苯甲酰胺类化合物重量的2-100倍。
在上述合成方法的反应中,反应温度在30~120℃。
本发明的方法合成路线短、条件温和、操作简单和收率较高。喹唑啉酮类化合物广泛应用于化学领域的多个方面,具有广阔的市场前景。例如喹唑啉酮及其衍生物是一类重要的生物活性分子,其骨架结构频繁出现于天然分子和药物分子中,对高血压、肺癌以及焦虑症都有较好的治疗效果,在有机合成及药物化学等领域有着重要的应用。
附图说明
图1是实施例1中化合物3a的1h核磁谱图。
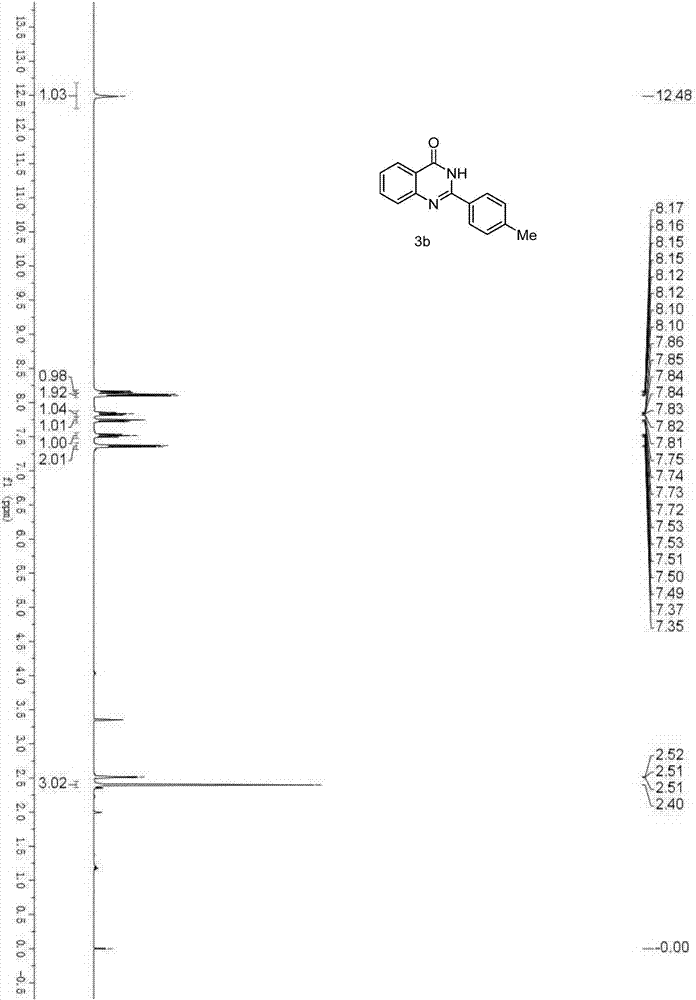
图2是实施例2中化合物3b的1h核磁谱图。
图3是实施例3中化合物3c的1h核磁谱图。
图4是实施例4中化合物3d的1h核磁谱图。
图5是实施例5中化合物3e的1h核磁谱图。
图6是实施例6中化合物3f的1h核磁谱图。
图7是实施例7中化合物3g的1h核磁谱图。
图8是实施例8中化合物3h的1h核磁谱图。
图9是实施例9中化合物3i的1h核磁谱图。
图10是实施例10中化合物3n的1h核磁谱图。
具体实施方式
以下结合附图和技术方案,进一步说明本发明的具体实施方式。
实施例1:3-苯基喹唑啉酮(3a)的合成
将2-溴苯甲酰胺(100.0mg,0.5mmol)、醋酸铜(1.0mg,0.01mmol)、叔丁醇钾(56.0mg,0.5mmol)、苯甲腈(51.6mg,0.5mmol)依次加入到schlenk反应瓶中,真空、氮气置换3次后,在氮气气氛中,加入甲苯0.2ml,30℃反应4小时,反应结束后,减压除去溶剂,柱层析分离(洗脱剂为石油醚:乙酸乙酯=20:1,v:v),得到淡黄色固体产物0.089g,收率为80%。mp235–236℃.1hnmr(400mhz,cdcl3)δ7.49–7.53(m,1h),7.58–7.60(m,3h),7.78–7.86(m,2h),8.25–8.28(m,2h),8.32–8.35(m,1h),11.67(s,1h).
实施例2:3-对甲苯基喹唑啉酮(3b)的合成
将2-溴苯甲酰胺(100.0mg,0.5mmol)、醋酸铜(9.1mg,0.1mmol)、叔丁醇钾(56.0mg,0.5mmol)、4-甲基苯甲腈(117.1mg,1.0mmol)依次加入到schlenk反应瓶中,真空、氮气置换3次后,在氮气气氛中,加入甲醇1.0ml,50℃反应5小时,反应结束后,减压除去溶剂,柱层析分离(洗脱剂为石油醚:乙酸乙酯=20:1,v:v),得到白色固体产物0.105g,收率为89%。mp240–241℃.1hnmr(400mhz,cdcl3)δ2.40(s,3h),7.36(d,j=8.0hz,2h),7.49–7.53(m,1h),7.74(d,j=8.0hz,1h),7.81–7.86(m,1h),8.11(d,j=8.0hz,2h),8.16(dd,j=12.0,4.0hz,1h),12.48(s,1h).
实施例3:3-(4-甲氧基苯基)喹唑啉酮(3c)的合成
将2-溴苯甲酰胺(100mg,0.5mmol)、醋酸铜(18.2mg,0.2mmol)、叔丁醇钾(84.0mg,1.0mmol)、4-甲氧基苯甲酰胺(99.9mg,0.75mmol)依次加入到schlenk反应瓶中,真空、氮气置换3次后,在氮气气氛中,加入乙二醇二甲醚0.5ml,60℃反应6小时,反应结束后,减压除去溶剂,柱层析分离(洗脱剂为石油醚:乙酸乙酯=20:1,v:v),得到白色固体产物0.107g,收率为85%;mp249–250℃.1hnmr(400mhz,dmso-d6)δ3.84(s,3h),7.07–7.09(d,j=8.0hz,2h),7.46–7.50(m,1h),7.70(d,1h),7.78–7.83(m,1h),8.13(d,j=8.0hz,1h),8.19(d,j=8.0hz,2h),12.42(s,1h).
实施例4:3-(2-甲基苯基)喹唑啉酮(3d)的合成
将2-溴苯甲酰胺(100.0mg,0.5mmol)、醋酸铜(1.0mg,0.005mmol)、碳酸钾(69.0mg,0.5mmol)、2-甲基苯甲腈(117.1mg,1.0mmol)依次加入到schlenk反应瓶中,真空、氮气置换3次后,在氮气气氛中,加入乙醇2.0ml,90℃反应9小时,反应结束后,减压除去溶剂,柱层析分离(洗脱剂为石油醚:乙酸乙酯=20:1,v:v),得到白色固体产物0.106g,收率为90%;mp221–222℃.1hnmr(400mhz,cdcl3)δ2.53(s,3h),7.33–7.36(m,2h),7.41–7.45(m,1h),7.49–7.53(m,1h),7.56–7.59(m,1h),7.79–7.80(d,j=4.0hz,2h),8.25–8.27(d,j=8.0hz,1h),10.56(s,1h).
实施例5:3-(2-氯苯基)喹唑啉酮(3e)的合成
将2-溴苯甲酰胺(100.0mg,0.5mmol)、溴化铜(2.2mg,0.01mmol)、叔丁醇钾(78.5mg,1.0mmol)、2-氯苯甲腈(137.6mg,1.0mmol)依次加入到schlenk反应瓶中,真空、氮气置换3次后,在氮气气氛中,加入乙醇3.0ml,50℃反应10小时,反应结束后,减压除去溶剂,柱层析分离(洗脱剂为石油醚:乙酸乙酯=20:1,v:v),得到淡黄色固体产物0.193g,收率为65%;mp176–178℃.1hnmr(400mhz,dmso-d6)δ7.47–7.63(m,4h),7.66–7.73(m,2h),7.83–7.87(m,1h),8.17-8.20(d,j=8.0hz,1h),12.64(s,1h);
实施例6:3-(2-溴苯基)喹唑啉酮(3f)的合成
将2-溴苯甲酰胺(100.0mg,0.5mmol)、氧化铜(8.0mg,0.1mmol)、叔丁醇钾(78.5mg,1.0mmol)、2-溴苯甲腈(61.0mg,0.5mmol)依次加入到schlenk反应瓶中,真空、氮气置换3次后,在氮气气氛中,加入乙二醇二甲醚3.0ml,50℃反应12小时,反应结束后,减压除去溶剂,柱层析分离(洗脱剂为石油醚:乙酸乙酯=20:1,v:v),得到白色固体产物0.108g,收率为72%;mp175–177℃.1hnmr(400mhz,dmso-d6)δ7.46–7.59(m,3h),7.62–7.66(m,1h),7.74(dd,j=24.0,8.0hz,2h),7.83–7.88(m,1h),8.18(d,j=7.9hz,2h),12.61(s,1h).
实施例7:3-甲基喹唑啉酮(3g)的合成
将2-溴苯甲酰胺(100.0mg,0.5mmol)、三氟甲基磺酸亚铜(0.8mg,0.005mmol)、碳酸钠(106.0mg,1.0mmol)、乙腈(41.5mg,1.0mmol)依次加入到schlenk反应瓶中,真空、氮气置换3次后,在氮气气氛中,加入四氢呋喃1.0ml,50℃反应12小时,反应结束后,减压除去溶剂,柱层析分离(洗脱剂为石油醚:乙酸乙酯=20:1,v:v),得到白色固体产物0.064g,收率为80%;mp234–235℃.1hnmr(400mhz,dmso-d6)δ2.34(s,3h),7.44(t,j=8.0hz,1h),7.56(d,j=4.0hz,1h),7.73–7.78(m,1h),8.06(dd,j=8.0,4.0hz,1h),12.19(s,1h).
实施例8:3-正丁基喹唑啉酮(3h)的合成
将2-溴苯甲酰胺(100.0mg,0.5mmol)、氯化亚铜(2.0mg,0.02mmol)、氢氧化钾(112.0mg,1.0mmol)、正己腈(97.1mg,1.0mmol)依次加入到schlenk反应瓶中,真空、氮气置换3次后,在氮气气氛中,加入乙腈4.0ml,30℃反应12小时,反应结束后,减压除去溶剂,柱层析分离(洗脱剂为石油醚:乙酸乙酯=20:1,v:v),得到白色固体产物0.131g,收率为75%;mp109–110℃.1hnmr(400mhz,cdcl3)δ1.01(t,j=8.0hz,3h),1.52(q,j=4.0hz,2h),1.86–1.94(m,2h),2.83(t,j=8.0hz,2h),7.47(t,j=8.0hz,1h),7.70–7.80(m,2h),8.29(d,j=4.0hz,2h),12.21(s,1h).
实施例9:4-甲氧基-3-苯基喹唑啉酮(3i)的合成
将2-溴-5-甲氧基苯甲酰胺(115.0mg,0.5mmol)、溴化亚铜(1.4mg,0.01mmol)、叔丁醇钠(96.1mg,1.0mmol)、苯甲腈(103.1mg,1.0mmol)依次加入到schlenk反应瓶中,真空、氮气置换3次后,在氮气气氛中,加入正己烷4.0ml,50℃反应12小时,反应结束后,减压除去溶剂,柱层析分离(洗脱剂为石油醚:乙酸乙酯=20:1,v:v),得到白色固体产物0.098g,收率为78%;mp247–248℃.1hnmr(400mhz,cdcl3)δ3.96(s,3h),7.39–7.42(m,1h),7.56–7.57(m,3h),7.69(d,j=4.0hz,1h),7.77(d,j=8.0hz,1h),10.57(s,1h).
实施例10:6-甲基-3-苯基喹唑啉酮(3n)的合成
将4-甲基2-溴苯甲酰胺(107.0mg,0.5mmol)、碘化亚铜(18.9mg,0.1mmol)、碳酸钾(60.0mg,1.5mmol)、苯甲腈(77.3mg,0.75mmol)依次加入到schlenk反应瓶中,真空、氮气置换3次后,在氮气气氛中,加入甲苯4.0ml,120℃反应12小时,反应结束后,减压除去溶剂,柱层析分离(洗脱剂为石油醚:乙酸乙酯=20:1,v:v),得到白色固体产物0.112g,收率为95%;mp240–241℃.1hnmr(400mhz,cdcl3)δ2.46(s,3h),7.33(d,j=8.0hz,1h),7.52–7.68(m,4h),8.03(d,j=8.0hz,1h),8.17(d,j=8.0hz,1h),12.44(s,1h).
- 还没有人留言评论。精彩留言会获得点赞!
- 一类苯內酰烯酯酰胺类衍生物在制备抗骨质疏松药物中的应用的制作方法与工艺
- 一种丹参酮类化合物17位酯化衍生物及其制备工艺和应用的制作方法与工艺
- 用于治疗癌症的异喹啉酮衍生物的制作方法与工艺
- 二氢碟啶酮衍生物及其用途的制作方法与工艺
- 一种酞嗪酮衍生物、该衍生物的制备方法及其制备用催化剂与流程
- 环烃基取代的甲磺酰基苯甲酰胺衍生物、其制法与医药上的用途的制作方法与工艺
- 一种以喹唑啉酮衍生物为核心的化合物及其在OLED上的应用的制作方法与工艺
- 一种母核为喹唑啉酮衍生物的化合物及其在OLED上的应用的制作方法与工艺
- 一种母核为喹唑啉酮衍生物的化合物及其应用的制作方法与工艺
- 蝶啶酮衍生物作为EGFR抑制剂的应用的制作方法与工艺