一种寨卡病毒的检测引物及应用的制作方法
本发明涉及医学检验领域,具体而言,涉及一种寨卡病毒的检测引物及应用。
背景技术:
寨卡病毒ZIKV(zika virus,ZIKV)是一种蚊媒病毒,属黄病毒科黄病毒属,为单股正链RNA病毒,全基因长度约为11Kb,病毒颗粒直径40~70nm,有包膜,包含有10794个核苷酸,编码3419个氨基酸,ZIKV病毒基因编码3个结构蛋白:衣壳蛋白(C)、膜前体蛋白(pr M)和包膜蛋白(M),以及7个非结构蛋白(NS1,NS2a,NS2b,NS3,NS4a,NS4b和NS5)。根据寨卡病毒ZIKV基因型分为非洲型和亚洲型。
临床上的检测方法包括一般血常规检查、血清学检查、病毒分离培养等。血清学方法只适用于急性或恢复期标本,因为在感染早期Ig M和IgG抗体滴度较低,且寨卡病毒ZIKV抗体与同为黄病毒属的登革病毒、黄热病毒和西尼罗病毒抗体等有较强的交叉反应,易于产生假阳性;病毒分离培养对实验室要求高、耗费时间长,相比之下,实时RT-PCR在感染早期能更快速、准确、灵敏地检测出标本中的寨卡病毒ZIKV。但由于寨卡病毒ZIKV亚型较多,且保守区又与其他黄病毒属病毒有高度同源性,给实时RT-PCR特异性引物的设计带来困难。
目前,还没有比较有效的专门针对寨卡病毒ZIKV的精确检测手段。
技术实现要素:
本发明的第一目的在于提供一种寨卡病毒的检测引物,该检测引物能特异的检测出寨卡病毒。
本发明的第二目的在于提供上述检测引物在寨卡病毒检测中的应用。
本发明的第三目的在于提供上述检测引物在制备检测寨卡病毒试剂盒中的应用。
本发明的第四目的在于提供一种寨卡病毒的检测试剂盒,该检测试剂盒能方便快捷的检测出寨卡病毒。
本发明的第五目的在于提供上述检测试剂盒在检测寨卡病毒中的应用。
为了实现本发明的上述目的,采用以下技术方案:
一种寨卡病毒的检测引物,该检测引物包括引物对,引物对的碱基序列分别如SEQ ID No.1-2所示。
上述的寨卡病毒的检测引物在寨卡病毒检测中的应用。
上述寨卡病毒的检测引物在制备检测寨卡病毒试剂盒中的应用。
一种寨卡病毒的检测试剂盒,该检测试剂盒包括上述的检测引物。
上述检测试剂盒在检测寨卡病毒中的应用。
与现有技术相比,本发明的有益效果为:本发明提供的寨卡病毒检测引物能准确地、特异的检测出寨卡病毒,浓度低至1×101拷贝/μL依然能检测出,具有较高的灵敏度;应用该检测引物检测寨卡病毒能提高检测的准确性,且应用该检测引物制备检测寨卡病毒的试剂盒可以方便应用,检测快速灵活,且检测结果准确可靠。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实施例1提供的电泳结果图;
图2为本发明实施例4提供的荧光定量PCR熔解曲线图;
图3为本发明实施例4提供的标准曲线图;
图4为本发明实施例4提供的实验组荧光信号图;
图5为本发明实验例1提供的实验结果图;
图6为本发明实施例2提供的实验结果图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
检测引物由海南隽誉有限公司合成,Ribolock RNase抑制剂(Thermo Fisher)、M-MLV反转录酶(Promega)购自海南隽誉有限公司,dNTPs(凯基)购自海南莱博科达科技有限公司,SuperReal PreMix Plus实时荧光定量试剂盒(TIANGEN)海南莱博科达科技有限公司提供,病毒RNA提取试剂盒购自Qiagen公司。其余常规试剂购自国药集团。
下面对本发明实施例的一种寨卡病毒的检测引物及应用进行具体说明。
一种寨卡病毒的检测引物,该检测引物包括引物对,引物对的碱基序列分别如SEQ ID No.1-2所示。
检测引物的上游引物序列如下所示:
SEQ ID No.1:5’-RCTCAAACGAATGGCRGTCAG-3’;
检测引物的下游引物序列如下所示:
SEQ ID No.2:5’-CAATCAGTTCATCTTGGTGGC-3’。
上述引物序列是通过生物信息学的方法对寨卡病毒基因组序列进行分析后,确定寨卡病毒的保守序列,然后通过序列设计软件设计和人工优化后得到;上述检测引物扩增的目的片段产物长度245bp,比较合适,适于快速扩增。
需要说明的是,引物中R表示A或G的简并碱基。
上述检测引物的退火温度合适,扩增的目的片段长度合适,节约检测反应的时间,方便快速地获得检测结果;同时检测引物针对性强,特异性好,灵敏度高,检测结果可靠准确。在保证检测准确性的前提下,缩短反应时间。
上述的寨卡病毒的检测引物在检测寨卡病毒中的应用。
进一步地,上述应用包括以待检样本为模板进行PCR反应;PCR反应程序为:95℃,预变性15min;95℃,变性15s;54-60℃,退火20s;72℃,延伸32s,30个循环;72℃,延伸5min。
选择54-60℃退火温度,能扩增出较好的目的条带,避免扩增出非特异的条带干扰实验结果,30个循环能扩增出大量片段,将微量的模板放大,利于检测,而且30个循环反应时间相对较缩短,利于快速反应,快速拿到检测结果。
上述寨卡病毒的检测引物在制备检测寨卡病毒试剂盒中的应用。
一种寨卡病毒的检测试剂盒,该检测试剂盒包括上述的检测引物。
进一步地,检测试剂盒包括PCR反应缓冲液、Taq DNA聚合酶、dNTPs、2×Super Real PreMix、2×SYBR green I、目的片段标准品和Mg2+中的至少一种。
试剂盒中,包括进行普通PCR的试剂,可以对样本的寨卡病毒进行先期的定性分析;同时,试剂盒中还包括进行荧光定量PCR的试剂,选用荧光定量PCR的试剂可以对样本的寨卡病毒进行定量分析;另外,试剂盒中还包括目的片段标准品,可在检测待检样本的时候,作为阳性对照;标准品的目的片段可以是人工合成也可以是通过PCR扩增得到。
进一步地,上述检测试剂盒还包括反转录试剂。
进一步地,反转录试剂包括dNTPs、oligo dT primer、5×Reverse缓冲液、RNase抑制剂或反转录酶中的至少一种。
由于寨卡病毒是一种单股正链的RNA病毒,需要对病毒基因组进行反转录扩增,获得寨卡病毒基因组的cDNA序列,方便后续的普通定性PCR和荧光定量PCR反应。
上述的检测试剂盒在检测寨卡病毒中的应用。
进一步地,上述的检测试剂盒在检测寨卡病毒中的应用,包括以待检样本为模板,进行PCR反应;
PCR反应程序为:95℃,预变性15min;95℃,变性10s;54-59℃,退火20s;72℃,延伸20s;72℃收集荧光信号15s,40个循环。
使用温和条件进行荧光定量PCR,能快速准确的获得样本中寨卡病毒的含量。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供一种寨卡病毒的检测引物,该检测引物包括引物对,引物对的碱基序列分别如SEQ ID No.1-2所示。
检测引物的上游引物序列如下所示:
SEQ ID No.1:5’-RCTCAAACGAATGGCRGTCAG-3’;
检测引物的下游引物序列如下所示:
SEQ ID No.2:5’-CAATCAGTTCATCTTGGTGGC-3’。
寨卡病毒的检测引物具体使用方法如下:
1.1以0.5μL待检样本为模板,加入2×Taq Mix 10μL,SEQ ID No.1-2所示的引物对各0.5μL,加入ddH2O,补足到20μL;
1.2进行PCR反应程序为:95℃,预变性5min;95℃,变性30s;54℃,退火30s;55℃,延伸30s;30个循环;72℃,10min。
1.3反应结束后,反应产物进行琼脂糖凝胶电泳;
1.4琼脂糖凝胶电泳结束后,对凝胶进行查看,通过电泳的条带判断结果。
实验结果如图1所示,图中M表示DNA Marker D2000,1表示阴性对照,2表示目的条带;从图中可以看出,目的条带的大小245bp与实验设计大小一致,且条带单一明亮;说明设计的引物扩增效果较好,符合预期,且具有较好的特异性。
实施例2
本实施例提供一种寨卡病毒的检测试剂盒,试剂盒含有实施例1提供的检测引物,该检测引物包括引物对,引物对的碱基序列分别如SEQ ID No.1-2所示。
检测引物的上游引物序列如下所示:
SEQ ID No.1:5’-AAGGGTGTTAGGCTTGTCG-3’;
检测引物的下游引物序列如下所示:
SEQ ID No.2:5’-CAGGCTTAGAAATCAGACG-3’。
本实施例提供的试剂盒的使用方法参考实施例1提供的PCR扩增方法。
实施例3
本实施例提供一种寨卡病毒的检测试剂盒,试剂盒含有实施例1提供的检测引物,该检测引物包括引物对,引物对的碱基序列分别如SEQ ID No.1-2所示。
检测引物的上游引物序列如下所示:
SEQ ID No.1:5’-AAGGGTGTTAGGCTTGTCG-3’;
检测引物的下游引物序列如下所示:
SEQ ID No.2:5’-CAGGCTTAGAAATCAGACG-3’。
当然,本试剂盒还包括可以直接进行PCR反应的试剂,包括PCR反应缓冲液、Taq DNA聚合酶、dNTPs、2×Super Real PreMix、2×SYBR green I、目的片段标准品和Mg2+中的至少一种。
本实施例提供的试剂盒的使用方法,具体如下:
荧光定量PCR的实验操作方法如下:
1.1荧光定量PCR的反应体系:以0.5μL待检样本为模板,2×Super Real PreMix 10μL,0.4的2×SYBR green I,SEQ ID No.1-2所示的引物对各0.5μL,ddH2O补足到20μL;
1.2荧光定量PCR的反应程序:95℃,预变性15min;95℃,变性10s;59℃,退火20s;72℃,延伸20s;72℃收集荧光信号15s,40个循环。
实施例4
本实施例提供一种寨卡病毒的检测试剂盒,试剂盒含有实施例1提供的检测引物,该检测引物包括引物对,引物对的碱基序列分别如SEQ ID No.1-2所示。
检测引物的上游引物序列如下所示:
SEQ ID No.1:5’-AAGGGTGTTAGGCTTGTCG-3’;
检测引物的下游引物序列如下所示:
SEQ ID No.2:5’-CAGGCTTAGAAATCAGACG-3’。
当然,本试剂盒还包括可以直接进行PCR反应的试剂,包括PCR反应缓冲液、Taq DNA聚合酶、dNTPs、2×Super Real PreMix、2×SYBR green I、目的片段标准品和Mg2+中的至少一种。
当然,本试剂盒还包括反转录试剂包括dNTPs、oligo dT primer、5×Reverse缓冲液、RNase抑制剂或反转录酶中的至少一种。
寨卡病毒RNA的提取(参照Qiagen的病毒RNA提取试剂盒)
1.1室温下取感染寨卡病毒的宿主动物的血浆或者血清200μL,如果补足200μL,可以用0.9%的生理盐水补足;
1.2加入20μL的Proteinase K溶液,混匀;
1.3加入200μL的Buffer RLV,漩涡震荡15s;
1.4在56℃条件下孵育15min,短暂离心,将管壁的溶液收集到管底;
1.5加入250μL的无水乙醇,漩涡震荡15s,室温孵育5min,短暂离心;
1.6将步骤1.5的溶液全部加入到吸附柱中,12000rpm离心1min,倒掉废液,将吸附柱重新放回收集管;
1.7向吸附柱中加入500μL的Buffer RW1,12000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管;
1.8向吸附柱中加入500μL的Buffer RW2,12000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管;
1.9向吸附柱中加入500μL的无水乙醇,12000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管;
1.10以12000rpm离心1min,倒掉收集管中的废液,将吸附柱置于室温5-10min,彻底晾干;
1.11将吸附柱置于RNase-free的离心管中,向吸附柱中悬空滴加50μL的RNase-free Water,室温放置5min,12000rpm离心1min,收集RNA溶液,-80℃保藏备用。
寨卡病毒RNA的反转录,具体操作如下:
2.1以步骤1.11获得RNA为模板,进行反转录,加入500ng的Total RNA,dNTPs(10mM each)1μL,oligo dT primer 1μL,加RNase-free Water补足到8μL;
2.2在65℃反应5min,冰上放置2min;
2.3再加入5×Reverse缓冲液4μL,RNase抑制剂1μL,dNTPs(10mM each)2μL,反转录酶1μL,加入RNase-free Water补足到12μL;
2.4混匀后短暂离心,42℃反应1h,70处理5min;
2.5反应结束后,获得寨卡病毒基因组cDNA,取出后置于冰上3-5min,-20℃保存备用。
本实施例提供的试剂盒普通常规PCR方法参考实施例1,荧光定量PCR方法参考实施例3。
目的片段标准品制备,具体实验方法如下:
根据基因序列数据库的Genebank数据库中提供的寨卡病毒非结构蛋白基因5(nonstructural protein 5gene,NS5)基因的碱基序列序列的第234bp至633bp,全长400bp作为标准品参照序列,命名为NS5-S序列;寨卡病毒NS5基因的Genebank信息为:Gi|1016884668|gb|KX059014.1。标准品参照序列NS5-S序列由华大基因合成,且经Sanger测序验证正确。
3.1将NS5-S序列片段1μL与pUC-57-simple载体3μL经Topo异构酶连接;
3.2将步骤3.1中的连接产物转入50μL的大肠杆菌DH5α感受态细胞混匀,冰浴30min,42℃热激45s,转移冰浴并冰上放置2-3min;
3.3加入500μL新鲜不含抗生素的液体LB培养基,于37℃摇床上150rpm震荡培养45min复苏菌体;
3.4在含有氨苄青霉素的LB平板上挑选白斑,并进行扩增培养并提取含有NS5-S片段的重组质粒。
对本实施例提供的试剂盒进行灵敏度的检测和标准曲线的建立,具体方法如下:
4.1将步骤3.4中提取的重组质粒按照1×101拷贝/μL、1×102拷贝/μL、1×103拷贝/μL、1×104拷贝/μL、1×105拷贝/μL、1×106拷贝/μL、1×107拷贝/μL和1×108拷贝/μL的浓度进行稀释;
4.2以步骤4.1中的8个浓度梯度的重组质粒为模板,以及设置的空白组和阴性对照组,进行荧光定量PCR扩增,荧光定量PCR的操作方法参考实施例3;
实验结果如图2所示,图中曲线从左到右分别表示浓度为1×108拷贝/μL、1×107拷贝/μL、1×106拷贝/μL、1×105拷贝/μL、1×104拷贝/μL、1×103拷贝/μL、1×102拷贝/μL和1×101拷贝/μL的重组质粒的熔解曲线。
可以看出,当重组质粒浓度为1×101拷贝/μL时,依然有扩增的溶解曲线,说明设计的引物具有较好的灵敏度。
以与基线的交点的循环次数(Ct)值为横坐标,质粒拷贝数的对数值为纵坐标,制作标准曲线;标准曲线如图3所示,R2=0.999。通过标准曲线可以计算出任意样本的寨卡病毒含量。
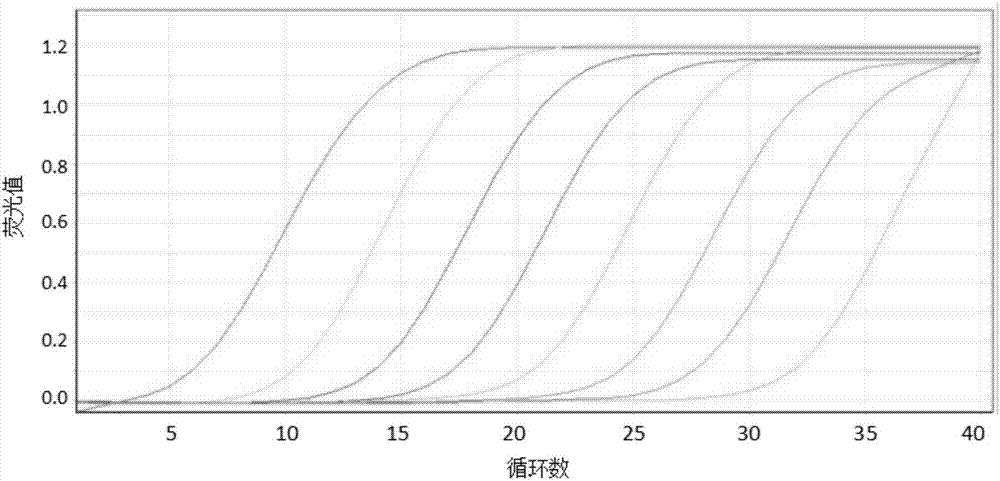
调整基线以空白组和阴性对照组曲线不出现为准,取实验组57℃-95℃的荧光信号;结果如图4所示,实验组8个浓度的模板反应曲线基本一致,高度吻合,进一步说明本发明设计的引物特异性良好;每个浓度都能检测出来荧光信号,说明本发明设计的引物特还具有较好的灵敏度。
实验例1
本实验例运用实施例4提供的试剂盒进行验证,采用已知的含有ZIKV亚洲型MR766株样本的含量进行测定。
荧光定量PCR实验方法参考实施例3,样本模板RNA提取、反转录实验和标准曲线指定方法参考实施例4。
实验结果如图5所示,通过循环数对比计算,得出样本拷贝数约为9.0×104拷贝/μL。该检测结果与样品已知浓度一致。
实验例2
本实验例运用实施例4提供的试剂盒进行验证,采用已知的含有ZIKV非洲型PVRABC59株样本的含量进行测定。
荧光定量PCR实验方法参考实施例3,样本模板RNA提取、反转录实验和标准曲线指定方法参考实施例4。
实验结果如图6所示,通过循环数对比计算,得出样本拷贝数约为8.5×104拷贝/μL。该检测结果与样品已知浓度一致。
综上所述,本发明实施例的提供的寨卡病毒的检测引物具有较好的特异性和较高的灵敏度,使用该检测引物应用于检测寨卡病毒,以及应用于制备检测寨卡病毒的试剂盒,都具有较好的特异性和较高的灵敏度;检测寨卡病毒的试剂盒方便提取病毒的核酸并进行实验,具有较高的实用性和较高的推广应用价值,且检测结果也更可靠。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
SEQUENCE LISTING
<110> 海南医学院
<120> 一种寨卡病毒的检测引物及应用
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> DNA
<213> zika virus
<400> 1
rctcaaacga atggcrgtca g 21
<210> 2
<211> 21
<212> DNA
<213> zika virus
<400> 2
caatcagttc atcttggtgg c 21
- 还没有人留言评论。精彩留言会获得点赞!
- 李坏死环斑病毒LAMP引物、试剂盒及检测方法与流程
- 一种检测脑炎病毒的引物组合及应用、试剂盒的制作方法与工艺
- 一种犬博卡病毒的通用型PCR检测引物、试剂盒和检测方法与流程
- 检测辣椒叶脉黄化病毒的引物组合物、试剂盒及其应用的制作方法与工艺
- 多重PCR检测七种腹泻病毒用引物组和试剂盒及其检测方法与流程
- 一种检测鲑鱼甲病毒的引物对、SYBR GreenⅠ荧光定量PCR试剂盒及其应用的制作方法与工艺
- 一种用于检测犬圆环病毒的引物和高效CL‑RCA‑PCR检测试剂盒及方法与流程
- 黄瓜花叶病毒LAMP引物、试剂盒及检测方法与流程
- 香蕉束顶病毒LAMP引物、试剂盒及检测方法与流程
- 一种锦鲤疱疹病毒CPA检测引物及应用的制作方法与工艺
- 用于检测AEDs引起的SJS/TEN的引物、试剂盒及方法与制造工艺
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种基于特异性SS-COI引物的丽草蛉PCR快速检测方法与制造工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 用于检测牛源性成分的lamp引物及其设计方法
- 七种不同种属来源细胞的pcr检测引物和检测方法与应用
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 用于检测牛源性成分的lamp引物及其设计方法
- 七种不同种属来源细胞的pcr检测引物和检测方法与应用