生物燃料物质及生物化学物质的制备方法与流程
技术领域:
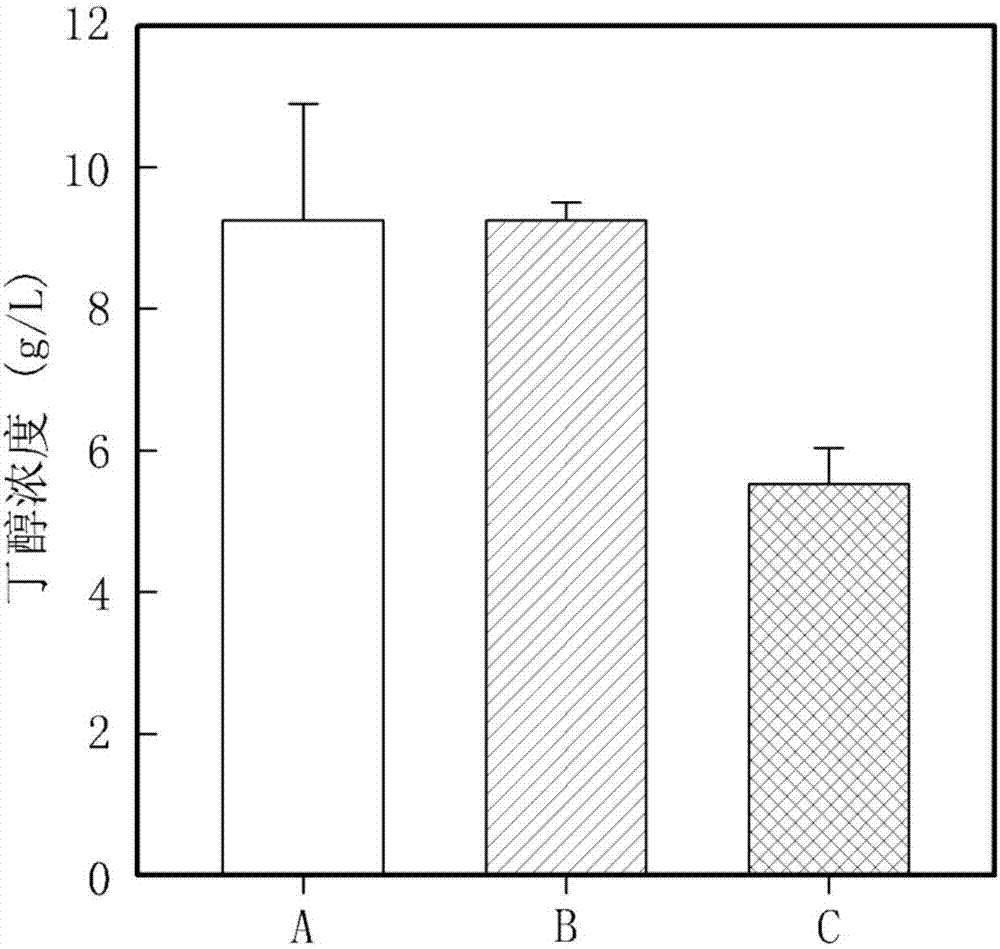
本发明涉及生物燃料物质及生物化学物质的制备方法,特别是,涉及可在制备工程中较大地减少原料和能源费用的经济性的并是环保的生物燃料物质及生物化学物质的制备方法。技术背景为了将微生物在特殊的环境下人工培养,需在培养基中添加多种营养成分。该微生物的营养成分需求根据微生物的种类各不相同。因此,为了满足上述微生物的营养成分需求,一般情况下使用添加有无机盐、氨基酸、维生素、蛋白胨(peptone)、玉米浆(cornsteepliquor)、酵母提取物(yeastextract)等的多种培养基。微生物培养基可大致分为合成培养基(syntheticmedium)和复合培养基(complexmedium)。合成培养基含有类似无机盐、氨基酸、维生素等化学性成分被明确地说明的营养成分;复合培养基含有类似蛋白胨、玉米浆、酵母提取物等化学性成分没有被明确地说明的营养成分。为了开发合成培养基,如上所述,由于根据微生物的种类所需的营养成分各不相同,因此需要先进行查明微生物所需的所有营养成分的工作。为此,一般情况下,在将所有种类的氨基酸和维生素添加至含无机盐的培养基中制备培养基后,在所述的培养基中培养微生物来确认该微生物是否成长。当微生物的成长被确认时,在所述的添加至培养基的营养成分中重新制备一种营养成分被清除的培养基后,在所述的特定营养成分被清除的培养基中培养微生物来确认该微生物是否成长。当微生物的成长被确认时,在所述的添加至培养基的营养成分中再重新制备其他的一种营养成分被清除的培养基。与此相反,当微生物的成长没有被确认时,将被清除的营养成分定义为合成培养基制备中必须添加的必须营养成分,并在随后的培养基制备中必须添加。至今为止,一般反复执行上述的方法来进行查明微生物培养中所需的所有营养成分的工作,从而来开发合成培养基(Zhangetal.,App.Microbiol.Biotechnol.,51:407,1997)。但是,所述的方法,即,单一除去法(singleomissiontechnique)作为反复试验的方法需要大量的时间、人力、研究费用。最近,用于补充单一除去法的统计性培养基开发方法正被研究者提出,但成功的概率十分低,没有广泛地被实际使用。利用如上所述的单一除去法及统计性方法来将微生物培养所需的营养成分全部确认后,对于每一个营养成分,为了促进微生物成长,必须确认所需的须添加至培养基中的最适当的营养成分的量。特别是,相当数量的微生物具备在含有所有氨基和维生素的合成培养基中也不能成长的缺点。因此,多数的微生物相对合成培养基,在含有作为复合培养基的营养成分来添加的蛋白胨和酵母提取物等的培养基中更能促进成长。此外,由于化学上的成分被明确地说明的合成培养基的制备中所添加的氨基酸或维生素的价格十分贵,因此,在通过微生物培养产业性地大量生产生物燃料物质及化学物质中使用含有上述物质的合成培养基具有一定的局限性。在通过微生物培养的生物燃料物质及生物化学物质的制备中,虽然化学性成分没有被说明,但添加有含微生物培养所需的所有营养成分的蛋白胨、玉米浆、酵母提取物等的复合培养基正被广泛使用。蛋白胨作为蛋白质被分解的物质,由于肽酶被重新转换成氨基酸,可在微生物培养中作为氮源来使用。但是,为了通过产业性规模的微生物培养生产生物燃料物质及化学物质而使用蛋白胨同样是十分贵的物质。玉米浆在玉米湿磨(cornwet-milling)工程中作为以副产物产生的物质,价格较低,因此作为微生物培养的重要营养成分被广泛地使用(Liggettetal.,Bacteriol.Rev.,12:297,1948;Liggettetal.,Bacteriol.Rev.,12:300,1948)。此外,玉米浆不仅是用于微生物培养的氮源,还具有除了含有维生素和氨基酸以外还含有其他多种营养成分的优点(Atkinsonetal.,BiochemicalEngineeringandBiotechnologyHandbook,TheNaturePress,NY,57,1983;Milleretal.,ManualofIndustrialMicrobiologyandBiotechnology,AmericanSocietyofMicrobiology,WashingtonDC,122,1986;Akhtaretal.,TapiJ.80:161,1997)。在微生物培养中玉米浆虽然是价格低廉优选的营养成分,但与蛋白胨或酵母提取液相比,具有需在培养基中添加相对较多的量的缺点。此外,在玉米浆中存在抑制微生物成长的成分,因此,将相同量的酵母提取液添加至培养基中时,相对来说,微生物的成长速度、微生物浓度、以及要生产的目标物质的生产性十分低(Amarteyetal.,Bullet.Chem.Technol.,Macedonia,19:65,2000;Silveiraetal.,Appl.Microbiol.Biotechnol.,55:442,2001;Underwoodetal.,Appl.Environ.Microbiol.,70:2734)。经许多研究者的研究,酵母提取液被确认为是用于微生物培养的最优选的营养成分,特别是,通过研究报告(Laubeetal.,Biotechnol.Lett.,6:535,1984;Bibaletal.,Appl.Microbiol.Biotechnol.,30:630,1989;Aeschlimannetal.,Appl.Microbiol.Biotechnol.,32:398,1990;Nortonetal.,J.DairySci.,77:2494,1994;Kazamiasetal.,Appl.Environ.Microbiol.,61:2425,1995;Potvinetal.,J.Microbiol.Methods,29:153,1997;afrncovaetal.,Biotechnol.Lett.,21:337,1999;Buryetal.,CzechJ.FoodSci.,19:166,2001),其可促进微生物成长,从而较大地提高通过微生物培养来生产的目标物质的生产性。此外,酵母提取液中含有相当数量的碳水化合物及溶解性糖,不仅在微生物培养中作为营养成分,同时也提供给碳源(Revillionetal.,Braz.Arch.Biol.Technol.,46:121,2003;Ojokohetal.,Afr.J.Biotechnol.,4:1281,2005)。由于酵母提取液的该优秀性,酵母提取液在食品产业中也作为添加物被广泛地使用。一般情况下,酵母提取液通过在啤酒和面包制造中使用的酵母的一种酿酒酵母(Saccharomycescerevisiae)中人工培养菌株后通过自体溶解(autolysis)工程被制造。但是,由于通过所述的工程被制造的酵母提取液价格十分贵,因此,作为用于当前产业性规模中的生物燃料物质及化学物质生产的微生物培养的营养成分来使用时,事实上并不适合。实际上,通过研究报告(Mulliganetal.,Biotechnol.Bioeng.,38:1173,1991),在将2g/L的酵母提取液作为营养成分添加来生产乳酸时,酵母提取液费用要占到整个乳酸生产费用的32%。有关通过微生物培养的生物燃料物质和化学物质生产的研究可分为低价格碳源及培养基开发、发酵工程开发、分离及精炼工程开发、优秀的菌株开发等。当前,通过产业性规模的微生物培养的生物燃料物质及化学物质生产主要是使用添加有玉米浆、酵母提取液、蛋白胨等营养成份的复合培养基。如上所述,玉米浆虽然价格低廉但抑制微生物成长,从而不能保障要生产的目标物质的生产性。与此相反,酵母提取液和蛋白胨作为营养成分,虽然优秀但价格贵,不能确保经济性。因此,为了产业性规模中的生物燃料物质及化学物质生产,需要一种在保障生产性的同时也能保障经济性,且价格低廉并充分含有优秀的营养成分的培养基的开发。用于将微生物发酵工程中产生的副产物再利用的研究正在通过一部分研究者被进行,因此开发了一种将在实际醇的发酵工程中产生的没有被发酵的固体残留碳水化合物在污泥槽中重新加水分解来作为碳源再提供至相同的乙醇发酵槽中来使用的工程(美国专利4,578,353)。此外,还开发了将2个醇发酵槽连接,在各自的发酵槽中将以副产物产生的有机酸和气体成分选择性地分离,从而来重新使用的工程(PCT专利WO2008/115080)。但是,所述的工程只是选择性地重新使用作为原料物质被提供的物质,或是在发酵槽中经微生物以副产物产生的物质中的一部分成分,因此是十分局限性的方法。将化石资源作为原料来使用而生产的燃料物质和化学物质不同,生物燃料物质及生物化学物质是通过将可完全循环的生物学性资源生物质作为原料物质来使用从而可获得的燃料物质和化学物质。最近,为了克服由于化石燃料耗竭的能源危机和温室气体带来的气候变化的环境危机,对可实现资源和二氧化碳的完全循环(CarbonNeutralorCarbonZero)的环保生物燃料物质及生物化学物质的需求正在不断增大。特别是,对于搬运和储存较容易且适合作为输送燃料的类似乙醇和丁醇的生物燃料物质备受瞩目。至今为止,生物燃料物质及生物化学物质大部分是通过将玉米或小麦等淀粉加水分解而获得的葡萄糖或甘蔗中所包含的蔗糖(Sucrose)的微生物发酵被生产的。但是,由于连续的谷物价格上升,以及将粮食资源用于燃料物质和化学物质的生产中具有伦理性的问题,因此,为了将地球上最丰富的非食用生物学性资源木质纤维生物质(lignocellulosicBiomass)作为原料物质来使用,从而有效地生产燃料物质和化学物质的研究正在全世界被广泛地进行。木质纤维生物质可大致分为木质生物质(woodybiomass)和草质生物质(grassybiomass),此类物质以纤维素(cellulose)、半纤维素(hemicellulose)、木质素(lignin)为主要成份来构成。木质纤维生物质在经过利用酸、盐基、蒸气等的物理化学性电处理工程后,通过加水分解酵素,最终,纤维素转换成含有葡萄糖的6碳糖,且半纤维素与6碳糖一起转换成含有木糖(xylose)、阿拉伯糖(arabinose)等的5碳糖。几乎所有的微生物具备在发酵过程中将6碳糖葡萄糖作为碳源和能源资源来使用的能力,但一部分微生物不具备将5碳糖葡萄糖作为碳源和能源资源来使用的能力。因此,在通过微生物发酵的生物燃料物质及生物化学物质生产中,由于不具备使用上述的5碳糖的能力,或是明显能力较低,不能使用从木质纤维生物质可获取的在整个糖中约占35%的5碳糖,从而造成巨大的原料物质价格上升,较难确保经济性。此外,存在于发酵后所产生的废液中的5碳糖使化学需氧量及生物需氧量(chemicaloxygendemand,biologicaloxygendemand)急剧地增加,因此需要用于处理该问题的新废水处理工程因此,需要开发一种可有效地使用来源于木质纤维生物质的5碳糖和6碳糖,同时可经济性并环保地生产生物燃料物质及生物化学物质的制备方法。技术实现要素:技术课题本发明提供一种具有可节省原料物质和培养基制备费用的,并可节省巨大的能源费用的环保型经济性的生物燃料物质及生物化学物质的制备方法。技术方案根据本发明的一个实施例的生物燃料物质的制备方法,其包括以下步骤:准备培养基,所述培养基包含在醇生产工程中所发生的发酵废物;将第1微生物接种于所述培养基中;培养接种有所述第1微生物的培养基。根据本发明的另一个实施例的生物燃料物质的制备方法,其包括以下步骤:从5碳糖和6碳糖的混合物使6碳糖发酵来生成乙醇发酵液;将所述乙醇发酵液分离精炼;准备培养基,所述培养基包含在所述分离精炼的步骤中所生成的发酵废物;将第1微生物接种于所述培养基中;以及培养接种有所述第1微生物的培养基。其中,所述5碳糖和6碳糖的混合物为含有糖的混合物,所述糖是通过将从由木质纤维生物质和纤维生物质组成的群中选择出来的一个以上进行物理化学性预处理以及糖化工程被生成的。所述发酵废物包含从由6碳糖和5碳糖组成的群中选择出来的一个以上的糖,所述6碳糖包含葡萄糖(glucose)、半乳糖(galactose)、和甘露糖(mannose)等,且,所述5碳糖包含木糖(xylose)和阿拉伯糖(arabinose)等。根据本发明的另一个实施例的生物燃料物质的制备方法,其中,所述第1微生物包含从由酵母、梭菌属(Clostridium)、大肠菌、芽孢杆菌属(Bacillus)、厌氧粘细菌(Anaeromyxobacter)、产碱杆菌属(Alcaligenes)、拟杆菌属(Bacteroides)、埃希氏菌属(Escherichia)、乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、毕赤酵母属(Pichia)、假单胞菌属(Pseudomonas)、罗尔斯顿菌属(Ralstonia)、红球菌属(Rhodococcus)、酵母菌属(Saccharomyces)、链霉菌属(Streptomyces)、栖热菌属(Thermus)、栖热袍菌属(Thermotoga)、嗜热菌(Thermoanaerobacter)、克雷伯菌属(Klebsiella)、链霉菌科(Streptomycetaceae)、放线菌科(Actinomycetaceae)、可啉杆菌(Colinebacterium)、发酵单胞菌属(Zymomonas)、放线杆菌属(Actinobacillus)、厌氧螺菌属(Anaerobiospirillum)、曼海姆菌(Mannheimia)组成的群中选择出来的一个以上。其中,将接种有所述第1微生物的培养基以在由分批(batch)培养、流加式(fed-batch)培养、和连续(continuous)培养组成的群中选择出来的至少一个以上的方法来培养。并可进一步包括以下步骤:将培养接种有所述第1微生物的培养基后所生成的生物燃料物质分离及精炼。其中,所述生物燃料物质为能够以燃料使用的生物气体、醇、烷烃类化合物、和烯烃类化合物。其中,所述生物气体包含甲烷和氢,所述醇包含乙醇、丙醇、丁醇、戊醇、己醛根据本发明的一个实施例的生物化学物质的制备方法,包括以下步骤:准备培养基,所述培养基包含在醇生产工程中所发生的发酵废物;将第2微生物接种于所述培养基中;培养接种有所述第2微生物的培养基。根据本发明的另一个实施例的生物化学物质的制备方法,包括以下步骤:从5碳糖和6碳糖的混合物使6碳糖发酵来生成乙醇发酵液;将所述乙醇发酵液分离精炼;准备培养基,所述培养基包含在所述分离精炼的步骤中所生成的发酵废物;将第2微生物接种于所述培养基中;以及培养接种有所述第2微生物的培养基。其中,所述5碳糖和6碳糖的混合物是通过将从由木质纤维生物质和纤维生物质组成的群中选择出来的一个以上进行物理化学性预处理以及糖化工程被生成的混合物质。所述发酵废物包含从由6碳糖和5碳糖组成的群中选择出来的一个以上的糖,所述6碳糖包含葡萄糖(glucose)、半乳糖(galactose)、和甘露糖(mannose)等,且,所述5碳糖包含木糖(xylose)和阿拉伯糖(arabinose)等。根据本发明的另一个实施例的生物化学物质的制备方法,其中,所述第2微生物包含从由酵母、梭菌属(Clostridium)、大肠菌、芽孢杆菌属(Bacillus)、厌氧粘细菌(Anaeromyxobacter)、产碱杆菌属(Alcaligenes)、拟杆菌属(Bacteroides)、埃希氏菌属(Escherichia)、乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、毕赤酵母属(Pichia)、假单胞菌属(Pseudomonas)、罗尔斯顿菌属(Ralstonia)、红球菌属(Rhodococcus)、酵母菌属(Saccharomyces)、链霉菌属(Streptomyces)、栖热菌属(Thermus)、栖热袍菌属(Thermotoga)、嗜热菌(Thermoanaerobacter)、克雷伯菌属(Klebsiella)、链霉菌科(Streptomycetaceae)、放线菌科(Actinomycetaceae)、可啉杆菌(Colinebacterium)、发酵单胞菌属(Zymomonas)、放线杆菌属(Actinobacillus)、厌氧螺菌属(Anaerobiospirillum)、曼海姆菌(Mannheimia)组成的群中选择出来的一个以上。其中,所述生物化学物质包含从由氨基酸、有机酸、酵素、生物降解高分子、醇组成的群中选择出来的一个以上。所述氨基酸包含甲硫氨酸和苏氨酸。所述有机酸包含从由乳酸、丁酸、丁二酸、和羟基丙酸组成的群中选择出来的一个以上。所述生物降解高分子包含生物聚酯。技术效果根据本发明的生物燃料物质及生物化学物质的制备方法,由于将醇生产工程中产生的发酵废物作为用于微生物培养的培养基来使用,可低廉并环保地制备生物燃料物质及生物化学物质。此外,由于将醇生产工程中产生的发酵废物作为用于微生物培养的培养基来使用,可减少通常要添加至微生物培养基中的各种化学物质及营养成分的添加量,或是不添加。此外,可减少通常使用的葡萄糖,蔗糖,丙三醇等碳源的添加量。此外,由于在醇蒸馏过程中微生物被消毒,因此可节省通常在微生物培养基的消毒过程中所消耗的巨大的能源费用。同时,由于从木质纤维生物质中生成的5碳糖和6碳糖都可被有效地用于微生物发酵工程中,因此可较大地较少原料物质费用。因此,根据本发明的生物燃料物质及生物化学物质的制备方法,制备中所需的原料物质及能源费用可被较大地较少。此外,由于将醇发酵工程中产生的废物再利用并使用6碳糖和5碳糖,因此可同时获得环境保护和节省资源的效果。本发明提供一种可有效地利用木质纤维生物质,并且不仅可节约工程过程中所需的能源,还能节约废水处理费用、附加营养素所需费用等的生物燃料物质及生物化学物质的制备方法。附图说明图1是示出根据本发明的一个实施例的生物燃料物质及生物化学物质制备方法的流程图。图2是比较丙酮丁醇梭菌ATCC824(ClostridiumacetobutylicumATCC824)菌株丁醇生产量的图。图3是比较丙酮丁醇梭菌ATCC824(ClostridiumacetobutylicumATCC824)菌株丁醇生产量的图。图4是比较丙酮丁醇梭菌ATCC824(ClostridiumacetobutylicumATCC824)菌株丁醇生产量的图。图5是比较拜氏梭菌NCIMB8052(ClostridiumbeijerinckiiNCIMB8052)菌株丁醇生产量的图。图6是比较酿酒酵母ATCC2601(SaccharomycescerevisiaeATCC2601)菌株乙醇生产量的图。图7是比较酪丁酸梭菌ATCC25755(ClostridiumtyrobutyricumATCC25755)菌株丁酸生产量的图。图8是比较嗜酸乳杆菌NCFM(LactobacillusacidophilusNCFM)乳酸生产量的图。图9是比较丁二酸放线杆菌ATCC55618(ActinobacillussuccinogenesATCC55618)菌株丁二酸生产量的图。图10是比较E.coli菌株3-羟基丙酸生产量的图。图11是示出根据本发明的一个实施例的生物燃料物质及生物化学物质制备方法的流程图。图12是比较拜氏梭菌ATCC35702菌株丁醇生产量的图。图13是比较酪丁酸梭菌ATCC25755菌株丁酸生产量的图。具体实施方式虽然用于将微生物发酵工程中产生的副产物再利用的研究正在进行中,但只是涉及将以副产物产生的物质中的一部分成分选择性地分离来重新使用的方法,且,至今为止,还没有关于将在醇生产工程中产生的发酵废物本身作为用于微生物培养的培养基来使用的生物燃料物质及生物化学物质的制备方法。以下参照附图对本发明进行详细说明。根据本发明的一个实施例的生物燃料物质的制备方法,包括以下步骤:准备培养基,所述培养基包含在醇生产工程中所产生的发酵废物;将第1微生物接种于所述培养基中;以及培养接种有所述第1微生物的培养基。根据本发明的另一个实施例的生物化学物质的制备方法,包括以下步骤:准备培养基,所述培养基包含在醇生产工程中所产生的发酵废物;将第2微生物接种于所述培养基中;以及培养接种有所述第2微生物的培养基。图1是示出根据本发明的一个实施例的生物燃料物质及生物化学物质制备方法的流程图。在乙醇发酵器中通过微生物发酵获得发酵液。虽然多种微生物具有生产乙醇的能力,但当前主要在产业中使用的微生物为酿酒酵母,其是酵母中的一种。在乙醇发酵中可使用多种碳源。通过生物质预处理,将可生成乙醇的微生物接种至含有生产的碳源的培养基中之后,执行分批培养、流加式培养、和连续培养的发酵工程。将获得的发酵液送至蒸馏塔中,在蒸馏塔中蒸馏乙醇,并将乙醇回收至乙醇储存槽中。通过将培养基的温度上升至80℃-90℃,来蒸馏具有约95%纯度的乙醇,从而进行一次回收。为了生产更高纯度的乙醇,需要附加的脱水工程。在一般的乙醇发酵工程中二氧化碳气体以副产物产生,可将其捕集/压缩来用于饮料或其他工业。将乙醇回收至乙醇储存槽后会产生剩余的发酵废物。在80℃-90℃的高温的乙醇蒸馏工程中,死灭的微生物、没有被加水分解的固态的残留碳水化合物、以及没有发酵的糖以发酵废物产生。所述发酵废物包括在醇生产工程中将可生产醇的微生物接种至含有碳源的培养基中后通过发酵工程生产醇时所产生的发酵废物。为了作为用于农业或林业作物的肥料来使用,所述发酵废物可直接撒在耕作物上或作为家畜饲料来使用。但是,当将发酵废物直接撒在耕作物上时,具有土壤和水质污染的危险性,而作为饲料来使用时,由于需要将发酵废物重新在高温中去除水分来回收被浓缩的残留固体物质,因此用于去除水分的巨大的能源费用被消耗。由于蒸馏过程后产生发酵废物中充分存在微生物培养基所需要的营养成分,将其直接作为培养基来使用时,可较大地节省通常在培养基准备阶段中所必需添加至培养基中的营养成分的费用。由于能够将发酵废物中存在的残留糖作为碳源来使用,同样可节省微生物培养所需的碳源的费用。此外,在高温的蒸馏过程中,由于微生物被消毒,将所述的发酵废物直接作为培养基来使用时,由于高温中的培养基不需要消毒过程,因此可节省培养基消毒过程中所消耗的巨大的能源费用。将所述发酵废物送至固体/液体分离装置中,只将固体成分被分离的液体发酵废物送至生物燃料物质及生物化学物质发酵器中,或是不送至固体/液体分离装置中,将包含所有固体和液体成分的发酵废物按原样送至生物燃料物质及生物化学物质发酵器中,作为本发明的生物燃料物质及生物化学物质的制备中的培养基来准备。可选择地,可将水、碳源、和营养成分等附加地加入生物燃料物质及生物化学物质发酵器中。作为碳源,可使用适用于葡萄糖或微生物培养的所有碳源。作为营养成分,包含添加至培养基后可促进微生物成长的所有物质。将可生成生物燃料物质及生物化学物质的微生物接种至所述培养基中。在可生成生物燃料物质的第1微生物及可生成生物化学物质的第2微生物中包含酵母、梭菌属(Clostridium)、大肠菌、芽孢杆菌属(Bacillus)、厌氧粘细菌(Anaeromyxobacter)、产碱杆菌属(Alcaligenes)、拟杆菌属(Bacteroides)、埃希氏菌属(Escherichia)、乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、毕赤酵母属(Pichia)、假单胞菌属(Pseudomonas)、罗尔斯顿菌属(Ralstonia)、红球菌属(Rhodococcus)、酵母菌属(Saccharomyces)、链霉菌属(Streptomyces)、栖热菌属(Thermus)、栖热袍菌属(Thermotoga)、嗜热菌(Thermoanaerobacter)、克雷伯菌属(Klebsiella)、链霉菌科(Streptomycetaceae)、放线菌科(Actinomycetaceae)、可啉杆菌(Colinebacterium)、发酵单胞菌属(Zymomonas)、放线杆菌属(Actinobacillus)、厌氧螺菌属(Anaerobiospirillum)、曼海姆菌(Mannheimia)等,并包含上述菌的野生型菌株、突然异变菌株及再组合菌株。将接种有所述微生物的培养基通过分批培养、流加式培养、和连续培养等方法来培养。在通过微生物培养来生成生物燃料物质及生物化学物质之后,将生成的生物燃料物质及生物化学物质分离及精炼从而进行回收。生物燃料物质不仅其生物燃料本身可被使用,生物燃料物质中添加的添加剂也可被使用,且生物燃料物质中包含生物气体、醇、烷烃类化合物、和烯烃类化合物等。生物气体包含甲烷和氢;醇包含从由乙醇、丙醇、丁醇、戊醇、己醛等。生物化学物质作为在化学物质制造过程中的原料物质或以原料物质中添加的添加剂来使用的物质,包含通过微生物培养可生产的氨基酸、有机酸、酵素、生物降解高分子、醇等。氨基酸包含甲硫氨酸和苏氨酸;有机酸包含从由乳酸、丁酸、丁二酸、和羟基丙酸等;生物降解高分子包含生物聚酯。根据本发明的一个实施例,将从木质纤维生物质提取的糖的主要构成成分5碳糖和6碳糖经联合发酵工程来有效地制备生物燃料物质及生物化学物质。图11是示出根据本发明的一个实施例的生物燃料物质及生物化学物质制备方法的流程图。参照图11,将木质纤维生物质通过物理化学性方法预处理后,利用酵素来加水分解,从而获得5碳糖和6碳糖的混合糖化液。通过乙醇发酵消耗6碳糖,并将其分离精炼从而获得乙醇。发酵后通过蒸馏清除乙醇并使用含有剩余的5碳糖的发酵废物来制备生物燃料物质及生物化学物质。作为可灵活使用5碳糖的工程有丁醇发酵工程、丁酸或丁二酸发酵工程等,在该工程中可添加5碳糖来提供碳源和营养成分。由于一般商用的乙醇酵母不能将5碳糖作为碳源来使用,或是使用能力较低,因此,为了使用剩余的5碳糖,需要基因制造的附加的菌株开发。同时,在可消耗5碳糖的生物燃料物质生产菌株或生物化学物质生产菌株大部分为6碳糖和5碳糖同时存在的情况下,在全部消耗6碳糖之前不消耗5碳糖,或是以单一碳源只存在5碳糖时,由于在混合的糖化液中以明显的速度消耗5碳糖,因此在同时产生5碳糖和6碳糖的木质纤维生物质糖化液的使用中具有一定的困难。本发明通过如上所述的连锁工程连续地消耗6碳糖和5碳糖,从而有效地灵活使用木质纤维生物质,且不仅可节约工程过程中所消耗的能源,还可节约添加营养源所需的费用等。以下,通过实施例对本发明进行更详细的说明。实施例作为用于具体说明本发明,本发明的范围并不受实施例所限制。实施例发酵废物回收及成分分析从韩国CHANGHAE乙醇股份公司的商业用乙醇生产工厂获得发酵废物,该公司生产产业性规模的乙醇。韩国CHANGHAE乙醇股份公司在乙醇生产菌株酿酒酵母中培养菌株来生产约100g/L的乙醇后,将所述发酵培养液在80℃-90℃中一次蒸馏,从而获得具有95%以上纯度的商业用乙醇来进行销售。在所述商业用乙醇生产工厂中,乙醇被蒸馏及产生后,将含有固体成分的发酵废物本身回收来用于以下的实施例。将发酵废物在4℃,12,000rpm中10分钟离心分离后,使用气相色谱法(GC)和液相色谱法(HPLC)来分析存在于上清液中的乙醇、乙酸、葡萄糖浓度。此外,在以下的实施例中,同样使用气相色谱法(GC)和液相色谱法(HPLC)来分析通过微生物培养来生产的乙醇、丁醇、丁酸、乳酸的浓度。同时,固体成分中存在的淀粉,是将100mL的5%HCl添加至50mL的试料中,在95℃下进行2.5小时的酸糖化后冷却来形成的。所述的酸糖化液以28%NaOH中和后,将其通过液相色谱法(HPLC)来分析,从而测定出发酵废物中存在的总糖量。蛋白质浓度是使用从阿德里奇化学(Sigma-Aldrich)公司购买的全蛋白试剂装(TotalProteinKit,Cat.No.TP0200)来进行了分析。通过上述分析方法分析了韩国CHANGHAE乙醇股份公司工厂中回收的发酵废物,其特性在表1中被显示出。表1成分浓度乙醇0.0g/L乙酸2.1g/L蛋白质2.0mg/mL液相中的糖4.0g/L整个糖(含有的固体成分)6.8g/L利用包含发酵废物的培养基的生物燃料物质的生产(1)利用丙酮丁醇梭菌菌株的生物丁醇的生产A.通过直接利用发酵废物的生物丁醇的生产将从韩国CHANGHAE乙醇股份公司的商业用乙醇生产工厂回收的发酵废物作为培养基使用,并将只包含清除固体成分的发酵废物的培养基和包含不清除固体成分的发酵废物的培养基各自作为用于丁醇生产的培养基来进行了使用。将丙酮丁醇梭菌ATCC824(ClostridiumacetobutylicumATCC824)菌株在6.6L生物反应器中进行了分批培养。为了掌握用于发酵废物的丁醇生产的培养基的特性,将一般在梭菌菌株培养中使用的梭菌培养基作为控制(Control)培养基来进行了使用。此外,将梭菌培养基与发酵废物以50:50的容积比例混合制备的培养基作为用于丁醇生产的培养基来进行了使用。丙酮丁醇梭菌ATCC824菌株培养是将200mL的培养液接种于生物反应器中来进行的。其中,生物反应器中各自包括:从韩国CHANGHAE乙醇股份公司的商业用乙醇工厂回收的2.0L发酵废物中包含清除固体成分的发酵废物的培养基;包含不清除固体成分的发酵废物的培养基;梭菌培养基;梭菌培养基与发酵废物以50:50的容积比例混合制备的培养基。培养条件为:葡萄糖初期浓度为40g/L;初期pH为6.0;培养温度为37℃;以及搅拌速度为150rpm。此外,培养中为了维持厌氧状态,将氮气以50mL/min的流速来连续供应,且培养中使用28%(w/v)氨溶液,从而pH调整为5.0以上。在将发酵废物作为培养基来使用时;在使用菌株培养基时;在使用梭菌培养基与发酵废物以50:50容积比例混合制备的培养基时,丙酮丁醇梭菌ATCC824菌株都在70小时的培养后将添加至培养基中的40g/L葡萄糖完全消耗了。图2是比较丙酮丁醇梭菌ATCC824(ClostridiumacetobutylicumATCC824)菌株丁醇生产量的图。参照图2,作为乙醇生产工程中所产生的发酵废物且只包含清除固体成分的发酵废物的培养基A和作为乙醇生产工程中所产生的发酵废物且包含不清除固体成分的发酵废物本身的培养基B中的丙酮丁醇梭菌ATCC824菌株的丁醇生产量为9.2±1.7g/L,且作为对照培养基使用的梭菌培养C中生成5.5±0.6g/L的丁醇。图3是比较丙酮丁醇梭菌ATCC824(ClostridiumacetobutylicumATCC824)菌株丁醇生产量的图。参照图3,梭菌培养基与发酵废物以50:50容积比例混合制备的培养基A生成7.4±0.7g/L的丁醇,且作为对照培养基使用的梭菌培养基B生成5.5±0.6g/L的丁醇,由此,比较A和B可确认培养基A的丁醇生产量更优秀。根据上述结果,发酵废物与现有的丁醇生产中通常被广泛使用的梭菌培养基相比较时,可确认丁醇的生产被提高了67%。B.利用发酵废物的自体溶解(Autolysis)处理的生物丁醇的生产将通过从韩国CHANGHAE乙醇股份公司的商业用乙醇生产工厂回收的发酵废物的自体溶解(Autolysis)过程所生成的自溶产物(Autolysate)作为用于丁醇生产的培养基进行了使用。自体溶解是将乙醇发酵废物在50℃中通过24小时分批反应来进行的。将丙酮丁醇梭菌ATCC824(ClostridiumacetobutylicumATCC824)菌株在6.6L生物反应器中进行了分批培养。为了掌握用于发酵废物的丁醇生产的培养基的特性,将一般在梭菌菌株培养中使用的梭菌培养基作为对照(Control)培养基来进行了使用。丙酮丁醇梭菌ATCC824菌株培养是将200mL的培养液接种于生物反应器中来进行的。其中,生物反应器中各自包括:将从韩国CHANGHAE乙醇股份公司的商业用乙醇工厂回收的发酵废物的自体溶解物在4℃,12,000rpm中离心分离后含有1.0L上清液的培养基;和梭菌培养基。培养条件为:葡萄糖初期浓度为40g/L;初期pH为6.0;培养温度为37℃;以及搅拌速度为150rpm。此外,培养中为了维持厌氧状态,将氮气以50mL/min的流速来连续供应,且培养中使用28%(w/v)氨溶液,从而pH调整为5.0以上。在将发酵废物的自溶产物作为培养基来使用时;在使用梭菌培养基时,丙酮丁醇梭菌ATCC824菌株都在72小时的培养后将添加至培养基中的60g/L葡萄糖完全消耗了。图4是比较丙酮丁醇梭菌ATCC824(ClostridiumacetobutylicumATCC824)菌株丁醇生产量的图。参照图4,将乙醇发酵废液的自溶产物作为培养基梭菌培养基A来使用时生成8.9±0.3g/L的丁醇,且作为对照培养基使用的梭菌培养基B生成9.0±0.1g/L的丁醇,由此,比较A和B可确认丁醇生产量为同等水平。根据上述结果,可得知直接使用发酵废物或进行自体溶解(autolysis)处理来使用也可以。(2)利用拜氏梭菌菌株的生物丁醇的生产。将从韩国CHANGHAE乙醇股份公司的商业用乙醇生产工厂回收的发酵废物中清除固体成分的发酵废物作为培养基,来将拜氏梭菌NCIMB8052(ClostridiumbeijerinckiiNCIMB8052)菌株在6.6L生物反应器中进行了分批培养。为了掌握通过发酵废物的微生物培养的用于丁醇生产的培养基的特性,将一般在梭菌菌株培养中使用的梭菌培养基作为对照培养基来进行了使用。拜氏梭菌NCIMB8052菌株培养是将200mL的培养液接种于生物反应器中来进行的。其中,生物反应器中各自包括:从韩国CHANGHAE乙醇股份公司的商业用乙醇工厂回收的2.0L发酵废物中只含有清除固体成分的发酵废物的培养基;和梭菌培养基。培养条件为:葡萄糖初期浓度为60g/L;初期pH为6.0;培养温度为37℃;以及搅拌速度为150rpm。此外,培养中为了维持厌氧状态,将氮气以50mL/min的流速来连续供应,且培养中使用28%(w/v)氨溶液,从而pH调整为5.0以上。24小时培养后,在使用含有清除固体成分的发酵废物的培养基时,葡萄糖消耗量为20g/L,且在使用梭菌培养基时,葡萄糖消耗量为30g/L。图5是比较拜氏梭菌NCIMB8052(ClostridiumbeijerinckiiNCIMB8052)菌株丁醇生产量的图。参照图5,在使用乙醇生产工程中所产生的发酵废物中含有清除固体成分的发酵废物的培养基A时,丁醇生产量为9.2±0.7g/L,且使用梭菌培养基B时,丁醇生产量为9.8±1.0g/L。(3)生物乙醇的生产虽然将从韩国CHANGHAE乙醇股份公司的商业用乙醇生产工厂回收的发酵废物作为培养基进行了使用,但将只包含清除固体成分的发酵废物的培养基和只包含不清除固体成分的发酵废物的培养基来作为用于乙醇生产的培养基各自使用,并将酿酒酵母ATCC2601(SaccharomycescerevisiaeATCC2601)菌株在250mL烧瓶中进行了培养。为了掌握用于乙醇生产的培养基的特性,将一般在乙醇发酵中以培养基被使用的酵母提取物(YeastMold)培养基(YMBroth,Difco,Cat.No.271120)作为对照培养基来进行了使用。酵母提取物(YeastMold)的组成在表2中被显示出。表2成分含量(g/L)酵母提取物2.1麦芽提取物2.0蛋白胨4.0葡萄糖6.8酿酒酵母ATCC2601菌株培养是将3mL的培养液接种于烧瓶中来进行的。其中,烧瓶中各自包括:从韩国CHANGHAE乙醇股份公司的商业用乙醇工厂回收的发酵废物100mL中只含有清除固体成分的发酵废物的培养基;只含有不清除固体成分的发酵废物的培养基;和YM培养基。作为碳源,将葡萄糖的初期浓度调定为40g/L。此外,将初期培养基的pH调整为5。培养是在可调节温度的振荡培养箱(Shakingincubator)中实施的,培养温度为30℃,搅拌速度调整为200rpm。在将发酵废物作为培养基来使用时;以及在使用YM培养基时,酿酒酵母ATCC2601菌株都在24小时的培养后将添加至培养基中的40g/L葡萄糖完全消耗了。图6是比较酿酒酵母ATCC2601(SaccharomycescerevisiaeATCC2601)菌株乙醇生产量的图。参照图6,作为在乙醇生产工程中所产生的发酵废物,含有清除固体成分的发酵废物的培养基A和含有不清除固体成分的发酵废物的培养基B中的乙醇生产量为20.5±0.3g/L和23.5±1.3g/L。同时,在乙醇生产中被一般使用的YM培养基C中的乙醇生产量为17.7±0.7g/L。由此,与现有乙醇生产中被使用的YM培养基相比,可确认在使用根据本发明的制备方法的培养基时,乙醇生产被提高了15%。利用含有发酵废物的培养基的生物化学物质的生产(1)丁酸的生产将从韩国CHANGHAE乙醇股份公司的商业用乙醇生产工厂回收的发酵废物作为培养基使用,并将只包含清除固体成分的发酵废物的培养基和包含不清除固体成分的发酵废物的培养基各自作为用于丁醇生产的培养基来进行了使用。将酪丁酸梭菌ATCC25755(ClostridiumtyrobutyricumATCC25755)菌株在6.6L生物反应器中进行了分批培养。为了掌握通过发酵废物的微生物培养的用于丁酸生产的培养基的特性,将一般在梭菌菌株培养中使用的梭菌培养基作为对照培养基来进行了使用。酪丁酸梭菌ATCC25755菌株培养是将200mL的培养液接种于生物反应器中来进行的。其中,生物反应器中各自包括:从韩国CHANGHAE乙醇股份公司的商业用乙醇工厂回收的发酵废物2.0L中含有清除固体成分的发酵废物的培养基;和梭菌培养基。培养条件为:葡萄糖初期浓度为40g/L;培养温度为37℃;以及搅拌速度为150rpm。此外,培养中为了维持厌氧状态,将氮气以50mL/min的流速来连续供应,且培养中使用28%(w/v)氨溶液,从而pH调整为5.0以上。在使用含有清除固体成分的发酵废物的培养基和使用梭菌培养基时,酪丁酸梭菌ATCC25755菌株都在22小时的培养后将添加至培养基中的葡萄糖完全消耗了。图7是比较酪丁酸梭菌ATCC25755(ClostridiumtyrobutyricumATCC25755)菌株丁酸生产量的图。参照图7,作为在乙醇生产工程中所产生的发酵废物,在含有清除固体成分的发酵废物的培养基A中,丁酸的生产量为19.0±0.5g/L,且在梭菌培养基B中,乙醇生产量为14.5±0.2g/L。由此,发酵废物在与现有丁酸生产中一般被使用的梭菌培养基比较时,可确认丁酸生产被提高了31%。(2)乳酸的生产从韩国CHANGHAE乙醇股份公司的商业用乙醇生产工厂回收的发酵废物中使用包含不清除固体成分的发酵废物的培养基和包含清除固体成分的发酵废物的培养基,来将嗜酸乳杆菌NCFM(LactobacillusacidophilusNCFM)菌株接种于含有1.5L培养液的2.5L的发酵器中从而进行了分批培养。为了掌握通过发酵废物的微生物培养的用于乳酸生产的培养基的特性,将一般在乳杆菌培养中使用的MRS培养基(MRSBroth,Difco,Cat.No.288130)作为对照培养基来进行了使用。MRS培养基的组成在表3中被显示出。表3乳酸生产培养是将60mL的嗜酸乳杆菌培养液接种于1.5L培养基中来进行的。初期葡萄糖浓度调整为50g/L,在培养温度37℃、搅拌速度200rpm中进行了培养。此外,来了乳酸的生产,利用10MNaOH将pH调整为6.5。与嗜酸乳杆菌菌株相似,乳酸生产菌株作为兼生性厌氧性菌不需要附加的厌氧条件。在24小时培养后,嗜酸乳杆菌NCFM菌株在包含不清除固体成分的发酵废物的培养基A、包含清除固体成分的发酵废物的培养基B、和MRS培养基C中完全将初期葡萄糖消耗了。图8是比较嗜酸乳杆菌NCFM(LactobacillusacidophilusNCFM)乳酸生产量的图。参照图8,作为在乙醇生产工程中所产生的发酵废物,在包含不清除固体成分的发酵废物的培养基A中,乳酸的生产量为48.2±0.4g/L,在包含清除固体成分的发酵废物的培养基B中,乳酸的生产量为41.2±0.9g/L,且在MRS培养基C中,乳酸的生产量为47.2±0.5g/L。参照图8可确认,在将乙醇工程中产生的发酵废物作为乳酸发酵培养基来使用时,与固体成分的清除无关,都可代替作为乳酸培养基。特别是,在培养生产乳酸的嗜酸乳杆菌菌株的情况下,在包含不清除固体成分的发酵废物的培养基条件下,从发酵废物乳酸生产量更为优秀。(3)丁二酸的生产从韩国CHANGHAE乙醇股份公司的商业用乙醇生产工厂回收的发酵废物中使用包含清除固体成分的发酵废物的培养基,来将丁二酸放线杆菌ATCC55618(ActinobacillussuccinogenesATCC55618)菌株在500mL烧瓶中进行培养,从而试图生产了丁二酸。为了掌握通过发酵废物的微生物培养的用于丁二酸生产的培养基的特性,将表4中的培养基作为对照培养基来进行了使用。表4成分含量(g/L)酵母提取物5.0NaHCO310.0NaH2PO4·H2O8.5K2HPO415.5葡萄糖18.0丁二酸放线杆菌ATCC55618菌株培养是在从韩国CHANGHAE乙醇股份公司的商业用乙醇工厂回收的发酵废物中将固体成分清除,添加表4中的对照培养基中除了酵母提取物(YeastExtract)以外的成分来进行的。将10mL的试管培养液接种于各自包含200mL的培养基的烧瓶中,在48小时39℃中进行烧瓶培养后,接种至含有2L培养液的6.5L发酵剂中。作为碳源,将18g/L的葡萄糖添加至培养基中。此外,使用28%氨溶液来将发酵机的pH调整至7.0。发酵中,将99.999%的二氧化碳CO2以0.05vvm持续净化(Purge),并保持培养温度为39℃。在40小时的培养后,丁二酸放线杆菌ATCC55618菌株培养将被添加的18g/L的葡萄糖完全消耗了。图9是比较丁二酸放线杆菌ATCC55618(ActinobacillussuccinogenesATCC55618)菌株丁二酸生产量的图。参照图9,在包含乙醇生产工程中所产生的发酵废物的培养基A中,丁二酸的生产量为10.7±0.8g/L,同时,在对照培养基B中,丁二酸的生产量为10.1±0.8g/L。由此,与在丁二酸生产中使用的对照培养基相比,可确认在使用根据本发明的制备方法的培养基时丁二酸生产为同等以上。(4)3-羟基丙酸(3-HydroxypropionicAcid)的生产从韩国CHANGHAE乙醇股份公司的商业用乙醇生产工厂回收的发酵废物中使用包含清除固体成分的发酵废物的培养基,来将为生产3-羟基丙酸菌株而开发的再组合E.coliBL21_pCDFDuet_dhaB_gdrAB_EcoRI_AflII#15__pQE80L_Kp_aldH_BamHI_HindIII#2菌株在250mL烧瓶中培养50mL,从而试图生产了3-羟基丙酸。为了掌握通过从乙醇生产工厂回收的发酵废物的微生物培养的用于3-羟基丙酸生产的培养基的特性,将表5中的成分附加至为3-羟基丙酸生产而制备的M9盐(M9Salt)中的培养基作为控制基来进行了使用。作为碳源,使用了50mM丙三醇来进行了培养。表5成分浓度IPTG0.1mM酵母提取物0.2g/L酵素B1220μM丙三醇50mM更详细地,E.coli菌株培养是使用从韩国CHANGHAE乙醇股份公司的商业用乙醇生产工厂回收的发酵废物的清除固体成分的5%液相来代替对照培养中作为氮源使用的酵母提取物(yeastextract),在添加的培养基和对照培养基中各自进行的。在各自包含上述的50mL培养基的烧瓶中接种5mL试管培养液,在30小时37℃下,以200rpm进行搅拌从而实施了培养。图10是比较E.coli菌株3-羟基丙酸生产量的图。参照图10,在包含乙醇生产工程中所产生的发酵废物的培养基中的3-羟基丙酸生产量A为8.4±0.7g/L,且在对照培养基的3-羟基丙酸生产量B中为8.6±0.0g/L。根据上述结果,与3-羟基丙酸生产中使用的对照培养基相比,可确认在3-羟基丙酸生产中,通过本发明而开发的培养基具有同等的水准。木质纤维生物质的预处理和乙醇发酵木质纤维生物质是使用了农村振兴厅国家食物科学院所提供的大麦稿秆。所述大麦稿秆由37.2%纤维素(cellulose),22.4%半纤维素(hemicelluloses),19.3%木质素,1.7%灰分(ash)所组成。大麦稿秆的组成在表6中被显示出。表6成分%纤维素(葡萄糖)37.2半纤维素(木糖)22.4木质素19.3水分(Water)7.9灰分(Ash)1.7其他11.5利用破碎机和粉碎机来将被粉碎成1mm以下的10%(w/v)大麦稿秆沉浸于15%(v/v)氨溶液中之后,在150℃中使其反应60分钟。预处理的大麦稿秆的组成为54.8%纤维素(cellulose),21.9%半纤维素(hemicelluloses),12.7%木质素。被预处理的大麦稿秆250g中将0.1M柠檬酸钠缓冲液(Sodiumcitratebuffersolution)1000mL和蒸馏水1000mL混合后,为糖化添加符复合纤维素酶(Novozyme,NS50015)30FPU/g和β-葡糖苷酶30CBU/g,使其在振荡培养器中以45℃,150rpm糖化72小时。糖化结束后,糖化液含有54.9g/L葡萄糖(glucose)、25.1g/L木糖(xylose),将预处理糖化液直接作为乙醇发酵培养基来进行了使用。将上述组成的糖化液添加至YPD培养基中,其中YPD培养基为:10g/L酵母提取物(yeastextract)、20g/L蛋白酶蛋白胨(proteasepeptone)、和10g/L右旋糖(dextrose),将通过32℃,120rpm的振荡培养器12小时培养的酿酒酵母(Saccharomycescerevisiae)CHY1011菌株培养液5%(v/v)接种,在32℃,150rpm的振荡培养器中发酵24小时。发酵结束后,生成了20.7g/L的乙醇,且剩余糖分的组成为0g/L葡萄糖、20.1g/L木糖。将乙醇发酵液在89℃中减压蒸馏来分离乙醇,且将剩余的发酵废物作为生物燃料物质或生物化学物质生产的培养基来使用。利用乙醇发酵后的发酵废物的生物丁醇的生产将木质纤维生物质大麦稿秆乙醇发酵并减压蒸馏后,将剩余的发酵废物直接作为用于丁醇发酵的培养基来使用,或是在12,000rpm中15分钟离心分离来使用。将发酵废物在4℃,12,000rpm中10分钟离心分离后,使用气相色谱法(GC)和液相色谱法(HPLC)来分析了存在于上清液中的乙醇、乙酸、葡萄糖浓度。此外,在一以下实施例中通过微生物培养,同样是用来气相色谱法(GC)和液相色谱法(HPLC)来分析了生产的乙醇、丁醇、丁酸、乳酸的浓度。总蛋白质浓度是使用从阿德里奇化学(Sigma-Aldrich)公司购买的全蛋白试剂装(TotalProteinKit)(SigmaTP200,Micro-Lowry,Onishi&BarrModification)来进行了分析。α-氨基氮(aminonitrogen)是通过USPXXI程序(USPXXIProcedure)(1985)方法来进行了分析。通过上述方法来分析的乙醇发酵废物的特性在表7中被显示出。表7pH3.7葡萄糖含量(g/L)0木糖含量(g/L)17乙醇含量(g/L)0总蛋白质(mg/mL)1.3α-氨基氮(mg/mL)0.16在将乙醇发酵废物作为培养基使用的丁醇发酵中使用了拜氏梭菌ATCC35702(ClostridiumbeijerinckiiATCC35702)菌株。在250mL烧瓶中放入50mL的乙醇发酵废物并接种2mL的拜氏梭菌ATCC35702菌株培养液,在厌氧室(N290%,CO25%,H25%)中37℃下进行了60小时的放置培养。作为培养基,使用了含有作为碳源具有与糖化液相同浓度的木糖(xylose)的梭菌培养基,梭菌培养基的组成在表8中被显示出。表8成分组成(g/L)KH2PO40.75K2HPO40.75MgSO4·H2O0.4MnSO4H2O0.01FeSO4·7H2O0.01NaCl1.0氨羰丙氨酸2.0酵母提取物5.0(NH4)2SO42.0在使用含有5碳糖的乙醇发酵废物的培养基和梭菌培养基时,拜氏梭菌ATCC35702菌株全都在60小时培养内将17g/L木糖(Xylose)完全消耗。图12是比较拜氏梭菌ATCC35702菌株丁醇生产量的图。参照图12,在使用乙醇生产工程中所产生的含有5碳糖的发酵废物的培养基A时,丁醇生产量为4.7±0.2g/L,且在使用梭菌培养基B时,丁醇生产量为3.3±0.5g/L。根据上述结果,与在丁醇生产中使用的对照培养基进行比较,可确认在使用根据本发明的制备方法的培养基时,丁醇生产被提高了42%以上。利用乙醇发酵后的发酵废物的丁酸的生产通过如上所述的方法准备乙醇发酵废物来用于丁酸培养。并使用液相色谱法(HPLC)来分析了木糖(xylose)的浓度和所生产的丁酸的浓度。为了生产丁酸使用了酪丁酸梭菌ATCC25755(ClostridiumtyrobutyricumATCC25755)菌株。在250mL烧瓶中放入50mL的乙醇发酵废物并在接种2mL酪丁酸梭菌ATCC25755菌株培养液之后,在厌氧室(N290%,CO25%,H25%)中37℃下进行了60小时的放置培养。作为培养基,使用了含有作为碳源具有与糖化液相同浓度的木糖的梭菌培养基,培养中使用28%氨溶液pH维持在pH6以上。在使用含有5碳糖的乙醇发酵废物的培养基和梭菌培养基时,酪丁酸梭菌ATCC25755菌株全都在80小时培养内将17g/L木糖(Xylose)完全消耗。图13是比较酪丁酸梭菌ATCC25755菌株丁酸生产量的图。参照图13,在使用包含乙醇生产工程中所产生的5碳糖的发酵废物的培养基A时,丁酸生产量为7.3±0.3g/L,且在使用梭菌培养基B时,丁酸生产量为7.0±0.1g/L。根据上述结果,与在丁酸生产中使用的对照培养基进行比较,可确认在使用根据本发明的一个实施例的培养基时,丁酸生产被提高了。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1