细辛醚或含有细辛醚的物质在制备促进神经干细胞增殖药物中的用途的制作方法
本发明属于药物研发领域,尤其涉及细辛醚或含有细辛醚的物质在制备促进神经干细胞增殖药物中的用途。
背景技术:
在哺乳动物大脑中,神经干细胞(neural progenitor cells,NPC)的增殖和自我更新持续于整个生命过程,是神经再生(neurogenesis)的重要环节。在衰老、长期压力以及神经系统疾病,比如阿尔兹海默症(Alzheimer’s disease,AD)发生的情况下,神经干细胞的增殖和自我更新能力下降,导致认知功能受损。促进神经再生被认为是抵抗衰老和衰老相关神经退行性疾病的潜在治疗手段。因此,一种可能的方案是移植胚胎神经干细胞或者体外诱导的神经干细胞来进行细胞替换疗法。但是,这种新创的复杂技术目前还存在一定争议,尤其是它们的安全性问题和细胞来源等问题。另一种方案是用药理学手段来激活内源的神经干细胞,以达到治疗神经退行性疾病的目的。药理学手段操作简便,并且可以特异性靶向神经干细胞的特定功能,因此,激活内源神经干细胞不仅是一种可行的治疗手段,还能作为预防手段。
神经干细胞的增殖受到许多细胞外信号和细胞内信号通路的调控。在生长因子、神经营养因子或其他形态建成因子的刺激下,细胞内关键的信号通路,如ERK和Akt级联反应被激活。研究表明,调控这些信号通路的化合物能够促进神经干细胞增殖和自我更新。近年来的研究发现,一些中草药来源的天然产物促进神经干细胞的增殖,揭示了这些中药益智作用的可能机制。中药石菖蒲(AT)来源于植物石菖蒲(Acori tatarinowii)的根,主治老年痴呆、健忘、中风等大脑疾病,在中药复方中作为“君”药被沿用至今。现代药理学研究表明,石菖蒲具有神经保护功能,改善衰老、健忘和脑缺血模型动物的学习记忆能力。但是,石菖蒲是否以及如何影响神经干细胞的增殖和自我更新还不知道。
技术实现要素:
为了克服现有技术中的缺陷,本发明提供了细辛醚或含有细辛醚的物质在制备促进神经干细胞增殖药物中的用途。
本发明是通过以下技术方案实现的:
本发明的第一方面,提供了细辛醚或含有细辛醚的物质在制备促进神经干细胞增殖药物中的用途。
优选的,所述细辛醚选自α-细辛醚、β-细辛醚、γ-细辛醚中任意一种或多种的组合。
优选的,所述细辛醚为促进神经干细胞增殖药物的药效成分之一或唯一药效成分。
进一步的,所述的细辛醚可以通过市购途径获得,也可以从含有细辛醚的物质中提取获得。
优选的,所述含有细辛醚的物质为石菖蒲或石菖蒲有效成分提取物。
进一步的,所述的石菖蒲来源于植物石菖蒲(Acori tatarinowii)的根。所述的石菖蒲可以通过市购途径获得。
本技术领域的技术人员可采用各种常规方式直接将石菖蒲或石菖蒲有效成分提取物作为用于促进神经干细胞增殖的药物或者生产该类药物的原料。
进一步的,所述石菖蒲有效成分提取物可采用下列方法制得:将石菖蒲干燥根部用乙醇回流提取,得到的提取物合并后蒸发浓缩获得石菖蒲有效成分提取物。
优选的,所述乙醇为60%乙醇。所述回流提取具体为回流提取3次,每次2h。
优选的,石菖蒲或石菖蒲有效成分提取物为所述促进神经干细胞增殖药物的药效成分之一或唯一药效成分。
优选的,所述促进神经干细胞增殖药物为对抗衰老和神经退行性疾病的药物。
本发明的第三方面,提供了一种用于促进神经干细胞增殖的药物制剂,其主要药效成分为细辛醚、石菖蒲、或石菖蒲有效成分提取物。
进一步的,本发明的用于促进神经干细胞增殖的药物制剂还包括一种或多种常规的药学上可接受的辅料。主药药效成分与药学上可接受辅料的总重量比例可为1∶0.1~10。
药学上可接受的辅料包括(但并不限于):药物可接受的载体、稀释剂、填充剂、结合剂及其它赋形剂。本领域枝术人员已知的治疗惰性的无机或有机的载体包括(但不限于)乳糖、玉米淀粉或其衍生物、滑石、植物油、蜡、脂肪、多羚基化合物例如聚乙二醇、水、蔗糖、乙醇、甘油,诸如此类,各种防腐剂、润滑剂、分散剂、矫味剂。保湿剂、抗氧化剂、甜味剂、着色剂、稳定剂、盐、缓冲液诸如此类也可加入其中,这些物质根据需要用于帮助配方的稳定性或有助于提高活性或它的生物有效性或在口服的情况下产生可接受的口感或气味。
本发明的药物制剂可以为口服制剂,如胶囊、片剂、分散片、口含片、咀嚼片、泡腾 片、缓释片、颗粒剂等。
本发明的药物制剂可采用常规方法制备,如将各有效成分混匀,或者根据各种制剂的常规制法,将药效成分与相应辅料混配后制备获得。本发明的药物制剂还可与其他治疗剂一起使用。
本发明的药物制剂可用于促进神经干细胞增殖。优选的,本发明的药物制剂可用于对抗衰老和神经退行性疾病。
本发明的药物制剂的有效治疗剂量应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
本发明的有益效果在于:
本发明首次发现,口服石菖蒲能够促进野生型小鼠、转基因AD模型小鼠以及年老小鼠的海马神经再生。在体外和体内实验中,石菖蒲及其活性成分细辛醚促进神经干细胞增殖。石菖蒲和细辛醚激活ERK级联反应而不影响Akt级联反应。本发明的研究表明,口服石菖蒲和细辛醚不仅能够预防,还能作为一种促进神经再生的治疗手段,来对抗衰老和神经退行性疾病相关的认知功能下降。
附图说明
图1:AT促进成年小鼠海马神经干细胞增殖和神经再生。(A)检测神经干细胞增殖的实验设计图示。(B,C)小鼠给药(B)对照溶剂(Ctrl)或(C)AT,方案如图(A)所示,对其海马DG区进行免疫荧光染色,检测BrdU(红色)和DAPI(蓝色)。标尺,100um。(D)BrdU+细胞的定量统计。每组N=5-6。(E,F)用免疫荧光的方法检测(E)对照溶剂(Ctrl)给药或(F)AT给药的小鼠DG区的GFAP(红色)、Nestin(绿色)和BrdU(灰色)。标尺,25um。(G)定量统计GFAP+Nestin+BrdU+细胞数。每组N=5-6。(H,I)对(H)对照溶剂(Ctrl)给药或(I)AT给药的小鼠DG区进行Tbr2(绿色)、BrdU(红色)和DAPI(蓝色)共染。标尺,100um。(J)定量统计Tbr2+BrdU+细胞数。每组N=5-6。(K,L)用免疫荧光的方法检测(K)对照溶剂(vehicle)给药或(L)AT给药的小鼠DG区的Ki67(红色)、Dcx(绿色)和DAPI(蓝色)。标尺,100um。(M)定量统计Dcx+Ki67-细胞数。每组N=5-6。(N)检测神经干细胞分化实验设计图示。(O,P)小鼠给药(O)对照溶剂(vehicle)或(P)AT,方案如图(N)所示,对其海马DG区进行免疫荧光染色,检测BrdU(红色) 和NeuN(绿色)。标尺,100um。(Q)BrdU+NeuN+细胞的定量统计。每组N=7。(R)BrdU+NeuN+细胞占BrdU+细胞的比例。每组N=7。右下方小图为高倍镜下拍摄,标尺为10um。定量结果表示为平均值±标准误;*P<0.05,**P<0.01,双尾t检验。
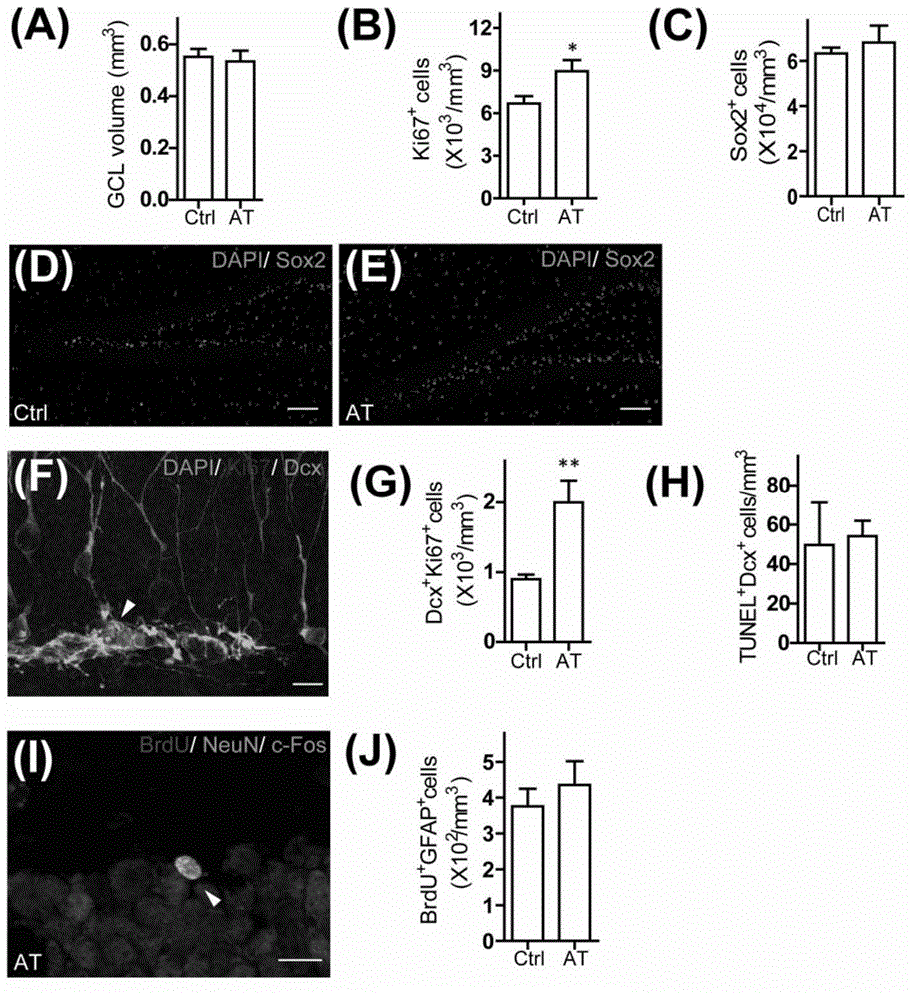
图2:AT对于成体海马神经再生的影响。(A)小鼠给药溶剂对照(Ctrl)或AT 28天,检测其大脑颗粒细胞层的体积。每组N=5-6。(B)定量统计Ki67+细胞数。每组N=5-6。(C-E)用免疫荧光的方法检测(D)对照溶剂(Ctrl)给药或(E)AT给药的小鼠DG区的Sox2(绿色)和DAPI(蓝色);并进行定量统计(C)。标尺,100um。每组N=3。(F-G)用免疫荧光的方法(F)检测小鼠DG区的Ki67(红色)、Dcx(绿色)和DAPI(蓝色);并定量统计Dcx+Ki67+细胞数。标尺,10um。(H)定量统计Dcx和TUNEL双阳性细胞。每组N=3。(I)在AT给药的小鼠海马DG区切片中共染c-Fos(蓝色)、BrdU(红色)和NeuN(绿色)。标尺,10um。(J)实验方案见图1N。小鼠DG区切片中共染GFAP、NeuN和BrdU,并定量统计GFAP+BrdU+细胞数。N=4-5每组。定量结果表示为平均值±标准误;*P<0.05,**P<0.01,双尾t检验。
图3:AT促进老年小鼠和转基因AD小鼠的海马神经再生。(A,B)18-23个月大的老年小鼠口服给药(A)溶剂对照(Ctrl)和(B)AT 28天,并在最初7天同时注射BrdU。实验方案见图1N。DG切片进行BrdU(红色)和NeuN(绿色)的染色。(C)定量统计BrdU+NeuN+细胞数。每组N=7。(D)BrdU+NeuN+在BrdU+细胞中的比例。每组N=7。(E-H)野生型(WT)和APP/PS1小鼠口服给药溶剂对照(Ctrl)和AT 17天,并在最后7天注射BrdU。对小鼠的DG切片进行BrdU(红色)和DAPI(蓝色)的染色。(I)定量统计BrdU+细胞数。每组N=6-8。(J-M)在溶剂对照(Ctrl)和AT给药的野生型和APP/PS1小鼠的DG脑片中进行Ki67(红色)和DAPI(蓝色)的染色。(N)定量统计Ki67+细胞数。每组N=6-8。(O-R)在溶剂对照(Ctrl)和AT给药的野生型和APP/PS1小鼠的DG切片中进行BrdU(红色)和NeuN(绿色)的染色。实验方案见图1N。(S)定量统计BrdU+细胞数。每组N=5。(T)定量统计BrdU+NeuN+细胞数。每组N=5。(U)BrdU+NeuN+在BrdU+细胞中的比例。定量结果表示为平均值±标准误;*P<0.05,**P<0.01,one-way ANOVA分析。标尺,100um。右下方小图为高倍镜下拍摄,标尺为10um。
图4:体外AT促进神经干细胞增殖。(A-C)在减生长因子(1ng/ml EGF和1ng/ml bFGF)的培液中贴壁培养成体海马神经干细胞,并用不同浓度的AT处理细胞24小时。细胞固定前2小时加入EdU。DMSO(A,Ctrl)或0.1mg/ml AT(B)处理的细胞进行EdU(红色)和DAPI(蓝色)染色。(C)定量统计EdU+细胞的比例。(D-F)在无生长因子的培液 中贴壁培养成体海马神经干细胞,并用不同浓度的AT处理细胞14小时。细胞固定前2小时加入EdU。DMSO(D,Ctrl)或0.1mg/ml AT(E)处理的细胞进行EdU(红色)和DAPI(蓝色)染色。(F)定量统计EdU+细胞的比例。(G-I)在减生长因子的培液中贴壁培养胚胎神经干细胞,并用不同浓度的AT处理细胞24小时。细胞固定前2小时加入EdU。DMSO(G,Ctrl)或0.1mg/ml AT(H)处理的细胞进行EdU(红色)和DAPI(蓝色)染色。(I)定量统计EdU+细胞的比例。(J-L)在无生长因子的培液中贴壁培养胚胎神经干细胞,并用不同浓度的AT处理细胞14小时。细胞固定前2小时加入EdU。DMSO(J,Ctrl)或0.1mg/ml AT(K)处理的细胞进行EdU(红色)和DAPI(蓝色)染色。(L)定量统计EdU+细胞的比例。定量结果表示为8次实验的平均值±标准误;*P<0.05,**P<0.01,***P<0.001,one-way ANOVA分析。标尺,100um。
图5:体外AT对神经干细胞分化的影响。(A)成体神经干细胞表达Nestin(绿色)和(Sox2)。(B)胚胎神经干细胞表达Nestin(绿色)和(Sox2)。(C)成体海马神经干细胞在体外分化5天后,细胞表达Tuj 1(绿色,神经元标志物)或GFAP(红色,星型胶质细胞标志物)。(D)定量统计AT处理的细胞在分化5天后Tuj 1+细胞的比例(左图)和GFAP+细胞的比例(右图)。定量结果表示为5次实验的平均值±标准误;one-way ANOVA分析。标尺,100um。
图6:细辛醚是AT促进神经干细胞增殖的主要活性成分。(A)石菖蒲成分的提取和拆分。(B)在减生长因子(1ng/ml EGF和1ng/ml bFGF)的培养条件下,3个组分分别处理的胚胎神经细胞中的EdU+细胞的比例。(C)α-细辛醚、β-细辛醚和2个结构类似物处理的胚胎神经干细胞中的EdU+细胞比例。(D)细辛醚处理的成体海马神经细胞中的EdU+细胞的比例。(E)用DMSO(Ctrl)、1uMα-细辛醚和1uMβ-细辛醚处理成体海马神经干细胞,并对EdU(红色)和DAPI(蓝色)染色。(F)在无生长因子的培养条件下,细辛醚处理的成体海马神经细胞中的EdU+细胞的比例。(G)在无生长因子(1ng/ml EGF和1ng/ml bFGF)的培养条件下,细辛醚处理的成体海马神经细胞中的EdU+细胞的比例。定量结果表示为8次实验的平均值±标准误;*P<0.05,**P<0.01,***P<0.001,one-way ANOVA分析。标尺,100um。
图7:高效液相色谱分析AT、ATE、ATB和ATW。β-asarone,tR=25.0min;α-asarone,tR=27.3min。
图8:细辛醚对神经干细胞分化和神经突触生长的影响。(A)在无生长因子的培液中贴壁培养成体海马神经干细胞,并用不同浓度的3各组分处理细胞14小时。细胞固定前2 小时加入EdU。对EdU染色,并定量统计EdU+细胞的比例。N=8次独立实验。(B)在无生长因子的培养条件下,α-细辛醚、β-细辛醚和2个结构类似物处理的胚胎神经干细胞中的EdU+细胞比例。N=8次独立实验。(C)定量统计细辛醚处理的成体海马神经细胞在分化5天后Tuj 1+细胞的比例(左图)和GFAP+细胞的比例(右图)。(D-F)原代培养的神经元在培养的第3-7天用AT或细辛醚处理,并对MAP2进行免疫荧光染色,来检测神经突触生长。(D)用DMSO(Ctrl)、10ug/ml AT、0.1uMα-细辛醚或0.1uMβ-细辛醚处理的细胞,对MAP2(红色)和DAPI(蓝色)进行染色。(E)定量统计MAP2+神经元的突触长度。N=4次独立实验。(F)定量统计每个细胞的平均突触数。N=4次独立实验。定量结果表示为平均值±标准误;*P<0.05,**P<0.01,***P<0.001,one-way ANOVA分析。标尺,100um。
图9:AT和细辛醚对成神经细胞瘤细胞系增殖的影响。在无血清的培液中用不同药物处理SH-SY5Y细胞2天,用MTT法分析细胞增殖。定量结果表示为平均值±标准误;***P<0.001,one-way ANOVA分析。
图10:细辛醚促进成体海马神经干细胞增殖和神经再生。(A)检测神经干细胞增殖实验设计图示。(B-D)8周大的小鼠给药(B)对照溶剂(Ctrl),(C)α-细辛醚或(D)β-细辛醚,方案如图(A)所示,对其海马DG区进行免疫荧光染色,检测BrdU(红色)和DAPI(蓝色)。(E)BrdU+细胞的定量统计。每组N=5-6。(F)检测神经干细胞分化实验设计图示。(G-I)小鼠给药(G)对照溶剂(Ctrl),(H)α-细辛醚或(I)β-细辛醚,方案如图(F)所示,对其海马DG区进行免疫荧光染色,检测BrdU(红色)和NeuN(绿色)。(E)BrdU+NeuN+细胞的定量统计。每组N=4-7。(K)BrdU+NeuN+细胞在BrdU+细胞中的比例。每组N=4-7。(L-N)18-23个月大的小鼠给药(L)对照溶剂(Ctrl),(M)α-细辛醚或(N)β-细辛醚,方案如图(F)所示,对其海马DG区进行免疫荧光染色,检测BrdU(红色)和NeuN(绿色)。(O)BrdU+NeuN+细胞的定量统计。每组N=5-7。(P)BrdU+NeuN+细胞在BrdU+细胞中的比例。每组N=5-7。定量结果表示为平均值±标准误;*P<0.05,***P<0.001,one-way ANOVA分析。标尺,100um。
图11:细辛醚对成体海马神经再生的影响。(A-C)实验方案如图10A所示。(A)对照溶剂(Ctrl)、(B)α-细辛醚和(C)β-细辛醚给药小鼠的DG脑片进行免疫荧光染色,检测GFAP(红色)、Nestin(绿色)和BrdU(灰色)。标尺,25um。(D)定量统计GFAP+Nestin+BrdU+细胞数。每组N=5-6。(E-G)(E)对照溶剂(Ctrl)、(F)α-细辛醚和(G)β-细辛醚给药小鼠的DG脑片进行免疫荧光染色,检测BrdU(红色)、Tbr2(绿色)和DAPI(蓝色)。标尺,100um。(H)定量统计Tbr2+BrdU+细胞数。每组N=5-6。(I-K)(I)对照溶剂(Ctrl)、(J) α-细辛醚和(K)β-细辛醚给药小鼠的DG脑片进行免疫荧光染色,检测Ki67(红色)、Dcx(绿色)和DAPI(蓝色)。标尺,100um。(L-N)定量统计(L)Ki67、(M)Dcx+Ki67+和(N)Dcx+Ki67-细胞数。每组N=5-6。(O)定量统计溶剂对照(Ctrl)和细辛醚给药小鼠DG区的Sox2+细胞数。每组N=3。(P)定量统计溶剂对照(Ctrl)和细辛醚给药小鼠DG区的Dcx+TUNEL+细胞数。每组N=3。(Q)在细辛醚给药的小鼠海马DG区切片中共染c-Fos(蓝色)、BrdU(红色)和NeuN(绿色)。实验方案见图5F。标尺,10um。(R)实验方案见图5F。小鼠DG区中共染GFAP、NeuN和BrdU,并定量统计GFAP+BrdU+细胞数。N=4-5每组。(S-T)老年小鼠新物体识别分析。(S)小鼠在训练期的偏好指数。(T)小鼠在1天后的测试期的认知指数。每组N=5-8。定量结果表示为平均值±标准误;*P<0.05,**P<0.01,one-way ANOVA分析;#P<0.05,##P<0.01,与50%几率水平比较的单样品t检验分析。
图12:AT和细辛醚激活ERK级联反应来促进神经干细胞增殖,但不影响Akt级联反应。(A)在减生长因子的条件(1ng/ml EGF和1ng/ml bFGF)下培养胚胎神经干细胞24小时,然后加入1mg/ml AT、1uM a-细辛醚或1uM b-细辛醚孵育一定时间。用免疫印迹法检测蛋白样品中的磷酸化ERK1/2和Akt。总ERK和Akt的量作为上样量的对照。4次独立实验得到类似的结果。(B)向胚胎神经干细胞中加入MEK抑制剂U0126(U;0.1uM),ERK抑制剂FR180204(F;10uM),PI3K抑制剂LY294002(L;10uM)或Akt抑制剂MK-2206(M;10uM)。30分钟后,再加入AT或细辛醚孵育5分钟。用免疫印迹法检测蛋白样品中的磷酸化ERK1/2、总ERK、磷酸化Akt和总Akt。4次独立实验得到类似的结果。(C-E)在减生长因子的条件下培养胚胎神经干细胞24小时,向细胞中加入MEK抑制剂U0126(U;0.1uM),ERK抑制剂FR180204(F;10uM),PI3K抑制剂LY294002(L;10uM)或Akt抑制剂MK-2206(M;10uM)。30分钟后,再加入(C)AT、(D)a-细辛醚或(E)b-细辛醚孵育24小时。对最后2小时的EdU掺入进行染色和定量统计。(C-E)中的所有实验组分别与该图中的只加有AT、α-细辛醚或β-细辛醚的实验组比较。N=5次独立实验。(F-G)小鼠口服给药溶剂对照(Ctrl)、AT或细辛醚5天。对其DG区进行免疫荧光染色,检测磷酸化的ERK1/2(F,红色)和Sox2(F,绿色);并对p-ERK+Sox2+细胞定量统计(G)。每组N=4-6。标尺,20um。定量结果表示为平均值±标准误;*P<0.05,**P<0.01,***P<0.001,one-way ANOVA分析。
图13:AT和细辛醚短期给药促进海马神经干细胞增殖。11周大的小鼠口服给药AT或细辛醚5天,通过BrdU注射来标记增殖的细胞。用免疫荧光法检测(A)溶剂对照(Ctrl)、 (B)AT、(C)α-细辛醚和(D)β-细辛醚给药的小鼠DG区中的BrdU(红色);并定量统计BrdU+细胞数(E)。每组N=5-7。定量结果表示为平均值±标准误;*P<0.05,**P<0.01,one-way ANOVA分析。标尺,100um。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其它优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组DNA技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见Sambrook等MOLECULAR CLONING:A LABORATORY MANUAL,Second edition,Cold Spring Harbor Laboratory Press,1989and Third edition,2001;Ausubel等,CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,John Wiley&Sons,New York,1987and periodic updates;the series METHODS IN ENZYMOLOGY,Academic Press,San Diego;Wolffe,CHROMATIN STRUCTURE AND FUNCTION,Third edition,Academic Press,San Diego,1998;METHODS IN ENZYMOLOGY,Vol.304,Chromatin(P.M.Wassarman and A.P.Wolffe,eds.),Academic Press,San Diego,1999;和METHODS IN MOLECULAR BIOLOGY,Vol.119,Chromatin Protocols(P.B.Becker,ed.)Humana Press,Totowa,1999等。
实施例1 石菖蒲提取物的制备和组分的分离
本实施例制备石菖蒲提取物(AT),并用高效液相色谱的方法进行质控。
19.5kg的石菖蒲干燥根部用70L的60%乙醇回流提取3次,每次2h。得到的提取物合并后蒸发浓缩获得2.2kg的石菖蒲总提物(AT),制备得率为11.3%(w/w)。再用10L蒸馏水溶解AT,先后用乙酸乙酯(10L,重复三次)和正丁醇(10L,重复三次)分离各组分,随后用真空蒸发去除有机溶剂,得到的各组分为(1)溶于乙酸乙酯的组分(ATE),346.8g,得率1.8%,(2)溶于正丁醇的组分(ATB),127.4g,得率0.7%,和(3)剩余溶于水的组分(ATW),1.25kg,得率6.4%。各组分中的化合物组成和含量在Waters 2695色谱仪上的UV通道进行检测,使用Cosmosil色谱柱(C18,5μm,250X 4.6mm),35℃,流速1.0ml/分钟,流动相为甲醇(A相)和水(B相),0-10分钟(10-55%,A),线性梯度为:10-20分钟(55-60%,A),20-40分钟(60-75%,A),40-50分钟(75-100%,A),50-65分钟(100%,A)。
实施例2 实验方法
(1)小鼠给药和BrdU注射
α-细辛醚,β-细辛醚和AT用含0.8%吐温-80的水溶解。在8周大小年轻小鼠的给药实验中,每只小鼠灌胃给药100μl,给药浓度分别为α-细辛醚10mg/kg小鼠体重,β-细辛醚30mg/kg小鼠体重和AT 20g/kg小鼠体重,另参照组给100μl含0.8%的吐温-80的水,每日一次,持续给药28天,而在5天短期给药实验中则给药5天。在检测神经干细胞体内增殖的实验中,最后一次给药后分3次腹腔注射150mg/kg小鼠体重的BrdU,每次之间间隔3h,在最后一次BrdU注射后2h,将小鼠麻醉后PFA灌流,取全脑进行下一步的实验。在检测神经干细胞体内分化的实验中,从第1天开始给药后腹腔注射50mg/kg小鼠体重的BrdU,每日一次,共注射7天,给药28天后将小鼠麻醉后PFA灌流,取全脑进行下一步的实验。在AD小鼠的给药实验中,参照组和AT组给药浓度均与年轻小鼠相同,给药时间为17天,在检测神经干细胞体内增殖的实验中,第10天开始给药后腹腔注射50mg/kg小鼠体重的BrdU,每日一次,共注射7天,在检测神经干细胞体内分化的实验中,从第1天开始给药后腹腔注射50mg/kg小鼠体重的 BrdU,每日一次,共注射7天,两者均在最后一天给药24h后将小鼠麻醉并PFA灌流,取全脑进行下一步的实验。20个月年老小鼠给药实验与检测8周大小年轻小鼠检测神经干细胞体内分化的实验步骤相同。
(2)细胞培养
成年小鼠海马神经干细胞的分离参考,并作适当修改。首先给8周大小小鼠腹腔注射10%(w/v)的水合氯醛,剂量为5ml/kg小鼠体重,麻醉后70%乙醇全身喷洒消毒,剪开颅骨,取出全脑,置于预冷的PBS中,去除小脑,再按中线将剩余部分切开,剥出左右两侧海马。将海马置于500μl预热的PDD(2.5U/ml,papain;1U/ml,dispase;250U/ml,DNase)中,用眼科剪剪碎至小于1mm3的碎块,每只小鼠再加入2ml消化液,吹匀后加入60mm细胞培养皿中铺开,放入37℃细胞培养箱摇床上消化20分钟,连未消化碎块一起吸出至15ml离心管,加入2.5ml NeuroCult NSC basal培液,用剪过头部的1ml枪头吹打10次,自然沉降30秒后,上清加入40μm滤网过滤,如此重复三次,之后再用5ml培液冲洗滤网,合并所有过滤的细胞。取部分细胞,与台盼蓝染料1:1混合,加入血细胞计数板计数(只计台盼蓝染色阴性的活细胞)。再以1X105/ml的细胞铺板密度种入24孔板,并加入生长因子(20ng/ml bFGF,20ng/ml EGF,2μg/ml heparin)。每2天加入1/10体积的新鲜培液,6天后大部分神经球可生长至50μm以上,此时可对细胞进行传代,Accutase 37℃消化5分钟,以1X105/ml的细胞铺板密度进行传代,由于刚分离出的细胞中有神经细胞等污染,故传代3代及以上的细胞才能进行实验。多余的细胞进行冻存,10%DMSO(v/v),30%Serum Replacement(v/v)。
胚胎神经干细胞的从E12.5的C57BL/6小鼠胚胎分离,取出胚胎后,剥开颅骨,取小鼠胚胎的皮层,消化培养,具体步骤同成体海马神经干细胞,所使用培液为添加B27的DMEM/F12,其中补充10ng/ml bFGF和20ng/ml EGF。
(3)体外EdU掺入实验
神经球在用Accutase消化后,重悬于含1ng/ml bFGF和1ng/ml EGF和B27的DMEM/F12培液(胚胎神经干细胞)中或者含1ng/ml bFGF和1ng/ml EGF的NeuroCult NSC增殖培液中,以4X104/cm2的细胞密度接种到预先包被好的96孔板中(PDL包被过夜,用水洗一遍后,再用laminin包被过夜),培养24小时后,加入AT,α-细辛醚和β-细辛醚,在有抑制剂的实验中,加入AT,α-细辛醚,β-细辛醚之前30分钟用ERK和Akt信号通路抑制剂(U0126,0.1μM;LY294002,1μM;MK-2206,10μM;FR180204,10μM)预处理,加药后共孵育24小时,在第22小时加入10μM的EdU,孵育2小时后收细胞染色。
(4)EdU染色和分析
细胞用4%PFA固定15分钟,PBS洗一遍后,再用含0.1%TritonX-100的PBS打孔处理15分钟,PBS洗一遍,含4%BSA的PBS封闭30分钟,Nestin(1:100,含4%BSA的PBS)一抗4℃孵育过夜,PBS洗一遍后,二抗(1:1000,含4%BSA的PBS)室温孵育1小时,PBS洗一遍后,加入配好的EdU染色液染色30分钟,配方下表1所示。
表1
EdU染色完毕后,PBS洗一遍,DAPI(1:5000,PBS)染色5分钟,PBS洗两遍,在operetta上进行检测和分析。
(5)神经干细胞体外分化
神经球在用Accutase消化后,重悬于含10ng/ml bFGF和20ng/ml EGF的NeuroCult NSC增殖培液中,以2.5X104/cm2的细胞密度接种到预先包被好的96孔板中(PDL包被过夜,用水洗一遍后,再用laminin包被过夜),培养24小时后,将培液换成NeuroCult NSC分化培液,同时加入AT,α-细辛醚,β-细辛醚,之后每隔一天更换培液,在培液换成NeuroCult NSC分化培液5天后,对各个谱系的分化标记分子进行染色分析。
(6)免疫印迹实验
神经球在用Accutase消化后,重悬于含1ng/ml bFGF和1ng/ml EGF和B27的DMEM/F12培液,再以3X106/ml的细胞密度接种到预先包被好的12孔板中,培养24小时后,加入AT,α-细辛醚,β-细辛醚,在有抑制剂的实验中,加入AT,α-细辛醚,β-细辛醚之前30分钟用ERK和Akt信号通路抑制剂(U0126,0.1M;LY294002,1M;MK-2206,10M;FR180204,10M)预处理,加药后5分钟将细胞放至冰上,用预冷的PBS洗两次,加入1XLB,95℃处理5分钟,跑SDS/PAGE胶,转至醋酸纤维膜上,与phospho-ERK,ERK,phospho-Akt,Akt一抗和IRDye800CW标记二抗孵育,用Odyssey远红外图像系统检测并在其自带软件上分析。
(7)免疫荧光实验
PFA灌流过的小鼠大脑继续在4%PFA中固定24小时,再在30%蔗糖固定液中静置72小时。 处理完毕后,去除小脑部分,将大脑嗅球朝上直立置于滤纸上,-80℃冻存至少24小时。以30μm厚度垂直纵向冰冻切片,按小鼠大脑图谱取DG部分,共切8X 9X=72张,共2.16mm,按切片顺序排列,每8片取1张,合并后编为一组脑片,进行染色。切好的脑片置于组织保护液中(30%蔗糖,30%乙二醇,0.1M PB),可在-20℃保存半年以上。染色时取一组脑片,在封闭液(10%驴血清,0.3%TritonX-100,PBS)中室温封闭45分钟,之后加入一抗4℃孵育过夜(一抗稀释比例为:大鼠抗BrdU,1:2000;兔抗Ki67,1:1000;羊抗Dcx,1:200;鼠抗NeuN,1:200;羊抗Sox2,1:60),再与合适的荧光二抗室温孵育1小时。DAPI对细胞核染色。之后用Olympus FV100i或Leica SP-8对染色的脑片进行拍照。阳性或双染细胞的数量通过Image Pro Plus软件分析。对于和BrdU共染,需要进行抗原修复的脑片,于血清封闭之前,在抗原修复液(10mM柠檬酸钠,pH 6.5)中95℃处理20分钟。BrdU染色,脑片在血清封闭之前,用2M的盐酸在37℃处理30分钟,再用0.1M的硼酸缓冲液(pH 8.5)清洗。
(8)MTT实验
将SH-SY5Y消化成单细胞状态,以4000个/孔的密度加入96孔板,每孔体积为200μl。细胞贴壁后加药,每种处理条件5个副孔。在37℃细胞培养箱中培养20小时,每孔加入20μl的MTT溶液(5mg/ml),继续培养4小时,终止培养,小心吸去孔内培养液,每孔加入150μl DMSO,置于摇床上低速震荡10分钟,使结晶物充分溶解,在酶联免疫检测仪OD 490nm处测量各孔的吸光值。实验中需同时设置调零孔(没有细胞,仅有培液,MTT和DMSO),对照孔(没有药物,仅有细胞,相同浓度的药物溶解介质,培液,MTT和DMSO)。
(9)数据统计分析
所有实验数据表示为平均值±标准误差。不同处理组之间采用t检验进行比较。多组结果之间采用one-way ANOVA进行分析,并用Fisher’s protected least significant difference test或Bonferroni t test进行事后检验,或者采用two-way ANOVA进行分析,并用Tukey post hoc test进行事后检验。P<0.05时认为组间有显著性差异。
实施例3 石菖蒲促进成年小鼠神经干细胞增殖
我们给8周大的C57BL/6小鼠按照200mg原药材/20g体重的剂量口服AT;对照组小鼠则口服相应体积溶剂(vehicle,水中溶解0.8%Tween-80),灌胃给药,每天1次,共28天。在最后一天,注射3次溴脱氧尿苷(bromodeoxyuridine,BrdU)来标记增殖的细胞。免疫组化分析结果表明,大部分BrdU阳性细胞位于神经干细胞集中的颗粒下区(subgranular zone, SGZ)。与对照组小鼠相比,口服AT使BrdU阳性细胞的数量增加31%(如图1B-D所示)。对另一增殖标志分子Ki67的染色也得到相似的结果(如图1K,L,图2B所示)。而AT并没有明显改变颗粒细胞层的体积(如图2A所示)。之前的研究表明,SGZ区存在两种类型的成体神经干细胞,分别是放射状胶质样细胞(radial glia-like cells)和非放射状神经干细胞(nonradial neural progenitor cells)。我们进一步检测这两种细胞的变化,发现口服AT促进Tbr2和BrdU双阳性的增殖的非放射状神经干细胞的数量(如图1H-J所示),而GFAP、Nestin和BrdU三阳性的增殖的放射状胶质样细胞数量没有明显改变。此外,SGZ区的Sox2阳性细胞数目也没有明显变化,表明口服AT不影响神经干细胞库的大小(如图2C-E所示)。我们进一步通过Dcx的染色,检测海马齿状回(dentate gyrus,DG)区成神经细胞(neuroblast)和非成熟神经元。口服AT后,Dcx和Ki67双阳性的成神经细胞和Dcx阳性、Ki67阴性的非成熟神经元都显著增加(如图1K-M,图2-F所示)。TUNEL实验表明,Dcx阳性细胞的存活率没有受到AT的影响(如图2H所示)。这些结果表明,口服AT促进成体海马神经干细胞增殖。
为了进一步检测由神经干细胞产生的新生神经元,我们在小鼠给药的最初7天,每日1次注射BrdU来标记增殖的细胞,距第一次注射BrdU的28天后,对小鼠大脑进行检测(如图1N所示)。我们在BrdU阳性细胞中检测了成熟神经元标志物NeuN,发现与对照组小鼠相比,口服AT的小鼠大脑中存在更多BrdU和NeuN双阳性的神经元(如图1O-Q所示)。其中一部分神经元同时还表达c-Fos,表明这些神经元处于激活状态(如图2I所示)。然而,口服AT后,BrdU阳性细胞中BrdU和NeuN双阳性细胞的比例没有明显改变(如图1R所示),表明AT并不影响神经干细胞像神经元方向的谱系分化(lineage commitment)。进一步地,我们发现口服AT后,GFAP和BrdU双阳性细胞的数量也没有明显变化,表明胶质再生(gliogenesis)没有受到影响。
实施例4 石菖蒲促进衰老小鼠和转基因AD小鼠的神经再生
首先,我们连续7天给18-23个月大的老年小鼠注射BrdU,并口服给药AT或对照溶剂28天。与8周大的小鼠相比,这些老年小鼠大脑中的BrdU和NeuN双阳性细胞的数量明显减少(如图3A所示;对比如图1O所示)。有趣的是,我们发现口服AT显著增加BrdU和NeuN双阳性细胞的数量(~90%,如图2A-C所示),而BrdU阳性细胞中的BrdU和NeuN双阳性细胞的比例没有变化(如图3D所示)。这些结果表明,口服AT能够促进老年小鼠的神经再生。
接着,给8-12个月大的中年APP/PS1转基因小鼠及其野生型同窝对照小鼠口服AT或对照 溶剂,然后对其注射BrdU。与8周大的小鼠相比,8-12个月的野生型小鼠大脑中BrdU阳性细胞数明显减少(如图3E,G,I所示),表明AD转基因小鼠神经干细胞增殖存在缺陷。我们发现,口服AT使野生型小鼠大脑中的神经干细胞增殖增加36%(如图3E,F,I所示),而在APP/PS1小鼠大脑中,增幅更是达到了98%(如图3G,H,I所示)。对Ki67的染色也显示类似的结果(如图3J-N所示)。我们也检测了口服AT的APP/PS1小鼠的神经再生。为此,我们给APP/PS1小鼠和他们的野生型同窝对照小鼠注射BrdU,并口服给药AT 28天。我们发现与野生型小鼠相比,APP/PS1小鼠DG区中的BrdU阳性细胞的数量以及其中BrdU和NeuN双阳性细胞的比例都显著下降(如图3O,Q,S-U所示)。APP/PS1小鼠口服AT后,BrdU阳性细胞的数量以及其中BrdU和NeuN双阳性细胞的比例都明显上升(如图3O-U所示),表明口服AT促进新生细胞的存活以及增加新生神经元的数量。这些结果表明,口服AT减少了AD模型小鼠神经干细胞增殖和神经再生的缺陷。
实施例5 在体外,石菖蒲促进神经干细胞增殖
为了探究AT是否直接作用于神经干细胞,我们从成体小鼠海马中分离培养了神经干细胞。细胞中约90%是Nestin和Sox2阳性的神经干细胞(如图5A所示)。这些贴壁培养的神经干细胞在含有20ng/ml EGF和20ng/ml bFGF的培液中迅速扩增。有研究表明,在衰老或者神经退行的大脑中,生长因子水平的下降以及静息调控因子水平的上升可能是导致神经再生减少的原因。因此,我们减少了神经干细胞培液中的EGF和bFGF浓度,来模拟这种生理或病理条件,并在这种细胞培养体系中,通过EdU掺入来检测AT对神经干细胞增殖的影响。如图4A所示,在含有1ng/ml EGF和1ng/ml bFGF的减生长因子的培液中,约有20%的细胞呈现EdU阳性,在不含EGF和bFGF的无生长因子培液中,这一比例下降到1%(如图4A,D)。在这两种细胞培养体系中,AT使EdU掺入呈剂量依赖性增加(如图4A-F)(在减少生长因子的条件下增加~30%,在无生长因子的条件下增加~65%)。同样地,AT也能促进从胎鼠大脑皮层中分离的神经干细胞的增殖(如图5B,图4G-L)。
另一方面,在分化的条件下,AT没有改变Tuj 1阳性或者GFAP阳性细胞的比例(如图5C,D),表明在体外AT不影响神经干细胞的谱系分化。这与我们在体内实验中观察到的现象一致(如图1R)。
实施例6 细辛醚是石菖蒲中调控神经干细胞的主要活性成分
为了进一步找到石菖蒲中的活性成分,我们把AT分成3各组分(图6A)。我们检测胚胎神经干细胞在减生长因子和无生长因子两种条件下的EdU掺入(图6B和图7A)。我们将每种组分的浓度根据得率折算成初始原药材的浓度。如图6B和图7A所示,乙酸乙酯溶组分(ATE)加药和AT加药类似,能够呈剂量依赖性地提高EdU阳性细胞的比例。与对照组相比,正丁醇和水溶组分,即ATB和ATW则对EdU掺入水平没有明显影响。因此,ATE是AT中促进神经干细胞增殖的主要组分。
为了进一步找到ATE中的主要活性成分,我们进行了高效液相色谱分析(图7A-D)。ATE中主要有2个化学成分富集,约占ATE总质量的20%,分别是β-细辛醚和α-细辛醚(图7B)。在AT中,含有3%的细辛醚(图7A)。在ATB和ATW中,只检测到微量的细辛醚(图7C,D)。
我们检测了细辛醚对神经干细胞增殖的影响。如图6C和图7B所示,α-细辛醚和β-细辛醚能够呈剂量依赖性地增加EdU掺入水平。相反地,用ATE中细辛醚的2个结构类似物cis-methylisoeugenol或asarylaldehyde处理细胞则对神经干细胞增殖没有明显影响。进一步地,细辛醚对成体海马神经干细胞也有呈剂量依赖性的促进增殖的作用(图6D-G)。为了进一步检测细辛醚是否对其它细胞,尤其是癌细胞也有类似的促增殖的作用,我们在无血清的条件下培养了成神经细胞瘤细胞SH-SY5Y,并用细辛醚处理。MTT实验结果表明,细辛醚与EGF和bFGF的作用不同,对SH-SY5Y的增殖没有明显影响(图9),表明细辛醚可能选择性地促进神经干细胞增殖。进一步地,与对照组相比,细辛醚处理后的神经干细胞所产生的Tuj 1阳性和GFAP阳性的细胞比例不变,表明与AT类似,细辛醚对神经干细胞的谱系分化没有明显影响(图8C)。在新生小鼠大脑皮层和海马来源的原代神经元中,AT和细辛醚呈剂量依赖性地增加神经突触的长度,但对它们的数量没有明显影响(图8D-F)。有趣的是,细辛醚促进神经突触生长的最佳浓度是0.1-0.3μM,比它们促进成体神经干细胞增殖的最佳剂量(0.3-3μM)低,暗示可能存在不同的作用机制。这些结果表明,α-细辛醚和β-细辛醚是AT在体外促进神经干细胞增殖的主要活性成分。
实施例7 在体内细辛醚促进海马神经干细胞增殖和神经再生
为了进一步检测细辛醚是否像AT一样能够在体内促进成体海马神经再生,我们给8周大的C57BL/6小鼠口服α-细辛醚和β-细辛醚28天,并注射BrdU标记增殖的细胞(图10A)。与 对照组小鼠相比,α-细辛醚和β-细辛醚给药的小鼠大脑SGZ区BrdU阳性的增殖的神经干细胞数量增多(图10B-E)。Ki67的染色分析也呈现相似的结果(图11I-L)。与AT给药类似,细辛醚给药主要促进Tbr2阳性的非放射状神经干细胞的增殖(图11E-H),而对GFAP和Nestin双阳性的放射状胶质样细胞的增殖没有明显影响(图11A-D)。Sox2阳性细胞组成的神经干细胞库的大小也没有明显改变(图11O)。细辛醚给药增加了Dcx和Ki67双阳性成神经细胞和Dcx阳性、Ki67阴性的非成熟神经元的数量(图11I-K,M,N),而对这两群细胞的存活没有明显影响(图11P)。为了进一步检测由神经干细胞产生的新生神经元,我们在细辛醚给药的前7天给小鼠注射BrdU,28天后取脑分析(图10F)。免疫组化分析发现,与对照组相比,细辛醚给药的小鼠脑中有更多的BrdU和NeuN双阳性新生神经元(图10G-J)。其中部分新生神经元同时表达c-Fos,表明其处于功能性激活状态(图11Q)。然而,细辛醚给药后,NeuN和BrdU双阳性的细胞在BrdU阳性细胞中的比例没有改变(图10K),表明细辛醚与AT类似,不影响神经干细胞向神经元方向的谱系分化。有趣的是,我们发现GFAP和BrdU双阳性的细胞数也增加了,表明细辛醚也能促进胶质再生(图11R)。这些结果表明细辛醚和AT促进成年小鼠海马中的神经干细胞增殖,并进一步增强了神经再生。
我们还检测了细辛醚给药的老年小鼠的神经再生。为此,我们给18-23个月大的小鼠注射了7天BrdU来标记增殖细胞,并给药细辛醚或对照溶剂28天。与AT的结果相似,细辛醚使BrdU和NeuN双阳性细胞的数量增加了约70%(图10L-O),但是神经元谱系分化没有变化(图10P)。这些数据表明细辛醚促进老年小鼠的神经再生。
随着年龄的增加,认知功能和神经再生衰退。为进一步探究AT和细辛醚给药是否能够改善行为学表现,我们用了新物体识别实验来检测老年小鼠中与海马相关的认知记忆。在小鼠训练过程中,对照组、AT给药组和细辛醚给药组的小鼠对两个相同物体表现出相等的偏好指数(图11S)。24小时后,对照组小鼠对新物体的探索没有超出50%的几率水平,表明其无法区分出新物体(图11T)。相反地,AT和细辛醚给药的小鼠对新物体表现出比熟悉物体更多的偏好性,表明它们还保留着对物体的记忆(图11T)。这些结果表明,AT和细辛醚减少了老年小鼠的认知记忆缺陷。
实施例8 石菖蒲和细辛醚激活ERK级联反应,但不影响Akt级联反应
研究表明,ERK和/或Akt级联反应的激活对于神经干细胞增殖和自我更新非常关键。因此,我们通过免疫印迹的方法来检测这些级联反应的激活。如图12A所示,AT和细辛醚加 药后,细胞内ERK磷酸化水平增加,在2-10分钟到达峰值,然后在30分钟内缓慢下降到基础水平。然而,Akt磷酸化水平则没有明显变化(图11A)。进一步地,AT和细辛醚对ERK的激活可以被MEK抑制剂U0126和ERK抑制剂FR180204阻断而不能被PI3K抑制剂LY294002或者Akt抑制剂MK-2206阻断(图11B)。为了进一步检测AT和细辛醚对神经干细胞增殖的促进作用是否依赖于ERK级联反应的激活,我们用U0126,FR180204,LY294002或MK-2206处理神经干细胞。如图11C-E所示,用U0126和FR180204处理细胞能够阻断AT和细辛醚促进神经干细胞增殖的作用,但是LY294002或MK-2206则不能,表明MEK/ERK级联反应,而非PI3K/Akt级联反应是AT和细辛醚促进神经干细胞增殖所必需的。为了进一步确定体内ERK信号通路在细辛醚促进神经干细胞增殖中起到的作用,我们给11周大的小鼠口服给药AT或者细辛醚5天。与对照组小鼠相比,AT和细辛醚给药的小鼠SGZ区BrdU阳性的增殖细胞的数目增加了25%,表明AT和细辛醚对神经干细胞增殖有直接和快速的促进作用(图13A-E)。同时,我们在SGZ区对磷酸化ERK和Sox2进行了共染,发现AT和细辛醚给药小鼠的磷酸化ERK阳性的神经干细胞数量也明显增加(图12F-G)。
实施例9 实验小结
我们发现AT在AD和年老小鼠体内促进神经干细胞增殖的效果,好于其在年轻小鼠中的作用,这可能是由多种因素造成的:首先AD和年老小鼠大脑内的生长因子如EGF,FGF和BDNF等低于年轻小鼠,因此AT给药的效果容易在更低的本底增殖背景上显示出来,同时AT通过生长因子信号通路产生的促进增殖作用也能得以体现;其次AD和年老小鼠大脑内存在Aβ,tau和损伤神经元等造成的慢性炎症环境,而这种环境对于神经干细胞增殖起到了抑制性的作用,之前报道AT有一定的抑制炎性反应的作用,因此这种抑炎作用于AT本身促进神经干细胞增殖的作用相协同,在AD和年老小鼠上发挥出更好的促进神经再生的效果。
我们的结果表明,AT和细辛醚的功能是多重性的,这种特性在治疗包括AD的多致病因子疾病中具有其独特的优势。
MEK/ERK和PI3K/Akt信号通路在调节神经干细胞功能上有非常关键的作用。激活MEK/ERK信号通路能促进神经干细胞的增殖,而PI3K/Akt信号通路不止对神经干细胞的增殖很重要,同时它也能调节神经干细胞的分化和存活。我们的结果表明,AT和细辛醚的作用是通过激活MEK/ERK信号通路而不是PI3K/Akt信号通路。和此结果吻合,抑制MEK或ERK的活化,可以抑制AT和细辛醚对于神经干细胞增殖的作用。而另一方面,AT和细辛醚处理对于神经干细胞的分化没有影响,也印证了AT和细辛醚不激活PI3K/Akt信号通路的现 象。说明细辛醚对增殖的促进作用是有细胞特异性的。
我们发现AT和细辛醚处理能够在微量生长因子存在的体外培养环境下,促进神经干细胞的增殖。而在常用的加入过量生长因子培养环境中,AT和细辛醚却没有促进增殖的作用。这个发现暗示AT和细辛醚可能在缺乏生长因子的生理和病理条件下,发挥其促进神经再生的功能。与这些体外结果相吻合,我们观察到在中年小鼠(8个月大)中AT促进神经再生的效果也优于年轻小鼠(8周大)。
综上所述,我们不仅发现了AT和和其中的活性成分细辛醚可以促进神经干细胞的增殖,同时我们也建立了添加微量生长因子的神经干细胞培养体系,可以用于模拟体内的生理和病理环境,给筛选治疗神经退行性疾病的药物提供了新的方法。
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!