重组人皮肤桥蛋白成熟肽段及其生产方法与流程
本发明涉及应用重组dna技术生产基因工程蛋白药物技术领域,特别是涉及一种高效重组人皮肤桥蛋白成熟肽段(rhdpt)及其生产方法。
背景技术:
皮肤桥蛋白(dermatopontin,dpt)基因定位于人染色体1q12-1q23,它是由183个氨基酸残基构成的分泌型蛋白质,相对分子质量为22kda。dpt中富含络氨酸残基且1/2被硫酸化,络氨酸的硫酸化可能与dpt对胶原纤维形成的影响和其与细胞表面受体的结合有关。dpt在哺乳动物的组织中分布广泛,猪和啮齿类动物的皮肤、骨骼、心、肺、肾、软骨、骨中均有dpt存在,人体中的dpt主要分布于肌肉、心脏、胰腺、肺等组织的成纤维细胞中。最新的研究发现dpt在哺乳动物的皮肤、角膜、前列腺等组织的细胞外基质中也有分布。
dpt的生理功能主要与细胞粘附相关,lewandowska等人用balb/c3t3细胞及胎牛和人的皮肤成纤维细胞研究发现,dpt有促进这3种细胞粘附的活性。体外研究发现dpt可促进胶原纤维的形成,并使新形成的胶原纤维更加稳定。dpt的表达主要受tgfβ和il-4的调节,tgfβ可使dpt的mrna和蛋白水平同时升高而il-4的作用则与之相反。dpt与tgfβ结合后可增强tgfβ的活性,包括抑制内皮细胞和上皮细胞的增生、调节多种细胞的分化、促进胶原蛋白和蛋白聚糖等细胞外基质蛋白表达的作用。dpt的异常表达与心肌梗死、子宫平滑肌瘤、前列腺癌等疾病密切相关。最新研究报道发现dpt可在体外维持造血干细胞的扩增,此外真皮细胞分泌的dpt可通过促进角质化细胞的迁移的方式促进伤口的愈合。
总之,dpt是广泛存在于细胞基质中的一种重要分泌蛋白,通过核心蛋白多糖、tgfβ、ⅰ型胶原蛋白等作用具有细胞粘附、促进胶原纤维形成等功能,在多种和细胞外基质相关的生理和病理过程中发挥作用,然而dpt在和胞外基质相关的生理和病理过程中的作用机制仍有待深入研究。目前,还没有dpt在体外大量表达纯化的相关报导。
技术实现要素:
基于此,本发明的目的在于提供一种高效稳定生产重组人皮肤桥蛋白成熟肽段的方法,根据该方法可稳定高水平分泌表达rhdpt,且其是经糖基化修饰的rhdpt糖蛋白,还具有很好的生物学活性。
解决上述技术问题的具体技术方案如下:
一种重组人皮肤桥蛋白成熟肽段的生产方法,包括如下步骤:
(1)制备质粒rhdpt/pmd-20t:获得碱基序列如seqidno.1所示的人dpt基因,将所述人dpt基因连接到pmd-20t载体,得质粒rhdpt/pmd-20t;
(2)构建重组载体ppiczαa/dpt:将ppiczαa原始载体和所述质粒rhdpt/pmd-20t分别用ecorⅰ和notⅰ进行双酶切,再纯化回收,将回收的ppiczαa载体基因片段与rhdpt基因片段用solutionⅰdna连接酶连接,得重组载体ppiczαa/dpt;
(3)转化重组载体至真核酵母宿主中:将所述重组载体ppiczαa/dpt用sacⅰ单酶切线性化,再转入毕氏酵母x-33宿主中,再经过含zeocin的ypdz平板筛选得到阳性克隆;
(4)高水平分泌表达酵母转化子的筛选:将所述阳性克隆转接至含zeocin的ypdz平板中,利用zeocin浓度梯度筛选得到高抗性酵母转化子,再用bmgy培养基培养,甲醇诱导,得高水平分泌表达酵母转化子;
(5)纯化:用镍亲和层析柱对rhdpt进行纯化,得重组蛋白rhdpt。
在其中一些实施例中,步骤(4)所述高水平分泌表达酵母转化子的筛选的具体方法为:将所述阳性克隆转接至含zeocin的ypdz平板中,利用zeocin浓度梯度筛选得到高抗性酵母转化子,再用bmgy培养基培养,离心收集细胞,用bmmy培养基重悬细胞,得细胞液,并调节所述细胞液中甲醇终浓度为0.95-1.05%,诱导70-74h,得高水平分泌表达酵母转化子。
在其中一些实施例中,步骤(4)所述的zeocin浓度梯度筛选的具体方法为:将所述阳性克隆转接至含有490-510μg/mlzeocin的ypdz平板中,筛选到抗性为500μg/mlzeocin的酵母转化子,再将所述酵母转化子用新鲜的ypd液体培养基洗下,经稀释后涂布到含有1490-1510μg/mlzeocin的ypdz平板中,再将含有1490-1510μg/mlzeocin的ypdz平板中生长的酵母转化子经稀释后涂布到含有2990-3010μg/mlzeocin的ypdz平板中,筛选得到抗性为3000μg/mlzeocin的高抗性酵母转化子。
在其中一些实施例中,步骤(4)所述的诱导的时间为72h。
在其中一些实施例中,步骤(4)所述的诱导的温度为28℃-32℃。
在其中一些实施例中,步骤(4)所述的诱导的转速为180-220rpm。
在其中一些实施例中,步骤(5)所述的纯化的具体方法为:将所述高水平分泌表达酵母转化子进行扩大培养,将培养上清液先用缓冲液a透析,再利用镍亲和层析柱于akta-hplc系统中纯化,即得;所述缓冲液a为含有0.2mnacl、50mm咪唑、20mmtris的缓冲液,其ph为8.0。
在其中一些实施例中,利用镍亲和层析柱于akta-hplc系统中纯化时,先用缓冲液a漂洗,再利用缓冲液b线性洗脱,收集mau大于100的洗脱液,即得;所述缓冲液b为含有0.2mnacl、0.5m咪唑、20mmtris的缓冲液,其ph为8.0。
在其中一些实施例中,步骤(3)所述的ypdz平板中zeocin的浓度为95-105μg/ml。
本发明还提供了一种重组人皮肤桥蛋白成熟肽段。
具体技术方案如下:
根据上述生产方法制备得到的重组人皮肤桥蛋白成熟肽段。
本发明的重组人皮肤桥蛋白成熟肽段及其生产方法具有以下优点和有益效果:
(1)本发明所述方法经发明人大量的实验和研究,得出:以如seqidno.1所示的人dpt基因为外源基因,首次利用毕氏酵母x-33成功实现了rhdpt的大量稳定高效表达,具体为:将dpt基因放入原始载体ppiczαa,并以毕氏酵母x-33为宿主菌,实现了rhdpt的大量高效稳定表达;该方法既能够防止宿主菌对表达产物的降解、减轻宿主细胞代谢负荷以及表达产物对宿主的毒性作用,还可促进分泌蛋白按适当的方式折叠、恢复其天然构象。
(2)采用本发明所述生产方法制得的表达产物带有his及c-myc标签,易于纯化和检测表达产物,且其具有良好的生物活性。
附图说明
图1为真核表达载体ppiczαa/rhdpt的构建示意图;
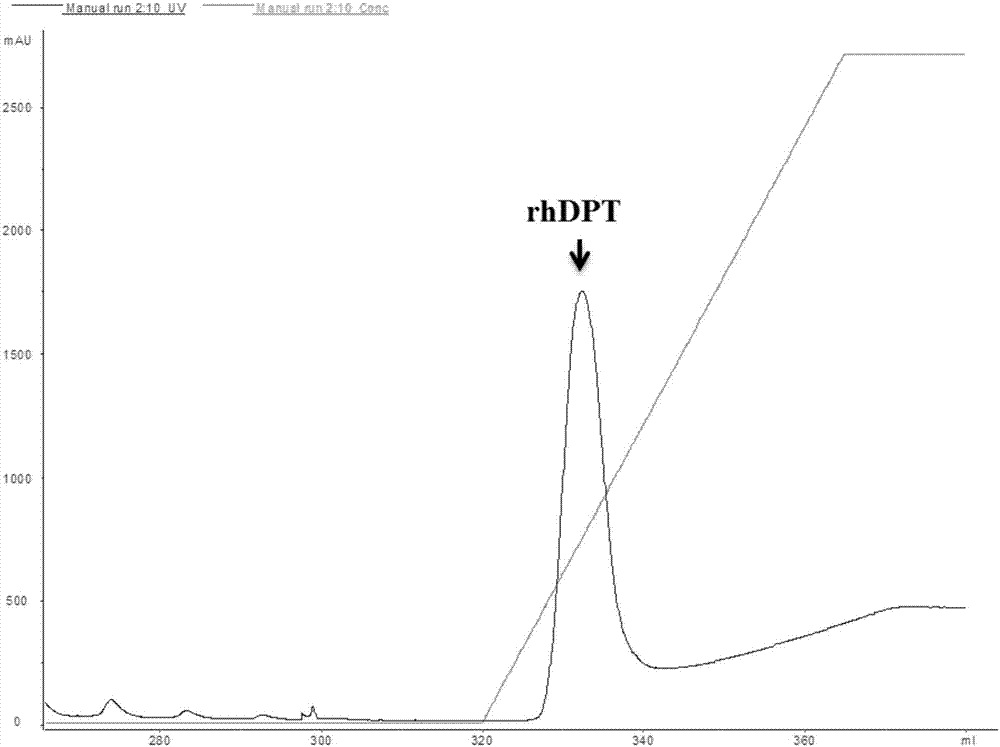
图2为rhdpt的镍亲和层析柱纯化色谱图;
图3为纯化的rhdpt蛋白sds-page电泳结果图,其中ds和dl均为rhdpt;
图4为rhdpt条带的质谱分析结果;其中a为rhdptds条带质谱分析结果;b为rhdptdl条带质谱分析结果;
图5为rhdpt对3t3-l1细胞增殖的影响结果示意图。
具体实施方式
本发明选用的毕氏酵母x-33菌株,整合性表达质粒ppiczαa载体均购自美国invitrogen公司。
本发明所述的人工合成的人皮肤桥蛋白cdna,购自南京金斯瑞公司;其5’端引入ecor1酶切位点,3’端引入not1酶切位点,序列如seqidno.1所示;
seqidno.1:
atggacctcagtcttctctgggtacttctgcccctagtcaccatggcctggggccagtatggcgattatggatacccataccagcagtatcatgactacagcgatgatgggtgggtgaatttgaaccggcaaggcttcagctaccagtgtccccaggggcaggtgatagtggccgtgaggagcatcttcagcaagaaggaaggttctgacagacaatggaactacgcctgcatgcccacaccacagagcctcggggaacccacggagtgctggtgggaggagatcaacagggctggcatggaatggtaccagacgtgctccaacaatgggctggtggcaggattccagagccgctacttcgagtcagtgctggatcgggagtggcagttttactgttgtcgctacagcaagaggtgcccatattcctgctggctaacaatagaatatccaggtcactatggtgaggaaatggacatgatttcctacaattatgattactatatccgaggagcaacaaccactttctctgcagtggaaagggatcgccagtggaagttcataatgtgccggatgactgaatacgactgtgaatttgcaaatgtttag
本发明所用培养基配方如下:
1)酵母生长培养基(bmgy):
完全溶解10g酵母提取物,20g蛋白胨,定容至700ml。121℃蒸汽高压灭菌15-20min,冷却至室温,加入100ml1m磷酸钾溶液,100mlynb,2ml500*biotin,100ml10*gy;
2)酵母诱导培养基(bmmy):
完全溶解10g酵母提取物,20g蛋白胨,定容至700ml。121℃蒸汽高压灭菌15-20min,冷却至室温,加入100ml1m磷酸钾溶液,100mlynb,2ml500*biotin,100ml10*m;
3)ypd液体培养基:
完全溶解10g酵母提取物,20g蛋白胨,10g葡糖糖,定容到1000ml,121℃蒸汽高压灭菌15-20min。(ypd固体培养基:向ypd液体培养基中加入15g琼脂即可)。
以下将结合具体实施例对本发明做进一步说明。
实施例1
本实施例一种高效rhdpt的表达纯化方法,主要包括以下步骤:
1、克隆rhdpt全基因:
设计一对dpt特性扩增引物,以人工合成的dptcdna为模板特异性扩增出完整人皮肤桥蛋白成熟肽基因片段(rhdpt基因),所述rhdpt基因的5’端引入ecor1酶切位点,3’端引入not1酶切位点(引入酶切位点的rhdpt基因的碱基序列如seqidno.1所示)以便后续对该rhdpt基因片段插入表达载体;pcr条件为:95℃预变性,5min,一个热循环;95℃热变性30s,55℃退火30s,72℃延伸30s,30个热循环;72℃复性10min。琼脂糖电泳回收扩增rhdpt基因片段,将rhdpt基因片段连接到pmd-20t载体(购自广州takara公司),得质粒rhdpt/pmd-20t,酶切和核酸测序鉴定,测定序列与genebank公布的dpt序列一致。
所述dpt特性扩增引物为:
dptfor:5’-gaattccagtatggcgattatggatac-3’,
dptfor:5’-gcggccgcaacatttgcaaattcacag-3’。
2、构建毕氏酵母分泌型表达载体ppiczαa/rhdpt:
1)用ecorⅰ和notⅰ双酶切重组质粒pmd-20t/rhdpt,获得目的基因片段rhdpt,反应体系如下(所用内切酶及缓冲液均购于thermo公司):
2)用ecorⅰ和notⅰ双酶切重组质粒ppiczαa,获得载体基因片段ppiczαa,反应体系如下(所用内切酶及缓冲液均购于thermo公司):
3)将1)、2)步骤所得的目的基因片段和载体基因片段用dna凝胶回收试剂盒进行纯化回收,该试剂盒购自magen公司,具体操作按试剂盒说明书进行。
4)回收到的目的基因片段rhdpt和载体基因片段ppiczαa用solutionⅰ连接酶(购自大连takara公司,是takara公司的预混连接酶,与t4连接酶是同类产品)进行连接反应,目的基因rhdpt插入到含有分泌信号α-因子的分泌型载体ppiczαa的读码框内,构建示意图见图1(如图所示,表达的重组蛋白含有6*his标签和c-myc标签),反应体系如下:
载体ppiczαa基因片段0.5μl
rhdpt目的基因片段4.5μl
solutionⅰ5μl
得到重组载体ppiczαa/rhdpt。
3、转化重组载体ppiczαa/rhdpt至毕氏酵母x-33:
将10μg经ecorⅰ和notⅰ双酶切验证的ppiczαa/rhdpt重组载体sacⅰ线性化后溶解在50μlmilliq水中,按照invitrigen公司操作手册licl转化法将重组载体ppiczαa/rhdpt转化到宿主毕氏酵母菌x-33中。转化后用含100μg/mlzeocin抗生素的ypdz平板进行阳性克隆筛选。
4、高水平分泌表达酵母转化子的筛选:
将阳性克隆转接至含有500μg/mlzeocin的ypdz平板,筛选到了zeocin抗性的酵母转化子;将含有500μg/mlzeocin的ypdz平板中的酵母转化子利用新鲜的ypd液体培养基将ypdz平板的菌落洗下,经稀释后,涂布到含有1500μg/mlzeocin的ypdz平板中,再将含有1500μg/mlzeocin的ypdz平板中生长的酵母转化子经稀释后涂布到含有3000μg/mlzeocin的ypdz平板中,最后得到最高抗性为3000μg/mlzeocin的高抗性酵母转化子,以bmgy培养基培养至光密度值>10.0,离心收集细胞,用bmmy培养基重悬细胞并使其甲醇浓度为1.0%,30℃、200rpm条件下诱导72h后,经sds-page分析,得到了高水平分泌表达rhdpt的酵母转化子。摇瓶条件下,dpt酵母转化子表达的rhdpt超过45mg/l。
5、rhdpt在摇瓶条件下的扩大表达
高水平分泌表达酵母转化子于1lbmgy培养基培养至光密度值>10,离心收集细胞,用200mlbmmy培养基重悬细胞并使其甲醇浓度为1.0%,每24小时取样一次并补加甲醇一次至终浓度为1%,经诱导72小时后,测定各时间段的样品总蛋白含量,摇瓶条件下,dpt酵母转化子表达的rhdpt超过45mg/l。
6、rhdpt的镍亲合柱纯化
诱导上清液于4℃离心,收集离心后的上清液,用含有0.2mnacl、50mm咪唑、20mmtris(ph8.0)的缓冲液进行透析后,利用镍亲合层析柱于atka-hplc系统中纯化,先用含有0.2mnacl、50mm咪唑、20mmtris(ph8.0)的缓冲液进行漂洗,再利用含有0.2mnacl、500mm咪唑、20mmtris(ph8.0)的缓冲液进行线性洗脱并收集洗脱峰rhdpt蛋白样品,收集mau(毫吸光度)大于100的洗脱液(色谱图如图2)。将收集到的蛋白样品经sds-page分析,结果表明,纯化到的蛋白是2条主带分别为约22kda和25kda的蛋白(如图3)。说明表达的蛋白带有正确的his×6标签和c-myc标签,能利用镍亲合层析柱有效纯化得到该重组蛋白。
7、肽脂纹图谱分析及比对:
镍亲合层析柱纯化到的蛋白经sds-page分析后,发现2条大小分别为22k和25k的蛋白,从胶上切下两条主带进行肽指纹图谱分析,结果表明,两蛋白都是dpt(如图4)。
8、rhdpt的生物学活性分析:
rhdpt体外活性测定:
将3t3-l1细胞接种至96孔板,待细胞融合至70%时分别添加购买的dpt以及用上述方法表达纯化到的不同浓度的rhdpt,分别在添加dpt后的第1天至第4天用mtt法测量活细胞数量。结果发现低浓度的rhdpt(1ug/ml)就具有良好的抑制3t3-l1增殖的效果,1ug/ml浓度的rhdpt比5ug/ml购买的hdpt在抑制3t3-l1增殖效果方面更为显著(如图5所示:横坐标为时间,纵坐标为细胞比例(测量点的活细胞数量与day0活细胞数量的比例))。该结果表明,本发明的方法表达纯化到的rhdpt能抑制3t3-l1的体外增殖,具有良好的体外生物活性。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
sequencelisting
<110>中国科学院广州生物医药与健康研究院
<120>重组人皮肤桥蛋白成熟肽段及其生产方法
<160>3
<170>patentinversion3.3
<210>1
<211>606
<212>dna
<213>人工序列
<400>1
atggacctcagtcttctctgggtacttctgcccctagtcaccatggcctggggccagtat60
ggcgattatggatacccataccagcagtatcatgactacagcgatgatgggtgggtgaat120
ttgaaccggcaaggcttcagctaccagtgtccccaggggcaggtgatagtggccgtgagg180
agcatcttcagcaagaaggaaggttctgacagacaatggaactacgcctgcatgcccaca240
ccacagagcctcggggaacccacggagtgctggtgggaggagatcaacagggctggcatg300
gaatggtaccagacgtgctccaacaatgggctggtggcaggattccagagccgctacttc360
gagtcagtgctggatcgggagtggcagttttactgttgtcgctacagcaagaggtgccca420
tattcctgctggctaacaatagaatatccaggtcactatggtgaggaaatggacatgatt480
tcctacaattatgattactatatccgaggagcaacaaccactttctctgcagtggaaagg540
gatcgccagtggaagttcataatgtgccggatgactgaatacgactgtgaatttgcaaat600
gtttag606
<210>2
<211>27
<212>dna
<213>人工序列
<400>2
gaattccagtatggcgattatggatac27
<210>3
<211>30
<212>dna
<213>人工序列
<400>3
gcggccgcagaagtgttgatgaacatttgg30
- 还没有人留言评论。精彩留言会获得点赞!