一种乳液中进行环介导等温扩增的数字核酸分析方法与流程
本发明属于分子生物学技术领域,尤其是涉及一种乳液中进行环介导等温扩增的数字核酸分析方法。
背景技术:
乳液pcr的原理简单来说是通过单链dna模板与捕获磁珠结合后,pcr反应试剂与油相混合形成乳液,得到一系列皮升大小的小液滴-小而独立的反应室。在这个微小的反应室中进行扩增反应,扩增后的产物富集在磁珠上,通过离心和磁分离收集磁珠,洗脱后对磁珠上的pcr产物进行测序。该技术可将样品稀释到单分子水平,并平均分配到几十至几万个单元中进行反应,最后通过直接计数或泊松分布公式计算得到样品的原始浓度或含量。
然而,目前数字pcr技术的由于pcr反应在乳液中的扩增效率不高,导致磁珠捕获扩增产物进行荧光标记后信号放大效果有限,通常需要对信号进行二次放大等步骤,需要使用更为精密的仪器以及较昂贵的控温设备,这在一定程度上制约了其在核酸数字定量上的发展。
技术实现要素:
针对现有技术存在的不足,本发明旨在提出一种乳液中进行环介导等温扩增的数字核酸分析方法,该方法较于乳液pcr有更高的核酸扩增效率和信号放大效果,而且本发明待测的核酸样本无需预先进行pcr扩增,在扩增反应后直接破乳即可上样分析。
为达到上述目的,本发明的技术方案是这样实现的:
一种用于环介导等温扩增的数字核酸分析方法的乳液,包括水相和油相:
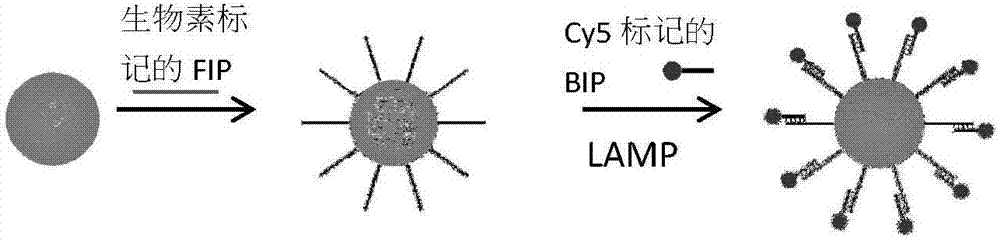
所述水相由生物素标记的内引物与亲和素标记的磁珠复合物、环介导等温扩增的外引物、荧光标记的内引物、反应缓冲溶液、目标核酸(对于mrna而言为反转录产物cdna)、bst聚合酶按体积比(3~6):(6~10):(2~6):(8~13):(0.5~2):(3~8)混合均匀;
所述油相由dc5225c、dc749、ar20按质量比(3~5):(2~4):(2~4)混合均匀;
将所述水相和油相按体积比1:2~1:3加入反应管中研磨,得到稳定乳液。
进一步的,所述乳液在环介导等温扩增的数字核酸分析方法中的应用。
一种乳液中进行环介导等温扩增的数字核酸分析方法,包括如下步骤:
(1)当目标为mrna时,需要预先反转录为cdna;当目标为dna时无需处理;
(1)制备生物素标记的内引物与亲和素标记的磁珠复合物,在离心管中用tes缓冲液洗涤链霉亲和素包被的直径为0.5~2μm的磁珠,洗涤两次后,向磁珠中加入7~15μm生物素标记的引物,室温下孵育15~30分钟,得到制备生物素标记的内引物与亲和素标记的磁珠复合物;
(2)配制乳液;
(3)将反应管放入恒温水浴槽中,在55℃~65℃下反应4~6小时,得到磁性颗粒-环介导等温扩增产物-荧光标记内引物的复合物;
(4)在反应管中加入1毫升异丙醇,破乳洗涤两次,离心后弃去上清收集磁珠;
(5)将步骤(4)得到的磁珠进行显微镜检测,对产生荧光信号的磁珠进行计数;
(6)将步骤(4)得到的磁珠进行流式检测,对产生荧光信号的磁珠进行计数。
进一步的,所述生物素标记的内引物与亲和素标记的磁珠复合物、环介导等温扩增的外引物、另一荧光标记的内引物、反应缓冲溶液、目标核酸(对于mrna而言为反转录产物cdna)、bst聚合酶按体积比3:8:4:10:1:6混合均匀。
相对于现有技术,本发明所述的一种乳液中进行环介导等温扩增的数字核酸分析方法具有以下优势:
(1)本发明所述的一种乳液中进行环介导等温扩增的数字核酸分析方法,该方法较于乳液pcr有更高的核酸扩增效率和信号放大效果,而且核酸样本无需预先进行pcr扩增,并在扩增反应后直接破乳即可上样分析。
(2)本发明所述的一种乳液中进行环介导等温扩增的数字核酸分析方法,此方法对目标序列没有依赖性,只要进行配套的引物设计即可开展目标核酸的数字分析
(3)本发明所述的一种乳液中进行环介导等温扩增的数字核酸分析方法,该方法不需要复杂的芯片、温控设备等成本较高的设备即可完成对核酸的数字分析,简化了实验步骤,利用环介导等温扩增的优势缩短了时间、提高了效率,为基因诊断和基因治疗等研究提供了一种工艺简单、信号稳定、具有较高的灵敏度与准确性的数字核酸分析手段。
附图说明
构成本发明的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1中为整个分析方法的流程图;
图2为磁珠在乳液中的反应原理图;
图3为乳液的显微镜成像图,白色箭头标记为引物标记的磁珠;
图4为破乳收收集磁珠的显微镜成像图;
图5为流式细胞计数图;
具体实施方式
下面结合实施例及附图来详细说明本发明。
实施例1基于环介导等温扩增的核酸数字分析检测志贺氏菌
(1)引物设计:针对志贺氏菌设计环介导等温扩增(lamp)引物。引物序列如下:
志贺氏菌靶基因序列(accessionno.m32063.1):
5'-atcacagatatggcatgcttttgaacatgaagagcatgccaacaccttttccgcgttccttgaccgcctttccgataccgtctctgcacgcaatacctccggattccgtgaacaggtcgctgcatggctggaaaaactcagtgcctctgcggagcttcgacagcagtctttcgctgttgctgctgatgccactgagagctgtgaggaccgtgtcgcgctcacatggaacaatctccggaaaaccctcctggtccatcaggcatcagaaggccttttcgataatgataccggcgctctgct-3'
志贺f3:5’-gttccttgaccgcctttcc-3’
志贺b3:5’-gagggttttccggagattgt-3’
biotin志贺fip:
5’-biotin-cagaggcactgagtttttccagccatgcagcgaccgataccgtctctgcacgc-3’
cy5志贺bip:5’-cy5-ctctgcggagcttcgacagctcctcacagctctcagtgg-3’
(2)制备引物标记的磁珠:
在1.5毫升微量离心管中,用100μltes缓冲液(20mmtris-hcl,ph值7.5;1mnacl)洗涤100μl(7-12×108)链霉亲和素包被的直径1μm磁珠。每次洗涤后,将管放在磁铁上1分钟以浓缩珠子然后用吸管除去上清液,洗涤2次后重新悬浮在100μltes缓冲液中。取10μm生物素标记的引物加入磁珠中,室温下孵育15~30分钟。反应后的磁珠用100μltes缓冲液洗涤三次,备用。
(3)制备乳液:a、水相制备:将生物素标记的内引物(fip)-链霉亲和素磁珠复合物3μl,环介导等温扩增的外引物f3(5μm)、b3(5μm)各4μl,荧光标记的内引物bip(40μm)4μl,thermopol(10x)缓冲溶液10μl,目标核酸1μl、mgso4(10mm)4μl,dntp(10mm)14μl,bsa(1mg/ml)1μl,bst2.0warmstart聚合酶6μl,混合均匀,加灭菌超纯水至100μl。b、油相制备:将dc5225c、dc749、ar20以质量比为40%、30%、30%混合均匀。c、形成乳液:将一个直径3毫米钢珠加入2毫升的反应管中,加入100μ水相反应液和200μl油相,调整组织研磨器的频率28hz,研磨时间1min,使其形成水相液滴直径约为3-10μm的稳定乳液,图3中白色箭头标记为引物标记的磁珠。
(4)lamp反应:将反应管放入恒温水浴中,在63℃下反应1小时,图4中黑色点为阴性磁珠,说明该磁珠所在的液滴未发生环介导等温扩增反应,不存在目标核酸。白色点为阳性磁珠,说明该磁珠所在的液滴发生了环介导等温扩增反应,存在目标核酸。
(5)破乳收集磁珠:在反应管中加入1毫升异丙醇,破乳洗涤两次,离心后弃去上清收集磁珠。用100μltes缓冲液(20mmtris-hcl,ph值7.5;100mmnacl)洗涤磁珠三次,待测;
(6)显微镜检测:调整荧光显微镜参数,在与荧光标记的内引物匹配的640荧光通道下可以拍摄到产生cy5荧光信号的磁珠,即为阳性磁珠,得到阳性磁珠的数量与目标核酸的加入量成正比;
(7)流式检测:调整流式细胞仪参数,对产生cy5荧光信号的磁珠进行计数,得到阳性磁珠的数量与目标核酸的加入量成正比,图5中,左峰为阴性磁珠计数,右峰为阳性磁珠计数。
实施例2基于环介导等温扩增的核酸数字分析检测hcv
(1)引物设计:针对志贺氏菌设计环介导等温扩增(lamp)引物。引物序列如下:
hcv-cdna序列:
5'-gtttaggattcgtgctcatggtgcacggtctacgagacctcccggggcactcgcaagcaccctatcaggcagtaccacaaggcctttcgcgacccaacactactcggctagcagtctcgcgggggcacgcccaaatctccaggcattgagcgggttgatccaagaaaggacccggtcgtcctggcaattccggtgtactcaccggttccgcagaccactatggctctcccgggagggggggtcctggaggctgcacgacactcatactaacgccatggctagacgctttctgcgtgaagacagtagttcctcacaggggagtgattcatggtggagtgtcgcccccatcagggggctggc-3'
hcv-f3:5'-tggtctgcggaaccgg-3'
hcv-b3:5'-ggggcactcgcaagca-3'
hcv-fip:5'-biotin-
tttttttttttttttttttt-spacer18-acgcccaaatctccaggcattgttttcattgccaggacgaccgg-3'
hcv-bip:5'-cy5-ccgcgagactgctagccgattttccctatcaggcagtaccaca-3'
(2)制备引物标记的磁珠:在1.5毫升微量离心管中,用100μltes缓冲液(20mmtris-hcl,ph值7.5;1mnacl)洗涤100μl(7-12×108)链霉亲和素包被的直径1μm磁珠。每次洗涤后,将管放在磁铁上1分钟以浓缩珠子然后用吸管除去上清液,洗涤2次后重新悬浮在100μltes缓冲液中。取10μm生物素标记的引物加入磁珠中,室温下孵育15~30分钟。反应后的磁珠用100μltes缓冲液洗涤三次,备用。
(3)制备乳液:a、水相制备:将生物素标记的内引物(fip)-链霉亲和素磁珠复合物3μl,环介导等温扩增的外引物f3(5μm)、b3(5μm)各4μl,荧光标记的内引物bip(40μm)4μl,thermopol(10x)缓冲溶液10μl,目标核酸1μl、mgso4(10mm)4μl,dntp(10mm)14μl,bsa(1mg/ml)1μl,bst2.0warmstart聚合酶6μl,混合均匀,加灭菌超纯水至100μl;
b、油相制备:将dc5225c、dc749、ar20以质量比为40%、30%、30%混合均匀;
c、形成乳液:将一个直径3毫米钢珠加入2毫升的反应管中,加入100μ水相反应液和200μl油相,调整组织研磨器的频率28hz,研磨时间1min,使其形成水相液滴直径约为3-10μm的稳定乳液。
(4)lamp反应:将反应管放入恒温水浴中,在63℃下反应1小时;
(5)破乳收集磁珠:在反应管中加入1毫升异丙醇,破乳洗涤两次,离心后弃去上清收集磁珠。用100μltes缓冲液(20mmtris-hcl,ph值7.5;100mmnacl)洗涤磁珠三次,待测;
(6)显微镜检测:调整荧光显微镜参数,在与荧光标记的内引物匹配的荧光通道下可以拍摄到产生cy5荧光信号的磁珠,即为阳性磁珠,得到阳性磁珠的数量与目标核酸的加入量成正比;
(7)流式检测:调整流式细胞仪参数,对产生cy5荧光信号的磁珠进行计数,得到阳性磁珠的数量与目标核酸的加入量成正比。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种霍乱弧菌环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于检测番茄晚疫病菌的LAMP引物组合物和应用的制造方法与工艺
- 基于颜色判定的环介导等温扩增(LAMP)技术检测雪松疫霉根腐病菌的制造方法与工艺
- Sortase A介导的(S)‑羰基还原酶寡聚体高效催化(S)‑苯基乙二醇的合成的制造方法与工艺
- 用于旋转机器中的超导线圈的等温支承部和真空容器的制造方法与工艺
- 基于环介导等温扩增消光技术的转基因玉米MIR604检测方法与制造工艺
- 基于环介导等温扩增消光技术的玉米检测方法与制造工艺
- 一套鉴定甘蔗上三种短体线虫的环介导等温扩增引物及其试剂盒的制造方法与工艺
- RNA扩增方法与制造工艺
- 用于扩增核酸样品的等温方法与制造工艺
- 环介导等温扩增多重耐药基因oqxAB的检测引物、检测试剂盒及检测方法与制造工艺
- 一种气单胞菌的核酸等温扩增检测试剂盒及其检测方法与制造工艺
- 一种霍乱弧菌环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于检测番茄晚疫病菌的LAMP引物组合物和应用的制造方法与工艺
- 基于颜色判定的环介导等温扩增(LAMP)技术检测雪松疫霉根腐病菌的制造方法与工艺
- Sortase A介导的(S)‑羰基还原酶寡聚体高效催化(S)‑苯基乙二醇的合成的制造方法与工艺
- 用于旋转机器中的超导线圈的等温支承部和真空容器的制造方法与工艺
- 用于扩增细胞群的方法、试剂盒及装置与制造工艺
- 基于环介导等温扩增消光技术的转基因玉米MIR604检测方法与制造工艺
- 基于环介导等温扩增消光技术的玉米检测方法与制造工艺