一种抑制感光细胞凋亡上的方法及SCF过表达病毒在制备抑制感光细胞凋亡药物上的应用与流程
本发明具体涉及一种抑制感光细胞凋亡上的方法及scf过表达病毒在制备抑制感光细胞凋亡药物上的应用。
背景技术:
视网膜变性是一类因视网膜神经细胞逐渐发生进行性变性而导致视力丧失的异质性疾病,其致病因素比较复杂,主要包括遗传因素和环境因素。流行病学调查显示,视网膜变性是目前我国导致视力丧失的首要因素,而视网膜感光细胞凋亡是引起我国眼盲和低视力的主要原因之一。
由于目前感光细胞凋亡的分子机制尚不明了,至今对视网膜变性相关疾病尚无有效的预防和治疗手段。
技术实现要素:
为了解决现有技术的不足,本发明的提供了一种抑制感光细胞凋亡上的方法及scf过表达病毒在制备抑制感光细胞凋亡药物上的应用。
一种抑制感光细胞凋亡上的方法,通过激活scf/kit信号通路抑制感光细胞凋亡。
所述的方法包括:通过scf在感光细胞中表达增加促进了scf/kit信号通路被激活。
scf为干细胞因子,亦为kit的配体(kitl)。
kit为酪氨酸激酶受体kit,亦为c-kit。
scf过表达病毒在制备抑制感光细胞凋亡药物上的应用。
所述的scf过表达病毒为腺相关病毒aav8-scf。
本发明的有益效果是:本发明提供了scf/kit信号通路在抑制感光细胞凋亡上的应用及scf过表达病毒在制备抑制感光细胞凋亡药物上的应用,利用基因敲除以及腺相关病毒过表达技术,发现干细胞因子/酪氨酸激酶受体kit(scf/kit)信号通路能够抑制感光细胞的凋亡,最终对视网膜产生神经保护作用。因此,scf/kit信号通路能够抑制感光细胞凋亡可用于视网膜变性相关疾病的预防和治疗。
附图说明
图1为强光诱导了两月龄的c57bl/6j小鼠视网膜轻微的损伤分析结果图。(其中图1中a图为抗gfap的视网膜切片免疫荧光结果;b图为视网膜石蜡切片h&e染色结果;c图为视网膜外核层厚度的定量分析统计图。)
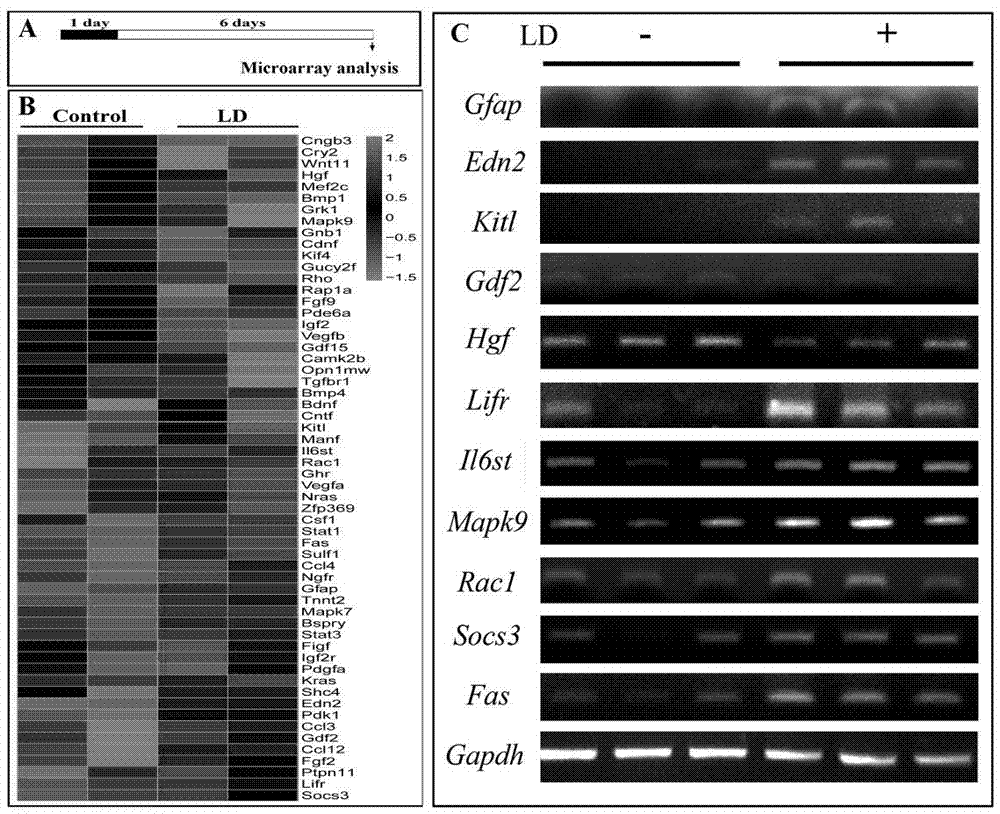
图2为光损伤诱导了视网膜的基因表达改变分析结果图。(其中a图为用于基因芯片分析的光诱导视网膜损伤模型;b图为正常光照条件下(control)和强光处理(ld)的视网膜的基因芯片表达谱分析的热图;c图为对基因芯片结果验证的rt-pcr结果。)
图3为光损伤诱导kitl的表达及激活受体kit分析结果图。(其中a、c、d图分别为检测kitl、kit以及p-kit蛋白量的westernblot实验结果;b图对kitl的含量的数据统计分析。e图为对kit以及p-kit的蛋白含量的数据统计分析。)
图4为光诱导kitl在感光细胞的内节表达分析结果图。(其中a、b图分别为正常光照条件下和强光处理的视网膜抗scf的切片免疫荧光结果。a、b图分别来自a图和b图白色方框区域的放大。gcl,神经节细胞层;inl,内核层;onl,外核层;is,感光细胞内节;os,感光细胞外节。)
图5为wps突变阻断视网膜中的kit活性分析结果图。(其中a为检测眼内注射kitl之后的kit、erk和akt的磷酸化水平变化的westernblot结果图(左)以及数据统计图(右)。b为抗ack45和ab5506的两月龄wt和wps纯合子小鼠视网膜切片免疫荧光图。左侧为两抗体识别受体kit部位示意图;白色箭头为kit阳性信号。rgc,神经节细胞层;ipl,内丛状层;inl,内核层;onl,外核层;is,感光细胞内节。标尺为50μm。)
图6为wps突变促进光诱导的视网膜损伤分析结果图。(其中a为光损伤模式图;b为erg分析的振幅波形图。上半部的振幅图为暗适应标准erg检测结果图,下半部的振幅图为明适应的视锥反应erg检测结果图;c和d分别为暗适应标准erg和明适应的视锥反应的erg数据统计结果图。e为抗gfap的视网膜切片免疫荧光图。control组为正常光照处理,ld组为强光照处理;rgc,神经节细胞层;inl,内核层;onl,外核层。标尺为50μm;**代表p<0.01。)
图7为wps突变促进光诱导的视网膜退行性变性分析结果图。(其中a为h&e染色的视网膜组织形态分析结果图。上部为h&e染色的视网膜切片图,下部为视网膜外核层厚度分析的数据统计图。b为检测rhodopsin在视网膜中表达情况的结果图。上部为抗rhodopsin的视网膜切片免疫荧光结果图,下部为westernblot检测rhodopsin在视网膜中的表达情况的条带图(左)和数据统计结果图(右)。c和d分别为抗opsin的视网膜切片免疫荧光结果图以及其opsin阳性细胞数量的统计结果图。e为tunel分析视网膜细胞凋亡情况的结果图。左边为tunel的切面荧光染色结果图,右边为tunel阳性细胞数量的统计结果图。control组为正常光照处理,ld组为强光照处理;onl,外核层;is,感光细胞内节;os,感光细胞外节。标尺为50μm;*代表p<0.05;**代表p<0.01。)
图8为验证aav-cmv-gfp病毒能特异性感染视网膜感光细胞。(其中a为aav-cmv-gfp病毒载体信息图;b为向wps纯合子小鼠注射aav-cmv-gfp病毒后的眼底图。左列为明场眼底图,右列为gfp绿色荧光眼底图。c为感染aav-cmv-gfp病毒后的视网膜切片荧光图。onl,外核层;rpe,视网膜色素上皮。标尺为50μm,白色箭头为gfp阳性信号。)
图9为aav-cmv-scf病毒在视网膜中的过表达scf情况分析结果图。(其中a为aav-cmv-scf病毒载体信息图。b为感染aav-cmv-scf病毒后的视网膜切片抗scf的免疫荧光图。)
图10为aav-cmv-scf病毒过表达的scf对光诱导的视网膜变性的作用分析结果图。(其中a为分析光诱导视网膜损伤后的视网膜结构变化的h&e染色结果图。b为分析光诱导损伤后的抗视蛋白rhodopsin的免疫荧光图(上排)和细胞凋亡分析的tunel检测(下排)。nl组为正常光照处理,ld组为强光照处理;rgc,神经节细胞层;inl,内核层;onl,外核层;is,感光细胞内节;os,感光细胞外节。)
具体实施方式
第一部分的实施方式:实验动物为2月龄c57bl/6j黑色小鼠。采用正常光(200lux)和强光(15,000lux,飞利浦冷光源led灯)从上往下持续性照射的饲养笼中饲养6天或18天,随后通过h&e染色视网膜组织形态学分析以及抗gfap免疫荧光的muller胶质细胞重新激活分析,建立合适的光诱导视网膜损伤模型。随后,利用基因表达谱芯片分析光损伤诱导的基因表达的改变情况,筛选感兴趣的候选靶基因。最后,通过rt-pcr、westernblot以及免疫荧光等实验,验证由光损伤诱导的候选靶基因表达的变化情况。
本研究采用野生型c57bl/6j小鼠结合长时间的强光照处理,建立了较轻微的光损伤模型,为后续分析光诱导基因表达提供更长的时间窗;随后,利用基因芯片分析光损伤诱导的视网膜基因表达的变化情况,最后运用rt-pcr实验进一步验证差异基因的表达,筛选出一系列的候选神经保护相关分子,其中包括scf/kit信号通路;最后,通过wb以及if检测发现kitl和kit均表达在成熟的视网膜中,且光损伤诱导了kitl的表达并促进kit的磷酸化水平上升。这些结果提示光损伤激活了视网膜中的kitl/kit信号通路。
图1,免疫荧光结果显示,在正常光照情况下,gfap阳性信号仅零星地出现在神经节细胞层,而经强光连续处理6天后(ld6days),gfap阳性信号在神经节细胞层明显增强,且出现在内丛状层和内核层(图1a)。h&e染色结果显示,与正常光照情况下的视网膜结构相比,光照6天的感光细胞外节稍有退化,但不是非常明显,然而光处理18天的感光细胞外节退化非常明显(图1b)。在离视神经约300~700μm的背侧区域,光处理18天的外核层明显变薄,然而在腹侧区域,外核层的厚度与正常对照组相比没有明显的差异,尽管在离视神经300~600μm的区域有一定的变薄趋势(图1c)。这些结果说明光诱导18天的视网膜损伤非常明显,而光诱导6天的视网膜损伤不是非常明显。
图2,基因芯片结果显示,gfap的表达在光诱导的视网膜中明显上调,提示视网膜遭受了光损伤;rhodopsin、grk1以及opn1mw等视觉信号传导相关蛋白的基因表达均受光诱导而明显下调;细胞因子edn2、fgf2、cntf以及相应受体lifr等均受光诱导而明显上调,与此同时,信号通路cntf/lifr的下游基因stat3以及socs3均受光诱导而明显上调;除此之外,干细胞因子(scf,也称kit的配体,kitl)在光诱导损伤的视网膜中也明显上调(图2a)。rt-pcr实验结果显示,gfap的表达在光诱导的视网膜中明显上调,细胞因子kitl(kit配体,也称为干细胞因子,stemcellfactor,scf)在光诱导的视网膜中也明显上调。这些结果显示光诱导scf在视网膜中的表达。
图3,westernblot结果显示,在分子量约40kd(m-kitl)和18kd(s-kitl)大小区域分别出现了特异性的条带,且每条带在光处理的视网膜中的阳性信号均明显强于正常对照组(m-kitl,2.39±0.87倍;s-kitl,4.52±1.57倍,n=3)(图3a,b),说明光损伤诱导了视网膜上调kitl蛋白表达。此外,在光损伤的视网膜中kit磷酸化水平(4.38±0.73倍,n=3)明显要高于正常对照组,说明光损伤激活了kit信号通路。
图4,免疫荧光结果显示kitl在视网膜中主要表达在感光细胞的内节,且受光诱导而在内节高表达(图4)。
第二部分的实施方式:本研究利用2月龄的wps突变小鼠,通过眼内注射外源性scf,选取多个刺激时间点,分析wt和wps纯合子小鼠视网膜中kit的磷酸化水平的变化情况,明确wps突变是否破坏kit对scf的应答。随后,基于实施例1部分的研究结果,光损伤激活了视网膜中的kit信号通路,本部分利用2月龄的wps突变和c57bl/6j小鼠结合光诱导的视网膜损伤模型,在光诱导18天后,通过erg、h&e染色以及tunel检测分析kit信号通路在lird过程中功能。
结果显示,wps突变不仅破环了kit对配体kitl的应答,同时也进一步证明成年视网膜的确存在kit的表达以及其下游信号通路。在强光诱导下,wps纯合子小鼠的erg检测的a波和b波振幅较c57bl/6j小鼠明显下降,视网膜感光细胞层明显退化,并出现大量的凋亡细胞。这些结果提示,wps突变促进了强光诱导的视网膜退行性变性。
图5,在注射kitl(100μg/μl)0.5小时和1小时后,kit磷酸化水平在wt小鼠视网膜中均明显上升(0.5h,2.3±0.32;1h,2.5±0.17,n=4),然而在wps纯合子小鼠上升并不明显(0.5h,1.1±0.132;1h,1.06±0.14,n=4)(图5a)。此外,kit的下游分子erk和akt的磷酸化水平的变化情况与kit磷酸化变化相似,表明注射kitl能够诱导wt小鼠视网膜中erk和akt的磷酸化水平升高,但在wps纯合子小鼠视网膜中却没有这种明显的变化。识别受体kit胞外免疫球蛋白区域的抗体(ack45)在wt视网膜中能检测到阳性信号,分别分布在神经节细胞层、内丛状层、内核层以及外核层,但在wps纯合子小鼠视网膜中难以检测到阳性信号,只在内核层的内则有少量的阳性信号,说明wps降低了kit与抗体ack45的结合(图5b)。识别kit胞内蛋白激酶区域的抗体ab5506均能在wt和wps纯合子小鼠视网膜中检测到阳性信号(图5b)。这些结果提示,wps突变破坏了kit的活性,可能阻断kit与配体kitl的结合而导致活性降低。
图6,小鼠经强光持续诱导18天后,通过视觉神经电生理(erg)检测,发现wt小鼠的标准erg的a波(215±10μv,n=5)和b波(562±63μv,n=5)的波幅与正常光照wt小鼠(a波,347±63μv;b波,853±136μv;n=5)相比均明显下降(图6b,c),提示光损伤诱导了wt视网膜功能退化。虽然在正常光照条件下wps纯合子小鼠的标准erg的a波(400±24μv,n=5)和b波(893±154μv,n=5)的波幅与wt小鼠相比均没有明显的差异,但在光损伤诱导之后,wps纯合子小鼠的标准erg的a波(131±13μv,n=5)和b波(229±79μv,n=5)的波幅较wt小鼠相比下降更为明显(图6b,d)。此外,明适应erg结果也显示类似的现象。光损伤均能诱导wt小鼠和wps纯合子小鼠的b波波幅下降,但wps纯合子小鼠的b波波幅下降更为明显。在正常光照情况下,gfap阳性信号仅仅出现在wt小鼠和wps纯合子小鼠的神经节细胞层,然而在强光损伤之后,gfap在wt小鼠和wps纯合子小鼠视网膜中均明显上调,且wps纯合子小鼠的gfap上调更为明显(图6e)。这些结果均说明wps纯合子小鼠经强光处理后较wt小鼠损伤更明显,提示wps突变促进了光诱导的视网膜损伤。
图7,h&e组织形态学分析结果显示,光损伤均明显导致wt小鼠和wps纯合子小鼠视网膜的外核层变薄,特别是在视网膜背侧区域。光诱导损伤之后,wt小鼠视网膜的感光细胞外节明显缩短,而wps纯合子小鼠视网膜的感光细胞外节几乎完全缺失(图7a)。视杆细胞外节的特异性标记分子rhodopsin进行免疫染色分析结果显示,在光诱导损伤后,rhodopsin在wt小鼠感光细胞外节的表达明显降低,而在wps纯合子小鼠视网膜的感光细胞外节的表达量下降更明显(图7b)。视锥细胞的特异性标记分子opsin进行免疫染色分析结果显示,在正常光照情况下,wt小鼠和wps纯合子小鼠视网膜中的opsin表达均呈现条状,清晰可见且间隔均匀;而经强光处理后,wt小鼠和wps纯合子小鼠视网膜中的opsin表达由原来的条状变为点状,且数量较在正常光照情况下明显减少,特别是wps纯合子小鼠视网膜中的opsin下降更为明显(图7c,d)。tunel检测分析结果显示,在正常光照条件下,wt小鼠和wps纯合子小鼠视网膜中几乎没有出现tunel阳性信号,然而在强光处理之后,tunel阳性细胞均能在wt小鼠(26±8,n=5)和wps纯合子小鼠(68±10,n=5)视网膜外核层中检测到,且wps纯合子小鼠视网膜中的tunel阳性细胞数量明显多于wt小鼠(图7e)。这些结果说明,强光处理的确诱导了视网膜感光细胞的凋亡,且wps突变促进了强光诱导的感光细胞凋亡。
第三部分的实施方式:利用腺相关病毒aav介导的基因过表达技术结合眼内注射,分析scf在光诱导的视网膜退行性变性过程中的功能。首先构建质粒aav8-cmv-scf病毒载体,待测序确定得到正确的载体后,通过病毒包装,获得滴度达1×1012以上的病毒。随后,在立体显微镜下向白化小鼠(abino)进行眼内注射0.5μl病毒液,两周后检测scf表达情况以及进行光诱导损伤实验。最后,在光诱导损伤3天后,利用h&e染色以及tnuel检测,分析scf对视网膜退行性变性的影响。
结果显示,aav8-cmv-scf病毒能够成功介导scf在感光细胞中异常高表达,并能抑制强光诱导的白化小鼠的视网膜退行性变性以及感光细胞的凋亡,说明scf能够抑制感光细胞的凋亡,有望用于治疗感光细胞退行性变性相关的疾病。
图8,在向眼内注射病毒两周后,通过oct眼底镜观察,发现注射病毒的眼底与未注射组相比没有明显的差异,提示眼内注射未造成眼底明显的改变。随后通过绿色荧光通道观察,发现注射病毒组的整个视网膜均有gfp阳性信号,而未注射组未观察到gfp阳性信号(图8b),说明aav8-cmv-gfp病毒能够成功感染整个视网膜。视网膜切片结果显示,gfp阳性信号主要分布在感光细胞的内节,且临近的rpe亦有少量的gfp阳性信号(图8c),说明aav8-cmv-gfp病毒主要感染视网膜的感光细胞,且能成功介导基因过表达。
图9,免疫荧光结果显示,在注射aav8-cmv空载体组,视网膜中scf的表达量非常低,而在注射aav8-cmv-scf病毒组,scf的表达在神经节细胞层和内核层没有出现明显的上调,但在视网膜的外核层却出现了异常地高表达,主要分布在感光细胞的外节以及与内核层神经元细胞之间形成的神经突触的连接处(图9b)。
图10,h&e染色结果显示,强光诱导了abino小鼠视网膜明显变薄,主要表现为外核层变薄,感光细胞外节缺失,然而对侧注射aav-cmv-scf腺病毒的视网膜的厚度明显要厚(图10a)。免疫荧光结果显示,强光诱导了abino小鼠视网膜中的视蛋白rhodopsin异常的分布,同时出现大量的凋亡细胞,然而,在对侧注射aav-cmv-scf腺病毒的视网膜中,视蛋白rhodopsin分布较正常,且凋亡细胞数量明显要低于未注射病毒组的视网膜(图10b)。这些结果说明,注射aav8-cmv-scf能够有效地抑制光诱导的视网膜退行性变性以及感光细胞的凋亡。
以上所述仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!