一种可识别赤藓红的核‑壳型分子印迹聚合物及制备方法与流程
本发明属于分子印迹功能材料技术领域,是一种基于分子印迹技术制备对人工合成色素赤藓红具有特异识别功能的聚合物材料,可用赤藓红的专一性识别与分离。
背景技术:
赤藓红作为一种人工合成色素,由于其着色力强,稳定性好,成本低廉,常用于食品中,以提高其感官性。对于大多数人工合成食品着色剂,其并非作为一种营养物质,不能被人体吸收,而且其制备常以苯、甲苯为原料,经一系列磺化、硝化反应,并且在合成过程中可能会混进砷和铅等重金属,如果对其滥用,对消费者的健康带来巨大的威胁。我国对食品着色剂有明确的使用标准和限量。目前,根据gb2760-2014《食品安全国家标准食品添加剂使用标准》规定,允许使用赤藓红的食品为以下几种:凉果类、可可制品、巧克力和巧克力制品(包括代可可脂巧克力及制品)以及糖果、酱及酱制品、糕点上彩妆、复合调料、果蔬汁类饮料、碳酸饮料、风味饮料(仅限果味饮料)、配制酒,使用限量为0.05g/kg;油炸坚果与籽类、膨化食品使用限量为0.025g/kg;肉灌肠类、肉罐头类使用限量为0.015g/kg;装饰性果蔬,使用限量为0.1g/kg。
目前,对于色素的检测方法主要是高效液相色谱法、紫外分光光度计法、色谱-质谱联用、毛细管电泳法及薄层色谱法等。为了减少食品基质的影响,样品的前处理对后续的仪器精密检测起着至关重要的作用。赤藓红在几种常用的食品着色剂中属于较特殊的一种,对于赤藓红的提取,常用的国标规定的聚酰胺粉吸附对此并不适用,而液液提取消耗的试剂较大,步骤较繁琐,导致工作效率低,而且大部分提取剂都有一定的毒性,长期使用对健康和环境会造成一定的伤害。此外固相萃取也是一种较常用的前处理方法,包括磁固相萃取,分散固相萃取,微固相萃取和分散微固相萃取已广泛用于多残留分析,其精简了检测步骤,节约了大量的溶剂,但固相萃取对于色素的提取缺乏选择性,对于结构类似的物质无法分离,且目前已有固相萃取方法对赤藓红的回收率不高。因此,探索一种新的方法用于赤藓红的检测有着重要的意义。
分子印迹技术(molecularimprintingtechnique,mit)是一种仿抗体技术,是指制备在特定结合位点上与模板分子能够在三维空间上相互识别的印迹聚合物的技术,是一种可以用来模拟天然物质的识别功能,制备具有特异选择性印迹聚合物的人工方法。分子印迹技术的基本原理是以目标分子为模板分子,选择特定的功能单体,在引发剂的作用下在特定的引发条件下通过交联剂的作用聚合在一起,然后用洗脱剂洗去模板分子就可以得到在三维空间上具有特定结构和识别位点的聚合物。与抗体、酶、生物分子相比,分子印迹聚合物显示的固有的特点有以下:印迹聚合物的制备是相当简单和经济的;聚合物展现出良好的物理和化学的稳定性;在极端的化学条件下不会丧失其模板的结合特性。近年来,mips的制备取得了较大的进展,已经开发出多种聚合物的制备方法,如本体聚合、沉淀聚合、悬浮聚合、表面聚合等,制备出各种各样的聚合物。常见的聚合物的形貌主要有块状的、棒状的、球形的、分子印迹膜以及分子印迹聚合物纳米材料如:纳米颗粒、纳米管、纳米线。分子印迹技术已在色谱分离、酶模拟、药物手性分离以及生物模拟传感器等领域得到应用,同时在低浓度分析物的富集、反应过程平衡转移的控制和组合化学库的放映技术等方面也得到了一定的进展。由于分子印迹聚合物优点和特性,如果将其用作一种吸附剂运用到赤藓红色素的检测中,会大大提高赤藓红的回收率,且目前还没有关于赤藓红分子印迹聚合物的相关文章,有研究的意义。
技术实现要素:
本发明的目的是为了克服现有方法的不足(操作步骤繁琐、消耗大量试剂、回收率低等),提供了一种可特异识别赤藓红核壳型分子印迹聚合物微球的制备方法,它是利用分子印迹技术制备仿抗体分子识别性能的功能性材料,其可简化操作步骤,降低溶剂的使用量,提高回收率。
为了实现本发明的目的,本发明人通过大量试验研究和不懈探索,最终获得了如下技术方案:
首先以二氧化硅微球为载体,在其表面进行氨基化修饰,氨基化完成后将氨基化的二氧化硅作为聚合反应的内核。将模板和功能单体在室温下进行孵育进而形成欲聚合物。然后将欲聚合物、交联剂和引发剂加入到含有氨基化二氧化硅微球内核的反应溶剂中进行第二步聚合反应,从而使得二氧化硅微球表面形成一层较薄的分子印迹外壳层。最后使用洗脱剂将聚合物表面的模板移除后,将会在微球表面的分子印迹薄层中留下模板分子的印迹空穴,用来与模板分子进行互相识别,具体制备方法如下:
(1)活化二氧化硅微球的制备:称取二氧化硅微球于烧瓶内,加入naoh,放在磁力搅拌器上室温下搅拌腐蚀30min,然后用超纯水洗脱,被碱处理过的二氧化硅再用hcl在90℃条件下回流8h,回流结束后用超纯水洗脱至中性,干燥,所述氢氧化钠、盐酸的浓度分别为0.25mol/l、2mol/l。
(2)氨基化二氧化硅微球的制备:将活化的二氧化硅微球放置在烧瓶内,加入甲苯,再加入硅烷偶联剂,超声15min,在90℃回流12h,回流结束后甲醇洗去未反应的硅烷偶联剂,将所得的氨基化二氧化硅粒子过滤,干燥,备用,其中硅烷偶联剂占甲苯体积的5%,所述的硅烷偶联剂为3-氨丙基三乙氧基硅烷(aptes),。
(3)欲聚合物的制备:准确称取赤藓红溶解在甲醇、水的混合物中,并加入功能单体,室温下搅拌孵育2h,所述的功能单体为4-乙烯吡啶(4-vp),甲醇、水的混合物中甲醇、水的体积比为4:1。
(4)赤藓红分子印迹聚合物的制备方法:在步骤(3)的反应物中依次加入氨基化二氧化硅微球、交联剂、引发剂,超声混匀,室温下磁力搅拌10min后上端加装三通玻璃管,通入氮气30-60min,以除去氧气;并将装有反应液的密闭容器放置在磁力搅拌器上,持续搅拌,60-70℃下油浴加热,反应24h后将其取出,反应结束后生成的聚合物用g1砂芯漏斗抽滤,以滤去小颗粒。然后用含10%氨水的甲醇用索氏提取的方式进行洗脱模板,最后一次用甲醇洗脱,洗去聚合物内的氨水,将聚合物干燥,即可收集到分子印迹聚合物,所述的交联剂为二甲基丙烯酸乙二醇酯(egdma),所述的引发剂为偶氮类如偶氮二异丁腈(aibn),功能单体、交联剂摩尔比为1:5,功能单体、交联剂在反应体系中的体积百分数2%。
使用本方法可得到对赤藓红具有特异性识别功能的核-壳型分子印迹聚合物微球,可作为一种吸附材料,对食品中赤藓红进行识别和吸附。
与现有技术相比,本发明的优点为:本发明采用表面分子印迹技术,以氨基化修饰的二氧化硅为核心,以赤藓红色素分子为模板,在其表面包裹一层印迹层。其优点为:印迹位点在聚合物表面,模板容易从聚合物上洗脱下来;克服了吸附/解吸过程的动力学缓慢和质量转让的缺点。其吸附色素的基本原理是通过赤藓红和4-乙烯基吡啶之间的静电作用相互识别,制备的核壳型印迹聚合物能够快速准确的对赤藓红进行特异性识别。
附图及其说明:
图1.核壳型赤藓红分子印迹聚合物微球的合成路线及其对赤藓红识别的示意图。
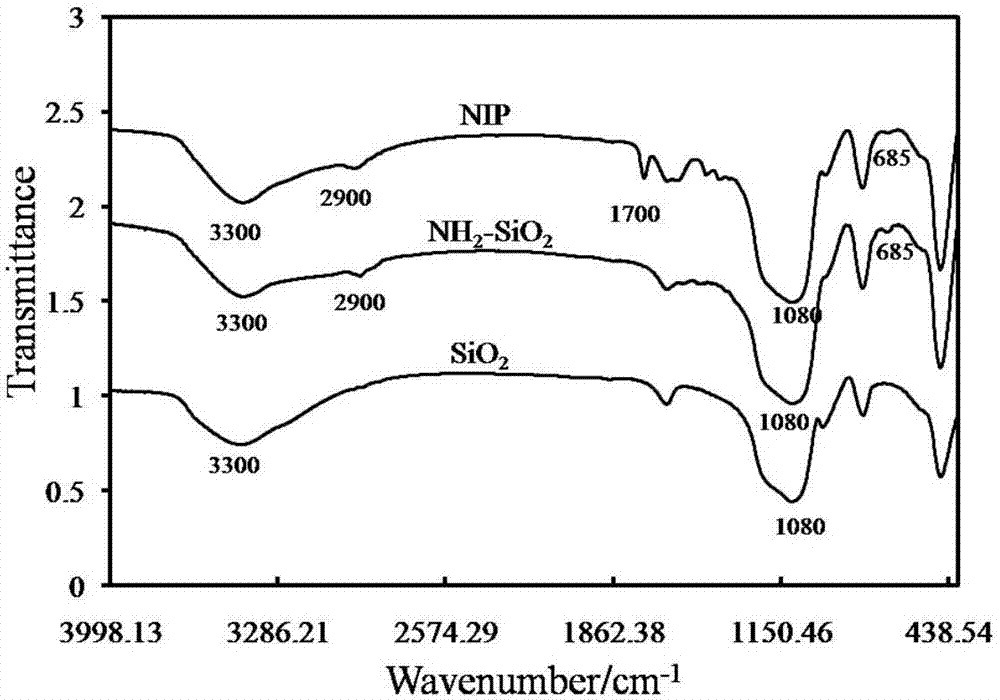
图2.实验所获得的二氧化硅、氨基化二氧化硅、非印迹聚合物微球(nip)的红外图谱照片。
图3.mip/nip微球对模板分子赤藓红的吸附动力学图。
图4.mip/nip微球对模板分子赤藓红的等温吸附性能图。
图5.mip/聚酰胺粉加标图。a表示吸附原液,b表示原液经聚酰胺粉吸附回收的色素,c表示原液经mip吸附所回收的色素,图a中离心管内赤藓红的浓度从左到右分别为:0、1、5、10μg/ml,图b和图c与图a相对应。
具体实施例
以下是本发明的具体实施例,对本发明的技术方案做进一步作描述,但是本发明的保护范围并不限于这些实施例。凡是不背离本发明构思的改变或等同替代均包括在本发明的保护范围之内。
(一)仪器和试剂
(1)仪器装置
c-maghs7磁力搅拌器(德国ika公司);kq5200超声波清洗器(昆山市超声仪器有限公司);al104精密电子分析天平(梅特勒—托利多仪器有限公司);zrd—7230全自动新型干燥箱(上海智城分析仪器制造有限公司);uv—lambda35紫外—可见分光光度计(铂金艾尔默公司);vp30真空抽滤泵(北京莱伯泰科仪器公司);ft-ir2000傅里叶红外扫描仪;电热恒温水槽(上海精宏实验设备有限公司);tgl-16g台式离心机(上海安亭科学仪器厂制造);ultimate3000高效液相色谱仪。
(2)试剂
二甲基丙烯酸乙二醇酯(egdma)、赤藓红(分析纯,阿拉丁);4-乙烯基吡啶、甲醇、氨水、聚酰胺粉(分析纯、国药集团化学试剂);偶氮二异丁腈(aibn)(98%,源叶生物);0.45μm水系滤膜(醋酸纤维;上海兴亚净化材料厂);0.45μm有机相滤膜(尼龙66;津隆);0.22μm水系针头滤器(聚醚砜,上海摩速科学器材有限公司);0.22μm疏水相针头滤器(聚四氟乙烯;上海摩速科学器材有限公司);氢氧化钠(分析纯,国药集团化学试剂有限公司);盐酸(分析纯,开封东大化工有限公司试剂厂);3-氨丙基三乙氧基硅烷(阿拉丁);甲苯(分析纯,上海凌峰化学试剂有限公司)。
(二)实验步骤
实例1:二氧化硅表面氨基化修饰
准确称取1g固体氢氧化钠,加100ml超纯水溶解,配置成浓度为0.25mol/l的氢氧化钠水溶液;准确量取6.18ml盐酸,加入93.82ml超纯水稀释,配置成浓度为2mol/l的盐酸水溶液。
(1)二氧化硅的活化:准确称取10g二氧化硅微球于250ml的圆底烧瓶内,加入100mlnaoh(0.25mol/l),放在磁力搅拌器上室温下搅拌腐蚀30min,然后用超纯水洗脱;被碱处理过的二氧化硅再用100ml、2mol/l的hcl在90℃条件下回流8h,回流结束后用超纯水洗脱至中性,干燥。
(2)二氧化硅表面氨基化:称取10g活化过的二氧化硅于250ml的圆底烧瓶内,加入100ml的甲苯,再加入5ml的3-氨丙基三乙氧基硅烷(aptes),超声15min,在90℃回流12h,回流结束后甲醇洗去未反应的aptes,将制备的氨基化的二氧化硅粒子过滤,干燥,备用。
实例2:赤藓红分子印迹聚合物和非分子印迹聚合物的制备
准确称取赤藓红0.2375mmol溶解在50ml甲醇:水=4:1(v/v)中,并将功能体4-vp(0.95mmol)加入到溶液中,室温下搅拌孵育2h,然后依次加入表面修饰过的二氧化硅(1g)、交联剂egdma(4.75mmol)、引发剂aibn(0.014g),超声混匀,然后装入圆底烧瓶内,室温下磁力搅拌10min后上端加装三通玻璃管,通入氮气(60min),以除去氧气。
将装有上述反应液的密闭容器放置在磁力搅拌器上,调节适当转速持续搅拌,70℃下油浴加热,反应24h后将其取出,反应液发生聚合从而制备赤藓红分子印迹聚合物(mip),反应过程中利用三通管的气球装置始终保持密闭容器的氮气环境,反应结束后聚合物用g1砂芯漏斗抽滤,以滤去小颗粒,然后用含10%氨水的甲醇用索氏提取的方式进行洗脱模板,最后一次用甲醇洗脱,洗去聚合物内的氨水。将聚合物干燥,收集mip。非印迹聚合物(nip)的制备除不加模板外,其它步骤与mip一样。
通过红外光谱仪对二氧化硅、氨基化二氧化硅及nip进行表征,结果如图2所示,对比未氨基化修饰的二氧化硅,在图中可以看出氨基化二氧化硅在1500cm-1和685cm-1处有峰出现,这是由于氨基化二氧化硅在1500cm-1左右处的c-n键和在685cm-1处的si-c键的伸缩振动引起的,说明二氧化硅的氨基修饰上去了。对比氨基化二氧化硅和nip的红外图谱,发现nip在1700cm-1左右处有峰,而氨基化二氧化硅没有,这是由于交联剂中c=o伸缩振动产生的,说明成功的在氨基化二氧化硅外面包裹了一层壳。
实例3:吸附动力学实验
准确称取7.2mg赤藓红固体样品,溶解于12ml超纯水中,超声混匀,配制成浓度为600μg/ml的赤藓红水溶液。取10个4ml离心管并标记序号,然后分别称取10mg制备好的mip微球和nip微球固体放置其中,两种微球各5管。向每个离心管内加入1ml浓度为600μg/ml赤藓红水溶液,超声混匀,然后室温下静置吸附。在吸附时间为5、15、30、45、60min时取样,离心取上清液,用紫外-可见分光光度仪(uv-vis)测其在533nm处的吸光值,通过(1)公式计算其吸附量(q),观察其吸附量随吸附时间的变化规律。
其中,q为吸附量(μg/mg);c0为吸附前赤藓红溶液的浓度(μg/ml);c为吸附后赤藓红溶液的浓度(μg/ml);v为吸附液体积(ml);m为聚合物的质量(mg)。以吸附时间(t)为横坐标,吸附量(q)为纵坐标作图,研究吸附量(q)随吸附时间的变化关系。结果如图3所示,mip和nip在15min时达到吸附平衡。
实例4:等温吸附实验
准确称取8mg赤藓红固体样品,溶解于8ml去离子纯水中,超声混匀,配制成1mg/ml的赤藓红水溶液。取8个4ml离心管并标记序号,配制成浓度分别为50μg/ml、100μg/ml、150μg/ml、200μg/ml、250μg/ml、350μg/ml、600μg/ml、800μg/ml的赤藓红水溶液各3ml。
然后分别称取10mg制备好的mip微球和nip微球固体放置4ml离心管内,两种微球各8管,并在各离心管上标记上50-800μg/ml不同的浓度,按照标号依次向各离心管中加入1ml浓度为50-800μg/ml的赤藓红水溶液,超声混匀后,微球浓度为10mg/ml,室温下静置吸附20min。吸附完成后,离心(15min,12000r/min),取上清液,用紫外-可见分光光度仪测定溶液中未被吸附的赤藓红在533nm处的吸光值。根据吸光值的变化算出赤藓红吸附前后浓度的变化,然后通过公式计算进而得出聚合物的吸附量。结果如图4所示,mip的饱和吸附量约为29μg/mg。
实例5:实际样品加标回收实验
选取黄色不含任何人工合成色素的“农夫果园果汁”饮料作为实验对象,在果汁样品中加入不同量的赤藓红,加标浓度配制为:0、1、5、10μg/ml。
分别准确称取20mg印迹聚合物(mip)和聚酰胺粉各4份于4ml的离心管内,然后加入2ml不同浓度的赤藓红果汁溶液,室温下静置吸附20min。静置吸附完成后,离心(12000r/min,15min),去除上清,保留离心管内的物质。
将离心管内的物质做两种处理,一种是先除杂即在每个离心管内加入2ml的淋洗液(v水:v甲酸:v甲醇=4:2:4),超声洗脱,离心(12000r/min,15min),去除上清,再用洗脱剂进行模板洗脱。另一种方法是直接进行模板洗脱,中间没有淋洗的过程,即在离心管内加入2ml10%的氨化甲醇溶液进行模板洗脱,超声,离心(12000r/min,15min),取上清液。
将得到的上清液过0.22μm的有机系针头滤器,然后将上清液放置水浴锅内蒸至200μl左右加甲醇复溶,过0.22μm聚四氟乙烯疏水系针头滤器,然后用hplc进行分析,计算其回收率。结果如表1和表二及图5所示,未经过淋洗步骤的mip回收率高于含有淋洗步骤的回收率,且mip的回收率较高于聚酰胺粉,在85%以上。以上这些结果表明赤藓红分子印迹聚合物可以用于食品样品中赤藓红的选择性吸附分离,且过程中不需要淋洗步骤节约了大量的有机溶剂,可以做为一种潜在的固相萃取吸附材料。
hplc分析条件:
紫外器检测,检测波长:254nm。
流动相:甲醇:乙酸铵溶液(ph=4,0.02mol/l)。
梯度洗脱:甲醇:20%-35%,3%/min;35%-98%,9%/min;98%继续6min。
流速:1ml/min。
乙酸铵溶液配置:准确称取1.54g乙酸铵固体样品,加水定溶至1000ml,超声使其充分溶解,用乙酸调ph至4,过0.45μm水系有机滤膜。
表1赤藓红在加标果汁中的回收率和精确度
注:在实验过程中包含淋洗步骤。
表2赤藓红在加标果汁中的回收率和精确度
- 还没有人留言评论。精彩留言会获得点赞!
- 磁性胶体核壳结构γ‑Fe2O3及Fe3O4的制备方法与流程
- 一种核壳结构Au@SiO2负载Pt纳米球的制备方法与流程
- 一种核壳结构Ag@TiO2@Pt纳米复合材料的制造方法与工艺
- 一种基于Ag@In核壳结构的高温钎料及其制备方法与流程
- 一种核壳结构Au@Co(OH)2纳米微球的制备方法与流程
- 一种制备核‑壳结构的高介低损钛酸铜钙基陶瓷的方法与流程
- 一种具有核壳结构的微球复合负极材料及其制备方法和应用与制造工艺
- 一种防潮耐水含橡胶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种耐盐雾含茶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种含锭子油的高流动性核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种核壳结构Au@SiO2负载Pt纳米球的制备方法与流程
- 一种核壳结构Ag@TiO2@Pt纳米复合材料的制造方法与工艺
- 一种基于Ag@In核壳结构的高温钎料及其制备方法与流程
- 一种核壳结构Au@Co(OH)2纳米微球的制备方法与流程
- 一种制备核‑壳结构的高介低损钛酸铜钙基陶瓷的方法与流程
- 一种具有核壳结构的微球复合负极材料及其制备方法和应用与制造工艺
- 一种防潮耐水含橡胶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种耐盐雾含茶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种含锭子油的高流动性核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种含椰子油的抗氧化核壳结构纳米改性变压器油及其制备方法与制造工艺