一种大鲵虹彩病毒MCP抗原的制备方法及其应用与流程
本发明涉及生物领域,具体涉及一种大鲵虹彩病毒mcp抗原的制备方法及其应用。
背景技术:
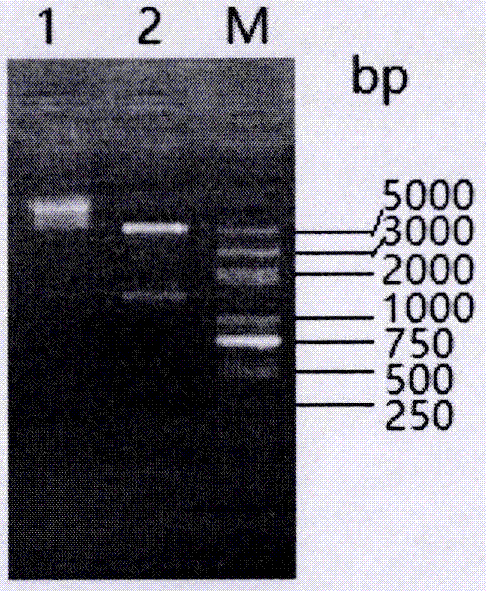
:中国大鲵(chinesegiantsalamander,andriasdavidianus)是现存个体最大的两栖动物,俗名“娃娃鱼”,是我国的珍贵特产,属于国家二级保护动物。近年来在我国的陕西、湖北、湖南、浙江、贵州等省份的大鲵主养区暴发了大鲵虹彩病毒病(chinesegiantsalamanderiridovirusdisease,cgsivd),该病可感染各种规格的养殖大鲵,死亡率高达90%以上,给大鲵养殖业造成了巨大的经济损失。大鲵虹彩病毒病的病原为大鲵虹彩病毒(chinesegiantsalamanderiridovirus,cgsiv),是虹彩病毒科(iridoviridae),蛙病毒属(ranavirus)的成员。虹彩病毒(iridoviruses)是一类病毒粒子较大,呈二十面体状的双链dna病毒。虹彩病毒科(iridoviridae)分为五个属:绿虹彩病毒属(chloriridovirus),虹彩病毒属(iridovirus),淋巴囊肿病毒属(lymphocystivirus),巨大细胞病毒属(megalocytivirus)和蛙病毒属(ranavirus)。虹彩病毒可感染无脊椎动物(绿虹彩病毒属,虹彩病毒属)及变温脊椎动物(蛙病毒属,淋巴囊肿病毒属,巨大细胞病毒属),包括两栖类、爬行类、甲壳类、软体动物、昆虫及鱼类等。脊椎动物虹彩病毒,尤其是蛙病毒属的一些成员已经成为导致变温动物发病的一个重要原因。为有效防控cgsiv的流行,目前众多学者针对cgsiv建立多种诊断方法,如环介导等温扩增(loop-mediatedisothermalamplification,lamp)检测方法、巢式pcr法等检测方法(刘星星,等.2014;meng,etal.,2013)。但这些方法均是建立在pcr检测原理基础之上,或者易污染,结果假阳性率较高,或者需要的仪器设备较为昂贵,用时较长,现场使用不便利。实际生产和科研都亟需更为简便、快速的免疫学检测方法用于现场cgsiv的检测和筛查。血清学检测方法是病毒性疾病的主要免疫学方法。其中通过检测感染后机体产生特异性抗体可以及早对机体是否感染病毒做出较为准确的判断。研究表明,动物在感染虹彩病毒或接种相应病毒灭活疫苗最早一周之内,就可以检测到特异性的抗体(maniero,etal.,2006;liu,etal.,2014)。elisa检测方法以其操作简便,检测样本量大等优点已经成为病毒血清学检测的主要手段。而在血清学检测方法的建立中,抗原的纯度和良好的抗原性是基础。主要衣壳蛋白(majorcapsidprotein,mcp)是虹彩病毒的一个晚期基因,在虹彩病毒感染的晚期大量表达,编码核苷酸全长为1392bp,编码氨基酸为463个氨基酸残基,编码的主要衣壳蛋白分子量约为50kd,构成病毒的二十面体衣壳。比较虹彩病毒mcp基因的氨基酸序列发现,虹彩病毒mcp基因的氨基酸序列是高度保守的,同一属的同源性一般在90%以上,不同属之间的同源性一般为40%-50%左右(tidona,etal.,1998;chinchar,etal,2011)。mcp能够诱导机体产生中和抗体的主要保护性抗原,是制备虹彩病毒人工抗原的首选靶蛋白(qin,etal.,2002;li,etal.,2014;liu,etal.,2015;zhou,etal.,2015)。很多发明者针对各自虹彩病毒mcp制备人工抗原,但通过体外重组表达全长mcp作为人工抗原,因生产过程中mcp表达量少,导致制备成本增加。为此,多数学者通过对mcp进行截短表达,以期提高表达量。但这样,mcp的抗原性就会变得较差。再者,为便于后续蛋白的纯化,已有的研究往往在表达各自虹彩病毒mcp时加入各种商业化的标签,这样虽然纯化步骤较为简单,但在应用时又要切割掉标签,无形之中导致操作步骤繁琐。近年来,杆状病毒表达载体因其具有操作简单、安全性高,可容纳大的目的基因,表达外源蛋白效率高,有翻译后修饰的作用,表达蛋白的免疫原性和抗原性、生物活性与天然的蛋白相似等优点,已经在表达载体上占了主导的地位(anderson,etal.,1995;wang,etal.,2001)。技术实现要素:为解决上述问题,本发明提供了一种大鲵虹彩病毒mcp抗原的制备方法及其应用。为实现上述目的,本发明采取的技术方案为:一种重组杆状大鲵虹彩病毒的构建方法,包括如下步骤:s1、以cgsiv-ly分离株mcp基因序列(genbankno.kf023635)为原始模板,序列表见seqidno.1;根据杆状病毒表达系统密码子的偏爱性人工合成cgsivmcp基因的序列,修饰后的基因序列如seqidno.2所示;根据人工修饰合成的mcp基因序列和杆状病毒穿梭载体pfastbac1所含的酶切位点,设计特异扩增引物,分别引入ecori、hindiii酶切位点,pcr扩增人工修饰mcp基因。引物序列如下:p1:5′-ccggaattcatgtcttctgtaactgg-3′(ecori);p2:5′-cccaagcttttacaagattgggaatcc-3′(hindiii);总体积为50μl的反应体系为:0.5μl的t5u/μl的takaraextaq,5.0μl10×extaqbuffer(mg2+plus),0.25nmol/ldntps4.0μl,引物50pmol/l各1.0μl,dna模板1μl,ddh2o补充至50μl;反应条件为:95℃3min,95℃45s,60℃45s,72℃1min,30个循环,72℃充分延伸10min;10g/l的琼脂糖凝胶电泳检测pcr产物,胶回收pcr产物;s2、将回收的人工修饰的mcp基因连接到pmd-18t载体,反应体系(总体积为10μl):1μlpmd-18t载体、2μl回收的核酸片段、5μlddh2o、1μl10×ligasebuffer、1μlt4dnaligase。充分混匀后,16℃低温水浴槽中连接过夜。转化大肠杆菌感受态细胞后过夜培养;菌落pcr方法检测目的片段是否连接到载体pmd-18t上;s3用质粒dna小量提取试剂盒提取质粒,分别用ecori和hindiii限制性内切酶双酶切pfastbac1载体和重组质粒,回收纯化后用t4dna连接酶连接,再转化至e.colidh5α感受态细胞中,涂布含amp(100mg/ml)的平板,筛选阳性克隆,挑取阳性克隆扩大培养后用质粒抽提试剂盒抽提质粒,进行酶切鉴定及测序,将鉴定正确的重组质粒命名为pfastbac-mcp;s4、将重组质粒pfastbac-mcp转化e.colidh10bac感受态细胞,涂布三抗(gen、kan、tet)、bluo-gal、iptg平板进行蓝白斑筛选,挑取白色菌落三次划线纯化,经m13通用引物和mcp特异性引物pcr初步鉴定后,测序进一步鉴定,将确认结果正确的阳性重组转座子,命名为rbacmid-mcp;s5、通过碱裂解法提取rbacmid-mcp质粒,然后将2μg的rbacmid-mcp质粒与10μl转染试剂轻轻混合后转染于细胞密度约为1×106个/ml的sf9单层细胞,27℃继续培养,待80%细胞出现病变后,收集细胞上清标记为p1代重组杆状病毒病毒,将p1代重组病毒继续感染sf9细胞,经3代扩大培养,得宿主细胞上清;s6、将所得的宿主细胞上清与制备好的免疫磁珠混匀,37℃孵育2h,用磁力架收集磁珠,洗涤2次,将磁珠悬浮于500μlph2.5gly-hcl,孵育5min,磁力收集磁珠,上清用100μlph8.0tris-hcl中和,即获得纯化后的大鲵虹彩病毒mcp抗原。所述免疫磁珠制备方法是将每500μlnhs磁珠洗涤后,与350μl的小鼠抗大鲵虹彩病毒mcp单抗结合,再按照产品说明书要求即可制备免疫磁珠。上述制备的大鲵虹彩病毒mcp抗原可用于制备检测大鲵虹彩病毒抗体elisa试剂盒,所述试剂盒包括所述的大鲵虹彩病毒mcp抗原、辣根过氧化物酶标记的小鼠抗大鲵虹彩病毒mcp单克隆抗体、阴性对照、阳性对照、底物反应液、洗涤液和反应终止液。本具体实施本具体实施将大鲵虹彩病毒mcp表达基因整合到质粒上得到重组质粒,而后将所述重组质粒利用杆状病毒表达系统表达大鲵虹彩病毒mcp;所述的大鲵虹彩病毒mcp表达基因是在大鲵虹彩病毒mcp天然表达基因基础上,以杆状病毒偏嗜密码子替换其中的杆状病毒非偏嗜密码子所修饰后的基因;在此基础上进一步优选的,所述大鲵虹彩病毒mcp表达基因,其核苷酸序列如seqidno1所示。在该优选技术方案中,所述大鲵虹彩病毒mcp天然表达基因,是指自然条件下野生型大鲵虹彩病毒mcp蛋白表达基因;所述的修饰,是指对基因的改造,这种改造行为应当保证改造前和改造后所表达的蛋白氨基酸序列不变,所述杆状病毒表达系统是杆状病毒表达系统。在该优选技术方案中,所述杆状病毒表达系统专指由美国thermofisherscientific公司出品的品牌为invitrogen的杆状病毒表达系统;所述大鲵虹彩病毒mcp表达基因,其核苷酸序列如seqidno.2所示。所述的小鼠抗大鲵虹彩病毒mcp单克隆抗体由杂交瘤细胞株mcp26分泌得到,所述的杂交瘤细胞株mcp26保藏于中国典型培养物保藏中心,保藏编号为:cctccc201533。优选地,重组杆状病毒感染宿主细胞的感染复数为10。本发明对大鲵虹彩病毒mcp蛋白编码基因和氨基酸进行分析,根据杆状病毒表达系统的密码子偏好性,对大鲵虹彩病毒mcp编码核苷酸序列进行了优化,同时通过优化表达条件,在不改变目的蛋白编码氨基酸的前提下,提高了大鲵虹彩病毒mcp蛋白在杆状病毒表达系统中的表达量,并利用已制备的小鼠抗大鲵虹彩病毒mcp单抗应用免疫磁珠法进行表达的mcp蛋白的纯化,纯化方法具有操作简单、用时短、收率和纯度均很好的效果。另外,利用制备的大鲵虹彩病毒mcp抗原包被elisa板制备了检测大鲵虹彩病毒抗体的elisa试剂盒,实现大鲵是否感染病毒和疫苗免疫效果评价的简便、快速,规模化检测。本发明具有以下有益效果:1、大鲵虹彩病毒mcp是该病毒的主要保护性抗原蛋白,也是建立大鲵虹彩病毒血清学检测方法的首选抗原。本发明所述的大鲵虹彩病毒mcp抗原为杆状病毒系统表达所表达,杆状病毒表达系统表达的外源蛋白,可进行正确的折叠、翻译后修饰等,表达产物更接近天然蛋白。2、本发明在不减弱大鲵虹彩病毒mcp抗原性的情况下,根据杆状病毒密码子偏好性,重新编码基因,通过优化表达条件,提升了重组蛋白大量表达。3、本发明在已制备小鼠抗大鲵虹彩病毒mcp单克隆抗体的基础上,应用免疫磁珠法纯化目的蛋白,蛋白纯度达到95%以上,且纯化方法操作简单、快速,纯度和抗原性均很好。4、本发明利用所制备的大鲵虹彩病毒mcp抗原制备了可用于大鲵虹彩病毒抗体检测的阻断elisa检测试剂盒,具有很高的灵敏度和特异性。附图说明图1为本发明实施例中mcp基因扩增产物电泳图;图中:m:dl2000dna分子量标准;1:mcp扩增产物。图2为本发明实施例中重组质粒pfastbac-mcp的酶切鉴定图中:m:dl5000分子量标准;1.pfastbac1单酶切产物;2:pfastbac-mcp双酶切产物。图3为本发明实施例中重组杆粒rbacmid-mcp的pcr鉴定;图中:m:dl5000dna分子量标准;1:mcp的pcr扩增产物2:rbacmid-mcp的pcr扩增产物。图4为本发明实施例中重组杆状病毒(acnpv-mcp)的免疫电镜观察图。a:正常sf9细胞对照;b:重组杆状病毒感染的sf9细胞(箭头为胶体金标记的重组杆状病毒)图5为本发明实施例中重组mcp蛋白的sds-page鉴定;图中:a:野生型杆状病毒感染的sf9细胞(72h);b:感染acnpv-mcp后72h的sf9细胞。图6为本发明实施例中间接免疫荧光法检测重组mcp蛋白的表达图中:m:蛋白分子量标准;1:阴性对照;2:rbacmid-mcp转染sf9昆虫细胞(moi=10);3:rbacmid-mcp转染sf9昆虫细胞(moi=5);4:rbacmid-mcp转染sf9昆虫细胞(moi=2)。图7为本发明实施例中纯化重组mcp蛋白的sds-page图图中1为纯化的mcp;m为蛋白分子量标准图8为表达的mcp蛋白和纯化后的mcp蛋白的western-blot鉴定图中m:蛋白分子量标准;c:阴性对照:1:未经纯化的mcp蛋白;2:纯化的mcp蛋白。图9为本发明实施例中大鲵虹彩病毒衣壳蛋白天然表达基因与修饰后的基因核苷酸序列对照图;图中,optimized字样代表修饰后的基因序列,original字样代表大鲵虹彩病毒衣壳蛋白天然表达基因序列,二者序列存在差异的部分通过下划线表示。具体实施方式为了使本发明的目的及优点更加清楚明白,以下结合实施例对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。实施例1人工修饰cgsivmcp基因的重组质粒pfastbac-mcp的构建1.cgsivmcp基因的人工修饰合成在保持氨基酸不变的前提下,将密码子改造为杆状病毒偏嗜密码子,提高表达量。进行密码子优化时,优先选择昆虫细胞使用频率最高的密码子。根据具体情况(避免多个重复序列的出现等)作适当调整,若不能使用频率最高的密码子,则选择使用频率次高的密码子。根据上述理论,以cgsiv-ly分离株mcp基因序列(genbankno.kf023635)为原始模板,根据密码子的偏爱性人工合成cgsivmcp基因的序列,修饰后的基因序列如seqidno.2所示,修饰前后的基因序列对比情况图9所示。以上修饰前后基因所编码的氨基酸序列如seqidno.3所示2.人工修饰mcp基因的扩增根据人工修饰合成的mcp基因序列和杆状病毒穿梭载体pfastbac1所含的酶切位点,设计特异扩增引物,分别引入ecori、hindiii酶切位点。引物序列如下:p1:5′-ccggaattcatgtcttctgtaactgg-3′(ecori);p2:5′-cccaagcttttacaagattgggaatcc-3′(hindiii)。体积为50μl的反应体系为:0.5μltakaraextaq(5u/μl),5.0μl10×extaqbuffer(mg2+plus),0.25nmol/ldntps4.0μl,引物(50pmol/l)各1.0μl,dna模板1μl,ddh2o补充至50μl。反应条件为:95℃3min,95℃45s,60℃45s,72℃1min,30个循环,72℃充分延伸10min。10g/l的琼脂糖凝胶电泳检测pcr产物,检测大小为1392bp(图2),符合预期。胶回收pcr产物。3.人工修饰的mcp基因连接到pmd-18t载体将回收的人工修饰的mcp基因连接到pmd-18t载体,反应体系(总体积为10μl):1μlpmd-18t载体、2μl回收的核酸片段、5μlddh2o、1μl10×ligasebuffer、1μlt4dnaligase。充分混匀后,16℃低温水浴槽中连接过夜。转化大肠杆菌感受态细胞后过夜培养,菌落pcr方法检测目的片段是否连接到载体pmd-18t上。4.重组质粒pfastbac-mcp的构建用质粒dna小量提取试剂盒提取质粒,分别用ecori和hindiii限制性内切酶双酶切pfastbac1载体和重组质粒,回收纯化后用t4dna连接酶连接,再转化至e.colidh5α感受态细胞中,涂布含amp(100mg/ml)的平板,筛选阳性克隆,挑取阳性克隆扩大培养后用质粒抽提试剂盒抽提质粒,进行酶切鉴定(图3)及测序,结果表明已正确构建了重组质粒,将其命名为pfastbac-mcp。实施例2人工修饰mcp基因的重组杆状病毒的制备1.重组杆粒的制备将重组质粒pfastbac-mcp转化e.colidh10bac感受态细胞,涂布三抗(gen、kan、tet)、bluo-gal、iptg平板进行蓝白斑筛选,挑取白色菌落三次划线纯化,经m13通用引物和mcp特异性引物pcr初步鉴定后(图4),并将阳性菌落送武汉天一辉远生物科技有限公司测序进一步鉴定。将确认结果正确的阳性重组转座子,命名为rbacmid-mcp。2.重组杆状病毒的制备按insecttransfectionreagent操作说明书的方法,首先碱裂解法提取rbacmid-mcp质粒,然后将2μg的rbacmid-mcp质粒与10μl转染试剂轻轻混合后转染于sf9单层细胞(细胞密度约为1×106个/ml),27℃继续培养,待80%细胞出现病变后,收集细胞上清标记为p1代重组杆状病毒病毒,将p1代重组病毒继续感染sf9细胞,经3代扩大培养;同时参照bactobacbaculovirusexpressionsystems使用手册中的蚀斑法测定各代重组病毒滴度,进行重组病毒的筛选。病毒滴度测定结果显示,p1代重组病毒的滴度为5×106pfu/ml,p2代重组病毒的滴度逐渐升高,为2×107pfu/ml;p3代和p4代病毒的滴度均为1×108pfu/ml。因此,选择p3代重组病毒感染细胞的培养上清作为重组病毒母液,4℃避光保存备用。将该重组杆状病毒命名为acnpv-mcp。3.重组杆状病毒acnpv-mcp的鉴定胶体金免疫电镜法acnpv-mcp感染sf9细胞72h后,弃掉培养液,刮集细胞于10ml离心管中,3000rpm离心20min,弃上清;经2.5%戊二醛固定,乙醇脱水,环氧树脂包埋后,用leicacm1950超薄切片机制备厚度为50~80nm的超薄切片,将切片至于1%h2o2中10min,pbs洗3次,加入5%bsa室温孵育20~30min,然后置于胶体金标记的鼠抗大鲵虹彩病毒mcp单抗中室温孵育30min,双蒸水洗涤3-5次。最后将切片置于有支持膜的铜网上,醋酸铀及柠檬酸铅染色,然后置于h-7650型透射电镜(日立)在80kv下观察。如图5所示,在对照细胞中,几乎看不到特异性的胶体金颗粒,而在重组杆状病毒感染的sf9中可以看到大量被特异性胶体金标记的杆状病毒,大小约为200nm×40nm,,具有典型的杆状病毒形态,说明已成功获得了大量重组杆状病毒。间接免疫荧光法(ifa)鉴定将无菌盖玻片置于6孔板(corning)中培养单层的sf9细胞,acnpv-mcp感染细胞72h后弃去培养液,经4%多聚甲醛固定过夜,pbst洗涤,3%bsa封闭2h,以小鼠抗大鲵虹彩病毒mcp单抗(1∶3000)为一抗,室温下孵育2h。pbst洗涤后,以fitc标记的羊抗小鼠igg(1∶2500)为二抗,室温避光孵育2h。pbst洗涤后用荧光染料hoechest33258进行染色。将盖玻片有细胞的一面朝下,50%甘油封片置于载玻片上,荧光显微镜(olympusbx-51)下观察,拍照。同时,设野生型杆状病毒感染的sf9细胞作阴性对照。间接免疫荧光检测结果显示,acnpv-mcp感染的sf9细胞出现特异性的绿色荧光(图6),且荧光分布在细胞表面,而阴性对照细胞未出现荧光。以上所述的小鼠抗大鲵虹彩病毒mcp单抗由杂交瘤细胞株mcp26分泌得到,所述的杂交瘤细胞株mcp26保藏于中国典型培养物保藏中心,保藏编号为:cctccc201533。实施例3重组mcp的表达及sds-page分析根据病毒滴度,确定不同感染复数(multiplicityofinfection,moi)时病毒的用量,将acnpv-mcp按不同感染复数(moi=2、5、10)接种处于对数生长期的sf9细胞(细胞密度约为1×106个/ml),进行mcp基因表达。待80%以上细胞出现明显细胞病变后,收集细胞,1000rpm离心10min,上清4℃避光保存,收集细胞沉淀。将细胞沉淀用预冷的pbs洗涤两次,加入细胞裂解液缓冲液重悬,之后超声破碎(200hz,运行15s间歇30s,3个循环),13000rpm4℃离心30min,然后取上清以12%凝胶进行sds-page电泳,完毕后经考马斯亮蓝染色,后将凝胶置于syngene化学发光凝胶成像系统进行观察和拍照。同时设野生型杆状病毒感染的sf9细胞为对照。mcp蛋白的理论相对分子量为50kd,而acnpv-mcp感染sf9昆虫细胞后,经sds-page分析,和对照相比,在53ku处出现一条较为明显的目的条带,而且感染复数moi为10时,目的蛋白的表达量最高(图7)。实施例4重组mcp蛋白的纯化及westernblot鉴定根据操作说明书,经试验确定,按每500μl磁珠可结合350μl的小鼠抗大鲵虹彩病毒mcp单抗制备免疫磁珠。将确定的最佳表达条件下收获的含有目的蛋白表达产物的sf9细胞用tritonx-100冰上裂解1min,4℃600g离心3min,收集上清,再与制备好的免疫磁珠混匀,37℃孵育2h,用磁力架收集磁珠,洗涤2次,将磁珠悬浮于500μlph2.5gly-hcl,孵育5min,磁力收集磁珠,上清用100μlph8.0tris-hcl中和,即获得纯化后的目的蛋白。取纯化的目的蛋白经sds-page电泳,利用灰度分析测定纯度,bca蛋白浓度测定试剂盒(sigma)测定蛋白浓度。纯化蛋白经sds-page电泳检测。结果只有一单一条带,相对分子质量约为53kd(图8),与预期大小相符合。纯化蛋白的纯度和定量测定结果显示,纯化目的蛋白的纯度为95.8%,蛋白浓度为1.05mg/ml。为检测纯化蛋白的生物活性,按常规将未经纯化的mcp和纯化的mcp蛋白样品进行sds-page电泳,之后将电泳产物电转到pvdf膜上,同时以野生型杆状病毒感染sf9细胞的裂解物为阴性对照。氨基黑染色5min,甲醇褪去背景色。4℃,50g/l脱脂奶粉封闭2h;用pbst洗涤后,置于1∶500稀释的兔抗大鲵虹彩病毒mcp血清中,室温孵育过夜;pbst洗涤后,加hrp标记的羊抗兔igg(1∶3000),室温孵育2h;pbst洗涤3次,ecl法检测。westernblot反应,结果如图8所示:未纯化的重组mcp蛋白和纯化蛋白在pvdf膜上均可见单一条带印记,且大小符合预期,而阴性对照则无此条带,表明表达的目的蛋白具有抗原活性,且能够被兔抗大鲵虹彩病毒mcp血清识别。以上所述的兔抗大鲵虹彩病毒mcp血清已由发明人公开(周小愿,张星朗,贾秋红,等.大鲵虹彩病毒mcp蛋白主要抗原表位区原核表达及抗血清制备[j].细胞与分子免疫学杂志,2016,32(10):1407-1411.)实施例5一种检测大鲵虹彩病毒的阻断elisa抗体检测试剂盒,该试剂盒包括:本发明制备的大鲵虹彩病毒mcp蛋白作为包被板抗原,辣根过氧化物酶标记的小鼠抗大鲵虹彩病毒mcp蛋白的单克隆抗体,小鼠抗大鲵虹彩病毒mcp单克隆抗体由杂交瘤细胞株mcp26分泌得到,所述的杂交瘤细胞株mcp26保藏于中国典型培养物保藏中心,保藏编号为:cctccc201533。所述的试剂盒还包括:抗原包被板、阳性对照、阴性对照、样品稀释液、20倍浓缩洗涤液、显色液a、显色液b、终止液;所述抗原包被板是用0.1mol/l,ph9.6的碳酸氢钠溶液作为包被液,将本发明表达并纯化的mcp蛋白稀释一定浓度后,包被elisa板;所述的阳性对照为大鲵虹彩病毒灭活疫苗免疫的高免血清,将高免血清按1000u/ml加入青霉素和链霉素,无菌过滤,作为阳性对照;所述的阴性对照为未感染过大鲵虹彩病毒和未经大鲵虹彩病毒灭活疫苗免疫的健康大鲵血清,是将获得的大鲵阴性血清按1000u/ml加入青霉素和链霉素,无菌过滤,作为阴性对照;所述的样品稀释液是称取牛血清白蛋白(bsa)5g、吐温20(tween-20)0.5ml、氯化钠(nacl)8.0g、氯化钾(kcl)0.2g、磷酸二氢钾(kh2po4)0.24g、磷酸氢二钾(k2hpo4)1.8g加注射用水溶解并定容至1000ml;所述的20倍浓缩洗涤液是称取氯化钠(nacl)160g、氯化钾(kcl)4g、磷酸二氢钾(kh2po4)4.8g、磷酸氢二钾(k2hpo4)36g、吐温20(tween-20)10ml,加注射用水溶解并定容至1000ml;所述的显色液a为含有50mg/ml过氧化氢脲的柠檬酸盐缓冲液,显色液b为含有0.2mg/mltmbph5.0的柠檬酸/柠檬酸钠缓冲液;所述的终止液为含有0.25%体积比氢氟酸溶液。所述的抗原包被板的制备,其步骤是:将本发明制备的纯化好的大鲵虹彩病毒mcp蛋白用ph9.6的碳酸氢钠溶液稀释为1.00μg/ml,按100μl/孔加入96孔酶标板中,4℃放置过夜,甩干,按120μl/孔用5mg/mlbsa的磷酸盐缓冲液(ph7.4),37℃封闭2h,甩干,置干燥室干燥后,装入含干燥剂的包装中密封保存。所述的小鼠抗大鲵虹彩病毒mcp单克隆抗体由杂交瘤细胞株mcp26分泌得到,其是否具有阻断作用按以下步骤进行判定。将所述的杂交瘤细胞株mcp26的培养上清收集起来,在包被好本发明制备的纯化mcp抗原的酶标板上加100μl稀释好的大鲵虹彩病毒阴、阳性对照血清,于37℃温育45min,洗涤3次后,再加上述细胞培养上清100μl,37℃反应30min,洗涤3次,加稀释好的羊抗鼠igghrp,再洗板3次,加入显色液,10min后用酶标仪测每孔od630nm读值。结果显示,阳性血清孔的od630nm值小于阴性血清孔od630nm值一半。因此,所述的小鼠抗大鲵虹彩病毒mcp单克隆抗体具有阻断作用。所述的小鼠抗大鲵虹彩病毒mcp单抗已按照发明人公开的方法(周小愿,张星朗,贾秋红,等.抗大鲵虹彩病毒mcpcoe蛋白单克隆抗体的制备及初步应用[j].水产学报,2016,40(12):1923-1930)进行了大量制备和纯化。所述的小鼠抗大鲵虹彩病毒mcp单抗的标记,其步骤是:称取5mg辣根过氧化物酶(hrp)溶于1ml双蒸水中,加500μl新配置的0.06mol/l的naio4,4℃放置30min,此时溶液呈早绿色,加入0.5ml乙二醇(0.16mol/l)室温避光反应30min。再加入5mg/ml的纯化单克隆抗体1ml,在0.05mol/lph9.5的碳酸盐缓冲液中4℃透析过夜。吸出后加5mg/ml新配置的nabh40.2ml,4℃放置2h,再加等体积的饱和硫酸铵溶液,4℃放置30min,7000rpm离心10min,弃上清,用生理盐水重悬,再在0.15mol/lph7.4的pbs中透析过夜。收集透析袋中标记的抗体进行工作浓度标定,然后分装于20ml瓶中,4℃保存备用。(每个批次的酶标抗体都要进行工作浓度标定)。实施例6一种大鲵虹彩病毒阻断elisa抗体检测试剂盒在检测大鲵虹彩病毒抗体中的应用,其步骤是:1)从试剂盒中取出已包被有本发明制备的mcp蛋白抗原包被板,将待检血清用样品稀释液按1∶4稀释,每孔100μl加入到抗原包被板中,同时设阴、阳性对照孔,各设2孔,每孔100μl;2)轻轻振匀孔中样品,置37℃45min,甩掉孔中的溶液,用洗涤液洗板3次,200μl每孔,最后一次在吸水纸上拍干;3)每孔加酶标单抗100μl,置37℃30min,洗涤3次,方法同步骤(2),每孔加显色液a、显色液b各50μl,混匀,室温(20~25℃)避光显色10min,每孔加终止液50μl,15min内用酶标仪测定每孔od630nm读值。本发明试剂盒判定标准为:试验成立条件是阴性对照的平均od630nm值大于0.50,阳性对照的阻断率(pi%)大于50%。若样品的阻断率(pi%)大于或等于40%,判为大鲵虹彩病毒抗体阳性。若样品的阻断率(pi%)小于或等于30%,判为大鲵虹彩病毒抗体阴性。若样品的阻断率(pi%)在30%~40%之间,该样品必须重测,如果结果相同,则过一段时间后重新从动物取样进行检测。阻断率(pi%)=(阴性对照平均od630nm值-样品od630nm值)/阴性对照平均od630nm值×100%。1.特异性试验用大鲵虹彩病毒阻断elisa抗体检测试剂盒检测大鲵虹彩病毒(cgsiv)、中华鳖病毒(soft-shelledturtlevirus,stv)、饰纹汀蛙病毒(bohleiridovirus,biv)、鲤春病毒血症病毒(springviremiaofcarpvirus,svcv)、草鱼呼肠孤病毒(grasscarpreovirus,gcrv)、虹鳟传染性胰腺坏死病病毒(infectiouspancreaticnecrosisvirus,ipnv)、锦鲤疱疹病毒(koiherpesvirus,khv)等阳性血清,所述的上述病毒阳性血清由上述活病毒感染各自的天然宿主得到。检测结果表明,除了大鲵虹彩病毒阳性血清的阻断率(pi%)明显大于50%外,其余血清的阻断率(pi%)均<30%,符合阴性血清的判定标准,表明这种方法特异性良好。表1特异性血清的检测血清cgsivstvbivsvcvgcrvipnvkhv阳性对照阴性对照od6300.1401.0421.1020.9070.9851.0230.9650.1251.230pi(%)88.6215.2810.4126.2619.9216.8321.54--2.灵敏度试验取5份大鲵虹彩病毒阳性血清按不同稀释倍数稀释后用本发明制备的elisa试剂盒进行检测,可以看到当阳性血清最高稀释到16倍时,检测结果仍为阳性,表明试剂盒具有很高的灵敏度。3.本发明制备的大鲵虹彩病毒抗体elisa检测试剂盒应用用本发明制备的elisa检测试剂盒对来自陕西不同地区的大鲵养殖场采集的85份大鲵血清样品进行了检测,结果显示,在85份送检样品中,阳性样品44份,阴性样品41份,阳性率51.76%。表2灵敏度检测以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种人类免疫缺陷病毒抗原抗体联合检测试剂盒及其制备方法和应用的制作方法
- 用于检测抗人乳头瘤病毒抗体的抗原及试剂盒和应用的制作方法
- 丙型肝炎病毒第一高变区抗原及其在制备丙型肝炎病毒检测试剂中的用途的制作方法
- 测定sars病毒核衣壳蛋白的测定方法、测定用试剂盒、试验器具、sars病毒核衣壳蛋白单 ...的制作方法
- 猪圆环病毒2型抗原或抗体检测试纸条的制作方法
- 通过EB病毒p18与p23融合衣壳抗原检测EBV特异性的方法
- 重组赤羽病毒核衣壳蛋白、其制备方法及应用的制作方法
- 衍生自非洲淋巴瘤病毒VCA-p18衣壳抗原的肽及其用途的制作方法
- 隐孢子虫病毒衣壳蛋白抗体elisa检测方法及试剂盒的制作方法
- EB病毒衣壳抗原IgM抗体胶体金法检测试剂及其制备方法