Aβ42在大肠杆菌中的高效可溶性表达及纯化方法与流程
技术领域:
本发明属于生物技术和基因工程技术领域,特别涉及一种利用大肠杆菌表达系统高效可溶性表达制备人淀粉样蛋白aβ42融合蛋白的方法,具体为重组大肠杆菌表达载体的构建及转化方法、蛋白表达及纯化方法。
背景技术:
:
淀粉样蛋白聚集成不溶性的淀粉纤维可导致各种神经性疾病,例如阿尔兹海默症(alzheimer’sdisease,ad),又称老年痴呆症,是一种神经退行性疾病。这种疾病严重影响着世界上数以百万计的老年患者,从而对家庭对社会造成了极大的社会和经济负担。据国际阿尔茨海默病协会2016年公布的数据,2015年全球约有4680万ad患者,且其数量以20年翻一番的速度递增,预测2050年全球将有1.3亿ad患者。由于ad病程长(约10年)且患者生活需要护理,因此医疗和护理花费惊人。2015年全球ad患者的医疗花费约为8180亿美元,占全球gdp的1.1%。作为老龄化进展最迅速的国家之一,我国的形势更为严峻。2014年我国ad患者数量(约600万)已居世界第一,同时还是全球增速最快的国家之一。例如,65岁以上的老人患病率为6.6%,远超世界平均发病率(4.0%左右)。因此,我国已成为ad的重灾区,这将给家庭和社会带来沉重的负担。因此该疾病的病因和寻找抗ad药物成为世界范围内研究人员关注的焦点。
淀粉样蛋白斑(ad患者大脑中老年斑的主要成分),主要是由淀粉样β-蛋白(aβ)聚集形成的,主要含有39-43个氨基酸。aβ主要是通过一个含695-770个氨基酸组成的淀粉样前体蛋白app通过β-和γ-分泌酶水解而成,但该前体蛋白的生物功能目前尚不清楚。据报道,aβ42是大脑中老年斑的主要成分之一。尽管目前对纤维形成过程中的聚集体的研究,已经取得了较大的进展,但很多关于这些体的大小、结构、形态以及与细胞毒性之间的关系等方面目前仍存在很多未知的问题。
目前许多基于抑制aβ42多肽聚集进行抗ad药物的设计和筛选,为探索其聚集机制和毒理学性质,首先需要获得高纯度aβ42。该多肽分子量大小约为4.5kda,含有胞外和跨膜结构域。目前aβ多肽主要通过固相化学合成法(spps)制备,然而spps合成过程中残留的氨基酸或多肽片段均严重影响了aβ的聚集和毒理特性。由于aβ42自身存在高疏水性和易于聚集的特性,很难从神经细胞组织中提取和纯化,因此难以获得大量高纯度的多肽。基因工程方法具有能够大量生产aβ的优势,目前已有一些研究组设计出一些表达系统,并表达纯化获得重组aβ,然而由于aβ的高疏水性和聚集体具有较高的细胞毒性,利用传统的大肠杆菌表达系统依然存在表达量低、纯化步骤复杂、获得aβ纯度不高等缺点。利用可溶的蛋白质与aβ融合表达来增加其溶解性和稳定性是解决aβ上述缺点的常用方法之一。
mbp即麦芽糖结合蛋白作为常用的融合标签,具有帮助目标蛋白高效可溶性表达的功能,因此利用该表达载体可实现疏水性蛋白和多肽的大量可溶性表达,也可用于难以化学合成的多肽或蛋白的基因重组合成。另外,mbp蛋白广泛用做蛋白纯化标签,采用直链淀粉树脂可特异性亲和层析纯化目标蛋白。
此外,融合标签和目的蛋白之间一般设计蛋白酶切的酶切位点,从而可以通过蛋白酶的酶切将二者分开。常用的蛋白酶包括tev蛋白酶、凝血酶、肠激酶等,其中以tev蛋白酶最为重要。tev蛋白酶来源于烟草蚀纹病毒,其具有很强的位点特异性,能够识别enlyfqg的七氨基酸序列,其切割位点位于第六位和第七位氨基酸之间。由于tev蛋白酶有着很好的酶切活性、氨基酸酶切位点的转移性以及酶切条件的宽容性,因而广泛用于融合蛋白的分离、基因组学和蛋白质组学中特定蛋白的标记和分离等研究。但是,采用tev蛋白酶切存在酶切后的目的蛋白携带氨基酸残基的问题,该问题可通过对tev酶切位点进行修饰即将七氨基酸序列修饰为六氨基酸序列,使用目的蛋白的末端氨基酸替代第七位氨基酸而获得解决,但tev酶切位点进行修饰的同时又会带来酶切效率降低的问题,verenah.finder等在《therecombinantamyloid-βpeptideaβ1-42aggregatesfasterandismoreneurotoxicthansyntheticaβ1-42》中提到“当识别位点中第七位氨基酸-甘氨酸被天冬氨酸替代后,蛋白酶的切割效率降至90%”,天冬氨酸即为本发明中目的蛋白aβ42的末端氨基酸。
为了解决上述问题,本发明将提供一种aβ42可溶性表达和高效纯化方法,以获得高表达、高纯度以及不含任何残基的aβ42多肽的方法。
技术实现要素:
:
为了实现上述目的,本发明提供一种人淀粉样β蛋白42(aβ42)可溶性表达和高效纯化方法。
本发明提供的高纯度人淀粉样蛋白aβ42多肽可溶性表达纯化方法,包括重组表达载体构建、转化与筛选、诱导表达及纯化,步骤如下:
(1)将3个(nanp)多肽循环结构(以下简称(nanp)3)形成的可溶连接肽链linker及带有改进后的tev蛋白酶切位点的aβ42融合基因核苷酸编码序列(以下简称(nanp)3-tev-aβ42融合基因核苷酸编码序列)插入到表达载体pmalc2x(载体上自带mbp标签)的多克隆位点,构建重组表达载体质粒;
所述改进后的tev蛋白酶切位点具体为:由enlyfqg改为enlyfq;
优选地,所述(nanp)3-tev-aβ42融合基因核苷酸编码序列如seqidno.1所示;
(2)将(1)中构建的重组表达载体质粒转入宿主细胞,经菌落pcr及测序鉴定得到成功导入表达载体的重组菌株;
所述的宿主细胞是大肠杆菌ecoli.bl21(de3);
(3)诱导表达mbp-aβ42(含有融合标签mbp的aβ42)融合蛋白,并进行蛋白纯化;
所述诱导表达使用的诱导剂为异丙醇-β-硫代半乳糖苷(iptg);
优选地,所述的蛋白纯化是将细胞破碎后过直链淀粉树脂,进行亲和层析纯化得mbp-aβ42融合蛋白;
(4)采用tev蛋白酶将(3)所得的mbp-aβ42融合蛋白中的mbp标签切除并纯化目的蛋白aβ42多肽;
优选地,所述的纯化方法为分子筛凝胶过滤层析。
进一步地,本发明实现上述目的的过程具体如下:
1、可溶性表达载体及重组aβ42基因的大肠杆菌工程菌的构建
(1)根据(nanp)3-tev-aβ42氨基酸序列进行大肠杆菌表达密码子偏好性优化,并由基因公司合成,序列如下:
gaattcaatgccaatccgaatgccaacccgaacgccaacccggaaaacctgtacttccaggatgccgagtttcgccatgatagcggctatgaggtgcaccaccagaaactggtgttctttgccgaggatgtgggcagcaacaaaggcgccattattggcctgatggtgggtggcgtggtgattgcctaaaagctt(seqidno.1);
(2)将优化后(nanp)3-tev-aβ42融合基因核苷酸编码序列与pmalc2x表达载体连接,挑选阳性转化子验证,并提取质粒pmal-aβ42备用;
优选地,操作条件如下:
(nanp)3-tev-aβ42基因片段与pmalc2x表达载体连接,16℃反应4-6h后,连接产物加入到大肠杆菌jm109感受态细胞中,冰浴30min,42℃反应1min30s,冰浴2min,加入lb液体培养基,250rpm,37℃孵育1h;
离心收集菌体,去除后重悬菌体,涂布氨苄霉素抗性的lb培养基平板,37℃培养过夜,挑取单菌落至液体培养基中,250rpm,37℃过夜培养。
菌落pcr鉴定阳性克隆后进行测序分析,提取测序正确的阳性转化子质粒备用;
菌落pcr验证正向引物(ecori)nanp-aβ42-f:
cggaattcaatgccaatccgaatgcca(seqidno.2);
菌落pcr验证反向引物(hindiii)aβ42-r:
ccaagcttttaggcaatcaccacgcc(seqidno.3);
(3)aβ42大肠杆菌表达菌株的构建:
将测序正确的pmal-aβ42表达载体质粒转化大肠杆菌表达宿主ecoli.bl21(de3)中,菌落pcr验证转化子,最终获得重组aβ42基因的大肠杆菌工程菌bl21-mbp-aβ42。
2、mbp-aβ42融合蛋白的表达纯化及蛋白酶切提纯aβ42多肽
(4)mbp-aβ42融合蛋白的表达:采用iptg诱导融合蛋白表达,16℃低温诱导16-18h,菌液离心收集菌体,获得含有mbp-aβ42融合蛋白的大肠杆菌菌体;
(5)mbp-aβ42融合蛋白的纯化:用缓冲液将上述所得菌体重悬,加入终浓度30μg/ml的溶菌酶和1%pmsf,冰浴30min后超声破碎,12000rpm离心40min,收集上清;将上清过直链淀粉树脂亲和层析柱,缓冲液充分洗涤柱子后用10个柱体积的含10mm麦芽糖的缓冲液洗脱;
(6)tev蛋白酶酶切mbp-aβ42融合蛋白提纯aβ42多肽:将上述mbp-aβ42融合蛋白浓缩,加入tev蛋白酶及相应buffer,23℃反应6-12h,可完全切开;
(7)分子筛凝胶过滤层析纯化高纯度aβ42:将上述蛋白酶切产物经superdex200分子筛凝胶柱进一步纯化,最终得到不含任何残基的高纯度aβ42。
上述aβ42多肽的鉴定:
(1)电泳鉴定:mbp-aβ42融合蛋白的表达纯化及tev酶切过程中每一步取样进行sds-page电泳检测,最终得到的aβ42多肽经tricine-sds-page电泳确定纯度及分子量,结果显示在4.5kda附近有一条明显的条带;
(2)质谱鉴定:将纯化所得aβ42多肽进行质谱鉴定分子量,结果表明纯化所得产物确为目标aβ42多肽;
(3)tht荧光染色分析聚集特性:将上述纯化所得aβ42多肽进行培养,并按时间段取样进行tht染色,通过检测荧光值变化来分析聚集特性,证明本发明所得aβ42多肽与人淀粉样蛋白aβ42一致。
有益效果:
1、本发明构建的aβ42表达体系提供了原核生物可溶性融合表达人淀粉样蛋白aβ42的表达载体的构建方法,并将表达载体导入至大肠杆菌表达宿主中,经诱导表达、蛋白酶切、两步纯化及鉴定后获得具有高纯度生物活性的目标aβ42。本方法所采用的大肠表达系统及融合蛋白,具有表达效率高、表达量大、成本低、易操作等特点,所表达的aβ42多肽不含任何残基、纯度高、产率高等优点,可用于阿尔兹海默症致病机理研究和相应药物筛选开发的研究中;同时为其他疏水性、毒性蛋白或多肽的研究提供新的思路;
2、本发明通过对烟草蚀纹病毒蛋白酶(tev)酶切位点进行修饰,从而达到aβ42多肽产物不含任何残基的效果;
3、本发明首次使用3个(nanp)多肽循环结构形成的可溶性连接区,不仅能起到连接mbp融合标签与目的蛋白aβ42的作用,以此构建的融合蛋白表达体系还能够大大提高酶切效率,6h时酶切率为97.9%,12h酶切率达到99.4%,解决了tev酶切位点进行修饰后由于识别率降低导致的酶切效率降低的问题。
附图说明:
图1aβ42可溶性表达和纯化流程图;
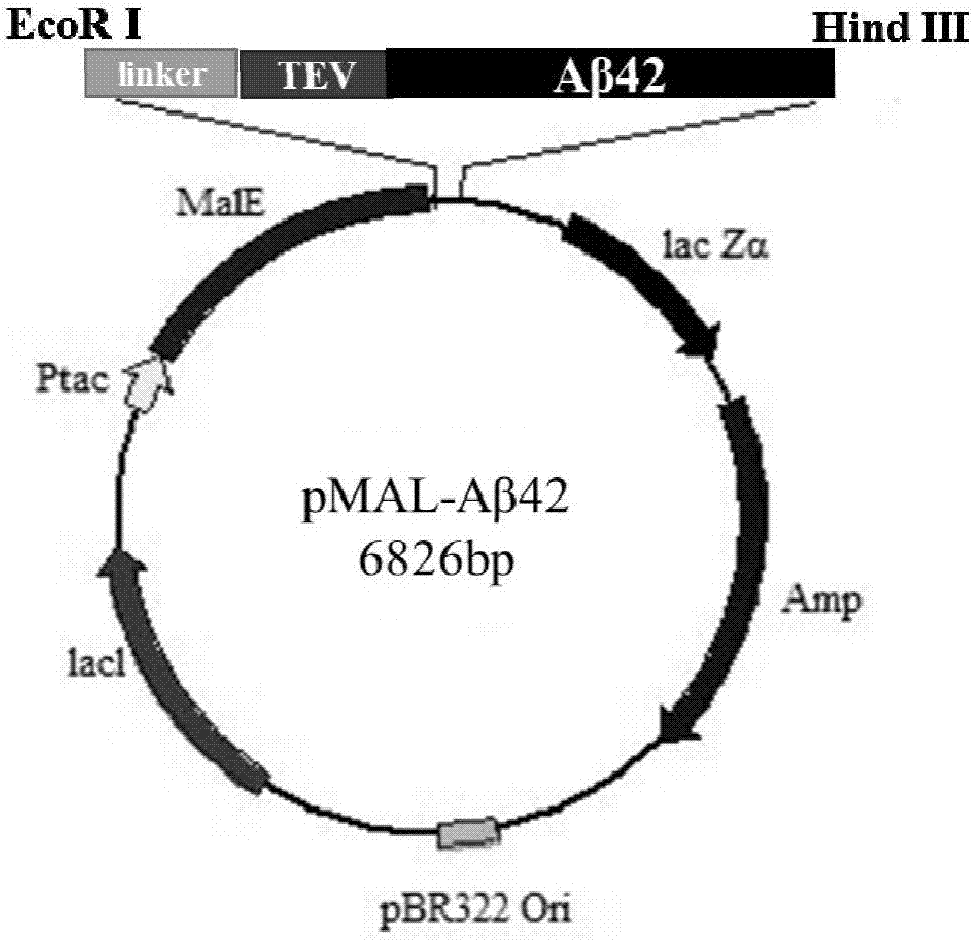
图2表达载体pmal-aβ42构建示意图;
图3mbp-aβ42融合蛋白纯化电泳图;
其中,m:蛋白marker;1:细胞破碎液上清;2:过树脂后washbuffer洗脱液;3:elutionbuffer洗脱液;
图4tev蛋白酶酶切mbp-aβ42融合蛋白电泳分析;
其中,a为不同酶切时间的蛋白电泳图,m:蛋白marker,1:0h,2:3h,3:6h,4:12h;b为蛋白电泳图灰度分析;
图5tricine-sds-page电泳,分离鉴定凝胶过滤层析提纯后的aβ42多肽;
其中,m:蛋白marker;1:aβ42;
图6mass质谱检测提纯后的aβ42;
图7tht荧光染色分析聚集特性。
具体实施方式:
本发明使用限制性内切酶购自大连宝生物工程有限公司,tev蛋白酶购自sigma,其他试剂未特别注明来源的,均购自上海生工生物工程股份有限公司。基因及引物合成来自于苏州金唯智生物科技有限公司。实验操作未详述的,均根据实验室手册——如《分子克隆》进行操作。
aβ42可溶性表达和纯化流程图如图1所示。
实施例1:pmal-aβ42表达载体质粒及aβ42大肠杆菌表达菌株的构建
表达载体pmal-aβ42构建示意图如图2所示;
(1)首先根据(nanp)3-tev-aβ42氨基酸序列进行大肠杆菌表达密码子偏好性优化,并由基因公司合成获得(nanp)3-tev-aβ42融合基因片段,序列如seqidno.1所示,目的片段两端酶切位点分别为ecori和hindiii;
(2)用ecori和hindiii将(nanp)3-tev-aβ42片段从质粒上切下,经琼脂糖凝胶电泳后,胶纯化回收目标酶切产物。同样用ecori和hindiii双酶切pmalc2x表达载体质粒,胶回收后与上述得到的目标融合基因片段连接。16℃反应4-6h后,连接产物加入到大肠杆菌jm109感受态细胞中,冰浴30min,42℃反应1min30s,冰浴2min,加入1mllb液体培养基,250rpm,37℃孵育1h。4000rpm离心收集菌体,去除800μl上清后重悬菌体,涂布氨苄霉素抗性的lb培养基平板,37℃培养过夜。挑取单菌落至5mllb液体培养基中,250rpm,37℃过夜培养。菌落pcr鉴定阳性克隆后进行测序分析。提取测序正确的阳性转化子质粒备用,命名为pmal-aβ42。
菌落pcr引物设计如下:
正向引物(ecori)nanp-aβ42-f:cggaattcaatgccaatccgaatgcca(seqidno.2);
反向引物(hindiii)aβ42-r:ccaagcttttaggcaatcaccacgcc(seqidno.3)。
(3)aβ42多肽大肠杆菌表达菌株的获得:将测序正确的pmal-aβ42表达载体质粒转化大肠杆菌表达宿主bl21(de3)中,菌落pcr验证转化子,最终获得重组aβ42基因的大肠杆菌工程菌bl21-mbp-aβ42。
实施例2:mbp-aβ42融合蛋白的表达纯化及蛋白酶切提纯aβ42多肽
(4)mbp-aβ42融合蛋白的表达:
挑取构建好的bl21-mbp-aβ42工程菌单菌落至5mllb培养基中过夜37℃培养,按1%接种量转接新鲜lb培养基中,37℃培养至od600为0.6-0.8,加入终浓度0.5mmiptg诱导,诱导温度为16℃,诱导时间16-18h。最终6000rpm离心10min收集菌体。
(5)mbp-aβ42融合蛋白的纯化:
用缓冲液lysisbuffer(20mmtris-hcl,ph7.4,200mmnacl,1mmedta,1mmdtt)将上述所得菌体重悬,加入终浓度30μg/ml的溶菌酶和1%pmsf,冰浴30min后超声破碎,12000rpm离心40min,收集上清。将上清加入到直链淀粉树脂亲和层析柱,再用10个柱体积的washbuffer(20mmtris-hcl,ph7.4,200mmnacl,1mmedta,1mmdtt,2mm麦芽糖)洗涤柱子,最后用10个柱体积的elutionbuffer(20mmtris-hcl,ph7.4,200mmnacl,1mmedta,1mmdtt,10mm麦芽糖)缓冲液洗脱。经bca试剂盒测定蛋白浓度,计算蛋白含量,1l菌液可得约240mgmbp-aβ42融合蛋白,mbp-aβ42融合蛋白纯化电泳图如图3所示。
(6)tev蛋白酶酶切mbp-aβ42融合蛋白提纯aβ42多肽:
将上述洗脱下的mbp-aβ42融合蛋白:tev蛋白酶=1mg:4μl的比例加入蛋白酶和相应buffer,23℃反应6-12h,可完全切开。
tev蛋白酶酶切mbp-aβ42融合蛋白电泳图如图4-a所示;利用imagelab软件对4-a蛋白电泳图进行灰度分析,分别分析酶切3h、6h、12h后残留mbp-aβ含量。结果如图4-b所示,显示酶切3h后剩余融合蛋白含量占酶切前含量的38.28%,6h后占2.1%,12h后占0.62%,表明酶切12h后mbp-aβ基本切割完全。
(7)分子筛凝胶过滤层析纯化高纯度aβ42:
将上述蛋白酶切产物经superdex200分子筛凝胶柱进一步纯化,该步骤中所用流动相buffer为20mmph7.4tris-hcl,150mmnacl,最终得到不含任何残基的高纯度aβ42。
实施例3:aβ42多肽鉴定
(1)电泳鉴定:最终得到的aβ42多肽经tricine-sds-page电泳确定纯度及分子量,如图5所示,在4.5kda附近有一条明显的条带。经bca试剂盒测定蛋白浓度,最终计算1l菌液可得约20mgaβ42多肽,远高于现有其他生物表达aβ42方法。
(2)质谱鉴定:将纯化所得aβ42多肽进行质谱鉴定分子量,如图6所示,分子量为4539.15,与人淀粉样多肽aβ42分子量一致。
实施例4:硫黄素(tht)荧光染色分析聚集特性
(1)已知荧光化合物硫黄素(tht)具有与淀粉样蛋白的β-sheet结构特异性结合而显著增强荧光强度的性质。将上述纯化所得aβ42脱盐并冻干处理后,称取少量aβ42粉末,用20mmnaoh溶液溶解,配成275μm母液,并用ph8.0pbs缓冲液稀释至终浓度25μm,37℃培养7天,浓度按aβ42:tht=1:1比例混匀,在激发波长440nm,发射波长485nm条件下检测荧光强度变化来分析聚集特性。
结果显示:纯化所得aβ42在37℃培养时生长曲线与化学合成的aβ42具有相同的聚集特性,如图7所示,因此证明本发明所得aβ42多肽与人淀粉样蛋白aβ42一致。
sequencelisting
<110>天津科技大学
<120>aβ42在大肠杆菌中的高效可溶性表达及纯化方法
<130>1
<160>3
<170>patentinversion3.5
<210>1
<211>195
<212>dna
<213>人工序列
<400>1
gaattcaatgccaatccgaatgccaacccgaacgccaacccggaaaacctgtacttccag60
gatgccgagtttcgccatgatagcggctatgaggtgcaccaccagaaactggtgttcttt120
gccgaggatgtgggcagcaacaaaggcgccattattggcctgatggtgggtggcgtggtg180
attgcctaaaagctt195
<210>2
<211>27
<212>dna
<213>人工序列
<400>2
cggaattcaatgccaatccgaatgcca27
<210>3
<211>26
<212>dna
<213>人工序列
<400>3
ccaagcttttaggcaatcaccacgcc26
- 还没有人留言评论。精彩留言会获得点赞!