一种利用含血清培养液体外构建的3D模型及其构建方法与流程
本发明属于组织工程学生物材料技术领域,具体涉及一种利用含血清培养体系在体外构建的3d模型及其构建方法。
背景技术:
本发明中3d模型是应用细胞生物学和工程学原理,将少量种子细胞经体外扩增后构建而成,其结构与正常人角膜上皮结构高度类似,由下而上的结构依次为基底层、棘层、颗粒层、棘层,均无角质层,具有完整的上皮结构,且表达角膜相关角蛋白。该体外构建的3d模型主要用作眼刺激体外检测,对小分子化合物、活性蛋白、医疗器械、化学品、化妆品等产品的安全性进行评价。
化学物直接接触或者暴露于眼部,会引发刺激性以及局部毒性。因此,眼表刺激性风险评估是危害评价以及风险规避程序中非常需要的一项。传统方法中对新型化合物的眼刺激潜在风险的评估主要依赖于体外的兔眼实验,这种方法耗时耗力、且成本较高。因此,寻找快速、经济的化合物筛选方法成为该领域的一项迫切需求,并激发了大量的关于眼表刺激性风险评估的体外替代方法的建立的相关工作的开展,例如牛角膜不透明度及渗透性检测,鸡胚尿囊膜实验等,上述技术通过一定程度的组合可以实现体外眼刺激性评价,但却都无法完全实现体外兔眼刺激实验的替代。近年来,随着体外器官培养技术的发展,基于体外细胞培养构建的3d重组角膜上皮模型,在眼刺激风险评价领域表现出特有的趋势。体外构建的3d角膜上皮模型,类似于人体角膜上皮的三维结构,其不仅可以更为真实的反映人体对化学物的响应,准确给出化学物刺激性的预测,对于化合物筛选的种类也具有更宽的应用范畴,除了不同功效目的的剂型开发,也包括化妆品具体成分的危害评价。目前,采用体外构建3d重组角膜模型进行的眼刺激性检测已被国际认可,2015年oecd指南492即给出了采用该模型的一种替代方法。
目前,国际上主要有三种商业化的体外重组角膜上皮模型,第一款epiocular™(mattek,ma,usa),hce(skinethic,france)以及cornea-model(labcyte,japen)。其中,mattek的epioculartm以人源的表皮角质化细胞作为种子细胞,体外培养形成类似于角膜上皮结构的模型,虽然该模型在眼刺激性动物替代评价方法中扮演着重要的角色,但非角膜细胞系并不能完全等同于人角膜。labcyte的cornea-model采用正常的人角膜上皮细胞系进行构建,体外培养形成角膜上皮结构;角膜上皮细胞是体外研究细胞分化、信号传导、细胞稳态信号通路的模式工具,也可以用来构建体外三维的角膜上皮组织模型,但是,可用角膜组织的有限来源,加之角膜细胞自身短暂的生命周期以及快速的分化,使得角膜上皮细胞体外培养难度大,且非常耗时。许多尝试增长角膜上皮细胞体外培养周期的工作都有开展,例如病毒转染,端粒酶逆转录基因转染等,skinethic的hce模型采用永生化的角膜上皮细胞系作为种子细胞进行培养,形成多细胞层的角膜上皮组织类似物,其结构上和角膜黏膜非常类似。
中国专利201410062366申请公开了一种简易角膜缘干细胞分离和体外培养试剂盒及方法,采用该方法进行角膜缘干细胞分离和体外培养,操作简单,干细胞得率高,所得原代干细胞损伤少,增值能力强,体外培养成功率高,重现性好。
中国专利03150375.6申请公开了一种组织工程自体角膜上皮及其制备方法,该方法将来源于患者自体的角膜上皮干细胞和角膜上皮细胞在体外扩增和分化后,接种到纤维蛋白生物支架上进行培养,在体外构建组织工程自体角膜上皮。
中国专利200410019341.x申请公开了一种角膜缘干细胞组织工程复合体及其制备方法,该方法采用去除上皮的羊膜作为载体,以3t3成纤维细胞作为滋养层,在体外构建组织工程角膜复合体。
中国专利200410019342.4申请公开了一种人成纤维细胞滋养的人角膜缘干细胞组织工程产品及制备方法,该方法采用去除上皮的羊膜作为载体,以人成纤维细胞作为滋养层,在体外构建组织工程角膜复合体。
中国专利201019018004.1申请公开了一种组织工程角膜的制备方法,该方法采用表皮干细胞和多能基质干细胞为种子细胞,经体外扩增培养后种植在脱细胞天然角膜基质的两面,再经体外诱导培养形成组织工程角膜。
角膜上皮模型的细胞来源包括胚胎干细胞、间充质干细胞、皮肤干细胞以及口腔黏膜上皮细胞等,其作为种子细胞的动物实验及临床应用已有了报道并取得了突破性的进展,尤其是对于口腔黏膜上皮细胞的研究,目前已经成为热点。目前在临床治疗中,使用口腔黏膜上皮细胞构建生物膜片移植治疗眼表疾病,该方法已成为临床治疗中常用方法。自口腔黏膜分离的上皮细胞与表皮角质化细胞相比处于较低的分化阶段,由于其细胞循环周期相对短暂,体外培养时间也会缩短,且延长培养时间也会维持非角化状态;其次,取活组织后残留的疤痕不明显,使口腔成为获取活组织的一个理想场所。shigeru及nakamura等指出,口腔黏膜上皮组织由5~6层细胞构成,具有基底层、棘层、颗粒层,无角质层,并且具有桥粒、半桥粒等紧密连接结构,该组织结构与角膜组织结构相似;并且研究发现口腔黏膜上皮细胞表达非角质层特异蛋白ck4、ck13,及角膜特异蛋白ck3。yasutaka等研究也指出,口腔黏膜上皮细胞表达角膜特异蛋白ck3,非角质层特异蛋白ck4、ck13,而角质层特异蛋白ck1、ck10无表达,其表达情况与角膜中角蛋白的表达情况相同。
口腔黏膜上皮细胞在临床治疗上的成功应用,说明口腔黏膜上皮细胞可以作为角膜上皮细胞理想替代物用于眼表重建,表明口腔黏膜上皮细胞具有替代角膜细胞构建体外模型的潜能。
中国专利200610128698.0申请公开了一种自体角膜上皮的制备方法,该方法采用原代培养患者自体的口腔黏膜组织细胞3~15天,对所得细胞进行传代扩增培养7~30天,再接种到纤维蛋白生物支架上进行培养构建,最终制备成角膜上皮,应用于临床治疗。但目前使用口腔黏膜细胞构建的角膜模型,其构建时间长,体外构建一批模型需长达一个月时间,过长的构建时间会增加过程中的不可控因素,影响模型的稳定性;需要滋养层,为上皮层提供营养;多应用于临床治疗。
目前,体外构建组织工程角膜大多应用于临床治疗,而制约组织工程角膜移植的瓶颈是构建载体,因此组织工程角膜的研究主要集中在构建载体上,其构建体系也更加适合载体,且大多需要滋养层为上皮层提供营养。另外,目前使用角膜细胞构建的角膜模型,其构建时间长,体外构建一批模型需长达一个月时间,过长的构建时间会增加过程中的不可控因素,影响模型的稳定性。
技术实现要素:
本发明实施例提供了一种利用含血清培养体系在体外构建的3d模型及其构建方法,由于该3d模型的种子细胞选择多样,体外构建重复性佳,可实现产业化制备;同时,使用含血清培养体系,提供细胞所需营养的同时,减少了因子的添加;并且构建培养体系更适合上皮细胞的增殖分化,使细胞无须基质和支架也能复层分化良好,保证了模型的正常复层化,从而形成了和人体角膜上皮高度类似的连接结构,并正常表达了角膜上皮相关蛋白。
本发明内容如下:
一种3d模型,所述模型是一种利用含血清培养液体外构建的3d模型及其构建方法,是应用细胞生物学和工程学原理,使用组织分离的原代角膜上皮细胞,或角膜缘干细胞,或永生化角膜上皮细胞,或原代口腔黏膜上皮细胞,或口腔黏膜鳞状癌细胞株tr146,经体外扩增后,采用含血清培养液,及液下-气液面分段培养法,使其复层化,形成体外3d模型。
进一步地,所用的细胞为使用组织分离的原代角膜上皮细胞,或角膜缘干细胞,或永生化角膜上皮细胞,或原代口腔黏膜上皮细胞,或口腔黏膜鳞状癌细胞株tr146中的一种。
进一步地,使用的培养基含5%~20%的胎牛血清fbs。
一种利用含血清培养液体外构建3d模型的体外构建方法,包括以下方法步骤:
步骤一、细胞的准备
取原代角膜上皮细胞,或角膜缘干细胞,或永生化角膜上皮细胞,或原代口腔黏膜上皮细胞,或口腔黏膜鳞状癌细胞株tr146,复苏扩增后,使用p4~p20代细胞,以胰酶消化制成单细胞悬液,调整细胞密度5.0×104个/ml~5.0×106个/ml,接种于培养瓶中,加含5%~20%胎牛血清的培养液ⅰ培养,轻轻晃动培养瓶,使细胞分散均匀后,置于37℃、5%co2条件下培养;
所述培养液ⅰ,为dmem,其所含葡萄糖含量为1.0~4.5g/l,谷氨酰胺含量为0.2g/l~20.0g/l。
步骤二、3d模型的液下接种培养
取对数生长期细胞,以培养液ⅱ制成单细胞悬液,调整细胞密度为5.0×104个/ml~5.0×106个/ml,以200μl/室的体积,接种于小室内,将小室置于模型培养皿内,每皿添加适量培养液ⅱ,使小室内外液面高度一致,进行浸没式培养;置于37℃、5%co2条件下培养0.5~2小时,后转入液下培养,培养时间为1~3天,每天换液;
所述培养液ⅱ,是以dmem:f12含量为3:1~1:3的培养基为基础培养基,添加胎牛血清浓度为5%~20%,维甲酸浓度为4~10μg/ml,人表皮生长因子浓度为0.1~10.0ng/ml,胰岛素浓度为5.0~50.0ng/ml,氢化可的松浓度为0.1~5.0μg/ml,腺嘌呤浓度为5.0~50.0μg/ml,三碘甲状腺氨酸浓度为0.1~10.0μg/ml,透明质酸浓度为0.01%~0.1%,黄酮浓度为5.0~50.0μg/ml,谷氨酰胺浓度为0.2g/l~20.0g/l,霍乱毒素浓度为1.0~100.0μg/l,二性霉素b浓度为1.0~10.0mg/l,青霉素浓度为10.0~100.0iu/ml,链霉素浓度为10.0~100.0μg/ml;
上述步骤中采用的培养液ⅱ,在基础培养液的基础上,添加了胎牛血清,胎牛血清中含有各种血浆蛋白、多肽、脂肪、碳水化合物、生长因子、激素、无机物等,能够提供人工合成培养液中所缺少的生物因子及物理因素,形成与体内微环境相似的细胞生长场所,使细胞生长或抑制达到生理平衡。并且,有学者研究发现无血清培养的细胞似乎只有在基质或支架材料上才能良好复层分化形成黏膜片,而添加血清的培养基,细胞无须基质和支架也能复层分化良好。但血清中一些成分也会对上皮细胞的分化产生一定的抑制作用,因此,培养液ⅱ中添加了各种因子,调节细胞的增殖及分化。其中维甲酸能够促进上皮细胞增生、分化、角质溶解等代谢作用。氢化可的松可能兼有促细胞贴附和增殖作用,细胞密度高时可诱导细胞发生分化。透明质酸是葡糖醛酸和-n乙酞氨基葡萄糖为双糖单位构成的直链高分子多糖,含有大量的羧基和羟基可与水形成氢键而结合大量的水,能进行溶液渗透压的调节;并且对细胞具有多种保护作用,对带电大分子的扩散具有阻止作用,对细胞行为也具有一定影响;透明质酸还能抑制自由基的形成与释放。黄酮中含有丰富的酚类物质,可与过氧化自由基结合,阻断过氧化链式反应的进行,提高细胞的抗氧化能力;黄酮还能够通过降低caspase-3蛋白的表达来抑制细胞凋亡的发生。针对传统培养所使用的单一培养基(例如单纯使用dmem培养基)只能够提供氨基酸、维生素、无机盐、有机化合物、微量元素的缺陷,这些因子的添加,一方面保证了细胞的营养需求,促进了细胞的生长;另一方面从培养基的渗透压及抗氧化能力等方面保证了细胞的活性。
步骤三、3d模型的气液面增殖分化培养
将上述小室内的培养液弃掉,更换模型培养皿内的培养液为培养液ⅲ,使液面与小室内细胞上表面位于同一水平线,进行气液面培养,培养时间为1~7天,每天换液,培养结束,模型的体外构建结束;
所述培养液ⅲ,为在培养液ⅱ中,增加氢化可的松浓度为5.0~10.0μg/ml,透明质酸浓度为0.1%~1%,黄酮浓度为50.0~150.0μg/ml,并添加维生素e浓度为20.0~80.0μg/ml。
上述步骤中采用气液面分段培养的方法,使其复层化,形成体外模型。该气液面培养阶段使用的培养液ⅲ,与培养液ⅱ的区别在于,增加了培养液ⅱ中氢化可的松、透明质酸、黄酮的浓度,并添加了维生素e。维生素e是最主要的抗氧化剂之一,保护细胞免受自由基的毒害,抑制细胞凋亡;并能降低细胞需要氧量,维持细胞活性;并参与细胞dna的合成。氢化可的松浓度的适量增加,能够在细胞密度增加的情况下,发挥了诱导细胞分化的作用,保证了模型完整复层化。透明质酸一方面抑制自由基的形成与释放,一方面维持细胞正常代谢所需的渗透压,从而保证了细胞的增殖、分化。黄酮浓度的增加,进一步抑制细胞在快速生长过程中的凋亡。上述条件共同作用,保证了细胞快速健康的增殖、分化,最终形成复层化角膜上皮结构,并简化的构建方法,缩短了构建时间。
进一步地,该模型构建时间为3~10天,构建所需时间短。
进一步地,构建体系能够提供上皮细胞增殖分化所需营养及微环境,不需要滋养层。
进一步地,模型结构与正常人角膜上皮结构相似,均为复层化结构,无角质层。
进一步地,模型角膜特异性蛋白表达与正常人角膜上皮相似,表达角膜特异性蛋白ck3。
进一步地,使用et50法(0.3%tritonx-100使模型内半数细胞死亡所需的时间)检测其屏障功能,在液下培养结束后,其et50为5~15min。
进一步地,使用et50法检测其屏障功能,在气液面培养结束后,其et50为30~70min。
进一步地,该模型应用于小分子化合物、活性蛋白、医疗器械、化学品、化妆品等产品的眼刺激性体外检测。
本发明的有益效果是:
采用本发明提供的方法构建的3d模型,具有以下优点:一,种子细胞选择多样,体外构建重复性佳,可实现产业化制备;二、使用含血清培养体系,提供细胞所需营养的同时,减少了因子的添加;三,透明质酸的添加,一方面抑制自由基的形成与释放,一方面能进行溶液渗透压的调节,维持细胞正常代谢所需的渗透压,从而保证了细胞的增殖、分化;四、黄酮的添加,降低了caspase-3蛋白的表达,从而抑制了细胞凋亡的发生;五、液下及气液面阶段不同的氢化可的松浓度,保证了细胞不同时期的需求,有利于复层化角膜上皮结构的形成;六、气液面培养阶段的简化,在保证细胞快速增殖分化的同时,缩短了构建时间、降低生产成本;七,该构建培养体系更适合上皮细胞的增殖分化,使细胞无须基质和支架也能复层分化良好,保证了模型的正常复层化,从而形成了和人体角膜上皮高度类似的连接结构,并正常表达了角膜上皮相关蛋白,这种自身结构和细胞外微环境的影响可进一步提升模型的屏障功能,最终构建的体外3d模型与人角膜上皮组织具有高度相似的结构及功能;八,使用构建的3d模型对《全球化学品统一分类和标签制度》中部分化学品进行检测,结果显示,使用本发明提供的方法制备的3d模型能够准确判定该化学品是否具有眼刺激性,其结果与兔眼实验的判定结果一致,因此,3d模型能够客观真实的反映检测结果,能够很好的替代动物模型,成为体外测试的核心工具,应用于小分子化合物、活性蛋白、医疗器械、化学品、化妆品等产品的眼刺激性体外检测。
附图说明
图1为利用含血清培养液体外构建的3d模型的组织学切片he染色照片;
图2为利用含血清培养液体外构建的3d模型的角蛋白ck3免疫组化染色照片;
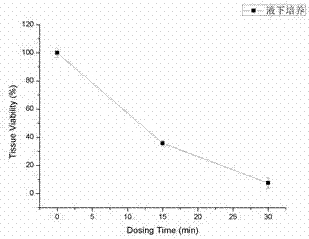
图3为利用含血清培养液体外构建的3d模型的液下培养结束后组织活性与0.3%tritonx-100作用时间的曲线图,可计算得出et50值;
图4为利用含血清培养液体外构建的3d模型的气液面培养结束后组织活性与0.3%tritonx-100作用时间的曲线图,可计算得出et50值;
图5为利用含血清培养液体外构建的3d模型进行化合物眼刺激性检测结果图。
具体实施方式
下面通过具体实施实例对本发明作进一步说明,并不作为对权利要求的限制。
实施例1:
本实施例着重介绍利用原代角膜上皮细胞体外构建的3d模型的体外构建方法步骤:
步骤一、细胞的准备
取原代角膜上皮细胞,复苏扩增后,使用p7代细胞,以胰酶消化制成单细胞悬液,调整细胞密度5.0×104个/ml,接种于培养瓶中,加10%胎牛血清的培养液ⅰ培养,轻轻晃动培养瓶,使细胞分散均匀后,置于37℃、5%co2条件下培养;
所述培养液ⅰ,为dmem,其所含葡萄糖含量为1.0g/l,谷氨酰胺含量为0.2g/l。
步骤二、3d模型的液下接种培养
取对数生长期细胞,以培养液ⅱ制成单细胞悬液,调整细胞密度为5.0×104个/ml,以200μl/室的体积,接种于小室内,将小室置于模型培养皿内,每皿添加适量培养液ⅱ,使小室内外液面高度一致,进行浸没式培养;置于37℃、5%co2条件下培养0.5小时,后转入液下培养,培养时间为3天,每天换液;
所述培养液ⅱ,是以dmem:f12含量为3:1的培养基为基础培养基,添加胎牛血清浓度为20%,维甲酸浓度为8μg/ml,人表皮生长因子浓度为0.8ng/ml,胰岛素浓度为20.0ng/ml,氢化可的松浓度为0.5μg/ml,腺嘌呤浓度为25.0μg/ml,三碘甲状腺氨酸浓度为0.1μg/ml,透明质酸浓度为0.1%,黄酮浓度为10.0μg/ml,谷氨酰胺浓度为0.2g/l,霍乱毒素浓度为1.0μg/l,二性霉素b浓度为1.0mg/l,青霉素浓度为100.0iu/ml,链霉素浓度为100.0μg/ml;
步骤三、3d模型的气液面增殖分化培养
将上述小室内的培养液弃掉,更换模型培养皿内的培养液为培养液ⅲ,使液面与小室内细胞上表面位于同一水平线,进行气液面培养,培养时间为7天,每天换液,培养结束,3d模型的体外构建结束;
所述培养液ⅲ,为在培养液ⅱ中,增加氢化可的松浓度为10.0μg/ml,透明质酸浓度为1%,黄酮浓度为100.0μg/ml,并添加维生素e浓度为50.0μg/ml。
利用原代角膜上皮细胞体外构建的3d模型的组织学切片he染色结果见图1,说明利用原代角膜上皮细胞体外构建的3d模型复层化结构完整。
实施例2:
本实施例着重介绍利用永生化角膜上皮细胞体外构建的3d模型的体外构建方法步骤:
步骤一、细胞的准备
取永生化角膜上皮细胞,复苏扩增后,使用p20代细胞,以胰酶消化制成单细胞悬液,调整细胞密度5.0×105个/ml,接种于培养瓶中,加10%胎牛血清的培养液ⅰ培养,轻轻晃动培养瓶,使细胞分散均匀后,置于37℃、5%co2条件下培养;
所述培养液ⅰ,为dmem,其所含葡萄糖含量为4.5g/l,谷氨酰胺含量为0.2g/l。
步骤二、3d模型的液下接种培养
取对数生长期细胞,以培养液ⅱ制成单细胞悬液,调整细胞密度为5.0×105个/ml,以200μl/室的体积,接种于小室内,将小室置于模型培养皿内,每皿添加适量培养液ⅱ,使小室内外液面高度一致,进行浸没式培养;置于37℃、5%co2条件下培养2小时,后转入液下培养,培养时间为3天,每天换液;
所述培养液ⅱ,是以dmem:f12含量为3:1的培养基为基础培养基,添加胎牛血清浓度为20%,维甲酸浓度为8μg/ml,人表皮生长因子浓度为0.5ng/ml,胰岛素浓度为20.0ng/ml,氢化可的松浓度为0.5μg/ml,腺嘌呤浓度为25.0μg/ml,三碘甲状腺氨酸浓度为0.1μg/ml,透明质酸浓度为0.1%,黄酮浓度为8.0μg/ml,谷氨酰胺浓度为0.2g/l,霍乱毒素浓度为1.0μg/l,二性霉素b浓度为1.0mg/l,青霉素浓度为100.0iu/ml,链霉素浓度为100.0μg/ml;
步骤三、3d模型的气液面增殖分化培养
将上述小室内的培养液弃掉,更换模型培养皿内的培养液为培养液ⅲ,使液面与小室内细胞上表面位于同一水平线,进行气液面培养,培养时间为7天,每天换液,培养结束,3d模型的体外构建结束;
所述培养液ⅲ,为在培养液ⅱ中,增加氢化可的松浓度为8.0μg/ml,透明质酸浓度为0.5%,黄酮浓度为80.0μg/ml,并添加维生素e浓度为40.0μg/ml。
利用永生化角膜上皮细胞体外构建的3d模型的角蛋白ck3免疫组化染色结果见图2,说明利用永生化角膜上皮细胞体外构建的3d模型蛋白表达与人角膜相似。
实施例3:
本实施例着重介绍利用口腔粘膜鳞状癌细胞株tr146体外构建的3d模型的体外构建方法步骤:
步骤一、细胞的准备
取口腔粘膜鳞状癌细胞株tr146,复苏扩增后,使用p14代细胞,以胰酶消化制成单细胞悬液,调整细胞密度5.0×106个/ml,接种于培养瓶中,加10%胎牛血清的培养液ⅰ培养,轻轻晃动培养瓶,使细胞分散均匀后,置于37℃、5%co2条件下培养;
所述培养液ⅰ,为dmem,其所含葡萄糖含量为1.0g/l,谷氨酰胺含量为0.2g/l。
步骤二、3d模型的液下接种培养
取对数生长期细胞,以培养液ⅱ制成单细胞悬液,调整细胞密度为5.0×106个/ml,以200μl/室的体积,接种于小室内,将小室置于模型培养皿内,每皿添加适量培养液ⅱ,使小室内外液面高度一致,进行浸没式培养;置于37℃、5%co2条件下培养2小时,后转入液下培养,培养时间为2天,每天换液;
所述培养液ⅱ,是以dmem:f12含量为3:1的培养基为基础培养基,添加胎牛血清浓度为10%,维甲酸浓度为8μg/ml,人表皮生长因子浓度为0.5ng/ml,胰岛素浓度为30.0ng/ml,氢化可的松浓度为1.0μg/ml,腺嘌呤浓度为50.0μg/ml,三碘甲状腺氨酸浓度为0.1μg/ml,透明质酸浓度为0.3%,黄酮浓度为8.0μg/ml,谷氨酰胺浓度为0.2g/l,霍乱毒素浓度为1.0μg/l,二性霉素b浓度为1.0mg/l,青霉素浓度为100.0iu/ml,链霉素浓度为100.0μg/ml;
步骤三、3d模型的气液面增殖分化培养
将上述小室内的培养液弃掉,更换模型培养皿内的培养液为培养液ⅲ,使液面与小室内细胞上表面位于同一水平线,进行气液面培养,培养时间为6天,每天换液,培养结束,3d模型的体外构建结束;
所述培养液ⅲ,为在培养液ⅱ中,增加氢化可的松浓度为8.0μg/ml,透明质酸浓度为0.6%,黄酮浓度为100.0μg/ml,并添加维生素e浓度为50.0μg/ml。
实施例4:
本实施例着重介绍利用原代角膜上皮细胞体外构建的3d模型进行et50检测的步骤:
1)将模型放入6孔板,在孔板内添加0.9ml的培养液。
2)吸取80μl0.3%tritonx-100,缓慢滴加于组织表面,确保试剂能够尽量覆盖在组织表面。
3)给药时间分别为0、30、60min。
4)最后一块组织给药后,将所有的6孔板转移到恒温培养箱中(37±1℃、5±1%co2、95%相对湿度)。
5)在组织孵育结束前30min,预备1mg/mlmtt溶液,并向24孔板每孔加入300μl的mtt溶液。
6)给药结束后开始洗涤程序,采用装有无菌dpbs的洗瓶清洗组织,清洗10次以后,采用dpbs浸洗组织培养小室里、外各一次。
7)将清洗好并且干燥的组织,转移至加有mtt测试溶液的24孔板中,恒温培养箱中(37±1℃、5±1%co2、95%相对湿度),孵育3hmin。
8)mtt孵育完成后,从孔板中轻柔的吸去mtt溶液,给孔板中加入dpbs溶液进行清洗过程。
9)洗涤完毕后,将组织底面用吸水纸擦干,转移到新的24孔板中,在培养小室中加入2ml异丙醇,它能够溶解mtt产生的结晶。采用封口膜密封24孔板间隙避免异丙醇挥发影响终体积。4℃静置过夜溶解。
10)溶解完成后,对于每个组织,吸取2份200μl的紫色甲瓒溶液到同一96孔板中。重复处理平行的组织,并依据孔板的设计转移液体,采用异丙醇作为空白对照。分光光度计570nm波长读取吸光度,不采用滤光镜。
11)3d模型的液下培养结束后组织活性与0.3%tritonx-100作用时间的曲线图见图3,可计算得出et50值为11.7min。3d模型的气液面培养结束后组织活性与0.3%tritonx-100作用时间的曲线图见图4,可计算得出et50值为59.6min。
实施例5:
本实施例着重介绍利用永生化角膜上皮细胞体外构建的3d模型进行化合物眼刺激性检测的步骤:
1)准备样品
进行实验分组,样本组为2种液体状的化学标准品,分别为二丙基二硫醚和n,n-二乙基间甲苯胺,其中二丙基二硫醚在人体试验中属于非眼表刺激性化学品,n,n-二乙基间甲苯胺人体试验结果为眼表刺激性化学品,阴性对照组为超纯水,阳性对照组为乙酸甲酯。
2)测试安全性
(1)每种测试物预备1个六孔板,共准备4个6孔板。在第一排各孔中添加0.9ml的dmem细胞培养液,每孔放置一个表面积为0.5cm2的体外重组角膜上皮模型。
(2)测试物及对照物处理前,用20μl杜氏磷酸盐缓冲液处理步骤(1)中的组织表面,在黑暗环境下于36~37℃、5%co2、95%相对湿度(标准培养条件)的培养箱中,培养15min,模拟人眼潮湿状态。
(3)测试物给药。在超净工作台中进行所有的给药操作:每隔30s给药一个模型(时间可不定,根据自身给药时间控制,但须保证每个模型的给药时间是一定的),确保给药后,留有充分的浸洗时间间隔。在0.5cm2组织表面分别进行给药,给药量为83.3μl/cm2(液体化学品)或83.3mg/cm2(固态化学品),给药后,轻摇细胞小室促进测试物在组织表面的铺展,在室温下,孵育30min,。注意:不可按压组织表面。
(4)至第一个给药的组织的给药时间结束,取出体外重组角膜上皮模型,准备三个无菌24孔板,用于细胞活力检测。
(5)开始洗涤程序。控制每个培养小室洗涤30s,用杜氏酸盐缓冲溶液洗体外重组角膜上皮模型15次,用无菌纱布或无菌棉棒擦拭。
(6)清洗结束后,在36~37℃、5%co2、95%相对湿度培养条件下,使用新鲜的dmem培养基培养组织120min。
(7)mtt测试将表面干燥的体外重组角膜上皮模型转移到含有1mg/ml噻唑蓝溶液的24孔板中,每孔0.3ml,在36~37℃、5%co2、95%湿度的细胞培养箱中避光孵育3小时。
(8)用移液器吸除噻唑蓝溶液,将体外重组角膜上皮模型完全浸没至每孔含2ml异丙醇的24孔板,用封口膜密封,在4℃静置提取12~16小时,得到异丙醇的浸提物。
(9)采用200μl移液器枪尖刺穿培养小室底部,使体外重组角膜上皮模型的异丙醇浸提物流到培养孔中。吸取200μl到异丙醇浸提物到96孔板中。
(10)测量吸光度:用96孔板分光光度计检测在波长为550~570nm的吸光度od值。
(11)判定刺激性:以阴性对照去离子水的吸光度值为分母,分别以测试样二丙基二硫醚和n,n-二乙基间甲苯胺的吸光度值为分子,比值的百分数作为各自的相对细胞活力。结果见图5,二丙基二硫醚的相对为69.1%,相对细胞活力高于60%,所以属于非眼表刺激性化学品。n,n-二乙基间甲苯胺的相对细胞活力为20.7%,相对细胞活力低于60%,说明n,n-二乙基间甲苯胺对眼表具有刺激性。(相对细胞活力高于60%,被检测的化学品无眼表刺激性,相对细胞活力低于60%,被检测的化学品具有刺激性。)
以上显示和描述了本发明的基本原理和主要特征及本发明的优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内,本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!