一种侧链及其合成方法,及采用该侧链合成硫酸羟基氯喹的方法与流程
本发明属于医药化工领域,具体涉及一种侧链及其合成方法,及采用该侧链合成硫酸羟基氯喹的方法。
背景技术:
硫酸羟基氯喹,化学名2-4-(7-氯-4-喹啉基)氨基戊基乙氨基-乙醇硫酸盐,英文名:hydroxychloroquinesulfate,化学结构式如下:
羟氯喹(hydroxychloroquine,hcq)是由4-氨基喹啉化合物构成的抗疟药,硫酸羟氯喹于1946年由surrey和hammer合成。临床上用于治疗盘状红斑狼疮及系统性红斑狼疮,目前也已广泛应用于风湿相关性疾病。
盘状红斑狼疮(dle)是比较常见的皮肤粘膜性结缔组织疾病,25%-35%有口腔损害,可单发于口腔而不合并皮肤损害,多无明显全身症状。其病因及发病机理目前尚不清楚,治疗上也比较困难,易复发及癌变。传统应用磷酸氯喹(cq)治疗dle有效,但副作用较大。hcq具有抗炎、抗阻胺与免疫抑制作用,使淋巴细胞转化率下降,抑制血管渗透性,稳定溶酶体膜,所以用hcq治疗dle有针对性。到目前为止,hcq被认为比cq安全。大量临床及文献报道证实,采用硫酸羟氯喹(hcq)治疗dle获得了满意的效果。
系统性红斑狼疮(systemiclupuserythematosus,sle)是一种多系统受累体内富含多种抗体的疾病,病因不清,治疗棘手。而抗疟药用于治疗sle始于1950年,dobois发现75%-80%的sle患者用抗疟药治疗后,皮疹、发热、关节症状改善,尤其是皮肤损害。其后研究发现,抗疟药可以使sle患者减少或停止使用皮质激素,并具有抗过敏作用。加拿大羟氯喹研究小组双盲对照研究表明,hcq能稳定sle患者的病情,明显减少复发。wallace等发现,hcq治疗可降低皮质激素依赖患者的血脂水平,可明显减少血栓形成的发生。鉴于hcq能为sle带来有益的作用,多数学者主张hcq用于轻到中度的sle患者,联合激素、免疫抑制剂用于重症sle的辅助治疗。
应用抗疟药治疗sle时,国外90%选择羟氯喹,而国内可能受认识和药物来源等因素的影响,大多数选择氯喹。其实从安全角度来说,如患者病情允许、不需要仅靠抗疟药物在短时间内发挥疗效时,应尽量选择羟氯喹。
随着科学家进一步研究发现,羟氯喹在风湿性疾病中可发挥多种免疫调节作用,首选羟氯喹具有显著的抗炎效应,它能稳定溶酶体、抑制酶的活性,进而抑制炎症介质的激活,同时可抑制炎症细胞如中性粒细胞的趋化和浸润,并显著减少促炎细胞因子如tnf-ɑ、il-1和il-6的产生;其次羟氯喹可通过抑制成纤维细胞的生长和结缔组织的沉积进而抑制关节炎患者滑膜的增生;再次羟氯喹可抑制抗原抗体的相互作用及免疫复合物的合成,促使类风湿因子滴度降低;羟氯喹还可通过影响紫外线吸收并阻挡紫外线对皮肤的伤害。以上种种皆为羟氯喹在临床治疗风湿性疾病提供大量依据。此外许多中心大规模临床研究也证实羟氯喹在风湿病的治疗中发挥显著的治疗效果。
目前,硫酸羟基氯喹的合成上一般采取如下合成路线:
该路线的核心是,5-(n-乙基-n-2-羟乙基胺)-2-戊胺(以下简称羟基氯喹侧链)与4,7-二氯喹啉在高温100~140℃反应制备得到羟基氯喹碱基,再与硫酸成盐。us2546658公开了一种硫酸羟基氯喹合成方法,反应过程如下:
该工艺较老,使用苯酚作为溶剂,苯酚有毒且具腐蚀性,环境污染严重,后处理复杂,不适宜工业化生产,且收率也比较低,在20%以下。
ca2561987公开了一种合成硫酸羟基氯喹的方法,反应过程如下:
该方法确立了羟基氯喹侧链与4,7-二氯喹啉合成羟喹碱基的提高收率的基本条件,即高温反应,虽然产品纯度也在99.5%以上,但所用溶剂甲基异丁基酮和试剂氢氧化锂价格高,原料成本高,且操作方法繁琐,时间长,不利于工业化生产。
wo2010027150也公开了一种合成硫酸羟基氯喹的方法,反应过程如下:
该法仍为高温反应,且需高压反应,安全风险较高。
cn103724261a公开了一种硫酸羟基氯喹啉的工业化新方法,反应过程如下:
该方法采用惰性气体保护,降低了氧化杂质产生的风险,但仍为高温反应,脱水、缩合等副反应无法避免,相应杂质仍然存在,其专利报道的hplc纯度也仅能保证≧99.2%。
羟基氯喹侧链是合成硫酸羟基氯喹的关键中间体,文献报道的合成方法有两种:路线一,是先将5-氯-2-戊酮先制备为缩酮,再与n-乙基乙醇胺反应,得到5-(n-乙基-n-2-羟乙基胺)-2-戊酮,再经氨化、氢化还原制得羟基氯喹侧链;路线二,以5-氯-2-戊酮与n-乙基乙醇胺反应得到5-(n-乙基-n-2-羟乙基胺)-2-戊酮,再经氨化、氢化还原制得羟基氯喹侧链。两种路线情况下均存在氨化、氢化步骤,需使用氨气或者高浓度液氨,气味重,对环境产生恶劣影响,同时亚胺需高压氢化还原制备氨基,安全风险较高。2015年,cn104803859a公布了一种5-(n-乙基-n-2-羟乙基胺)-2-戊胺的合成方法,即羟基氯喹侧链的合成方法,其合成路线如下:
综上,目前硫酸羟基氯喹的合成路线主要存在两个方面的不利因素:一是羟基氯喹侧链的制备:需使用氨气或者高浓度液氨,气味重,对环境产生恶劣影响,同时亚胺需高压氢化还原成氨基,安全风险较高;二是羟基氯喹碱基制备:由于4,7-二氯喹啉的4位氯活性相对较低,且无法仅使用催化剂如溴化钾、碘化钾等催化,因此需要在高温条件下反应,高温反应过程中,羟基氯喹侧链的端位-nh2及-oh均易氧化、脱水、缩合等,因此,如需保证产品质量均需采取较为繁琐后处理工艺及使用大量的有机溶剂。此外,现有合成路线还存在生产周期长、杂质含量偏高、收率偏低、原料成本偏高的缺陷。因此,设计一条工艺简单、反应条件温和、安全环保、收率和质量高、制造成本低的工业化合成路线将具有重大的社会意义和显著的经济价值。
技术实现要素:
本发明的目的在于提供一种侧链及其合成方法,及采用该侧链合成硫酸羟基氯喹的方法,该侧链的合成方法一方面可避免使用氨气或者高浓度液氨,且不需要高压氢化还原,使得该合成路线安全环保,另一方面,所合成的新的侧链替代了现有羟基氯喹侧链,在较低的反应温度下即可合成硫酸羟基氯喹,可避免羟基氯喹侧链的端位-nh2及-oh在高温条件下发生反应,有利于保证产品质量,并且不需要进行繁琐的后处理工艺。
本发明采用的技术方案如下:
一种侧链,其结构式如下:
一种侧链的合成方法,包括以下步骤:
(1)缩合反应:将n-乙基乙醇胺、相转移催化剂、无机碱、有机溶剂加入水中,控制温度为20~30℃,滴加5-氯-2-戊酮反应2~6小时,反应完成后分层,取有机层干燥后得到缩合产物有机相,缩合产物的化学名称为:5-(n-乙基-n-2-羟乙基胺)-2-戊酮;
(2)酯化反应:所述缩合产物有机相降温至0~10℃,保温滴加乙酰试剂反应1~3小时,反应完成后,分层,水洗,取有机层干燥后得到酯化产物有机相,酯化产物的化学名称为:5-(n-乙基-n-2-乙酰氧基胺)-2-戊酮;
(3)还原反应:将所述酯化产物有机相降温至-5~0℃,加入还原剂反应1~4小时,加入水,分层,取有机层干燥后得到还原产物有机相,还原产物的化学名称为:5-(n-乙基-n-2-乙酰氧基胺)-2-甲基戊醇;
(4)卤代反应:在还原产物有机相中加入催化剂,控制温度为25~40℃,保温滴加卤代试剂反应3~8小时,分层,水洗,取有机层干燥后得到侧链有机相,侧链的化学名称为:5-(n-乙基-n-2-乙酰氧基胺)-2-氯戊烷。
进一步地,酯化反应和卤代反应在反应完成进行分层前,需要将反应体系加入无机碱水溶液中反应,使酯化反应和卤代反应过程中生成的酸被中和,然后经分层、水洗,保证最终生成的侧链有机相中不含酸、碱等杂质,优选0~5℃的无机碱水溶液,可对反应后的体系进行初步降温,以利于后续反应。
进一步地,步骤(1)中,5-氯-2-戊酮与n-乙基乙醇胺的摩尔比为0.8~1.2,无机碱与5-氯-2-戊酮的摩尔比为1.2~1.8。
更为优选的,5-氯-2-戊酮与n-乙基乙醇胺的摩尔比为0.8~1.0,无机碱与n-乙基乙醇胺的摩尔比为1.2~1.5。该步骤中5-氯-2-戊酮与n-乙基乙醇胺的摩尔比设计为0.8~1.0,有利于5-氯-2-戊酮转化彻底,降低其在有机相中的残留,提高缩合产物的纯度及含量,减少杂质的生成,无机碱的摩尔用量略多于5-氯-2-戊酮摩尔用量即可,既确保催化性,辅酸量,又不至于浪费,还可降低三废排放。
进一步地,步骤(1)中,相转移催化剂为四丁基溴化铵、四丁基硫酸氢铵、四丁基氯化铵、三辛基甲基氯化铵、十二烷基三甲基氯化铵或十四烷基三甲基氯化铵。该步骤中,n-乙基乙醇胺溶于水,5-氯-2-戊酮溶于有机溶剂,因此反应体系是水相和有机相混合体系,属于异相系统,相转移催化剂可与水相中的离子所结合,并利用自身对有机溶剂的亲和性,将水相中的n-乙基乙醇胺转移到有机相中,促使反应发生,从而加快异相系统反应速率。
更为优选的,相转移催化剂为四丁基溴化铵。
进一步地,步骤(1)中,有机溶剂为二氯甲烷、氯仿或氯苯。
更为优选的,有机溶剂为氯仿。
进一步地,步骤(2)中,乙酰试剂与所述缩合产物的摩尔比为1.0~1.5。
进一步地,步骤(2)中,乙酰试剂为乙酰氯或醋酐。乙酰化就是在缩合产物中的端位-oh上引入乙酰基ch3co-的反应,具有产物转化率高、反应条件温和、环保等特点,常用乙酰试剂为乙酰氯或醋酐。
更为优选的,乙酰试剂为乙酰氯,其反应速率最快。
进一步地,步骤(2)中,无机碱水溶液的质量浓度为5~10%,用量为有机相重量的0.5~2.0倍。
更为优选的,无机碱水溶液的用量为有机相重量的1.0~2.0倍。
进一步地,步骤(3)中,还原剂与酯化产物的摩尔比为0.3~0.5。
进一步地,步骤(3)中,还原剂为硼氢化钠、硼氢化钾或硼烷乙醚。硼氢化还原试剂中的氢负离子释放后,碱性强,并具有强亲核性,可将酯化产物中的酯基还原成羟基。
更为优选的,还原剂为硼氢化钠,其反应条件温和,价格便宜,使用较为广泛。
进一步地,步骤(3)中,采用乙醇进行降温。乙醇除了可使酯化产物有机相迅速降温至所需反应温度外,其与有机溶剂混溶,还可促进反应物溶解,加快还原反应速率。
进一步地,步骤(3)中,乙醇的用量为有机溶剂重量的15~40%,水的用量为有机溶剂重量的0.5~2.0倍。
更为优选的,乙醇用量为有机溶剂重量的20~40%,水的用量为有机溶剂重量的0.5~1.5倍。
进一步地,步骤(4)中,卤代试剂与还原产物的摩尔比为1.2~1.5。
进一步地,步骤(4)中,卤代试剂为氯化亚砜、三氯化磷、溴化亚砜、三溴化磷、五溴化磷、n-氯代丁二酰亚胺、n-溴代丁二酰亚胺或n-碘代丁二酰亚胺。通过卤代反应,使还原产物中的羟基被卤素取代,形成卤代物,作为后续合成硫酸羟基氯喹的侧链。
更为优选的,卤代试剂为氯化亚砜。
进一步地,步骤(4)中,催化剂为n,n-二甲基甲酰胺,用量为卤代试剂重量的0.05~0.2倍。
进一步地,步骤(4)中,无机碱水溶液的质量浓度为8~10%,用量为有机相重量的4.0~6.0倍。
采用所述侧链合成硫酸羟基氯喹的方法,包括以下步骤:
(a)n保护反应:将4-氨基-7-氯喹啉、助溶剂加入到有机溶剂中,升温至30~40℃,加入对甲苯磺酰氯反应2~6小时,分层,水洗,经浓缩,重结晶、烘干得4-tos氨基-7-氯喹啉;
(b)缩合反应:在所述侧链有机相中,加入催化剂和4-tos氨基-7-氯喹啉,升温至60~80℃反应,反应完成后,降温至5~20℃,分层,有机层经浓缩后得到羟喹碱基粗品,重结晶、烘干后得到羟喹碱基;
更为优选的,反应完成后,降温至5~10℃,分层。
(c)成盐反应:将所述羟喹碱基加入到醇类溶剂中,升温至50~60℃,溶解完全后,滴加硫酸,反应1小时,降温至0~10℃结晶,得到硫酸羟基氯喹。
进一步地,步骤(a)和(b)中,反应完成进行分层前,需要将反应体系加入无机碱水溶液中反应。
步骤(a)中,采用0~10℃的无机碱水溶液。步骤(b)中,反应完成后,先将反应体系降温至20~30℃,然后加入至20~40℃的无机碱水溶液中反应3~8小时,优选30~40℃的无机碱水溶液。
进一步地,步骤(a)中,对甲苯磺酰氯与4-氨基-7-氯喹啉的摩尔比为1.0~1.2。
进一步地,步骤(a)中,有机溶剂为二氯甲烷、氯仿或二氯乙烷,用量为4-氨基-7-氯喹啉重量的3~6倍。
更为优选的,所述有机溶剂为氯仿。
进一步地,步骤(a)中,助溶剂为dmf、dmso或二氧六环,用量为4-氨基-7-氯喹啉重量的0.1~0.6倍。
更为优选的,所述助溶剂为dmf。
更为优选的,所述助溶剂的用量为4-氨基-7-氯喹啉重量的0.1~0.4倍。
进一步地,步骤(a)中,无机碱水溶液的质量浓度为5~10%,用量为有机相重量的1.0~2.0倍。
进一步地,步骤(a)中,烘干温度为40~70℃。
进一步地,步骤(b)中,侧链与4-tos氨基-7-氯喹啉的摩尔比为1.0~1.5。
更为优选的,所述侧链与4-tos氨基-7-氯喹啉的摩尔比为1.0~1.2。
进一步地,步骤(b)中,催化剂为碘化钾、碘化钠、四丁基溴化铵、dmap或吡啶,用量为侧链重量的0.02~0.1倍。
更为优选的,催化剂为四丁基溴化铵。
进一步地,步骤(b)中,无机碱水溶液的质量浓度为5~40%,用量为有机相重量的1.0~3.0倍。
更为优选的,所述无机碱水溶液的质量浓度为10~40%。
进一步地,步骤(b)中,烘干温度为40~70℃。
进一步地,步骤(c)中,硫酸与羟喹碱基的摩尔比为1.0~1.1。
进一步地,步骤(c)中,所述醇类溶剂为95%乙醇、甲醇或无水乙醇溶液,用量为羟喹碱基重量的3~5倍。
更为优选的,溶剂为95%乙醇。
进一步地,步骤(c)中,结晶时间为0.5~3小时。
进一步地,步骤(c)中,烘干温度为40~70℃。
上述侧链及硫酸羟基氯喹的合成方法中,采用的无机碱为碳酸钠、碳酸钾、氢氧化钠、氢氧化钾、碳酸氢钠或碳酸氢钾,其中,步骤(1)中的无机碱优选氢氧化钾,步骤(2)和步骤(4)中的无机碱优选碳酸钠,步骤(a)和步骤(b)中的无机碱优选氢氧化钠。步骤(1)中的无机碱是作为催化剂,和n-乙基乙醇胺、相转移催化剂、有机溶剂一起加入水中的,目的是促进n-乙基乙醇胺和5-氯-2-戊酮的缩合反应进程,加快反应速度,优选碱性较强的氢氧化钾。后续步骤中的无机碱均以碱水溶液的形式存在,用于中和反应过程中生成的酸,并调节ph,其中,步骤(2)和步骤(4)中生成的产物的稳定性较弱,因此,采用碱性较弱的碳酸钠,而步骤(a)和(b)中生成的产物的稳定性强,优选碱性较强的氢氧化钠。
上述一种侧链的合成方法中,干燥的方法为:有机层于10~20℃下在干燥剂的作用下干燥1~2小时,干燥剂为无水硫酸钠或无水硫酸镁,用量为有机溶剂的10~20%。
本发明合成路线的反应机理为:
首先,n-乙基乙醇胺和5-氯-2-戊酮经缩合、酯化、还原和卤代后得到侧链,反应过程如下:
然后,4-氨基-7-氯喹啉和对甲苯磺酰氯反应得到4-tos氨基-7-氯喹啉,最后4-tos氨基-7-氯喹啉再与所述侧链缩合、成盐,得到硫酸羟基氯喹,反应过程如下:
(其中r=cl、br、i,优选--cl)
综上所述,由于采用了上述技术方案,本发明的有益效果是:
1、本发明以n-乙基乙醇胺和5-氯-2-戊酮为原料进行缩合、酯化、还原及卤代反应后得到一种新的用于合成硫酸羟基氯喹的侧链,该侧链的合成为无氨化工艺、无催化氢化工艺,所使用的溶剂易回收利用,安全环保,并且操作方便,降低了工业化生产难度;
2、本发明的侧链替代了现有羟基氯喹侧链,并放弃传统4,7-二氯喹啉,改用4-氨基-7-氯喹啉与对甲苯磺酰氯反应,得到4-tos氨基-7-氯喹啉后,与所述新的侧链低温缩合即可合成硫酸羟基氯喹,降低了高温副反应杂质产生的风险,提升了产品的内在质量,简化了生产流程;
3、本发明的低温缩合工艺温度低、时间短,有利于降低能耗,提高设备利用率;
4.本发明的合成路线简单、反应条件温和、安全环保、收率和质量高、制造成本低,适于工业化生产硫酸羟基氯喹。
附图说明
图1是本发明合成路线示意图;
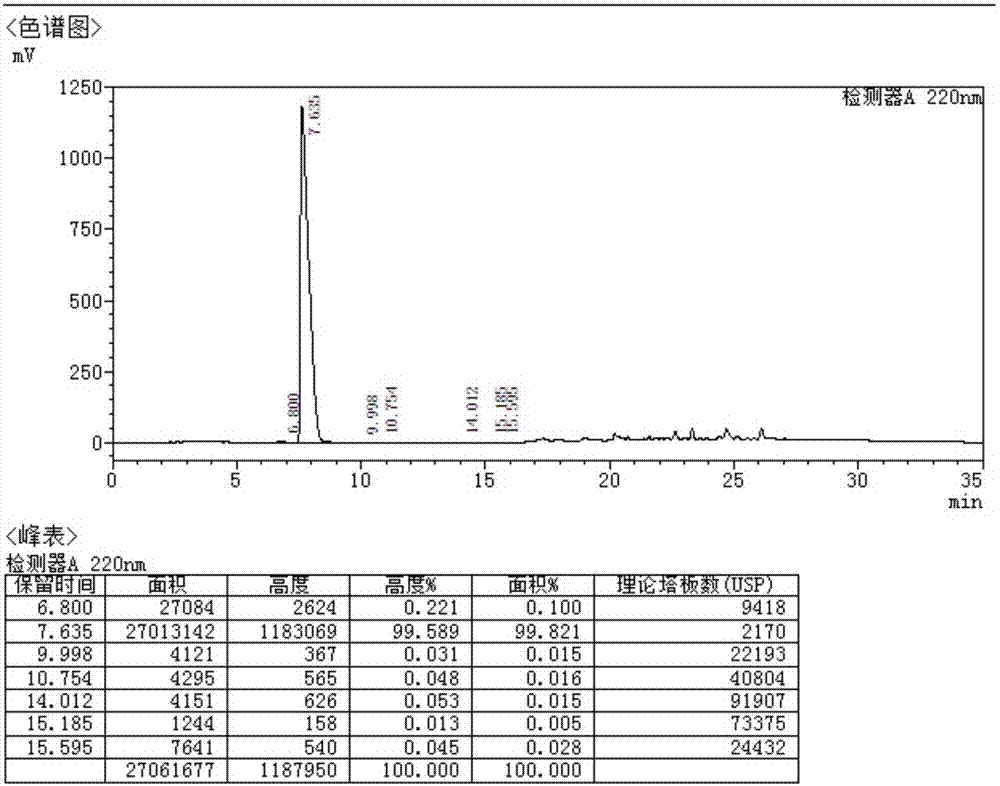
图2是硫酸羟基氯喹样品的hplc图谱;
图3是硫酸羟基氯喹对照品的hplc图谱。
具体实施方式
本说明书中公开的所有特征,除了互相排斥的特征和/或步骤以外,均可以以任何方式组合。
下面结合图1、图2、图3对本发明作详细说明。
本发明所用n-乙基乙醇胺、5-氯-2-戊酮、4-氨基-7-氯喹啉和对甲苯磺酰氯,以及所用到的有机溶剂、醇类溶剂均为可在市面上购买的工业原料,“95%乙醇”为工业95乙醇。
实施例1
侧链的制备:
(1)缩合反应:将30gn-乙基乙醇胺、0.6g四丁基溴化铵、25g氢氧化钾、240g氯仿、120g水加入反应瓶中,然后控制温度20~30℃,滴加38g5-氯-2-戊酮,滴加完毕后,搅拌反应3小时,静止分层,水相弃去,有机层加24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,滤液即为缩合产物有机相,检测其含量,缩合产物50.2g,摩尔收率92%(以5-氯-2-戊酮计),gc纯度≧98.5%。
(2)酯化反应:将步骤(1)制得的缩合产物有机相(缩合产物50.2g)降温至0~5℃,保温滴加24g乙酰氯,滴加完毕后,保温反应2小时,反应完毕将反应液缓慢加入预先降温至0~5℃的碳酸钠水溶液中(350g,碳酸钠质量分数为6%),搅拌30分钟,分层,有机相加200g水洗涤,分层,取有机层加24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,得到酯化产物有机相,检测其含量,酯化产物57.8g,摩尔收率91.9%,gc纯度≧99.0%。
(3)还原反应:在所述步骤(2)制得的酯化产物有机相(含酯化产物57.8g)中加入40g乙醇降温至-5~0℃,缓慢加入12.0g硼氢化钠,加完后保温反应2.0小时,加入180g水,搅拌30分钟,静置分层,再用100g水洗涤一次,静置分层,有机层加24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,得到还原产物有机相,检测其含量,还原产物54.6g,摩尔收率93.6%,gc纯度≧99.0%。
(4)卤代反应:在所述步骤(3)制得的还原产物有机相(含还原产物54.6g)中,加入2.0gmdf,控温25~40℃,保温滴加37.0g氯化亚砜,滴加完成后,反应4.0小时,将反应体系缓慢加入到0~5℃的碳酸钠水溶液中(800g,碳酸钠质量分数为8%),分层,有机层再加入200g水洗涤,静置分层后,有机层加24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,得到侧链有机相,检测其含量,侧链56.8g,摩尔收率96%,gc纯度≧99.0%。
实施例2
侧链的制备:
(1)缩合反应:将30gn-乙基乙醇胺、0.9g四丁基溴化铵、25g氢氧化钾、240g氯仿、120g水加入反应瓶中,然后控制温度20~30℃,滴加38g5-氯-2-戊酮,滴加完毕后,搅拌反应3小时,静止分层,水相弃去,有机层加24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,滤液即为缩合产物有机相,检测其含量,缩合产物50.8g,摩尔收率93.1%(以5-氯-2-戊酮计),gc纯度≧98.5%。
(2)酯化反应:将步骤(1)制得的缩合产物有机相(含缩合产物50.8g)降温至0~5℃,保温滴加24g乙酰氯,滴加完毕后,保温反应2小时,反应完毕,将反应液缓慢加入预先降温至0~5℃的碳酸钠水溶液中(350g,碳酸钠质量分数为6%),搅拌30分钟,分层,有机层加200g水洗涤,分层,有机层加入24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,得到酯化产物有机相,检测其含量,酯化产物57.9g,摩尔收率92.0%,gc纯度≧99.0%。
(3)还原反应:在步骤(2)制得的酯化产物有机相(含酯化产物57.9g)中加入40g乙醇,降温至-5~0℃,缓慢加入12.0g硼氢化钠,加完后保温-5~0℃反应2.0小时,加入180g水,搅拌30分钟,静置分层,再用100g水洗涤一次,静置分层,有机层加入24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,得到还原产物有机相,检测其含量,还原物53.8g,摩尔收率92.1%,gc纯度≧99.0%。
(4)卤代反应:在步骤(3)制得的还原产物有机相(含还原产物53.8g)中,加入2.0gmdf,控温25~40℃,保温滴加36.0g氯化亚砜,滴加完成后,反应4.0小时,将反应体系缓慢加入到0~5℃的碳酸钠水溶液中(800g,碳酸钠质量分数为8%),分层,有机层再加入200g水洗涤,静置分层后,有机层加入24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,得到侧链有机相,检测其含量,侧链56.0g,摩尔收率96%,gc纯度≧99.0%。
实施例3
侧链的制备:
(1)缩合反应:将30gn-乙基乙醇胺、1.2g四丁基溴化铵、25g氢氧化钾、240g氯仿、120g水加入反应瓶中,然后控制温度20~30℃,滴加38g5-氯-2-戊酮,滴加完毕后,搅拌反应3小时,静止分层,水相弃去,有机层加入24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,滤液即为缩合产物有机相,检测其含量,缩合产物51.7g,摩尔收率94.7%(以5-氯-2-戊酮计),gc纯度≧98.5%。
(2)酯化反应:将步骤(1)制得的缩合产物有机相(缩合产物51.7g)降温至0~5℃,保温滴加24g乙酰氯,滴加完毕后,保温反应2小时,反应完毕将反应液缓慢加入预先降温至0~5℃的碳酸钠水溶液中(350g,碳酸钠质量分数为6%),搅拌30分钟,分层,有机层加200g水洗涤,分层,有机层再加入24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,得到酯化产物有机相,检测其含量,酯化产物59.6g,摩尔收率93.2%,gc纯度≧99.0%。
(3)还原反应:在步骤(2)制得的酯化产物有机相(含酯化产物59.6g)中加入40g乙醇,降温至-5~0℃,缓慢加入12.0g硼氢化钠,加完后保温反应2.0小时,加入180g水,搅拌30分钟,静置分层,再用100g水洗涤一次,静置分层,有机层加入24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,得到还原产物有机相,检测其含量,还原产物55.6g,摩尔收率92.4%,gc纯度≧99.0%。
(4)卤代反应:在步骤(3)制得的还原产物有机相(含还原产物55.6g)中,加入2.0gmdf,控温25~40℃,保温滴加36.0g氯化亚砜,滴加完成后,反应4.0小时,将反应体系缓慢加入到0~5℃的碳酸钠水溶液中(800g,碳酸钠质量分数为8%),分层,有机层再加入200g水洗涤,静置分层后,有机层加入24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,得到侧链有机相,检测其含量,侧链57.0g,摩尔收率94.5%,gc纯度≧99.0%。
实施例4
侧链的制备:
(1)缩合反应:将30gn-乙基乙醇胺、0.6g四丁基溴化铵、25g氢氧化钾、240g氯仿、120g水加入反应瓶中,然后控制温度20~30℃,滴加38g5-氯-2-戊酮,滴加完毕后,搅拌反应3小时,静置分层,水相弃去,有机层加24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,滤液即为缩合产物有机相,检测其含量,缩合产物50.2g,摩尔收率91.9%(以5-氯-2-戊酮计),gc纯度≧98.5%。
(2)酯化反应:将步骤(1)制得的缩合产物有机相(缩合产物50.2g)降温至0~5℃,保温滴加24g乙酰氯,滴加完毕后,保温反应2小时,反应完毕将反应液缓慢加入预先降温至0~5℃碳酸钠水溶液中(350g,碳酸钠质量分数为6%),搅拌30分钟,分层,有机层加200g水洗涤,分层,有机层加入24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,得到酯化产物有机相,检测其含量,酯化产物57.4g,摩尔收率92.4%,gc纯度≧99.0%。
(3)还原反应:在步骤(2)制得的酯化产物有机相(含酯化产物57.4g)中加入40g乙醇,降温至-5~0℃,缓慢加入12.0g硼氢化钠,加完后保温反应2.0小时,加入180g水,搅拌30分钟,静置分层,再用100g水洗涤一次,静置分层,有机层加入24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,得到还原产物有机相,检测其含量,还原产物54.4g,摩尔收率93.8%,gc纯度≧99.0%。
(4)卤代反应:在步骤(3)制得的还原产物有机相(含还原产物54.4g)中,加入2.0gmdf,控温25~40℃,保温滴加39.0g氯化亚砜,滴加完成后,反应4.0小时,将反应体系缓慢加入到0~5℃的碳酸钠水溶液中(800g,碳酸钠质量分数为8%),分层,有机层再加入200g水洗涤,静置分层后,有机层加入24g无水硫酸钠,控制温度10~20℃,搅拌干燥1小时,过滤,得到侧链有机相,检测其含量,侧链56.7g,摩尔收率96.1%,gc纯度≧99.0%。
实施例5
硫酸羟基氯喹的制备:
(a)n保护反应:将45g4-氨基-7-氯喹啉、5gdmf加入180g氯仿中,升温至30~40℃,加入50.0g对甲苯磺酰氯,反应3小时,反应完成后,将反应体系加入0~10℃的氢氧化钠水溶液中(200g,氢氧化钠质量分数为8%),分层,有机层再加入100g水洗,分层,有机层减压浓缩回收氯仿,再加入100g甲醇,升温回流30分钟溶清,降温至0~5℃重结晶,过滤,50~60℃烘干,得4-tos氨基-7-氯喹啉80g,摩尔95.5%,纯度≧99.5%。
(b)缩合反应:在实施例1制得的侧链有机相中(含侧链56.8g)加入78.0g步骤(a)制得的4-tos氨基-7-氯喹啉,3.0g四丁基溴化铵,升温至65~70℃反应,反应6.0小时后,体系降温至20~30℃,加入至30~40℃的氢氧化钠水溶液中(300g,氢氧化钠质量分数为15%),保温30~40℃反应6.0小时,降温至10~15℃,静置分层,有机层浓缩回收氯仿后得到羟喹碱基粗品,再加入260g95%乙醇,升温回流溶清,降温至0~10℃,重结晶,过滤,50~60℃烘干得羟喹碱基110.4g,摩尔收率96.1%(以4-氨基-7-氯喹啉计),纯度≧99.5%。
(c)成盐反应:取70g步骤(b)制得的羟喹碱基、200g95%乙醇加入反应瓶中,升温至50~60℃,溶解,滴加18.8g质量分数为80%的硫酸,滴加完毕后保温反应1小时,降温至0~10℃结晶2.0小时,过滤,50~60℃烘干得硫酸羟基氯喹57.7g,摩尔收率93.2%,纯度≧99.8%,总杂≦0.2%,最大单杂≦0.1%,未知杂质≦0.1%,灼烧残渣≦0.2%,水分≦0.3%,重金属≦10ppm。
实施例6
硫酸羟基氯喹的制备:
(a)n保护反应:将45g4-氨基-7-氯喹啉、5gdmf加入180g氯仿中,升温至30~40℃,加入52.0g对甲苯磺酰氯,反应4小时,反应完成后,将反应体系加入0~10℃的氢氧化钠水溶液中(200g,氢氧化钠质量分数为8%),分层,有机层再加入100g水洗,分层,有机层减压浓缩回收氯仿,再加入100g甲醇,升温回流30分钟溶清,降温至0~5℃重结晶,过滤,50~60℃烘干,得4-tos氨基-7-氯喹啉81.3g,摩尔97.02%,纯度≧99.5%。
(b)缩合反应:在实施例2制得的侧链有机相中(含侧链53.8g)加入72.0g步骤(a)制得的4-tos氨基-7-氯喹啉,2.5g四丁基溴化铵,升温至65~70℃反应,反应6.0小时后,体系降温至20~30℃,加入至30~40℃的氢氧化钠水溶液中(300g,氢氧化钠质量分数为15%),保温30~40℃反应6.0小时,降温至10~15℃,静置分层,有机层经浓缩回收氯仿后得到羟喹碱基粗品,再加260g95%乙醇,升温回流溶清,降温至0~10℃,重结晶,过滤,50~60℃烘干得羟喹碱基101.9g,摩尔收率95.3%(以4-氨基-7-氯喹啉计),纯度≧99.5%。
(c)成盐反应:取70g步骤(b)制得的羟喹碱基、200g95%乙醇加入反应瓶中,升温至50~60℃,溶解,滴加18.8g质量分数为80%的硫酸,滴加完毕后保温反应1小时,降温至0~10℃结晶2.0小时,过滤,50~60℃烘干得硫酸羟基氯喹58.1g,摩尔收率93.8%,纯度≧99.8%,总杂≦0.2%,最大单杂≦0.1%,未知杂质≦0.1%,灼烧残渣≦0.2%,水分≦0.3%,重金属≦10ppm。
实施例7
硫酸羟基氯喹的制备:
(a)n保护反应:将45g4-氨基-7-氯喹啉、5gdmf加入180g氯仿中,升温至30~40℃,加入52.0g对甲苯磺酰氯,反应4小时,反应完成后,将反应体系加入0~10℃的氢氧化钠水溶液中(200g,氢氧化钠质量分数为8%),分层,有机层再加入100g水洗,分层,有机层减压浓缩回收氯仿,再加入100g甲醇,升温回流30分钟溶清,降温至0~5℃重结晶,过滤,50~60℃烘干,得4-tos氨基-7-氯喹啉80.6g,摩尔96.19%,纯度≧99.5%。
(b)缩合反应:在实施例3制得的侧链有机相中(含侧链57.0g)加入72.0g步骤(a)制得的4-tos氨基-7-氯喹啉,2.5g四丁基溴化铵,升温至65~70℃反应,反应6.0小时后,体系降温至20~30℃,加入至30~40℃的氢氧化钠水溶液中(300g,氢氧化钠质量分数为15%),保温30~40℃反应6.0小时,降温至10~15℃,静置分层,有机层经浓缩回收氯仿后得到羟喹碱基粗品,再加260g95%乙醇,升温回流溶清,降温至0~10℃重结晶,过滤,50~60℃烘干得羟喹碱基100.7g,摩尔收率95.0%(以4-氨基-7-氯喹啉计),纯度≧99.5%。
(c)成盐反应:取70g步骤(b)制得的羟喹碱基、200g95%乙醇加入反应瓶中,升温至50~60℃,溶解,滴加18.8g质量分数为80%的硫酸,滴加完毕后保温反应1小时,降温至0~10℃结晶2.0小时,过滤,50~60℃烘干得硫酸羟基氯喹58.7g,摩尔收率94.8%,纯度≧99.8%,总杂≦0.2%,最大单杂≦0.1%,未知杂质≦0.1%,灼烧残渣≦0.2%,水分≦0.3%,重金属≦10ppm。
实施例8
硫酸羟基氯喹的制备:
(a)n保护反应:将45g4-氨基-7-氯喹啉、5gdmf加入180g氯仿中,升温至30~40℃,加入52.0g对甲苯磺酰氯,反应4小时,反应完成后,将反应体系加入0~10℃的氢氧化钠水溶液中(200g,氢氧化钠质量分数为8%),分层,有机层再加入100g水洗,分层,有机层经减压浓缩回收氯仿,再加入100g甲醇,升温回流30分钟溶清,降温至0~5℃重结晶,过滤,50~60℃烘干,得4-tos氨基-7-氯喹啉80.9g,摩尔96.50%,纯度≧99.5%。
(b)缩合反应:在实施例4制得的侧链有机相中(含侧链56.7g)加入75.0g步骤(a)制得的4-tos氨基-7-氯喹啉,3.0g四丁基溴化铵,升温至60~65℃反应,反应6.0小时后,体系降温至20~30℃,加入至30~40℃的氢氧化钠水溶液中(300g,氢氧化钠质量分数为15%),保温30~40℃反应6.0小时,降温至10~15℃,静置分层,有机层经浓缩回收氯仿后得到羟喹碱基粗品,再加260g95%乙醇,升温回流溶清,降温至0~10℃重结晶,过滤,50~60℃烘干得羟喹碱基103.4g,摩尔收率93.6%(以4-氨基-7-氯喹啉计),纯度≧99.5%。
(c)成盐反应:取70g步骤(b)制得的羟喹碱基、200g95%乙醇加入反应瓶中,升温至50~60℃,溶解,滴加18.8g质量分数为80%的硫酸,滴加完毕后保温反应1小时,降温至0~10℃结晶2.0小时,过滤,50~60℃烘干得硫酸羟基氯喹57.8g,摩尔收率93.6%,纯度≧99.8%,总杂≦0.2%,最大单杂≦0.1%,未知杂质≦0.1%,灼烧残渣≦0.2%,水分≦0.3%,重金属≦10ppm。
实施例9
高效液相色谱法(hplc),以液体为流动相,采用高压输液系统,将具有不同极性的单一溶剂或不同比例的混合溶剂、缓冲液等流动相泵入装有固定相的色谱柱,在柱内各成分被分离后,进入检测器进行检测,从而实现对试样的分析。实施例5制得的硫酸羟基氯喹样品的hplc图谱如图2所示,硫酸羟基氯喹对照品的hplc图谱如图3所示。
通过图2和图3的对比可以明确的是,本发明制备的硫酸羟基氯喹相比于硫酸羟基氯喹对照品,其杂质种类少、总纯度高,并且最大单杂纯度更低,在质量上优于对照品。
如上所述即为本发明的实施例。本发明不局限于上述实施方式,任何人应该得知在本发明的启示下做出的结构变化,凡是与本发明具有相同或相近的技术方案,均落入本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!