盐生草耐盐基因HgS3及其应用的制作方法
本发明属于植物生物工程和转基因技术领域,具体涉及盐生植物盐生草耐盐基因及其在提高植物耐盐性中的应用。
背景技术:
土壤盐渍化是影响作物生长和产量的最主要非生物胁迫之一。随着全球气候的逐渐变暖,更是加剧了土壤盐渍化进程,尤其是针对我国西北广大旱区和半干旱地区来讲,原本极为有限的降雨量进一步减少,蒸发进一步的加强,致使土壤盐渍化形势更加严峻,且由于传统农业过度灌溉,只灌不排,更是让大面积宝贵的可耕作土地资源被盐渍化所吞噬,最终不得不被农业生产所抛弃,逐渐演变成荒漠化和沙漠化土地。因此,提高植物(作物)耐盐性,使得植物(作物)能够在这些荒废的盐渍地上生长,做到充分利用和有效改良这些盐渍土壤对保障我国粮食安全和改善生态环境,实现农业可持续发展具有重要意义。
我国西北地区广泛分布着多种耐盐植物,这些植物对当地严酷的自然环境形成了良好的适应性,从耐盐植物(作物)培育的角度来考虑,这些植物是宝贵的耐盐基因发掘优异材料。而关于西北旱区本土盐生植物耐盐基因发掘的研究较少,尤其是抗盐先锋植物盐生草(halogetonglomeratus),从中发掘优异耐盐基因对培育耐盐植物(作物)材料具有重要的运用价值。
技术实现要素:
本发明的目的在于避免现有技术的不足之处而提供一种盐生草耐盐基因hgs3,以应对当前对优良耐盐基因的需求。
本发明的又一目的在于提供了一种盐生草耐盐基因hgs3的制备方法,从而实现高效、快速获得该基因。
本发明的还一目的在于提供了一种所述的盐生草耐盐基因hgs3在提高植株耐盐性的应用。
本发明依据前期盐生草盐胁迫响应转录组学测序结果(transcriptomicprofilingofthesalt-stressresponseinthehalophytehalogetonglomeratus[j].bmcgenomics,2015,16(1):169),筛选鉴定到盐胁迫诱导表达基因hgs3,进一步在盐生草叶片中分离出hgs3基因,并将该基因连接到超表达载体pcambia3300上,而后通过农杆菌浸染法转化拟南芥,连续抗生素kan筛选,获得t2代转基因纯系,经幼苗耐盐性分析证实,hgs3基因能够显著提高拟南芥植株的耐盐性。
为实现上述目的,本发明采取的技术方案为:一种盐生草耐盐基因hgs3,其主要特点在于从盐生草叶片中分离得到的hgs3基因的核苷酸序列seqidno.1如下,分子量468bp:
所述的盐生草耐盐基因hgs3,其特征在于所述的基因cdna编码序列为分离到的hgs3基因的核苷酸序列中第208至第336位所述的核苷酸序列seqidno.2如下,分子量为219bp:
所述的盐生草耐盐基因hgs3,所述的基因cdna编码序列的基因编码蛋白氨基酸序列seqidno.3,由42个氨基酸组成:
所述的盐生草耐盐基因hgs3,其特异引物为:
hgs3-f1为5’-aaaagacactccataatcttgtgtt-3’,
hgs3-r1为5’-ttttattgatgcaaataagctacta-3’。
由上海生工生物工程公司合成。
所述的盐生草耐盐基因hgs3的制备方法,其主要特点在于步骤为:
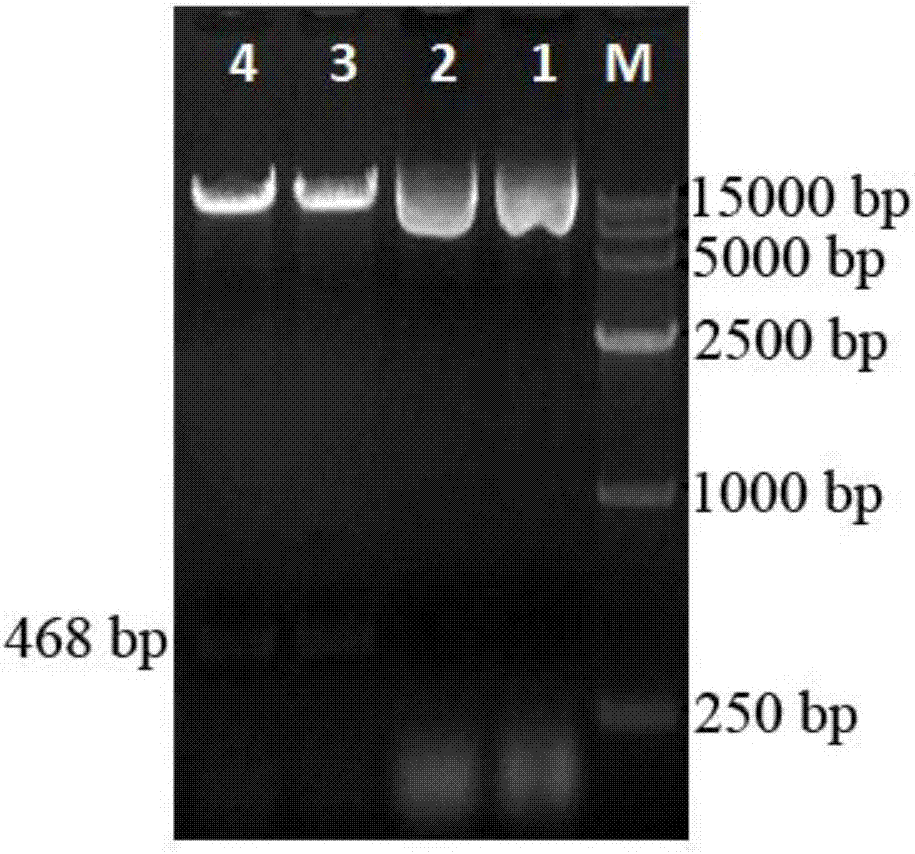
以200-500mmnacl处理3-7d的盐生草幼苗叶片组织为材料,用trizol法提取总rna,采用cdna合成试剂盒反转录合成cdna第一链,扩增所述基因片段,pcr反应体系为5×primestarbuffer5μl,dntpmixture(各2.5mm)2μl,上游引物f15’-aaaagacactccataatcttgtgtt-3’(10μm)1μl,下游引物r15’-ttttattgatgcaaataagctacta-3’(10μm)1μl,cdna1μl,primestarhsdna聚合酶0.25μl,超纯水14.75μl,总体积25μl;扩增程序为94℃预变性4min,94℃50s,60-60.4℃15-20s,72℃1min,共32-35个循环,72℃延伸7-8min,扩增结果如图1所示;利用胶回收试剂盒(大连宝生物工程有限公司)回收pcr产物,按照说明书步骤:首先用琼脂糖凝胶检测目的片段大小,用灭菌刀片切开含有目的基因的胶块,并装入1.5ml离心管中;对切下的胶块称重,根据1mg=1μl的比例将重量换算其体积,然后加入3倍体积的buffergm用于融化胶块,融化过程中振荡或吸打使其充分融化;将spin柱置于收集管,然后将所有胶块融化液转至spin柱里,室温离心12000rpm,1min,倒掉滤液;加700μlbufferwb于spin柱且静置5min后,室温离心12000rpm,1min,倒掉滤液,重复上一步骤;将空spin柱放在收集管上,室温离心12000rpm,1min,放置2min;再将spin柱放入新离心管上,在膜中央加20-30μl灭菌超纯水,放置1min;室温12000rpm,离心1min,用于洗脱dna,最后吸取2-3μl用于电泳检测,其它产物-20℃保存;接着将回收产物与pmd19-t载体连接,得到重组质粒pmd19-hgs3,转化大肠杆菌dh5α感受态细胞,筛选蓝白斑,并进行菌落pcr鉴定,电泳检测含有目标条带的菌液送上海生工生物工程公司进行测序。
所述的盐生草耐盐基因hgs3的表达载体的构建方法,其步骤为:
在所述的盐生草耐盐基因hgs3的上下游引物上分别添加bamhi和saci这两个酶切位点,上游引物f1为5’-cgggatccaaaagacactccataatcttgtgtt-3’、下游引物r1为5’-cgagctcttttattgatgcaaataagctacta-3’:
以200-500mmnacl处理3-7d的盐生草幼苗叶片组织为材料,用trizol法提取总rna,采用cdna合成试剂盒反转录合成cdna第一链,扩增所述基因片段,pcr反应体系为5×primestarbuffer5μl,dntpmixture(各2.5mm)2μl,上游引物f15’-cgggatccaaaagacactccataatcttgtgtt-3’(10μm)1μl,下游引物r15’-cgagctcttttattgatgcaaataagctacta-3’(10μm)1μl,cdna1μl,primestarhsdna聚合酶0.25μl,超纯水14.75μl,总体积25μl;扩增程序为94℃预变性4min,94℃50s,60-60.4℃15-20s,72℃1min,共32-35个循环,72℃延伸7-8min;利用胶回收试剂盒(大连宝生物工程有限公司)回收pcr产物,按照说明书步骤:首先琼脂糖凝胶检测目的片段大小,用灭菌刀片切开含有目的基因的胶片,并装入1.5ml离心管中;对切下的胶块称重,根据1mg=1μl的比例将重量换算其体积,然后加3倍体积的buffergm用于融化胶块,融化过程中适当振荡或吸打使其充分融化;将spin柱置于收集管,然后将所有胶块融化液转至spin柱里,室温离心12000rpm,1min,倒掉滤液;加700μlbufferwb于spin柱且静置5min后,室温离心12000rpm,1min,倒掉滤液,重复上一步骤;将空spin柱放在收集管上,室温离心12000rpm,1min,放置2min;再将spin柱放入新离心管上,于膜中央加20-30μl灭菌超纯水,放置1min;室温12000rpm,离心1min,用于洗脱dna,最后吸取2-3μl用于电泳检测,其它产物-20℃保存;接着将回收产物与pmd19-t载体连接,得到重组质粒pmd19-hgs3,转化大肠杆菌dh5α感受态细胞,筛选蓝白斑,并进行菌落pcr鉴定,电泳检测含有目标条带的菌液送上海生工生物工程公司进行测序。
提取含有bamhi和saci酶切位点的hgs3基因的t-载体和植物表达载体pcambia3300质粒dna并用bamhi和saci两种内切酶对所提质粒进行双酶切,酶切体系为10×quickcutbuffer3μl,质粒dna4μl,quickcutbamh11μl,quickcutsac11μl,ddh2o21μl,总体积30μl。在37℃酶切6-8h,并对酶切产物进行电泳检测并纯化回收。接着用t4dna连接酶,对上一步中纯化回收的载体及hgs3基因目的片段进行连接,连接体系为10×t4dna连接酶buffer1μl,目的片段7μl,载体dna1μl,总体积9μl。首先在65℃水浴保温3min后,迅速冰浴1-2min,然后加t4dna连接酶1μl于16℃下连接12-18h,得到重组质粒转化大肠杆菌感受态细胞,筛选蓝白斑并测序,确认得到含有带有目的基因hgs3的重组质粒pcambia3300-hgs3;同时对重组质粒pcambia3300-hgs3在37℃酶切6-8h,其双酶切体系为10×quickcutbuffer3μl,质粒dna6μl,quickcutbamh11.2μl,quickcutsac11.2μl,ddh2o18.6μl,总体积30μl。
所述的盐生草耐盐基因hgs3在提高植株耐盐性的应用。
本发明提供的重组质粒pcambia3300-hgs3,所述质粒为插入seqidno.1所示的hgs3基因cdna的核苷酸序列或cdna编码序列。需要说明的是,任何可以将外源基因导入植物的表达载体均适用于本发明,包括直接基因转移技术,如基因枪法、原生质体法、脂质体法、花粉管通道法、电激转化法、peg介导转化方法等;生物介导的转化方法,主要有农杆菌介导和病毒介导两种转化方法等。
本发明提供的耐盐基因hgs3在提高植物耐盐性的应用可广泛运用于耐盐作物、植物新品种(系)的选育。
本发明有益效果在于从西北本土盐生植物盐生草中克隆到一个新的耐盐基因,通过转化拟南芥植株进行耐盐性鉴定,结果显示转化hgs3基因的拟南芥株系表现出优良的耐盐特性。同时hgs3其分子量仅为468bp,极适合于遗传转化操作,本发明中耐盐基因hgs3的获得为通过生物技术手段培育耐盐植物(作物)新品系(种)培育提供了候选基因。
附图说明:
图1hgs3基因cdna编码核苷酸序列的扩增结果。m:dl1000marker;1-3为hgs3基因pcr产物;
图2pcambia3300-hgs3表达载体构建双酶切验证结果。m:dl15000marker;1-2:pcambia3300-hgs3质粒;3-4:酶切电泳结果;
图3转化hgs3基因拟南芥t2代阳性植株分子检测结果。m:dl2000marker;1-12pcr测定序列如seqidno.1所示:抗性苗pcr产物;“-”:空白对照;“wt”:野生型拟南芥;“+”:质粒;
图4转化hgs3基因拟南芥t2代株系在400mmnacl胁迫下的生长状态。
具体实施方式
以下的实施例便于更好地理解本发明,并非限制本发明。下面实施例的实验方法和试剂等,若无特殊说明,均为常规方法和试剂。
实施例1所述的盐生草耐盐基因hgs3的制备方法,其主要特点在于步骤为:
以200mmnacl处理3-7d的盐生草幼苗叶片组织为材料,用trizol法提取总rna,采用cdna合成试剂盒(大连宝生物工程有限公司)反转录合成cdna第一链,扩增所述基因片段,pcr反应体系为5×primestarbuffer5μl,dntpmixture(各2.5mm)2μl,上游引物f15’-aaaagacactccataatcttgtgtt-3’(10μm)1μl,下游引物r15’-ttttattgatgcaaataagctacta-3’(10μm)1μl(由上海生工生物工程公司合成),cdna1μl,primestarhsdna聚合酶0.25μl,超纯水14.75μl,总体积25μl;扩增程序为94℃预变性4min,94℃50s,60℃20s,72℃1min,共32个循环,72℃延伸8min,pcr扩增结果如图1所示;利用胶回收试剂盒(大连宝生物工程有限公司)回收pcr产物,按照说明书步骤:首先用琼脂糖凝胶检测目的片段大小,用灭菌刀片切开含有目的基因的胶块,并装入1.5ml离心管中;对切下的胶块称重,根据1mg=1μl的比例将重量换算其体积,然后加入3倍体积的buffergm用于融化胶块,融化过程中振荡或吸打使其充分融化;将spin柱置于收集管,然后将所有胶块融化液转至spin柱里,室温离心12000rpm,1min,倒掉滤液;加700μlbufferwb于spin柱且静置5min后,室温离心12000rpm,1min,倒掉滤液,重复上一步骤;将空spin柱放在收集管上,室温离心12000rpm,1min,放置2min;再将spin柱放入新离心管上,在膜中央加20-30μl灭菌超纯水,放置1min;室温12000rpm,离心1min,用于洗脱dna,最后吸取2-3μl用于电泳检测,其它产物-20℃保存;接着将回收产物与pmd19-t载体连接,得到重组质粒pmd19-hgs3,转化大肠杆菌dh5α感受态细胞,筛选蓝白斑,并进行菌落pcr鉴定,电泳检测含有目标条带的菌液送上海生工生物工程公司进行测序。pcr测定序列见seqidno.1:
所述的盐生草耐盐基因hgs3,所述的基因cdna编码序列为分离到的hgs3基因的核苷酸序列中第208至第336位所述的核苷酸序列seqidno.2如下,分子量为129bp:
所述的盐生草耐盐基因hgs3基因cdna编码序列的基因编码蛋白氨基酸序列seqidno.3,由42个氨基酸组成:
实施例2:所述的盐生草耐盐基因hgs3的制备方法,其特征在于步骤为:
以500mmnacl处理3-7d的盐生草幼苗叶片组织为材料,用trizol法提取总rna,采用cdna合成试剂盒(大连宝生物工程有限公司)反转录合成cdna第一链,扩增所述基因片段,pcr反应体系为5×primestarbuffer5μl,dntpmixture(各2.5mm)2μl,上游引物f15’-aaaagacactccataatcttgtgtt-3’(10μm)1μl,下游引物r15’-ttttattgatgcaaataagctacta-3’(10μm)1μl(由上海生工生物工程公司合成),cdna1μl,primestarhsdna聚合酶0.25μl,超纯水14.75μl,总体积25μl;扩增程序为94℃预变性4min,94℃50s,60.4℃15s,72℃1min,共35个循环,72℃延伸8min,pcr扩增结果如图1所示;利用胶回收试剂盒(大连宝生物过程有限公司)回收pcr产物,按照说明书步骤:首先用琼脂糖凝胶检测目的片段大小,用灭菌刀片切开含有目的基因的胶块,并装入1.5ml离心管中;对切下的胶块称重,根据1mg=1μl的比例将重量换算其体积,然后加入3倍体积的buffergm用于融化胶块,融化过程中适当振荡或吸打使其充分融化;将spin柱置于收集管,然后将所有胶块融化液转至spin柱里,室温离心12000rpm,1min,倒掉滤液;加700μlbufferwb于spin柱且静置5min后,室温离心12000rpm,1min,倒掉滤液,重复上一步骤;将空spin柱放在收集管上,室温离心12000rpm,1min,放置2min;再将spin柱放入新离心管上,在膜中央加20-30μl灭菌超纯水,放置1min;室温12000rpm,离心1min,用于洗脱dna,最后吸取2-3μl用于电泳检测,其它产物-20℃保存;接着将回收产物与pmd19-t载体连接,得到重组质粒pmd19-hgs3,转化大肠杆菌dh5α感受态细胞,筛选蓝白斑,并进行菌落pcr鉴定,电泳检测含有目标条带的菌液送上海生工生物工程公司进行测序,pcr测定序列如seqidno.1所示。
实施例3:所述的盐生草耐盐基因hgs3的表达载体的构建方法,其步骤为:
在所述的盐生草耐盐基因hgs3的上下游引物上分别添加bamhi和saci这两个酶切位点,上游引物f1为5’-cgggatccaaaagacactccataatcttgtgtt-3’、下游引物r1为5’-cgagctcttttattgatgcaaataagctacta-3’(由上海生工生物工程公司合成):
以200mmnacl处理3-7d的盐生草幼苗叶片组织为材料,用trizol法提取总rna,采用cdna合成试剂盒(大连宝生物工程有限公司)反转录合成cdna第一链,扩增所述基因片段,pcr反应体系为5×primestarbuffer5μl,dntpmixture(各2.5mm)2μl,上游引物f15’-cgggatccaaaagacactccataatcttgtgtt-3’(10μm)1μl,下游引物r15’-cgagctcttttattgatgcaaataagctacta-3’(10μm)1μl(由上海生工生物工程公司合成),cdna1μl,primestarhsdna聚合酶0.25μl,超纯水14.75μl,总体积25μl;扩增程序为94℃预变性4min,94℃50s,60℃20s,72℃1min,共32个循环,72℃延伸8min,pcr扩增结果如图1所示;利用胶回收试剂盒(大连宝生物过程有限公司)回收pcr产物,按照说明书步骤:首先用琼脂糖凝胶检测目的片段大小,用灭菌刀片切开含有目的基因的胶块,并装入1.5ml离心管中;对切下的胶块称重,根据1mg=1μl的比例将重量换算其体积,然后加入3倍体积的buffergm用于融化胶块,融化过程中适当振荡或吸打使其充分融化;将spin柱置于收集管,然后将所有胶块融化液转至spin柱里,室温离心12000rpm,1min,倒掉滤液;加700μlbufferwb于spin柱且静置5min后,室温离心12000rpm,1min,倒掉滤液,重复上一步骤;将空spin柱放在收集管上,室温离心12000rpm,1min,放置2min;再将spin柱放入新离心管上,在膜中央加20-30μl灭菌超纯水,放置1min;室温12000rpm,离心1min,用于洗脱dna,最后吸取2-3μl用于电泳检测,其它产物-20℃保存;接着将回收产物与pmd19-t载体连接,得到重组质粒pmd19-hgs3,转化大肠杆菌dh5α感受态细胞,筛选蓝白斑,并进行菌落pcr鉴定,电泳检测含有目标条带的菌液送上海生工生物工程公司进行测序,pcr测定序列如seqidno.1所示。
提取含有bamhi和saci酶切位点的hgs3基因的t-载体和植物表达载体pcambia3300质粒dna并用bamhi和saci两种内切酶对所提质粒进行双酶切,酶切体系为10×quickcutbuffer3μl,质粒dna4μl,quickcutbamh11μl,quickcutsac11μl,ddh2o21μl,总体积30μl(大连宝生物工程有限公司试剂)。在37℃酶切6-8h,并对酶切产物进行电泳检测并纯化回收(图2)。接着用t4dna连接酶,对上一步中纯化回收的载体及hgs3基因目的片段进行连接,连接体系为10×t4dna连接酶buffer1μl,目的片段7μl,载体dna1μl,总体积9μl。首先在65℃水浴保温3min后,迅速冰浴1min,然后加t4dna连接酶1μl于16℃下连接18h,得到重组质粒转化大肠杆菌感受态细胞,筛选蓝白斑并测序,确认得到含有带有目的基因hgs3的重组质粒pcambia3300-hgs3;同时对重组质粒pcambia3300-hgs3在37℃酶切6h,其双酶切体系为10×quickcutbuffer3μl,质粒dna6μl,quickcutbamh11.2μl,quickcutsac11.2μl,ddh2o18.6μl,总体积30μl。
实施例4:所述的盐生草耐盐基因hgs3的表达载体的构建方法,其步骤为:
在所述的盐生草耐盐基因hgs3的上下游引物上分别添加bamhi和saci这两个酶切位点,上游引物f1为5’-cgggatccaaaagacactccataatcttgtgtt-3’、下游引物r1为5’-cgagctcttttattgatgcaaataagctacta-3’(由上海生工生物工程公司合成)。
以500mmnacl处理3-7d的盐生草幼苗叶片组织为材料,用trizol法提取总rna,采用cdna合成试剂盒(大连宝生物工程有限公司)反转录合成cdna第一链,扩增所述基因片段,pcr反应体系为5×primestarbuffer5μl,dntpmixture(各2.5mm)2μl,上游引物f15’-cgggatccaaaagacactccataatcttgtgtt-3’(10μm)1μl,下游引物r15’-cgagctcttttattgatgcaaataagctacta-3’(10μm)1μl(由上海生工生物工程公司合成),cdna1μl,primestarhsdna聚合酶0.25μl,超纯水14.75μl,总体积25μl;扩增程序为94℃预变性4min,94℃50s,60.4℃15s,72℃1min,共35个循环,72℃延伸8min,pcr扩增结果如图1所示;利用胶回收试剂盒回收pcr产物,按照说明书步骤:首先用琼脂糖凝胶检测目的片段大小,用灭菌刀片切开含有目的基因的胶块,并装入1.5ml离心管中;对切下的胶块称重,根据1mg=1μl的比例将重量换算其体积,然后加入3倍体积的buffergm用于融化胶块,融化过程中适当振荡或吸打使其充分融化;将spin柱置于收集管,然后将所有胶块融化液转至spin柱里,室温离心12000rpm,1min,倒掉滤液;加700μlbufferwb于spin柱且静置5min后,室温离心12000rpm,1min,倒掉滤液,重复上一步骤;将空spin柱放在收集管上,室温离心12000rpm,1min,放置2min;再将spin柱放入新离心管上,在膜中央加20-30μl灭菌超纯水,放置1min;室温12000rpm,离心1min,用于洗脱dna,最后吸取2-3μl用于电泳检测,其它产物-20℃保存;接着将回收产物与pmd19-t载体连接,得到重组质粒pmd19-hgs3,转化大肠杆菌dh5α感受态细胞,筛选蓝白斑,并进行菌落pcr鉴定,电泳检测含有目标条带的菌液送上海生工生物工程公司进行测序,pcr测定序列如seqidno.1所示。
对hgs3再次进行pcr扩增,链接到t-载体测序,获得的hgs3基因序列如seqidno.1所示。提取含有bamhi和saci酶切位点的hgs3基因的t-载体和植物表达载体pcambia3300质粒dna并用bamhi和saci两种内切酶对所提质粒进行双酶切,酶切体系为10×quickcutbuffer3μl,质粒dna4μl,quickcutbamh11μl,quickcutsac11μl,ddh2o21μl,总体积30μl(大连宝生物工程有限公司试剂)。在37℃酶切6-8h,并对酶切产物进行电泳检测并纯化回收(图2)。接着用t4dna连接酶,对上一步中纯化回收的载体及hgs3基因目的片段进行连接,连接体系为10×t4dna连接酶buffer1μl,目的片段7μl,载体dna1μl,总体积9μl。首先在65℃水浴保温3min后,迅速冰浴2min,然后加t4dna连接酶1μl于16℃下连接12h,得到重组质粒转化大肠杆菌感受态细胞,筛选蓝白斑并测序,确认得到含有带有目的基因hgs3的重组质粒pcambia3300-hgs3;同时对重组质粒pcambia3300-hgs3在37℃酶切8h,其双酶切体系为10×quickcutbuffer3μl,质粒dna6μl,quickcutbamh11.2μl,quickcutsac11.2μl,ddh2o18.6μl,总体积30μl。
实施例5农杆菌拟南芥转化与培养
制备lba4404农杆菌并活化,将重组质粒pcambia3300-hgs3转入感受态农杆菌中,制备农杆菌浸染液,采用蘸花法侵染拟南芥花序,然后将侵染的植株覆盖塑料薄膜避光培养24h后移至温室中常规培养,待拟南芥植株成熟后分单株收获种子。收获的拟南芥种子低温处理、灭菌后撒播在含抗生素kan(50ug/ml)的1/2ms固体培养基中筛选抗性苗,并移栽培养,待幼苗长大后,剪取植株叶片提取dna,用实施例1中hgs3基因上下游引物扩增表达载体pcambia3300-hgs3中hgs3片段。连续筛选,并进行目标基因pcr检测(图3),直至获得t2转hgs3基因拟南芥纯系。
实施例6转hgs3基因拟南芥耐盐性鉴定
将实施例3中获得t2转hgs3基因拟南芥纯系植株和野生型拟南芥(col-1)种子播种于培养基质(草炭:蛭石:珍珠岩为1:3:0.5体积比混合)中,在温室中培养,待幼苗长至1个月后,分别浇灌400mmnacl溶液,观察幼苗生长特性,结果发现,随着盐胁迫的持续加重,野生型拟南芥生长严重减缓。在nacl胁迫处理6d后,发现野生型拟南芥植株严重萎蔫,植株部分叶片变黄干枯,当胁迫至9d后时,野生型拟南芥干枯死亡,而转hgs3基因拟南芥幼苗依旧存活(图4)。因此,可看出转化hgs3基因能够提高拟南芥植株的耐盐特性,该基因可运用到其他植物(作物)耐盐性育种工作中。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
sequencelisting
<110>甘肃农业大学
<120>盐生草耐盐基因hgs3及其应用
<130>
<160>3
<170>patentinversion3.3
<210>1
<211>468
<212>dna
<213>盐生草耐盐基因hgs3的核苷酸序列
<400>1
aaaagacactccataatcttgtgtttgcatggattctttaaatttgcaaggctcattctt60
attatcttatttaagcacctaacatttactacataaccacgaataagcagacaatacagt120
gttcttgtatcaagttttgcttagaagtattgttattcgacacaagtttcgatttgtcat180
agaaataacgtagcaactagcaatcaaatggcagtaagaggagctttatcgacaccaacc240
tcatctcttcaagcagcacttacccaattgtctttcataaagaaaactcaccctaaacag300
gtcttatttttactacttagcttgaaattgttataaatggggacagtatatattgttcta360
gtcattacgataaagagatatatgtcctattaatggatgaatcctcgtattttacctcct420
cgttgtaaatatgtactcgtccttgtagtagcttatttgcatcaataa468
<210>2
<211>129
<212>dna
<213>盐生草耐盐基因hgs3的编码序列
<400>2
atggcagtaagaggagctttatcgacaccaacctcatctcttcaagcagcacttacccaa60
ttgtctttcataaagaaaactcaccctaaacaggtcttatttttactacttagcttgaaa120
ttgttataa129
<210>3
<211>42
<212>prt
<213>盐生草耐盐基因hgs3编码序列的蛋白氨基酸序列
<400>3
metalavalargglyalaleuserthrprothrserserleuglnala
151015
alaleuthrglnleuserpheilelyslysthrhisprolysglnval
202530
leupheleuleuleuserleulysleuleu
3540
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于检测牛源大肠杆菌喹诺酮耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测肉鸡沙门氏菌环丙沙星耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测大肠埃希菌氧氟沙星耐药基因的分子标记及其应用的制造方法与工艺
- 检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR引物及方法与制造工艺
- 幽门螺旋杆菌及其耐药基因突变检测试剂盒和检测方法与制造工艺
- 一种糖肽类抗生素耐药基因检测试剂盒的制造方法与工艺
- 用于检测产AmpC酶的三种细菌耐药基因的LAMP引物组合及其应用的制造方法与工艺
- 环介导等温扩增多重耐药基因oqxAB的检测引物、检测试剂盒及检测方法与制造工艺
- 一种同时检测多种病原体的三重PCR检测方法与制造工艺
- 四环素耐药基因检测并联探针、基因芯片、试剂盒与检测法的制造方法与工艺
- 逆转肿瘤多药耐药的基因组合物h‑R3/PAMAM G5/MDR1 siRNA及其应用的制作方法与工艺
- 盐生草耐盐基因HgS2及其应用的制造方法与工艺
- 一种快速核酸检测肺炎支原体及耐药突变的方法和试剂盒与流程
- 一种用于检测巴氏杆菌氯霉素类药物耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测B族链球菌四环素耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测粪肠球菌庆大霉素耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测葡萄球菌磺胺类药物耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测肉鸡沙门氏菌环丙沙星耐药基因的分子标记及其应用的制造方法与工艺
- 检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR引物及方法与制造工艺
- 一种检测幽门螺杆菌耐药突变位点的试剂盒和方法与制造工艺