一种蛋白合成冻干制剂及其制备方法和应用与流程
本发明涉及生物技术领域,具体地,涉及一种蛋白合成冻干制剂及其制备方法和应用。
背景技术:
真空冷冻干燥技术是将湿物料或溶液在较低的温度(-10℃~-50℃)下冻结成固态,然后在真空(1.3~13帕)下使其中的水分不经液态直接升华成气态,最终使物料脱水的干燥技术。真空冷冻干燥全过程分为预冻、第一阶段升华干燥和第二阶段再干燥。
目前,冷冻干燥方法是保持蛋白质活性的一个有效的、普遍应用的方法,有益于储存和运输,然而冷冻干燥过程存在着一些潜在的损伤危险。在预冷、一次干燥、二次干燥和储存过程中,蛋白质可能存在一定程度的变性和损伤。
随着科学技术的发展,无细胞表达体系(也被称为体外蛋白合成系统),已经开始得到广泛应用,其是以外源目的mrna或dna为蛋白质合成模板,通过人工控制补加蛋白质合成所需的底物和转录、翻译相关蛋白因子等物质,能实现目的蛋白质的合成。体外翻译系统中表达蛋白质无需进行质粒构建、转化、细胞培养、细胞收集和破碎步骤,是一种快速、省时、便捷的蛋白质表达方式。
无细胞表达体系的一个缺点是细胞提取物的保存,液体必须储存于-80℃,同时不能反复冻融,否则会严重影响细胞提取物合成蛋白的能力。
目前仍未有冻干其他真核细胞,如酵母,无细胞表达体系的成功案例。
目前,酵母体外蛋白合成系统的细胞提取物的冻干工艺并不存在。
因此,本领域迫切需要开发一种能够在酵母体外蛋白合成系统中提高蛋白合成活性的冻干制剂。
技术实现要素:
本发明的目的在于提供一种能够在酵母体外蛋白合成系统中提高蛋白合成活性的冻干制剂。
本发明第一方面提供了一种用于体外蛋白合成的无细胞冻干制剂,所述冻干制剂包括:
(a)细胞提取物,所述的细胞提取物为酵母细胞的提取物;和
(b)蛋白合成促进剂,其中所述的蛋白合成促进剂选自下组:单糖、二糖、寡糖、可溶性淀粉、或其组合。
在另一优选例中,所述蛋白合成促进剂选自下组:蔗糖、海藻糖、甘露醇、乳糖、葡萄糖、麦芽糖、半乳糖、或其组合。
在另一优选例中,所述蛋白合成促进剂选自下组:蔗糖、海藻糖、乳糖、或其组合。
在另一优选例中,所述的无细胞冻干制剂还含有选自下组的一种或多种的任选的辅助性物质:(c)peg、葡聚糖、白蛋白、dmso、甘油、或其组合。
在另一优选例中,所述的无细胞冻干制剂由或基本上由组分(a)、(b)和(c)构成。
在另一优选例中,所述的蛋白合成促进剂是额外添加的(即不是来自酵母提取物)。
在另一优选例中,所述的无细胞冻干制剂进行重构后,形成无细胞的酵母体外蛋白质合成体系。
在另一优选例中,当所述的无细胞冻干制剂重构为液态制剂后,所述的蛋白合成促进剂的浓度为0.2-5wt%,以所述液态制剂的总重计。
在另一优选例中,所述的重构为用水进行重构。
在另一优选例中,所述的重构按0.1-4g冻干制剂:0.5-30g水(较佳地,0.2-2g冻干制剂:1-15g水,更佳地,0.3-1g冻干制剂:2-10g水)进行重构。
在另一优选例中,所述酵母细胞选自下组的一种或多种来源的酵母:酿酒酵母、毕氏酵母、克鲁维酵母、或其组合;较佳地,所述的酵母细胞包括:克鲁维酵母,更佳地为乳酸克鲁维酵母。
在另一优选例中,所述无细胞冻干制剂中,所述组分(a)的含量为10%-95%,较佳地,20%-80%,更佳地,40%-60%,以所述无细胞冻干制剂的总重量计。
在另一优选例中,在重构后形成的酵母体外蛋白质合成体系中,所述组分(a)的重量体积比为约50%。
在另一优选例中,在重构后形成的酵母体外蛋白质合成体系中,所述组分(b)的浓度(m/v)为0.5%-10%,较佳地,0.5%-4%,更佳地,1%-2%,以所述酵母体外蛋白质合成体系的总体积计。
在另一优选例中,在重构后形成的酵母体外蛋白质合成体系中,所述蛋白质体外合成的活性(rlu)≥4×107,较佳地,5×107-5×109,更佳地,6×107-4×109。
在另一优选例中,所述无细胞冻干制剂还包括选自下组的一种或多种组分:
(c1)聚乙二醇;
(c2)用于合成rna的底物;
(c3)用于合成蛋白的底物;
(c4)镁离子;
(c5)钾离子;
(c6)缓冲剂;
(c7)rna聚合酶;
(c8)能量再生系统。
在另一优选例中,所述的合成rna的底物包括:核苷单磷酸、核苷三磷酸、或其组合。
在另一优选例中,所述的合成蛋白的底物包括:1-20种天然氨基酸、以及非天然氨基酸。
在另一优选例中,所述镁离子来源于镁离子源,所述镁离子源选自下组:醋酸镁、谷氨酸镁、或其组合。
在另一优选例中,所述钾离子来源于钾离子源,所述钾离子源选自下组:醋酸钾、谷氨酸钾、或其组合。
在另一优选例中,所述能量再生系统选自下组:磷酸肌酸/磷酸肌酸酶系统、糖酵解途径及其中间产物能量系统、或其组合。
在另一优选例中,所述缓冲剂选自下组:4-羟乙基哌嗪乙磺酸、三羟甲基氨基甲烷、或其组合。
在另一优选例中,所述聚乙二醇选自下组:peg3000、peg8000、peg6000、peg3350、或其组合。
在另一优选例中,所述无细胞冻干制剂还包括(d1)外源的用于指导蛋白质合成的dna分子。
本发明第二方面提供了一种制备本发明第一方面所述的无细胞冻干制剂的方法,包括:
(i)提供一细胞提取物,所述的细胞提取物为酵母细胞的提取物;
(ii)向所述的细胞提取物中添加蛋白合成促进剂,获得一混合物,所述蛋白合成促进剂选自下组:单糖、二糖、寡糖、可溶性淀粉、或其组合;和
(iii)将所述的混合物进行冻干,获得经冻干的本发明第一方面所述的无细胞冻干制剂。
在另一优选例中,所述的酵母细胞提取物是用包括以下步骤的方法制备:
(i)提供酵母细胞;
(ii)对酵母细胞进行洗涤处理,获得经洗涤的酵母细胞;
(iii)对经洗涤的酵母细胞进行破细胞处理,从而获得酵母粗提物;和
(iv)对所述酵母粗提物进行固液分离,获得液体部分,即为酵母细胞提取物。
在另一优选例中,所述的固液分离包括离心。
在另一优选例中,在液态下进行离心。
在另一优选例中,所述离心条件为5000-100000×g,较佳地,8000-30000×g。
在另一优选例中,所述离心时间为0.5-2h,较佳地,20min-50min。
在另一优选例中,所述离心在1-10℃下进行,较佳地,在2-6℃下进行。
在另一优选例中,所述的洗涤处理采用洗涤液在ph为7-8(较佳地,7.4)下进行处理。
在另一优选例中,所述洗涤液选自下组:4-羟乙基哌嗪乙磺酸钾、醋酸钾、醋酸镁、或其组合。
在另一优选例中,所述的破细胞处理包括高压破碎、冻融(如液氮低温)破碎。
在另一优选例中,所述步骤(ii)中,所述冻干包括预冻阶段、冷冻干燥第一阶段、冷冻干燥第二阶段、和/或最终冻干阶段。
在另一优选例中,所述步骤(ii)中,所述冻干步骤中,所述预冻阶段的冻结温度为-55±5℃,所述冷冻干燥第一阶段的冻结温度为-30±5℃,所述冷冻干燥的第二阶段的冻结温度为-30±5℃,所述最终冻干阶段的冻结温度为-20±5℃。
在另一优选例中,所述步骤(ii)中,所述冻干步骤中,所述预冻阶段的干燥时间为4±4小时,所述冷冻干燥第一阶段的干燥时间为2-15小时,较佳地,3-12小时,所述冷冻干燥的第二阶段的干燥时间为10±2小时,所述最终冻干阶段的干燥时间为8-25小时,较佳地,10-20小时。
本发明第四方面提供了一种物质的用途,所述的物质选自下组:单糖、二糖、寡糖、可溶性淀粉、或其组合,并且所述物质用于制备提高蛋白合成活性的试剂。
本发明第四方面提供了一种试剂盒,所述的试剂盒包括容器以及位于所述容器中的本发明第一方面所述的无细胞冻干制剂。
在另一优选例中,所述的试剂盒还包括使用说明书和任选的一种或多种选自下组的任选试剂:
(a)复苏液或复苏试剂;
(b)检测试剂。
在另一优选例中,所述的复苏液选自下组:水、tris缓冲液、hepes缓冲液、或其组合。
在另一优选例中,所述复苏液或复苏试剂用于重构本发明第一方面所述的无细胞冻干制剂。
在另一优选例中,所述的冻干制剂和任选试剂是独立包装的。
本发明第五方面提供了一种表达待表达的外源蛋白的方法,包括:
(i)提供一酵母体外蛋白质合成体系,其中所述的合成体系中含有蛋白合成促进剂,所述蛋白合成促进剂选自下组;单糖、二糖、寡糖、可溶性淀粉、或其组合;和
(ii)在适合表达蛋白的条件下,在所述外源蛋白的模板存在下,孵育所述酵母体外蛋白质合成体系,从而表达所述的外源蛋白。
在另一优选例中,所述酵母体外蛋白质合成体系为本发明第一方面所述的无细胞冻干制剂经重构(或复溶)后形成的。
在另一优选例中,所述酵母体外蛋白质合成体系为未冻干的酵母体外蛋白质合成体系。
在另一优选例中,所述的蛋白合成促进剂为额外添加的。
在另一优选例中,所述的方法是非诊断性和非治疗性的。
在另一优选例中,所述酵母体外蛋白合成体系为基因改造的克鲁维酵母体外蛋白合成体系(优选乳酸克鲁维酵母体外蛋白合成体系)。
在另一优选例中,所述外源蛋白的编码序列来自原核生物、真核生物。
在另一优选例中,所述外源蛋白的编码序列来自动物、植物、病原体。
在另一优选例中,所述外源蛋白的编码序列来自哺乳动物,较佳地灵长动物,啮齿动物,包括人、小鼠、大鼠。
在另一优选例中,所述的外源蛋白的编码序列选自下组:编码荧光素蛋白、或荧光素酶(如萤火虫荧光素酶)、绿色荧光蛋白、黄色荧光蛋白、氨酰trna合成酶、甘油醛-3-磷酸脱氢酶、过氧化氢酶、肌动蛋白、抗体的可变区域的外源dna、萤光素酶突变体的dna、或其组合。
在另一优选例中,所述外源蛋白选自下组:荧光素蛋白、或荧光素酶(如萤火虫荧光素酶)、绿色荧光蛋白、黄色荧光蛋白、氨酰trna合成酶、甘油醛-3-磷酸脱氢酶、过氧化氢酶、肌动蛋白、抗体的可变区域、萤光素酶突变、α-淀粉酶、肠道菌素a、丙型肝炎病毒e2糖蛋白、胰岛素前体、干扰素αa、白细胞介素-1β、溶菌酶素、血清白蛋白、单链抗体段(scfv)、甲状腺素运载蛋白、酪氨酸酶、木聚糖酶、或其组合。
本发明第六方面提供了一种体外蛋白合成体系,包括:
(a)细胞提取物,所述的细胞提取物为酵母细胞的提取物;和
(b)蛋白合成促进剂,其中所述的蛋白合成促进剂选自下组:单糖、二糖、寡糖、可溶性淀粉、或其组合。
在另一优选例中,所述的体外蛋白合成体系为液态。
在另一优选例中,所述的体外蛋白合成体系是用本发明第一方面所述的用于体外蛋白合成的无细胞冻干制剂经重构(或复溶)而形成的。
在另一优选例中,所述体外蛋白合成体系还包括选自下组的一种或多种组分:
(c1)聚乙二醇;
(c2)用于合成rna的底物;
(c3)用于合成蛋白的底物;
(c4)镁离子;
(c5)钾离子;
(c6)缓冲剂;
(c7)rna聚合酶;
(c8)能量再生系统。
在另一优选例中,所述体外蛋白合成体系为未冻干的体外蛋白合成体系。
在另一优选例中,所述体外蛋白质合成体系为本发明第一方面所述的无细胞冻干制剂经重构(或复溶)后形成的。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
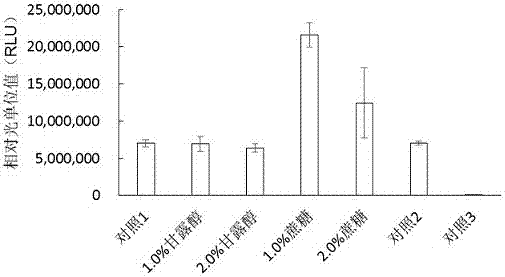
图1显示了0.5ml体系的细胞提取物的蛋白合成促进剂的影响示意图。对照1为未添加保护剂的细胞提取物的冻干粉,对照2为未冻干的细胞提取物,对照3为未添加萤火虫荧光素酶(fireflyluciferase,fluc)dna的体外蛋白质合成体系。其他的样品为加入了适当浓度的不同保护剂的细胞提取物冻干粉。反应条件为20-25℃反应2h。所有误差为三次重复的标准偏差。
图2显示了5ml体系的细胞提取物的蛋白合成促进剂的影响示意图。对照1为未添加保护剂的细胞提取物的冻干粉,对照2为未冻干的细胞提取物,对照3为未添加萤火虫荧光素酶(fireflyluciferase,fluc)dna的体外蛋白质合成体系。其他的样品为加入了适当浓度的不同保护剂的细胞提取物冻干粉。反应条件为20-25℃反应2h。所有误差为三次重复的标准偏差。
图3显示了0.5ml和5ml体系的细胞提取物冻干粉对于蛋白合成能力的影响示意图。对照1为未添加保护剂的细胞提取物的冻干粉。其他的细胞提取物冻干粉的蛋白合成促进剂为1%的蔗糖。样品1为添加1%的蔗糖的5ml的细胞提取物的冻干粉,样品2为添加1%的蔗糖的0.5ml的细胞提取物的冻干粉。反应温度为20-25℃,反应时间为2h。所有误差为三次重复的标准偏差。
图4显示了蔗糖浓度对于细胞提取物冻干粉的体外蛋白合成能力的影响示意图。反应温度为20-25℃,反应时间为2h。对照1为未添加保护剂的细胞提取物的冻干粉,对照2为未冻干的细胞提取物。其他样品为采用不同浓度蔗糖作为保护剂的细胞提取物的冻干粉。所有误差为三次重复的标准偏差。
图5显示了1%的蔗糖浓度对于不同批次细胞提取物冻干粉的体外蛋白合成能力的影响示意图。反应温度为20-25℃,反应时间为2h。本实验采用1%蔗糖作为保护剂的六种细胞提取物的冻干粉的体外合成蛋白能力的测定结果。所有误差为三次重复的标准偏差。
图6显示了蔗糖对于细胞提取物的冻干粉影响示意图。反应温度为20-25℃,反应时间为2h。样品1为未添加保护剂的细胞提取物的冻干粉,但在体外蛋白合成体系中加入1%的蔗糖,样品2为未添加保护剂的细胞提取物的冻干粉,体外蛋白合成体系中未加入蔗糖,样品3为添加1%蔗糖作为保护剂的细胞提取物的冻干粉,体外蛋白合成体系中未加入蔗糖。对照3为未添加萤火虫荧光素酶(fireflyluciferase,fluc)dna的体外蛋白质合成体系。所有误差为三次重复的标准偏差。
具体实施方式
本发明人经过广泛而深入的研究,首次意外地发现,由特定比例的细胞提取物(如酵母细胞提取物)、蛋白合成促进剂(如单糖、二糖、寡糖、可溶性淀粉等)制成的无细胞冻干制剂可显著提高外源蛋白的合成活性,其rlu最高可达3×109-4×109。并且本发明的蛋白合成促进剂可以在未冻干的体外蛋白合成体系(如酵母体外蛋白合成体系)中促进体外蛋白的合成,并且可以在体外蛋白合成体系(如酵母体外蛋白合成体系)冻干之前、冻干的同时、冻干之后加入本发明的蛋白合成促进剂,其中,在体外蛋白合成体系(如酵母体外蛋白合成体系)冻干之前加入蛋白合成促进剂对蛋白合成的促进作用更好。在此基础上,完成了本发明。
具体地,经过广泛研究和实验摸索,首次发现了一种可以用于具有合成能力的酵母细胞提取物的冻干方法,方便储存样品、降低成本。在保护剂的作用下,与未冻干的酵母无细胞表达体系相比,经过冻干的酵母无细胞表达体系所合成的外源蛋白(如荧光素酶)活性的相对光单位值显著提高了2-3倍,并且节约了3-30min的融化时间,提高了稳定性,增加了反复使用的次数。
蛋白合成促进剂
在本发明中,所述蛋白合成促进剂没有特别限制,只要能够显著提高蛋白合成活性的蛋白合成促进剂均在本发明的保护范围内。
在一优选实施方式中,本发明的蛋白合成促进剂选自下组的一种或多种:
a)糖类/多元醇:蔗糖、海藻糖、甘露醇、乳糖、葡萄糖、麦芽糖等;
b)聚合物:peg、葡聚糖、白蛋白等;
c)无水溶剂:甘油、dmso等;
在一优选实施方式中,本发明的蛋白合成促进剂选自下组:单糖、二糖、寡糖、可溶性淀粉、或其组合。
在一优选实施方式中,所述蛋白合成促进剂选自下组:蔗糖、海藻糖、甘露醇、乳糖、葡萄糖、麦芽糖、半乳糖、或其组合。
在一优选实施方式中,所述蛋白合成促进剂选自下组:蔗糖、海藻糖、乳糖、或其组合。
细胞提取物
在本发明中,所述细胞提取物为酵母细胞提取物。
在一优选实施方式中,所述酵母细胞选自下组的一种或多种来源的酵母:酿酒酵母、毕氏酵母、克鲁维酵母、或其组合;较佳地,所述的酵母细胞包括:克鲁维酵母,更佳地为乳酸克鲁维酵母。
在本发明中,所述细胞提取物的含量没有特别限制。
在一优选实施方式中,所述无细胞冻干制剂中,所述细胞提取物(如酵母细胞提取物)的含量为10%-95%,较佳地,20%-80%,更佳地,40%-60%,以所述无细胞冻干制剂的总重量计。
冷冻干燥(或冻干工艺)
为防止存储、运输和使用过程中的蛋白质变性,目前广泛应用的是冷冻干燥技术。冷冻干燥技术是将含水物质在低温下冻结,然后在真空条件下通过对冻干物料加热使冰升华,再除去物料中部分吸附水,得到干制品。有关蛋白质冷冻干燥的研究重点是保护剂的选择及浓度对冻干后蛋白质质量的影响。
在本发明中,可以用常规的冷冻干燥技术(或冻干工艺)。
在一优选实施方式中,所述冻干工艺包括预冻阶段、冷冻干燥第一阶段、冷冻干燥第二阶段、和/或最终冻干阶段。
在一优选实施方式中,所述冻干工艺的冻结温度和干燥时间没有特别限制。
在一优选实施方式中,所述冻干工艺中,所述预冻阶段的冻结温度为-55±5℃,所述冷冻干燥第一阶段的冻结温度为-30±5℃,所述冷冻干燥的第二阶段的冻结温度为-30±5℃,所述最终冻干阶段的冻结温度为-20±5℃。
在一优选实施方式中,所述冻干工艺中,所述预冻阶段的干燥时间为4±4小时,所述冷冻干燥第一阶段的干燥时间为2-15小时,较佳地,3-12小时,所述冷冻干燥的第二阶段的干燥时间为10±2小时,所述最终冻干阶段的干燥时间为8-25小时,较佳地,10-20小时。
无细胞冻干制剂及其制备
本发明提供了一种用于体外蛋白合成的无细胞冻干制剂,所述冻干制剂包括:
(a)细胞提取物,所述的细胞提取物为酵母细胞的提取物;和
(b)蛋白合成促进剂,其中所述的蛋白合成促进剂选自下组:单糖、二糖、寡糖、可溶性淀粉、或其组合。
在本发明中,本发明的无细胞冻干制剂用如下方法进行制备:
(i)提供一细胞提取物,所述的细胞提取物为酵母细胞的提取物;
(ii)向所述的细胞提取物中添加蛋白合成促进剂,获得一混合物,所述蛋白合成促进剂选自下组:单糖、二糖、寡糖、可溶性淀粉、或其组合;和
(iii)将所述的混合物进行冻干,获得经冻干的本发明所述的无细胞冻干制剂。
在本发明中,所述蛋白合成促进剂可以在冻干之前、冻干的同时、冻干之后加入。
在本发明中,所述蛋白合成促进剂的含量没有特别限制。
在一优选实施方式中,当本发明的无细胞冻干制剂重构为液态制剂后,所述的蛋白合成促进剂的浓度为0.2-5wt%,以所述液态制剂的总重计。
在一优选实施方式中,在重构后形成的酵母体外蛋白质合成体系中,所述蛋白合成促进剂的浓度(m/v)为0.5%-10%,较佳地,0.5%-4%,更佳地,1%-2%,以所述酵母体外蛋白质合成体系的总体积计。
实验证明,本发明的蛋白合成促进剂(如蔗糖)具有显著提高蛋白合成活性的效果,当蔗糖浓度为0.5%、1%、1.5%、2%时,均可显著提高酵母体外蛋白质合成体系中外源蛋白的合成活性。
酵母体外蛋白质合成体系
如本文所用,术语“酵母体外蛋白合成体系”、“酵母无细胞表达体系”、“体外蛋白合成体系”、“体外表达系统”可互换使用。
酵母(yeast)兼具培养简单、高效蛋白质折叠、和翻译后修饰的优势。其中酿酒酵母(saccharomycescerevisiae)和毕氏酵母(pichiapastoris)是表达复杂真核蛋白质和膜蛋白的模式生物,酵母也可作为制备体外翻译系统的原料。
克鲁维酵母(kluyveromyces)是一种子囊孢子酵母,其中的马克斯克鲁维酵母(kluyveromycesmarxianus)和乳酸克鲁维酵母(kluyveromyceslactis)是工业上广泛使用的酵母。与其他酵母相比,乳酸克鲁维酵母具有许多优点,如超强的分泌能力,更好的大规模发酵特性、食品安全的级别、以及同时具有蛋白翻译后修饰的能力等[5]。
在本发明中,酵母体外蛋白质合成体系不受特别限制,一种优选的酵母体外蛋白质合成体系为克鲁维酵母表达系统(更佳地,乳酸克鲁维酵母表达系统)。
在本发明中,所述酵母体外蛋白质合成体系包括:
(a)酵母细胞提取物;
(b)聚乙二醇;
(c)任选的外源蔗糖;和
(d)任选的溶剂,所述溶剂为水或水性溶剂。
在一特别优选的实施方式中,本发明提供的体外蛋白合成体系包括:酵母细胞提取物,4-羟乙基哌嗪乙磺酸,醋酸钾,醋酸镁,腺嘌呤核苷三磷酸(atp),鸟嘌呤核苷三磷酸(gtp),胞嘧啶核苷三磷酸(ctp),胸腺嘧啶核苷三磷酸(ttp),氨基酸混合物,磷酸肌酸,二硫苏糖醇(dtt),磷酸肌酸激酶,rna酶抑制剂,荧光素,萤光素酶dna,rna聚合酶。
在本发明中,rna聚合酶没有特别限制,可以选自一种或多种rna聚合酶,典型的rna聚合酶为t7rna聚合酶。
在本发明中,所述酵母细胞提取物在体外蛋白合成体系中的比例不受特别限制,通常所述酵母细胞提取物在体外蛋白质合成蛋白合成体系中所占体系为20-70%,较佳地,30-60%,更佳地,40-50%。
在本发明中,所述的酵母细胞提取物不含完整的细胞,典型的酵母细胞提取物包括用于蛋白翻译的核糖体、转运rna、氨酰trna合成酶、蛋白质合成需要的起始因子和延伸因子以及终止释放因子。此外,酵母提取物中还含有一些源自酵母细胞的细胞质中的其他蛋白,尤其是可溶性蛋白。
在本发明中,所述的酵母细胞提取物所含蛋白含量为20-100mg/ml,较佳为50-100mg/ml。所述的测定蛋白含量方法为考马斯亮蓝测定方法。
在本发明中,所述的酵母细胞提取物的制备方法不受限制,一种优选的制备方法包括以下步骤:
(i)提供酵母细胞;
(ii)对酵母细胞进行洗涤处理,获得经洗涤的酵母细胞;
(iii)对经洗涤的酵母细胞进行破细胞处理,从而获得酵母粗提物;
(iv)对所述酵母粗提物进行固液分离,获得液体部分,即为酵母细胞提取物。
在本发明中,所述的固液分离方式不受特别限制,一种优选的方式为离心。
在一优选实施方式中,所述离心在液态下进行。
在本发明中,所述离心条件不受特别限制,一种优选的离心条件为5000-100000×g,较佳地,8000-30000×g。
在本发明中,所述离心时间不受特别限制,一种优选的离心时间为0.5min-2h,较佳地,20min-50min。
在本发明中,所述离心的温度不受特别限制,优选的,所述离心在1-10℃下进行,较佳地,在2-6℃下进行。
在本发明中,所述的洗涤处理方式不受特别限制,一种优选的洗涤处理方式为采用洗涤液在ph为7-8(较佳地,7.4)下进行处理,所述洗涤液没有特别限制,典型的所述洗涤液选自下组:4-羟乙基哌嗪乙磺酸钾、醋酸钾、醋酸镁、或其组合。
在本发明中,所述破细胞处理的方式不受特别限制,一种优选的所述的破细胞处理包括高压破碎、冻融(如液氮低温)破碎。
所述体外蛋白质合成体系中的核苷三磷酸混合物为腺嘌呤核苷三磷酸、鸟嘌呤核苷三磷酸、胞嘧啶核苷三磷酸和尿嘧啶核苷三磷酸。在本发明中,各种单核苷酸的浓度没有特别限制,通常每种单核苷酸的浓度为0.5-5mm,较佳地为1.0-2.0mm。
所述体外蛋白质合成体系中的氨基酸混合物可包括天然或非天然氨基酸,可包括d型或l型氨基酸。代表性的氨基酸包括(但并不限于)20种天然氨基酸:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸。每种氨基酸的浓度通常为0.01-0.5mm,较佳地0.02-0.2mm,如0.05、0.06、0.07、0.08mm。
在优选例中,所述体外蛋白质合成体系还含有聚乙二醇或其类似物。聚乙二醇或其类似物的浓度没有特别限制,通常,聚乙二醇或其类似物的浓度(w/v)为0.1-8%,较佳地,0.5-4%,更佳地,1-2%,以所述蛋白合成体系的总重量计。代表性的peg例子包括(但并不限于):peg3000,peg8000,peg6000和peg3350。应理解,本发明的体系还可包括其他各种分子量的聚乙二醇(如peg200、400、1500、2000、4000、6000、8000、10000等)。
在优选例中,所述体外蛋白质合成体系还含有蔗糖。蔗糖的浓度没有特别限制,通常,蔗糖的浓度为0.03-40wt%,较佳地,0.08-10wt%,更佳地,0.1-5wt%,以所述蛋白合成体系的总重量计。
一种特别优选的体外蛋白质合成体系,除了酵母提取物之外,还含有以下组分:22mm,ph为7.4的4-羟乙基哌嗪乙磺酸,30-150mm醋酸钾,1.0-5.0mm醋酸镁,1.5-4mm核苷三磷酸混合物,0.08-0.24mm的氨基酸混合物,25mm磷酸肌酸,1.7mm二硫苏糖醇,0.27mg/ml磷酸肌酸激酶,1%-4%聚乙二醇,0.5%-2%蔗糖,8-20ng/µl萤火虫荧光素酶的dna,0.027-0.054mg/mlt7rna聚合酶。
在本发明中,所述酵母体外蛋白合成体系可以为未冻干的,可以是将本发明的无细胞的冻干制剂重构(加复溶试剂,如水,比例为,0.1-4g冻干制剂:0.5-30g水,较佳地,0.2-2g冻干制剂:1-15g水,更佳地,0.3-1g冻干制剂:2-10g水,更佳地,0.3-0.6g冻干制剂:3-7g水)后形成的。
在一优选实施方式中,在重构后形成的酵母体外蛋白合成体系中,所述细胞提取物(如酵母细胞提取物)的重量体积比为约50%。
在本发明中,所述蛋白合成促进剂可以添加入未冻干的酵母体外蛋白合成体系,也可以添加入冻干的酵母体外蛋白合成体系。
本发明的主要优点包括:
(1)本发明的细胞提取物的冷冻干燥方法可以用于所有细胞提取物的冻干,体外蛋白表达使用更简单快捷。
(2)本发明的冷冻干燥方法省略了耗时耗力的细胞提取物的低温储存和运输,极大地提高了工作效率,节省大量时间和成本。
(3)与细胞提取物的系统相比,本发明的冷冻干燥的酵母细胞提取物具有明显的优势,合成蛋白的能力提高2-3倍。
(4)经高压破碎法或液氮破碎法制备的酵母提取物可以直接用于冷冻干燥,成细胞提取物冻干粉。
(5)本发明中制备的体外蛋白质合成体系避免了反复冻融,直接添加buffer或水即可反应,简化了操作步骤,节约了运输和使用成本。
(6)本发明中制备的体外蛋白质合成体系方便分批使用,增加了体系保存和使用的稳定性,增加了后续实验的可重复度。
(7)本发明中的制备的酵母提取物冻干粉克服现有技术的缺陷,适于放大、工业化生产、运输、存储、分装、具有更大的优势和前景。
(8)本发明首次发现,将细胞提取物(优选酵母细胞提取物)和蛋白合成促进剂(优选蔗糖)以一定比例混合所制成的冻干制剂,可显著提高蛋白合成的活性。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
如无特别说明,则本发明实施例中所用的材料和试剂均为市售产品。
通用方法
在本发明中,在获得酵母提取物后,加入蔗糖和/或甘露醇,再进行冷冻干燥,获得冻干的酵母提取物。
实施例1液氮破碎法制备酵母细胞提取物
1.1.一级种子培养:用-80℃冻存菌种接种于摇瓶培养基中,30℃,200rpm培养至对数生长期。
1.2.二级种子培养:取适量一级种子菌液接种到二级种子,30℃,200rpm培养至对数生长期。
1.3.批培养阶段:将二级种子菌液接种到发酵罐中,温度控制在30ºc培养10-12h,进入补料培养阶段,当od600值为50-55时,收集细胞培养物。
1.4.将培养好的细胞培养物放在冰水混合物中预冷,时间为10-30min。
1.5.将1.4中预冷好的细胞培养物在低温离心机中进行离心,离心条件:3,000g、10min、4℃,得到酵母细胞。
1.6.用预冷的washingbuffer(洗涤液)对1.5酵母细胞用washingbuffer(洗涤液)进行重悬,将得到的重悬液进行离心,离心条件:3000g、10min、4℃,得到酵母细胞。washingbuffer(洗涤液)组成为:20-30mmph为7.4的4-羟乙基哌嗪乙磺酸钾,100-150mm醋酸钾,1-4mm醋酸镁;
1.7.重复1.6步2-3次。
1.8.将1.7步中获得的酵母细胞直接进行后续操作,或者采用液氮进行速冻后-80℃保存。
1.9.采用液氮匀浆器进行破碎:在匀浆器中加入适量液氮,再加入离心得到的酵母细胞或1.8中-80℃保存的酵母细胞,转速:45,000rpm,破碎3-10min;将破碎好的低温粉末分装到50ml离心管中,称重并储存于-80℃待用。
1.10.将1.9中得到的酵母细胞破碎粉在室温下降温至4℃,每克细胞破碎粉用0.2-1ml4℃预冷的lysisbuffer(裂解缓冲液)进行溶解,得到酵母细胞粗提物。lysisbuffer由10-40mmph为7.4的4-羟乙基哌嗪乙磺酸钾,50-150mm醋酸钾,1-4mm醋酸镁,2-7mm二硫苏糖醇,0.5-2mm苯甲基磺酰氟组成。
1.11.把步骤1.10中收获的酵母细胞粗提物进行离心1-2次,离心力为12000-30000g时间为30min,温度为4℃;
1.12.离心后,取上层澄清液体即为酵母细胞提取物。
1.13.将制备好的酵母细胞提取物分装,并在液氮中速冻后于-80℃保存。
实施例2细胞提取物的冷冻干燥
2.1将-80℃保存的酵母提取物放置于室温,解冻;
2.2将每个玻璃瓶或玻璃平板进行称重,并做好记录;
2.3将解冻的酵母提取物分装于玻璃瓶或玻璃平板内,每个玻璃瓶约500微升细胞提取物,每个玻璃平板约5毫升细胞提取物。
2.4将2.3中的装有细胞提取物的玻璃瓶和玻璃平板,进行再次称量,并做好记录;
2.5将2.4中的装有细胞提取物的玻璃瓶和玻璃平板,预冻于-80℃,预冻时间为2-4h;
2.6设置冷冻干燥程序:预冻阶段:-55℃,4h;冷冻干燥第一阶段:-30℃,4-10h;冷冻干燥第二阶段:-30℃,10h;最终冻干阶段:-20℃,10-20h。
2.7将2.5中预冻好的细胞提取物玻璃瓶和玻璃平板,放置于冻干机的平板上,进行冻干程序,真空度约为0.1mpa.
2.8将冻干的细胞提取物储存于-80℃,或直接加入与冻干前的相等质量的水,混匀进行后续的蛋白质体外合成活性测定。
实施例3无细胞体外蛋白质合成体系
3.1体外蛋白质合成体系的储存液配制:1mph为7.4的4-羟乙基哌嗪乙磺酸,5m醋酸钾,250mm醋酸镁,25mm四种核苷三磷酸的混合物,包括腺嘌呤核苷三磷酸、鸟嘌呤核苷三磷酸、胞嘧啶核苷三磷酸和尿嘧啶核苷三磷酸,1mm二十种氨基酸的混合物:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸,二十种氨基酸的浓度均为1.0mm,1m磷酸肌酸,1m二硫苏糖醇,6.48mg/ml磷酸肌酸激酶,1.7mg/mlt7rna聚合酶20%-50%聚乙二醇(polyethyleneglycol,peg)3350或者(polyethyleneglycol,peg)8000,1-4mm亚精胺,0.1-0.4mm血红素;
3.2体外蛋白质合成反应体系:终浓度为22mmph为7-8的4-羟乙基哌嗪乙磺酸,30-150mm醋酸钾,1.0-5.0mm醋酸镁,1.5-4mm核苷三磷酸混合物(腺嘌呤核苷三磷酸、鸟嘌呤核苷三磷酸、胞嘧啶核苷三磷酸和尿嘧啶核苷三磷酸),0.08-0.24mm的氨基酸混合物(甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸),25mm磷酸肌酸,1.7mm二硫苏糖醇,0.27mg/ml磷酸肌酸激酶,8-20ng/µl萤火虫荧光素酶dna,0.027-0.054mg/mlt7rna聚合酶,1%-4%的聚乙二醇,0.03-0.04mm血红素,0.3-0.4mm亚精胺,最后加入50%体积的酵母细胞提取物;
3.3体外蛋白质合成反应:将上述的反应体系放置在20-30℃的环境中,静置反应2-6h;
3.4萤光素酶活性测定:反应结束后,在96孔白板或384孔白板中加入等体积的底物荧光素(luciferine),立即放置于envision2120多功能酶标仪(perkinelmer),读数,检测萤火虫荧光素酶活性,相对光单位值(rlu)作为活性单位。
实验结果
1.不同的蛋白合成促进剂对0.5ml细胞提取物冻干体系的影响
从图1可以看出,对于0.5ml的细胞提取物冻干体系,添加1%-2%的甘露醇和蔗糖作为蛋白合成促进剂,能够使细胞提取物冻干粉仍具有体外蛋白合成能力,同时蔗糖作为蛋白合成促进剂,显著提高了细胞提取物合成蛋白的能力,比未冻干的酵母提取物提高2-3倍。由此可见,冻干的细胞提取物仍具有较强的蛋白合成能力。
2.不同的蛋白合成促进剂对5ml细胞提取物冻干效果的影响
从图2可以看出,对于5ml的细胞提取物冻干体系,添加1%-2%的甘露醇和蔗糖作为蛋白合成促进剂,能够使细胞提取物冻干粉仍具有体外蛋白合成能力,同时蔗糖作为蛋白合成促进剂,显著提高了细胞提取物合成蛋白的能力,比未冻干的酵母提取物提高2-3倍。由此可见,冻干的细胞提取物仍具有较强的蛋白合成能力。
3.不同体积的细胞提取物冻干处理后的体外蛋白合成能力比较
从图3可以看出,在1%的蔗糖保护剂的作用下,无论0.5ml或是5ml的细胞提取物冻干粉均显著提高了体外合成蛋白质的能力。0.5ml的细胞提取物的冻干粉的体外合成蛋白的能力高于5ml的细胞提取物冻干粉。
4.不同蔗糖浓度的细胞提取物冻干粉对体外蛋白合成能力的影响
从图4中可以看出,0.5%-2%的蔗糖作为保护剂,均可以使细胞提取物冻干粉仍具有体外蛋白质合成能力,尤其0.5%-1%的蔗糖可显著提高原有蛋白合成能力,与对照1相比,其蛋白合成活性提高了2倍,与对照2相比,其蛋白合成活性提高了2倍。因此可以作为优选的蛋白合成促进剂。
5.不同批次细胞提取物冻干粉的体外蛋白合成能力
从图5中可以看出,1%的蔗糖作为蛋白合成促进剂,均可以使六批细胞提取物冻干粉仍具有体外蛋白质合成能力,与未冻干的细胞提取物相比,其明显提高了2-3倍的体外蛋白合成能力,可以作为优选的蛋白合成促进剂。与未添加蛋白合成促进剂的冻干粉相比,添加蛋白合成促进剂的冻干粉的蛋白合成活性可提高2-3倍。
6.蔗糖对于细胞提取物的冻干粉影响示意图
从图6中可以看出,无论在体外合成体系中加入1%的蔗糖,或者在冻干体系(酵母提取物冻干粉)中加入1%的蔗糖,均可以提高细胞提取物冻干粉的体外蛋白质合成能力,但是在冻干体系(酵母提取物冻干粉)中,加入1%的蔗糖作为优选的蛋白合成促进剂,与未冻干的酵母提取物相比,其体外蛋白合成能力明显提高了2-3倍。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!