抗TLR4抗体及其用途的制作方法
本申请是申请日为2013年3月29日的中国专利申请201380027744.6“抗tlr4抗体及其用途”的分案申请。
相关申请
本申请请求2012年3月29日提交的美国临时申请号61/617,164的权益,其通过引用整体并入本文。
本发明一般性涉及特异性结合toll样受体4(tlr-4)的抗体,以及使用所述抗tlr4抗体作为治疗剂和诊断剂的方法。
背景技术:
toll受体首先在果蝇(drosophila)中发现,是i型跨膜蛋白,在该蛋白的细胞外部分中具有富含亮氨酸的重复序列(lrrs),并具有一个或两个富含半胱氨酸的结构域。果蝇toll受体的哺乳动物同源物称为“toll样受体”(tlr)。tlr通过识别微生物粒子并激活针对这些微生物粒子来源的免疫细胞在先天免疫中发挥作用。
在人中,已经鉴定了11种toll样受体,tlr1-11,并通过它们的细胞内结构域与il-1受体的同源性和通过细胞外富含亮氨酸的重复序列的存在得以表征。不同类型的tlr被不同类型的微生物粒子激活。例如,tlr4主要被脂多糖(lps)激活,而tlr2被脂磷壁质(lta)、脂阿拉伯甘露聚糖(lam)、脂蛋白(blp)和肽聚糖(pgn)激活。也已经鉴定了toll受体同源物例如rp105。
已证明tlr4与辅助蛋白髓样分化蛋白-2(md-2)结合。已发现此蛋白与tlr4直接相互作用,并且md-2具有使tlr4能够翻译后修饰以及促进其转运到细胞表面的能力。tlr4和md-2在细胞表面形成复合物。
脂多糖(lps),革兰氏阴性菌的组分,是能够强力激活先天免疫系统的微生物粒子。lps经由其多链(multi-chain)受体将信号递送至免疫细胞,所述受体包含tlr4/md-2复合物作为主要信号传导组分。
相应地,对于结合tlr4和调节由tlr4/md-2复合物介导的信号传导的方法和组合物存在需求。
技术实现要素:
本发明提供了识别细胞表面表达的人和/或食蟹猴tlr4/md-2受体的单克隆抗体。所述抗体能够阻断,例如中和tlr4配体例如lps诱导的受体激活和后续的细胞内信号传导。本发明的抗体包括结合人和食蟹猴tlr4/md-2受体复合物并独立于md-2的存在还结合tlr4的抗体。
本发明提供了特异性结合细胞表面上表达的人和/或食蟹猴tlr4/md-2受体并能够阻断通过lps诱导的受体激活和后续的细胞内信号传导的单克隆抗体。示例性单克隆抗体包括:1a1、1a6、1b12、1c7、1c10、1c12、1d10、1e11、1e11n103d、1g12、1e11.c1、1e11.c2、1e11.c3、1e11.c4、1e11.c5、1e11.c6、1e11.e1、1e11.e2、1e11.e3、1e11.e4,1e11.e5、1e11.c2e1、1e11.c2e3、1e11.c2e4和1e11.c2e5。
这些抗体具有不同的特异性。一些抗体显示对人和食蟹猴tlr4两者的特异性和/或对人和食蟹猴tlr4/md-2受体复合物两者的特异性,而且它们已经显示抑制经由lps的受体激活和后续的细胞内信号传导。例如1c12、1e11、1e11n103d、1e11.c1、1e11.c2、1e11.c3、1e11.c4、1e11.c5、1e11.c6、1e11.c2e1、1e11.c2e2、1e11.c2e3、1e11.c2e4和1e11.c2e5独立于人或食蟹猴md-2的存在结合人和食蟹猴tlr4两者。1a1、1a6、1b12、1c7、1c10、1d10和1g12独立于食蟹猴md-2的存在仅结合食蟹猴tlr4。1e11.e1、1e11.e2、1e11.e3、1e11.e4和1e11.e5独立于人md-2的存在仅结合人tlr4。这些抗体在本文中分别称作tlr4抗体。
本发明的人源化抗体包含具有seqidno:2、6、8、10、12、14、16、18、20、22、67、69、71、73、75、77、89、93、97或101的氨基酸序列的重链可变区。本发明的人源化的抗体包含轻链可变区,其具有氨基酸序列seqidno:4、79、81、83、85或87。
三个重链cdr包括与下列至少90%、92%、95%、97%、98%、99%或更多相同的氨基酸序列:选自g(f/y)pi(r/g/w)(y/f/g)gys(seqidno:110)、gysitggys(seqidno:25)、gfpirygys(seqidno:55)、gypirfgys(seqidno:56)、gypirhgys(seqidno:57)、gfpigqgys(seqidno:58)、gypiwggys(seqidno:59)和gypigggys(seqidno:60)的可变重链互补决定区1(vhcdr1,本文也称为cdrh1)氨基酸序列;ihysgyt(seqidno:26)的可变重链互补决定区2(vhcdr2,本文也称为cdrh2)氨基酸序列;和选自arkdsg(n/q/d/e)x1x2py(seqidno:111)(其中x1和x2每个独立地是任何疏水氨基酸)、arkdsgnyfpy(seqidno:27)、arkdsgrllpy(seqidno:28)、arkdsgkwlpy(seqidno:29)、arkdsghlmpy(seqidno:30)、arkdsghnypy(seqidno:31)、arkdsgknfpy(seqidno:32)、arkdsgqlfpy(seqidno:33)、arkdsghnlpy(seqidno:34)、arkdsgdyfpy(seqidno:35)和arkdsgrywpy(seqidno:36)的可变重链互补决定区3(vhcdr3,本文也称为cdrh3)氨基酸序列。三个轻链cdr包括与下列至少90%、92%、95%、97%、98%、99%或更多相同的氨基酸序列:qsisdh(seqidno:37)的可变轻链互补决定区1(vlcdr1,本文也称为cdrl1)氨基酸序列;yas(seqidno:38)的可变轻链互补决定区2(vlcdr2,本文也称为cdrl2)氨基酸序列;和选自qqg(y/n)(d/e)(f/y)pxt(seqidno:112)(其中x是任何疏水氨基酸)、qqghsfplt(seqidno:39)、qqgndfpvt(seqidno:61)、qqgydepft(seqidno:62)、qqgydfpft(seqidno:63)、qqgydypft(seqidno:64)和qqgyefpft(seqidno:65)的可变轻链互补决定区3(vlcdr3,本文也称为cdrl3)氨基酸序列。抗体结合人和食蟹猴tlr4/md-2复合物,当不与人和食蟹猴md-2复合时结合人和食蟹猴tlr4,结合人tlr4/md-2复合物,当不与人md-2复合时结合人tlr4,当不与食蟹猴md-2复合时结合食蟹猴tlr4/md-2复合物或食蟹猴tlr4。
本发明的抗tlr4抗体还包括如下抗体,其包括与seqidno:2、6、8、10、12、14、16、18、20、22、67、69、71、73、75、77、89、93、97或101的氨基酸序列至少90%、92%、95%、97%、98%、99%或更多相同的重链可变氨基酸序列,和/或与seqidno:4、79、81、83、85或87的氨基酸序列至少90%、92%、95%、97%、98%、99%或更多相同的轻链可变氨基酸。
本发明的抗体特异性结合人和/或食蟹猴tlr4和/或人和/或食蟹猴tlr4/md-2复合物,其中所述抗体结合人和/或食蟹猴tlr4上在seqidno:23(人tlr4)和/或seqidno:24(食蟹猴tlr4)的残基289-375之间包括一个或更多个氨基酸残基的表位。例如,tlr4抗体特异性结合包括seqidno:23(人)和/或seqidno:24(食蟹猴)的残基349的表位。在一些实施方案中,表位还包括额外的残基,例如选自下列的残基:seqidno:23(人)和/或seqidno:24(食蟹猴)的至少残基328和329;seqidno:23(人)和/或seqidno:24(食蟹猴)的至少残基351;和seqidno:23(人)和/或seqidno:24(食蟹猴)的至少残基369-371,及其任意组合。
在一些实施方案中,本发明提供特异性结合toll样受体4(tlr4)的分离的抗体,其中所述抗体结合包括seqidno:23的至少残基349的表位和包括seqidno:24的至少残基349的表位。在一些实施方案中,所述抗体包括具有三个互补决定区(cdr)的重链,所述互补决定区包括gysitggys(seqidno:25)的可变重链互补决定区1(cdrh1)氨基酸序列;ihysgyt(seqidno:26)的可变重链互补决定区2(cdrh2)氨基酸序列;和arkdsg(x1)(x2)(x3)py(seqidno:111)的可变重链互补决定区3(cdrh2)氨基酸序列,其中x1是n、q、d或e,x2是任何疏水氨基酸,并且x3是任何疏水氨基酸;以及具有三个cdr的轻链,所述互补决定区包括qsisdh(seqidno:37)的可变轻链互补决定区1(cdrl1)氨基酸序列;yas(seqidno:38)的可变轻链互补决定区2(cdrl2)氨基酸序列;和qqghsfplt(seqidno:39)的可变轻链互补决定区3(cdrl3)氨基酸序列。在一些实施方案中,表位进一步包括seqidno:23和seqidno:24的至少残基328和329。在一些实施方案中,表位进一步包括seqidno:23和seqidno:24的至少残基351。在一些实施方案中,表位进一步包括seqidno:23和seqidno:24的残基369至371之间的一个或更多个残基。在一些实施方案中,表位进一步包括seqidno:23和seqidno:24的至少残基369至371。在一些实施方案中,抗体特异性结合包括seqidno:23和seqidno:24的至少残基329、329、349、351和369至371的表位。在一些实施方案中,抗体进一步包括γ重链恒定区中的在eu氨基酸位置325的氨基酸取代和在eu氨基酸位置328的氨基酸取代。在一些实施方案中,在eu氨基酸位置325的氨基酸取代是丝氨酸,并且其中在eu氨基酸位置328的氨基酸取代是苯丙氨酸。
本发明还提供了特异性结合toll样受体4(tlr4)的分离的抗体,其中所述抗体结合包括seqidno:23的至少残基349的表位,并且其中所述抗体对于结合人tlr4展示的ec50值低于具有seqidno:43的可变重链氨基酸序列和seqidno:4的可变轻链氨基酸序列的参考抗体展示的ec50值。在一些实施方案中,对于结合人tlr4的ec50值通过竞争性elisa确定。在一些实施方案中,抗体展示对于结合人tlr4的ec50值比参考抗体展示的ec50值至少低10倍。在一些实施方案中,抗体进一步特异性结合包括seqidno:24的至少残基349的表位。在一些实施方案中,所述抗体包括具有三个互补决定区(cdr)的重链,所述互补决定区包括g(x1)pi(x2)(x3)gys(seqidno:110)的可变重链互补决定区1(cdrh1)氨基酸序列,其中x1是f或y,x2是r、g或w,x3是y、f或g;ihysgyt(seqidno:26)的可变重链互补决定区2(cdrh2)氨基酸序列;和arkdsg(x1)(x2)(x3)py(seqidno:111)的可变重链互补决定区3(cdrh2)氨基酸序列,其中x1是n、q、d或e,x2是任何疏水氨基酸,并且x3是任何疏水氨基酸;以及具有三个cdr的轻链,轻链的所述cdr包括qsisdh(seqidno:37)的可变轻链互补决定区1(cdrl1)氨基酸序列;yas(seqidno:38)的可变轻链互补决定区2(cdrl2)氨基酸序列;和包括qqg(x1)(x2)(x3)p(x4)t(seqidno:112)的氨基酸序列或qqghsfplt(seqidno:39)的氨基酸序列的可变轻链互补决定区3(cdrl3),其中x1是y或n,x2是d或e,x3是f或y,并且x4是任何疏水氨基酸。在一些实施方案中,抗体进一步包括在eu氨基酸位置325的γ重链恒定区中的氨基酸取代和在eu氨基酸位置328的氨基酸取代。在一些实施方案中,在eu氨基酸位置325的氨基酸取代是丝氨酸,并且其中在eu氨基酸位置328的氨基酸取代是苯丙氨酸。在一些实施方案中,tlr4抗体还结合人和/或食蟹猴tlr4/md-2复合物。
本发明还提供了特异性结合toll样受体4(tlr4)的分离的抗体,其中所述抗体结合包括seqidno:23的至少残基349的表位,并结合包括seqidno:24的至少残基349的表位,并且其中所述抗体对于结合人tlr4展示的ec50值低于具有seqidno:43的可变重链氨基酸序列和seqidno:4的可变轻链氨基酸序列的参考抗体展示的ec50值。在一些实施方案中,对于结合人tlr4的ec50值通过竞争性elisa确定。在一些实施方案中,抗体展示对于结合人tlr4的ec50值比参考抗体展示的ec50值至少低10倍。在一些实施方案中,抗体进一步特异性结合包括seqidno:24的至少残基349的表位。在一些实施方案中,所述抗体包括具有三个互补决定区(cdr)的重链,所述互补决定区包括g(x1)pi(x2)(x3)gys(seqidno:110)的可变重链互补决定区1(cdrh1)氨基酸序列,其中x1是f或y,x2是r、g或w,x3是y、f或g;ihysgyt(seqidno:26)的可变重链互补决定区2(cdrh2)氨基酸序列;和arkdsg(x1)(x2)(x3)py(seqidno:111)的可变重链互补决定区3(cdrh2)氨基酸序列,其中x1是n、q、d或e,x2是任何疏水氨基酸,并且x3是任何疏水氨基酸;以及具有三个cdr的轻链,轻链的所述cdr包括qsisdh(seqidno:37)的可变轻链互补决定区1(cdrl1)氨基酸序列;yas(seqidno:38)的可变轻链互补决定区2(cdrl2)氨基酸序列;和包括qqg(x1)(x2)(x3)p(x4)t(seqidno:112)的氨基酸序列或qqghsfplt(seqidno:39)的氨基酸序列的可变轻链互补决定区3(cdrl3),其中x1是y或n,x2是d或e,x3是f或y,并且x4是任何疏水氨基酸。在一些实施方案中,抗体进一步包括γ重链恒定区中的在eu氨基酸位置325的氨基酸取代和在eu氨基酸位置328的氨基酸取代。在一些实施方案中,在eu氨基酸位置325的氨基酸取代是丝氨酸,并且其中在eu氨基酸位置328的氨基酸取代是苯丙氨酸。在一些实施方案中,tlr4抗体还结合人和/或食蟹猴tlr4/md-2复合物。
本发明还提供了特异性结合seqidno:23的toll样受体4(tlr4)的分离的抗体,其中所述抗体在野生型人igg1fc主链上展示对于人全血测定中人tlr4的lps激活的抑制的ic50值低于具有seqidno:43的可变重链氨基酸序列和seqidno:4的可变轻链氨基酸序列的参考抗体展示的ic50值。在一些实施方案中,抗体展示对于人tlr4的lps激活的抑制的ic50值比参考抗体展示的ic50值至少低2倍。在一些实施方案中,所述抗体包括具有三个互补决定区(cdr)的重链,所述互补决定区包括g(x1)pi(x2)(x3)gys(seqidno:110)的可变重链互补决定区1(cdrh1)氨基酸序列,其中x1是f或y,x2是r、g或w,x3是y、f或g;ihysgyt(seqidno:26)的可变重链互补决定区2(cdrh2)氨基酸序列;和arkdsg(x1)(x2)(x3)py(seqidno:111)的可变重链互补决定区3(cdrh2)氨基酸序列,其中x1是n、q、d或e,x2是任何疏水氨基酸,并且x3是任何疏水氨基酸;以及具有三个cdr的轻链,轻链的所述cdr包括qsisdh(seqidno:37)的可变轻链互补决定区1(cdrl1)氨基酸序列;yas(seqidno:38)的可变轻链互补决定区2(cdrl2)氨基酸序列;和包括qqg(x1)(x2)(x3)p(x4)t(seqidno:112)的氨基酸序列或qqghsfplt(seqidno:39)的氨基酸序列的可变轻链互补决定区3(cdrl3),其中x1是y或n,x2是d或e,x3是f或y,并且x4是任何疏水氨基酸。在一些实施方案中,抗体结合包括seqidno:23的至少残基349的表位。在一些实施方案中,抗体结合包括seqidno:23的至少残基349的表位和结合包括seqidno:24的至少残基349的表位。在一些实施方案中,抗体进一步包括γ重链恒定区中的在eu氨基酸位置325的氨基酸取代和在eu氨基酸位置328的氨基酸取代。在一些实施方案中,在eu氨基酸位置325的氨基酸取代是丝氨酸,并且其中在eu氨基酸位置328的氨基酸取代是苯丙氨酸。在一些实施方案中,tlr4抗体还结合人和/或食蟹猴tlr4/md-2复合物。
本发明还提供特异性结合toll样受体4(tlr4)的分离的抗体,其中所述抗体包括具有三个互补决定区(cdr)的重链,所述互补决定区包括g(x1)pi(x2)(x3)gys(seqidno:110)的可变重链互补决定区1(cdrh1)氨基酸序列,其中x1是f或y,x2是r、g或w,x3是y、f或g;ihysgyt(seqidno:26)的可变重链互补决定区2(cdrh2)氨基酸序列;和arkdsg(x1)(x2)(x3)py(seqidno:111)的可变重链互补决定区3(cdrh2)氨基酸序列,其中x1是n、q、d或e,x2是任何疏水氨基酸,并且x3是任何疏水氨基酸;以及具有三个cdr的轻链,轻链的所述cdr包括qsisdh(seqidno:37)的可变轻链互补决定区1(cdrl1)氨基酸序列;yas(seqidno:38)的可变轻链互补决定区2(cdrl2)氨基酸序列;和包括qqg(x1)(x2)(x3)p(x4)t(seqidno:112)的氨基酸序列的可变轻链互补决定区3(cdrl3),其中x1是y或n,x2是d或e,x3是f或y,并且x4是任何疏水氨基酸。在一些实施方案中,抗体包括gysitggys(seqidno:25)、gfpirygys(seqidno:55)、gypirfgys(seqidno:56)、gypirhgys(seqidno:57)、gfpigqgys(seqidno:58)、gypiwggys(seqidno:59)或gypigggys(seqidno:60)的cdrh1氨基酸序列;ihysgyt(seqidno:26)的cdrh2氨基酸序列;以及选自arkdsgnyfpy(seqidno:27)、arkdsgqlfpy(seqidno:33)和arkdsgdyfpy(seqidno:35)的cdrh3氨基酸序列;qsisdh(seqidno:37)的cdrl1氨基酸序列;yas(seqidno:38)的cdrl2氨基酸序列;以及qqghsfplt(seqidno:39)、qqgndfpvt(seqidno:61)、qqgydepft(seqidno:62)、qqgydfplt(seqidno:63)、qqgydyplt(seqidno:64)或qqgyefplt(seqidno:65)的cdrl3氨基酸序列。在一些实施方案中,抗体进一步包括γ重链恒定区中的在eu氨基酸位置325的氨基酸取代和在eu氨基酸位置328的氨基酸取代。在一些实施方案中,在eu氨基酸位置325的氨基酸取代是丝氨酸,并且其中在eu氨基酸位置328的氨基酸取代是苯丙氨酸。在一些实施方案中,tlr4抗体还结合人和/或食蟹猴tlr4/md-2复合物。
本发明还提供特异性结合toll样受体4(tlr4)/md-2复合物的分离的抗体,其中所述抗体包括选自seqidno:2、6、8、10、12、14、16、18、20、22、67、69、71、73、75或77的重链可变氨基酸序列,并包括包含seqidno:4、79、81、83、85或87的氨基酸序列的轻链可变氨基酸。在一些实施方案中,抗体包括选自下列的可变重链氨基酸序列和可变轻链氨基酸序列的组合:(a)包括seqidno:6的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(b)包括seqidno:8的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(c)包括seqidno:10的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(d)包括seqidno:12的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(e)包括seqidno:14的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(f)包括seqidno:16的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(g)包括seqidno:18的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(h)包括seqidno:2的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(i)包括seqidno:20的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(j)包括seqidno:22的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(k)包括seqidno:67的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(l)包括seqidno:69的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(m)包括seqidno:71的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(n)包括seqidno:73的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(o)包括seqidno:75的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(p)包括seqidno:77的氨基酸序列的重链可变区和包括seqidno:4的氨基酸序列的轻链可变区;(q)包括seqidno:2的氨基酸序列的重链可变区和包括seqidno:79的氨基酸序列的轻链可变区;(r)包括seqidno:2的氨基酸序列的重链可变区和包括seqidno:81的氨基酸序列的轻链可变区;(s)包括seqidno:2的氨基酸序列的重链可变区和包括seqidno:83的氨基酸序列的轻链可变区;(t)包括seqidno:2的氨基酸序列的重链可变区和包括seqidno:85的氨基酸序列的轻链可变区;(u)包括seqidno:2的氨基酸序列的重链可变区和包括seqidno:87的氨基酸序列的轻链可变区;(v)包括seqidno:69的氨基酸序列的重链可变区和包括seqidno:79的氨基酸序列的轻链可变区;(w)包括seqidno:69的氨基酸序列的重链可变区和包括seqidno:83的氨基酸序列的轻链可变区;(x)包括seqidno:69的氨基酸序列的重链可变区和包括seqidno:85的氨基酸序列的轻链可变区;和(y)包括seqidno:69的氨基酸序列的重链可变区和包括seqidno:87的氨基酸序列的轻链可变区。在一些实施方案中,抗体进一步包括γ重链恒定区中的在eu氨基酸位置325的氨基酸取代和在eu氨基酸位置328的氨基酸取代。在一些实施方案中,在eu氨基酸位置325的氨基酸取代是丝氨酸,并且其中在eu氨基酸位置328的氨基酸取代是苯丙氨酸。在一些实施方案中,tlr4抗体还结合人和/或食蟹猴tlr4/md-2复合物。
优选地,tlr4抗体以igg同种型的形式。更优选地,tlr4抗体以igg1同种型的形式。示例性的igg1形式的抗体是包含如下所示的seqidno:40的重链序列和seqidno:41的轻链序列的igg1形式的1e11抗体:
>1e11重链氨基酸序列
>1e11轻链氨基酸序列
本文所述抗tlr4抗体还包括至少一个特定氨基酸取代,例如在fc区或其fcr结合片段内(例如在igg恒定结构域内具有氨基酸取代的多肽),使得所修饰的抗体相比未改变的抗体引起抗原依赖性效应器功能改变同时保持对抗原的结合。例如,所改变的抗体引起促炎介质释放的阻止。在优选实施方案中,改变的抗体是人抗体和igg1同种型。
本发明的抗tlr4抗体包括改变的抗体,其中在所述抗体的fc部分的恒定区中至少一个氨基酸残基已被修饰。例如,fc部分的ch2结构域中至少一个氨基酸已被不同残基替换,即氨基酸取代。在本文所述的改变的抗体中,相比未改变的抗体,对应残基325、326和328的一个或更多个氨基酸残基用不同残基取代。γ重链中残基的编号是eu索引的编号(参见edelman,g.m.等,1969;kabat,e,a.,t.t.wu,h.m.perry,k.s.gottesman和c.foeller.,1991.sequencesofproteinsofimmunologicalinterest,第5版u.s.dept.ofhealthandhumanservices,bethesda,md,nihpublicationn.91-3242)。在优选实施方案中,γ重链恒定区的eu氨基酸位置325用丝氨酸取代并且γ重链恒定区的eu氨基酸位置328用苯丙氨酸取代,使得改变的人igg1抗体的γ重链恒定区的eu氨基酸位置325至328包含氨基酸序列skaf(seqidno:42)。
本发明还提供了治疗或预防与异常的tlr4/md-2激活和/或异常的lps活性相关的病理的方法(例如,异常的促炎性细胞因子的产生,如异常的il-8的产生),或缓解与这些病理相关的症状,通过对希望这些治疗或预防的对象施用本发明的单克隆抗体(例如,鼠单克隆抗体或人源化单克隆抗体)。待治疗的对象是,例如人。以足以治疗、预防或缓解所述病理相关的症状的量施用单克隆抗体。足以治疗或预防对象中病理的单克隆抗体的量是,例如足以减少lps诱导的一种或更多种促炎性细胞因子(例如il-6、il-8)的产生的量。如本文所用术语“减少”指在存在本发明的单克隆抗体的情况下促炎性细胞因子产生的下降,其中所述产生是例如局部促炎性细胞因子产生(例如,在发炎组织的部位)或全身促炎性细胞因子产生。当在存在本发明的单克隆抗体的情况下,促炎性细胞因子产生的水平大于或等于比促炎性细胞因子产生的对照水平(即,在不存在单克隆抗体的情况下促炎性细胞因子产生的水平)低5%、10%、20%、25%、30%、40%、50%、60%、70%、75%、80%、90%、95%、99%或100%时,则lps诱导的促炎性细胞因子的产生下降。测量促炎性细胞因子产生的水平。本领域技术人员将理解,促炎性细胞因子产生的水平可以使用多种测定方法测量,包括例如本文所述方法以及市售的elisa试剂盒。
使用本发明的单克隆抗体(例如,鼠单克隆抗体或人源化单克隆抗体)治疗和/或预防的病理包括,例如,微生物产物诱导的脓毒症、急性炎症、慢性炎症(例如,与过敏性状况相关的慢性炎症和哮喘)、自身免疫性疾病(如ibd和动脉粥样硬化)、具有和不具有移植的缺血性损伤、肾疾病(例如糖尿病性肾病)、急性肾损伤和其中应激(例如细胞应激)诱导内源可溶性应激因子(如hsp60、纤连蛋白、硫酸乙酰肝素、透明质酸、gp96、β防御素-2和表面活性蛋白a)表达的疾病。其中应激(例如细胞应激)诱导内源可溶性应激因子表达的病理包括,例如,骨关节炎和类风湿关节炎。与应激(例如细胞应激)相关的病理也可发生在被置于呼吸机、通气机和其它呼吸辅助设备上的对象和患者中。这样的病理包括,例如,通气机诱导的肺损伤(“vili”),也被称为通气相关性肺损伤(“vali”)。
根据本发明的药物组合物可以包括本发明的抗tlr4抗体和载体。这些药物组合物可以包括在试剂盒,诸如,例如诊断试剂盒中。
附图说明
图1是描绘表达scfv,本文称为“1a1、1a6、1b12、1c7、1c10、1c12、1d10、1e11、1g12、15c1”的单克隆噬菌体结合食蟹猴tlr4的图形。结合的特异性通过流式细胞术显示,使用假转染的或用食蟹猴tlr4转染的cho细胞。使用假转染的细胞的结果用灰色标志显示(右边的图解),而使用食蟹猴tlr4转染的细胞的结果以其它带颜色的标志显示(左边的图解)。
图2是描绘表达scfv,本文称为“1a1、1a6、1b12、1c7、1c10、1c12、1d10、1e11、1g12、15c1”的单克隆噬菌体结合人tlr4/md2复合物的图形。结合的特异性通过流式细胞术显示,使用假转染的或用人tlr4/md2转染的cho细胞。使用假转染的细胞的结果用灰色标志显示(右边的图解),而使用人tlr4/md2转染的细胞的结果以其它带颜色的标志显示(左边的图解)。
图3是描绘纯化的抗体,本文称为“1a1、1a6、1b12、1c7、1c10、1c12、1d10、1e11、1g12、15c1”结合食蟹猴tlr4的图形。结合的特异性通过流式细胞术显示,使用假转染的或用食蟹猴tlr4/md2转染的cho细胞。使用假转染的细胞的结果用灰色标志显示(右边的图解),而使用食蟹猴tlr4/md2转染的细胞的结果以其它带颜色的标志显示(左边的图解)。
图4是描绘纯化的抗体,本文称为“1a1、1a6、1b12、1c7、1c10、1c12、1d10、1e11、1g12、15c1”结合人tlr4/md2复合物的图形。结合的特异性通过流式细胞术假转染的或用人tlr4/md2转染的cho细胞显示。使用假转染的细胞的结果用灰色标志显示(右边的图解),而使用人tlr4/md2转染的细胞的结果以其它带颜色的标志显示(左边的图解)。
图5是抗体互补位/tlr4表位潜在氨基酸接触的图解表示。人特异性tlr4抗体,15c1的cdrh3序列(seqidno:44)可以与人tlr4(seqidno:23)的赖氨酸349形成盐桥相互作用。食蟹猴特异性tlr41g12mab的cdrh3序列(seqidno:36)可以与食蟹猴tlr4(seqidno:24)的谷氨酸349形成盐桥相互作用。食蟹猴/人特异性tlr41e11mab的cdrh3序列可以与人tlr4(seqidno:23)的赖氨酸349和食蟹猴tlr4(seqidno:24)的谷氨酸349两者形成氢键。
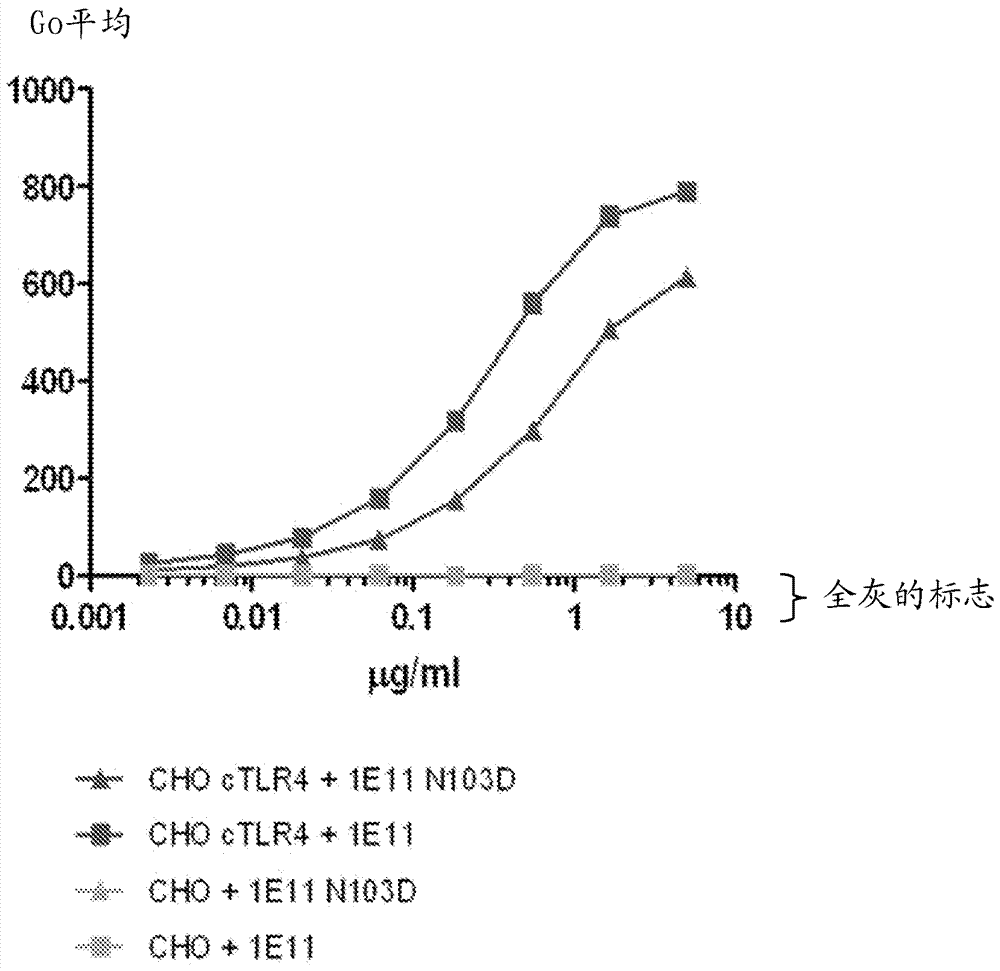
图6是描绘纯化的抗体,本文称为“1e11,1e11n103d”结合食蟹猴tlr4的图形。结合的特异性通过流式细胞术显示,使用假转染的或用食蟹猴tlr4/md2转染的cho细胞。使用假转染的细胞的结果用灰色标志显示,而使用食蟹猴tlr4/md2转染的细胞的结果以其它带颜色的标志显示。
图7是描绘纯化的抗体,本文称为“1e11,1e11n103d”结合人tlr4/md2复合物的图形。结合的特异性通过流式细胞术显示,使用假转染的或用人tlr4转染的cho细胞。使用假转染的细胞的结果用灰色标志显示,而使用人tlr4/md2转染的细胞的结果以其它带颜色的标志显示。
图8是描绘lps诱导的tlr4、nf-κb的下游信号传导级联被纯化的抗体,本文称为“1e11、15c1、1c12、1g12”抑制的图形。thp1-blue-cd14细胞系源自表达人tlr4/md2复合物的人单核细胞系并用有利于监测tlr诱导的nf-κb/ap-1激活的报告基因稳定转染。细胞与1e11、15c1、1c12和1g12在指示的浓度孵育并随后与lps(10ng/ml)孵育。通过使用酶标仪测量在650nm的吸收在lps处理后24小时评估分泌的胚胎碱性磷酸酶的水平。
图9是描绘具有cdrh1突变的纯化的抗体,本文称为“15c1、1e11.c2、1e11.c3、1e11.c4、1e11.c5、1e11.c6”对人tlr4/md2复合物的结合效价的图形。通过竞争性elisa确定结合效价。用亲本抗体15c1获得的结果用圆圈标志显示,而使用1e11.c2、1e11.c3、1e11.c4、1e11.c5和1e11.c6抗体的结果以其它带颜色的和其它形状的标志显示。
图10是描绘具有cdrh1突变的纯化的抗体,本文称为“15c1、1e11.e1、1e11.e3、1e11.e4、1e11.e5”对人tlr4/md2复合物的结合效价的图形。通过竞争性elisa确定结合效价。用亲本抗体15c1获得的结果用圆圈标志显示,而使用1e11.e1、1e11.e3、1e11.e4和1e11.e5抗体的结果以其它带颜色的和其它形状的标志显示。
图11是描绘具有cdrh1突变的纯化的抗体,本文称为“15c1、1e11.c2e1、1e11.c2e3、1e11.c2e4、1e11.c2e5”对人tlr4/md2复合物的结合效价的图形。通过竞争性elisa确定结合效价。用亲本抗体15c1获得的结果用圆圈标志显示,而使用1e11.c2e1、1e11.c2e3、1e11.c2e4和1e11.c2e5抗体的结果以其它带颜色的和其它形状的标志显示。
图12是描绘纯化的fab,本文称为“fab15c1、fab1e11、fab1e11.c2、fab1e11.e3和fab1e11.c2e3”结合食蟹猴tlr4/md2复合物的图形。结合的特异性通过流式细胞术假转染的或用食蟹猴tlr4/md2转染的cho细胞显示。使用假转染的细胞的结果用灰色标志显示(右边的图解),而使用食蟹猴tlr4/md2转染的细胞的结果以其它带颜色的标志显示(左边的图解)。
图13是描绘lps诱导的tlr4、nf-κb的下游信号传导级联被纯化的抗体,本文称为“15c1、1e11.e2”抑制的图形。thp1-blue-cd14细胞系源自表达人tlr4/md2复合物的人单核细胞系并用有利于监测tlr诱导的nf-κb/ap-1激活的报告基因稳定转染。细胞与15c1和1e11.e2在指示的浓度孵育并随后与lps(10ng/ml)孵育。通过使用酶标仪测量在650nm的吸收在lps处理后24小时评估分泌的胚胎碱性磷酸酶的水平。
图14是描绘纯化的抗体,本文称为“15c1、1e11c2、1e11.c2e3”对在人全血测定中tlr4激活诱导的il-6产生的抑制的图形。人血用浓度递减的抗体稀释并随后与lps孵育。il-6的水平在lps处理后24小时使用milliplex试剂盒评估。结果表示为il-6抑制的百分比。用亲本抗体15c1获得的结果用橙色标志显示,而使用1e11.c2和1e11.c2e3抗体的结果以其它带颜色的标志显示。
图15是描绘纯化的抗体,本文称为“15c1、1e11c2”对在食蟹猴全血测定中tlr4激活诱导的il-6产生的抑制的系列图形。此实验用2个不同动物的血液进行。食蟹猴血用浓度递减的抗体稀释并随后与lps孵育。il-6的水平在lps处理后24小时使用milliplex试剂盒评估。用亲本抗体15c1获得的结果用圆圈标志显示,而使用1e11.c2抗体的结果以正方形标志显示。
具体实施方式
本发明提供了特异性结合人和/或食蟹猴tlr4/md-2受体复合物的单克隆抗体(mab)。此受体复合物被脂多糖(lps,革兰氏阴性菌的外膜主要组分)激活。其还被额外的配体激活,通过非限制性实例的方式包括,呼吸道合胞病毒融合蛋白、oxpl、ox-ldl、淀粉样蛋白-β、β-防御素2、镍、hmgb1、hsp、s100a8/s100a9、肌腱蛋白c、纤连蛋白-eda、双糖链蛋白聚糖和透明质酸。本发明的单克隆抗体抑制受体激活和后续的经由lps的细胞内信号传导。因此,单克隆抗体中和tlr4/md-2受体复合物的激活。具体而言,本发明提供识别在细胞表面表达的tlr4/md-2受体复合物的单克隆抗体。另外,当不与md-2复合时,本发明的单克隆抗体也识别人和食蟹猴tlr4。单克隆抗体是,例如人源化的抗体。
本发明的抗体特异性结合人和/或食蟹猴tlr4/md-2复合物,其中所述抗体结合人和/或食蟹猴tlr4上在seqidno:23(人)和seqidno:24(食蟹猴)的残基289-375之间包括一个或更多个氨基酸残基的表位。
本发明的示例性抗体包括1a1、1a6、1b12、1c7、1c10、1c12、1d10、1e11、1e11n103d、1g12、1e11.c1、1e11.c2、1e11.c3、1e11.c4、1e11.c5、1e11.c6、1e11.e1、1e11.e2、1e11.e3、1e11.e4、1e11.e5、1e11.c2e1、1e11.c2e2、1e11.c2e3、1e11.c2e4和1e11.c2e5。一些抗体显示对人和食蟹猴tlr4/md-2受体复合物两者的特异性,而且它们已经显示抑制经由lps的受体激活和后续的细胞内信号传导。例如1c12、1e11、1e11n103d、1e11.c1、1e11.c2、1e11.c3、1e11.c4、1e11.c5、1e11.c6、1e11.c2e1、1e11.c2e2、1e11.c2e3、1e11.c2e4和1e11.c2e5独立于人或食蟹猴md-2的存在结合人和食蟹猴tlr4两者。示例性抗体1a1、1a6、1b12、1c7、1c10、1d10和1g12独立于食蟹猴md-2的存在仅结合食蟹猴tlr4。1e11.e1、1e11.e2、1e11.e3、1e11.e4和1e11.e5独立于人md-2的存在仅结合人tlr4。
tlr识别微生物粒子并激活针对这些微生物粒子来源的免疫细胞。(参见takeda等,annu.rev.immunol.,21:335-76(2003),herebyincorporatedbyreferenceinitsentirety)。已显示tlr4和md-2在细胞表面形成复合物,并且md-2的存在似乎对于tlr4对多种配体的反应性是必需的,所述配体通过非限制性实例的方式包括,lps、呼吸道合胞病毒融合蛋白、oxpl、ox-ldl、淀粉样蛋白-β、β-防御素2、镍、hmgb1、hsp、s100a8/s100a9、肌腱蛋白c、纤连蛋白-eda、双糖链蛋白聚糖和透明质酸。
lps经由其多链受体将信号递送至免疫细胞,其中tlr4/md-2复合物是主要信号传导组分。已显示lps经由通过tlr4的信号传导对免疫系统发挥其作用。lps快速结合血流中的脂多糖结合蛋白(lbp),并且以此形式,lps与gpi锚定的细胞表面蛋白cd14相互作用。lps然后被转移到tlr4,其转换细胞内激活信号。近来,发现另一种蛋白md-2对于经由tlr4的信号转导发生是必需的。md-2与tlr4直接相互作用并在其翻译后修饰和细胞内运输中发挥重要作用。此外,已显示md-2直接结合lps,其证明此辅助蛋白在lps受体复合物中的重要性(参见miyakek.,int.immunopharmacol.3:119-128(2003),由此通过引用以其整体并入)。因此,tlr4/md-2复合物介导的lps信号传导的中和在病症诸如,例如急性全身炎症和革兰氏阴性菌感染诱导的脓毒症的治疗中是潜在的治疗策略。
本发明的tlr4抗体包括,例如表1a中显示的重链互补决定区(cdr),表1b中显示的轻链cdr,及其组合。
表1来自结合并中和tlr4的抗体克隆的vhcdr序列
表1b.来自结合并中和tlr4的抗体克隆的vlcdr序列
本发明的tlr4抗体包括,例如,具有下表2中所示重链和轻链序列的组合的抗体。
表2来自结合并中和tlr4的抗体克隆的vh和vl序列
示例性的tlr4单克隆抗体是本文所述1e11抗体。如下文所示,1e11抗体包括由seqidno:1中所示核酸序列编码的重链可变区(seqidno:2),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1e11vh核酸序列
>1e11vh氨基酸序列
>1e11vl核酸序列
>1e11vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。1e11抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1a1抗体。如下文所示,1a1抗体包括由seqidno:5中所示核酸序列编码的重链可变区(seqidno:6),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1a1vh核酸序列
>1a1vh氨基酸序列
>1a1vl核酸序列
>1a1vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1a1抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsgrllpy(seqidno:28)。1a1抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1a6抗体。如下文所示,1a6抗体包括由seqidno:7中所示核酸序列编码的重链可变区(seqidno:8),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1a6vh核酸序列
>1a6vh氨基酸序列
>1a6vl核酸序列
>1a6vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1a6抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsgkwlpy(seqidno:29)。1a6抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1b12抗体。如下文所示,1b12抗体包括由seqidno:9中所示核酸序列编码的重链可变区(seqidno:10),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1b12vh核酸序列
>1b12vh氨基酸序列
>1b12vl核酸序列
>1b12vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1a6抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsghlmpy(seqidno:30)。1b12抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1c7抗体。如下文所示,1c7抗体包括由seqidno:11中所示核酸序列编码的重链可变区(seqidno:12),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1c7vh核酸序列
>1c7vh氨基酸序列
>1c7vl核酸序列
>1c7vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1c7抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsghnypy(seqidno:31)。1c7抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1c10抗体。如下文所示,1c10抗体包括由seqidno:13中所示核酸序列编码的重链可变区(seqidno:14),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1c10vh核酸序列
>1c10vh氨基酸序列
>1c10vl核酸序列
>1c10vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1c10抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsgknfpy(seqidno:32)。1c10抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1c12抗体。如下文所示,1c12抗体包括由seqidno:15中所示核酸序列编码的重链可变区(seqidno:16),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1c12vh核酸序列
>1c12vh氨基酸序列
>1c12vl核酸序列
>1c12vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1c12抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsgqlfpy(seqidno:33)。1c12抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1d10抗体。如下文所示,1d12抗体包括由seqidno:17中所示核酸序列编码的重链可变区(seqidno:18),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1d10vh核酸序列
>1d10vh氨基酸序列
>1d12vl核酸序列
>1d10vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1d10抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsghnlpy(seqidno:34)。1d10抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1e11n103d抗体。如下文所示,1e11n103d抗体包括由seqidno:19中所示核酸序列编码的重链可变区(seqidno:20),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1e11n103dvh核酸序列
>1e11n103dvh氨基酸序列
>1e11n103dvl核酸序列
>1e11n103dvl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11n103d抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsgdyfpy(seqidno:35)。1e11n103d抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1g12抗体。如下文所示,1g12抗体包括由seqidno:21中所示核酸序列编码的重链可变区(seqidno:22),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1g12vh核酸序列
>1g12vh氨基酸序列
>1g12vl核酸序列
>1g12vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1g12抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsgrywpy(seqidno:36)。1e11n103d抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1e11.c1抗体。如下文所示,1e11.c1抗体包括由seqidno:66中所示核酸序列编码的重链可变区(seqidno:67),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1e11.c1vh核酸序列
>1e11.c1vh氨基酸序列
>1e11.c1vl氨基酸序列
>1e11.c1vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.c1抗体的重链cdr具有下列序列gfpirygys(seqidno:55);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。gfpirygys抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1e11.c2抗体。如下文所示,1e11.c2抗体包括由seqidno:68中所示核酸序列编码的重链可变区(seqidno:69),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1e11.c2vh核酸序列
>1e11.c2vh氨基酸序列
>1e11.c2vl核酸序列
>1e11.c2vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.c2抗体的重链cdr具有下列序列gypirfgys(seqidno:56);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。gfpirygys抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1e11.c3抗体。如下文所示,1e11.c3抗体包括由seqidno:70中所示核酸序列编码的重链可变区(seqidno:71),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1e11.c3vh核酸序列
>1e11.c3vh氨基酸序列
>1e11.c3vl核酸序列
>1e11.c3vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.c3抗体的重链cdr具有下列序列gypirhgys(seqidno:57);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。gfpirygys抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1e11.c4抗体。如下文所示,1e11.c4抗体包括由seqidno:72中所示核酸序列编码的重链可变区(seqidno:73),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1e11.c4vh核酸序列
>1e11.c4vh氨基酸序列
>1e11.c4vl核酸序列
>1e11.c4vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.c4抗体的重链cdr具有下列序列gfpigqgys(seqidno:58);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。gfpirygys抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1e11.c5抗体。如下文所示,1e11.c5抗体包括由seqidno:74中所示核酸序列编码的重链可变区(seqidno:75),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1e11.c5vh核酸序列
>1e11.c5vh氨基酸序列
>1e11.c5vl核酸序列
>1e11.c5vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.c5抗体的重链cdr具有下列序列gypiwggys(seqidno:59);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。gfpirygys抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1e11.c6抗体。如下文所示,1e11.c6抗体包括由seqidno:76中所示核酸序列编码的重链可变区(seqidno:77),和由seqidno:3中所示核酸序列编码的轻链可变区(seqidno:4)。
>1e11.c5vh核酸序列
>1e11.c5vh氨基酸序列
>1e11.c5vl核酸序列
>1e11.c5vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.c6抗体的重链cdr具有下列序列gypigggys(seqidno:60);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。gfpirygys抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqghsfplt(seqidno:39)。
示例性的tlr4单克隆抗体是本文所述1e11.e1抗体。如下文所示,1e11.e1抗体包括由seqidno:2中所示核酸序列编码的重链可变区(seqidno:1),和由seqidno:78中所示核酸序列编码的轻链可变区(seqidno:79)。
>1e11.e1vh核酸序列
>1e11.e1vh氨基酸序列
>1e11.e1vl核酸序列
>1e11.e1vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.e1抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。
1e11抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqgndfpvt(seqidno:61)。
示例性的tlr4单克隆抗体是本文所述1e11.e2抗体。如下文所示,1e11.e2抗体包括由seqidno:2中所示核酸序列编码的重链可变区(seqidno:1),和由seqidno:80中所示核酸序列编码的轻链可变区(seqidno:81)。
>1e11.e2vh核酸序列
>1e11.e2vh氨基酸序列
>1e11.e2vl核酸序列
>1e11.e2vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.e2抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。1e11抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqgydepft(seqidno:62)。
示例性的tlr4单克隆抗体是本文所述1e11.e3抗体。如下文所示,1e11.e3抗体包括由seqidno:2中所示核酸序列编码的重链可变区(seqidno:1),和由seqidno:82中所示核酸序列编码的轻链可变区(seqidno:83)。
>1e11.e3vh核酸序列
>1e11.e3vh氨基酸序列
>1e11.e3vl核酸序列
>1e11.e3vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.e3抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。1e11抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqgydfplt(seqidno:63)。
示例性的tlr4单克隆抗体是本文所述1e11.e4抗体。如下文所示,1e11.e4抗体包括由seqidno:2中所示核酸序列编码的重链可变区(seqidno:1),和由seqidno:84中所示核酸序列编码的轻链可变区(seqidno:85)。
>1e11.e4vh核酸序列
>1e11.e4vh氨基酸序列
>1e11.e4vl核酸序列
>1e11.e4vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.e4抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。1e11抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqgydyplt(seqidno:64)。
示例性的tlr4单克隆抗体是本文所述1e11.e5抗体。如下文所示,1e11.e5抗体包括由seqidno:2中所示核酸序列编码的重链可变区(seqidno:1),和由seqidno:86中所示核酸序列编码的轻链可变区(seqidno:87)。
>1e11.e5vh核酸序列
>1e11.e5vh氨基酸序列
>1e11.e5vl核酸序列
>1e11.e5vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.e5抗体的重链cdr具有下列序列gysitggys(seqidno:25);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。1e11抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqgyefplt(seqidno:65)。
示例性的tlr4单克隆抗体是本文所述1e11.c2e1抗体。如下文所示,1e11.c2e1抗体包括由seqidno:88中所示核酸序列编码的重链可变区(seqidno:89),和由seqidno:90中所示核酸序列编码的轻链可变区(seqidno:91)。
>1e11.c2e1vh核酸序列
>1e11.c2e1vh氨基酸序列
>1e11.c2e1vl核酸序列
>1e11.c2e1vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.c2e1抗体的重链cdr具有下列序列gypirfgys(seqidno:56);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。1e11抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqgndfpvt(seqidno:61)。
示例性的tlr4单克隆抗体是本文所述1e11.c2e3抗体。如下文所示,1e11.c2e3抗体包括由seqidno:92中所示核酸序列编码的重链可变区(seqidno:93),和由seqidno:94中所示核酸序列编码的轻链可变区(seqidno:95)。
>1e11.c2e3vh核酸序列
>1e11.c2e3vh氨基酸序列
>1e11.c2e3vl核酸序列
>1e11.c2e3vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.c2e3抗体的重链cdr具有下列序列gypirfgys(seqidno:56);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。1e11抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqgydfplt(seqidno:63)。
示例性的tlr4单克隆抗体是本文所述1e11.c2e4抗体。如下文所示,1e11.c2e4抗体包括由seqidno:96中所示核酸序列编码的重链可变区(seqidno:97),和由seqidno:98中所示核酸序列编码的轻链可变区(seqidno:99)。
>1e11.c2e4vh核酸序列
>1e11.c2e4vh氨基酸序列
>1e11.c2e4vl核酸序列
>1e11.c2e4vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.c2e4抗体的重链cdr具有下列序列gypirfgys(seqidno:56);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。1e11抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqgydyplt(seqidno:64)。
示例性的tlr4单克隆抗体是本文所述1e11.c2e5抗体。如下文所示,1e11.c2e5抗体包括由seqidno:100中所示核酸序列编码的重链可变区(seqidno:101),和由seqidno:102中所示核酸序列编码的轻链可变区(seqidno:103)。
>1e11.c5e5vh核酸序列
>1e11.c2e5vh氨基酸序列
>1e11.c2e5vl核酸序列
>1e11.c2e5vl氨基酸序列
包含互补决定区(cdr)的氨基酸如m.p.lefranc所定义(参见lefranc,m.-p.,currentprotocolsinimmunology,j.wileyandsons,newyorksupplement40,a1.p.1-a.1p.37(2000)ligm:230)。1e11.c2e5抗体的重链cdr具有下列序列gypirfgys(seqidno:56);ihysgyt(seqidno:26);和arkdsgnyfpy(seqidno:27)。1e11抗体的轻链cdr具有下列序列qsisdh(seqidno:37);yas(seqidno:38);和qqgyefplt(seqidno:65)。
本发明的tlr4抗体特异性结合人和/或食蟹猴tlr4/md-2复合物,其中所述抗体结合人和/或食蟹猴tlr4上在seqidno:23(人)和seqidno:24(食蟹猴)的残基325和374之间包括一个或更多个氨基酸残基的表位。可替代地,所述单克隆抗体是与下列抗体结合相同表位的抗体:1a1、1a6、1b12、1c7、1c10、1c12、1d10、1e11、1e11n103d、1g12、1e11.c1、1e11.c2、1e11.c3、1e11.c4、1e11.c5、1e11.c6、1e11.e1、1e11.e2、1e11.e3、1e11.e4,1e11.e5、1e11.c2e1、1e11.c2e3、1e11.c2e4和1e11.c2e5。
本发明的抗tlr4抗体包括改变的抗体,其中抗体的fc部分的ch2结构域中至少在eu位置325的氨基酸残基和至少在eu位置328的氨基酸残基已被修饰。例如,至少在eu位置325的氨基酸残基已用丝氨酸取代,并且至少在eu位置328的氨基酸残基已用苯丙氨酸取代。
这些具有修饰的fc部分的抗tlr4抗体引起相比未改变的抗体修饰的效应器功能,例如修饰的fc受体活性。例如,人fc受体是cd32a。在一些实施方案中,这些抗tlr4抗体相比未改变的抗体在连接cd32a后引起促炎性介质释放的阻止。因此,这些抗tlr4抗体引起修饰的fc受体活性,例如阻止促炎性介质释放同时保持结合靶抗原的能力。在一些实施方案中,这些抗tlr4抗体是中和抗体,其中抗tlr4抗体引起修饰的fc受体活性,同时保持中和靶抗原的一种或更多种生物学活性的能力。
例如,本发明的抗tlr4抗体包括结合人tlr4/md-2受体复合物的单克隆抗体。此受体复合物被脂多糖(lps,革兰氏阴性菌的外膜主要组分)激活。本发明的抗tlr4抗体抑制受体激活和后续的经由lps的细胞内信号传导。因此,抗tlr4抗体中和tlr4/md-2受体复合物的激活。具体而言,本发明提供识别在细胞表面表达的tlr4/md-2受体复合物的抗tlr4抗体。这些抗tlr4抗体阻断lps诱导的il-8产生。另外,当不与md-2复合时,本发明的抗tlr4抗体也识别tlr4。改变的抗体是,例如人源化的抗体。
定义:
除非另有定义,否则与本发明结合使用的科学和技术术语应具有本领域技术人员通常理解的含义。此外,除非上下文另有要求,单数术语应包括复数,并且复数术语应包括单数。一般来说,与本文中所描述的细胞和组织培养、分子生物学以及蛋白质和寡核苷酸或多核苷酸化学和杂交结合使用的命名法以及本文中所描述的细胞和组织培养、分子生物学以及蛋白质和寡核苷酸或多核苷酸化学和杂交的技术是本领域中熟知和通常使用的那些。对于重组dna、寡核苷酸合成和组织培养和转化(例如电穿孔、脂质体转染)使用标准技术。根据制造商的说明书或如本领域所通常实施或如本文所述进行酶促反应和纯化技术。通常根据本领域熟知的常规方法和如在整个本说明书中引用和讨论的各种一般和更具体的参考文献中所述进行前述技术和方法。参见,例如sambrook等molecularcloning:alaboratorymanual(第2版,coldspringharborlaboratorypress,coldspringharbor,n.y.(1989))。与本文所述分析化学、合成有机化学以及医学和药物化学结合使用的命名法,和本文所述分析化学、合成有机化学以及医学和药物化学的实验室方法和技术是本领域熟知和通常使用的那些。对于化学合成、化学分析、药物制备、制剂,和递送,以及患者的治疗使用标准技术。
如根据本公开所用,下列术语,除非另有指示,应理解为具有下列含义:
如本文所用,术语“抗体”指免疫球蛋白分子和免疫球蛋白(ig)分子的免疫学活性部分,即包含特异性结合(与之发生免疫反应)抗原的抗原结合位点的分子。通过“特异性结合”或“与之发生免疫反应”或“免疫特异性结合”意指抗体与所需抗原的一个或更多个抗原决定簇反应,并且不与其它多肽反应或以低得多的亲和力(kd>10-6)结合。抗体包括,但不限于,多克隆、单克隆、嵌合、dab(结构域抗体)、单链、fab、fab'和f(ab')2片段、scfvs以及fab表达文库。
已知基本抗体结构单元包含四聚体。每个四聚体由两个相同的多肽链的对构成,每对具有一个“轻”链(约25kda)和一个“重”链(约50-70kda)。每条链的氨基末端部分包括主要负责抗原识别的约100至110或更多氨基酸的可变区。每条链的羧基末端部分限定了主要负责效应器功能的恒定区。通常,从人获得的抗体分子涉及任何igg、igm、iga、ige和igd类型,其通过分子中存在的重链的性质而彼此不同。某些类型还具有亚类,诸如igg1、igg2等。此外,在人中,轻链可以是κ链或λ链。
如本文所用术语“单克隆抗体”(单克隆抗体)或“单克隆抗体组合物”指仅包含由独特的轻链基因产物和独特的重链基因产物组成的抗体分子的一个分子种类的抗体分子的群体。具体而言,单克隆抗体的互补决定区(cdr)在群体的所有分子中是相同的。单克隆抗体包含能够与表征为对其独特的结合亲和力的抗原的特定表位发生免疫反应的抗原结合位点。
术语“抗原结合位点”或“结合部分”是指参与抗原结合的免疫球蛋白分子的部分。抗原结合位点由重(“h”)链和轻(“l”)链的n末端可变(“v”)区的氨基酸残基形成。重链和轻链的v区内的三个高度不同的延伸,称作“高变区”,插入在更保守的侧翼延伸称为“框架区”或“fr”之间。因此,术语“fr”是指在免疫球蛋白的高变区之间和邻近免疫球蛋白的高变区的天然存在的氨基酸序列。在抗体分子中,轻链的三个高变区和重链的三个高变区相对于彼此在三维空间中布置形成抗原结合表面。抗原结合表面与结合的抗原的三维表面互补,并且每条重链和轻链的三个高变区称为“互补决定区”或“cdr”。氨基酸对每个结构域的分配依据kabatsequencesofproteinsofimmunologicalinterest(nationalinstitutesofhealth,bethesda,md.(1987and1991)),或chothia&leskj.mol.biol.196:901-917(1987),chothia等nature342:878-883(1989)的定义。
如本文所用术语“表位”包括能够特异性结合免疫球蛋白、scfv或t细胞受体的任何蛋白决定簇。术语“表位”包括能够特异性结合免疫球蛋白或t细胞受体的任何蛋白决定簇。表位决定簇通常由分子的化学活性表面基团,例如氨基酸或糖侧链组成并且通常具有特定的三维结构特征,以及特定的电荷特征。例如,可以针对多肽的n末端或c末端肽产生抗体。当解离常数是≤1μm,例如,≤100nm,优选≤10nm和更优选≤1nm时,抗体是特异性结合抗原。
如本文所用,术语“免疫结合”和“免疫结合性质”指在免疫球蛋白分子和该免疫球蛋白特异性针对的抗原之间发生的类型的非共价相互作用。免疫结合相互作用的强度或亲和力可以表示为术语相互作用的解离常数(kd),其中更小的kd表示更大的亲和力。所选多肽的免疫学结合性质可以使用本领域熟知的方法定量。一种这样的方法需要测量抗原结合位点/抗原复合物形成和解离的速率,其中那些速率取决于复合物配偶体的浓度、相互作用的亲和力,以及在两个方向上同等影响速率几何参数。因此,“开速率常数”(kon)和“关速率常数”(koff)可以通过计算浓度和结合与解离的实际速率来确定。(参见nature361:186-87(1993))。koff/kon的比使得能够消掉所有与亲和力无关的参数,并且等于解离常数kd。(一般性参见davies等(1990)annualrevbiochem59:439-473)。本发明的抗体特异性结合其靶,同时平衡结合常数(kd)≤1μm,例如≤100nm,优选≤10nm,并且更优选≤1nm,如通过测定例如放射性配体结合测定或本领域技术人员已知的类似测定所测量。
如本文所用术语“分离的多核苷酸‘应意指基因组、cdna或合成起源或其一些组合的多核苷酸,其通过其起源,所述“分离的多核苷酸”(1)不与在自然界中其中发现所述“分离的多核苷酸”的多核苷酸的全部或部分结合,(2)与其在自然界中不连接的多核苷酸可操作地连接,或(3)在自然界中不作为更大序列的部分而存在。依据本发明的多核苷酸包括本文所述的编码重链免疫球蛋白分子的核酸分子和编码轻链免疫球蛋白分子的核酸分子。
术语“分离的蛋白”本文指cdna、重组rna或合成起源或其一些组合的蛋白,其通过其起源或衍生来源,所述“分离的蛋白”(1)不与自然界中发现的蛋白结合,(2)不含来自相同来源的其它蛋白,例如不含海洋蛋白,(3)由来自不同物种的细胞表达,或(4)在自然界中不存在。
术语“多肽”在本文用作指多肽序列的天然蛋白、片段或类似物的通用术语。因此,天然蛋白片段和类似物是多肽属的种。依据本发明的多肽包含本文所述重链免疫球蛋白分子和轻链免疫球蛋白分子,以及通过组合包含重链免疫球蛋白分子与轻链免疫球蛋白分子,诸如κ轻链免疫球蛋白分子并且反之亦然,及其片段和类似物形成的抗体分子。
如本文所用术语“天然存在的”如应用于对象指该对象可以在自然界中发现的事实。例如,多肽或多核苷酸序列,存在于生物体(包括病毒)中,可以从自然界中的来源分离,并且没有被人在实验室中有意地修饰或以其它方式是天然存在的。
如本文所用术语“可操作地连接”指这样描述的组分的位置是以允许它们以其预期方式发挥功能的关系。控制序列“可操作地连接”到编码序列以在与控制序列相容的条件下实现该编码序列的表达这样的方式连接。
如本文所用术语“控制序列”指对于实现它们连接的编码序列的表达和加工所必需的多核苷酸序列。这些控制序列的性质取决于宿主生物体而不同,在原核生物中,这些控制序列通常包括启动子、核糖体结合位点和转录终止序列,在真核生物中,通常,这些控制序列包括启动子和转录终止序列。术语“控制序列”意指包括,最低限度,其存在对于表达和加工必需的所有组分,并且还可以包括其存在对于例如前导序列和融合配偶体序列是有利的额外的组分。如本文所提及的术语“多核苷酸”指至少10个碱基长度的核苷酸的聚合物(polymericboron),核糖核苷酸或脱氧核糖核苷酸或任一类型核苷酸的修饰的形式。该术语包括dna的单和双链形式。
如本文所用,20种常规氨基酸和它们的缩写按照常规用法。参见immunology-asynthesis(2ndedition,e.s.golubandd.r.gren,eds.,sinauerassociates,sunderlandmass.(1991))。20种常规氨基酸的立体异构体(例如,d-氨基酸),非天然氨基酸如α-,α-双取代的氨基酸,n-烷基氨基酸,乳酸,和其它非常规氨基酸也可以是用于本发明多肽的合适的组分。非常规氨基酸的例子包括:4-羟基脯氨酸、γ羧基谷氨酸、ε-n,n,n-三甲基赖氨酸、ε-n-乙酰赖氨酸、o-磷酸丝氨酸、n-乙酰丝氨酸、n-甲酰甲硫氨酸、3-甲基组氨酸、5-羟基赖氨酸、σ-n-甲基精氨酸和其它类似的氨基酸和亚氨基酸(例如4-羟基脯氨酸)。在本文中所用的多肽符号中,左手方向是氨基末端方向并且右手方向是羧基末端方向,根据标准用法和惯例。
应用于多肽时,术语“实质同一性”是指两个肽序列,当最佳比对时,例如通过程序gap或bestfit使用缺省缺口权重,共有至少80%的序列同一性,优选至少90%的序列同一性,更优选至少95%的序列同一性,和最优选至少99%的序列同一性。
优选地,不相同的残基位置区别在于保守的氨基酸取代。
保守的氨基酸取代是指具有相似侧链的残基的可互换性。例如,一组具有脂肪族侧链的氨基酸是甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸。一组具有脂肪族羟基侧链的氨基酸是丝氨酸和苏氨酸;一组具有含酰胺侧链的氨基酸为天冬酰胺和谷氨酰胺;一组具有芳香侧链的氨基酸是苯丙氨酸、酪氨酸和色氨酸;一组具有碱性侧链的氨基酸是赖氨酸、精氨酸和组氨酸;并且一组具有含硫侧链的氨基酸是半胱氨酸和甲硫氨酸。优选的保守氨基酸取代组是:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸缬氨酸、谷氨酸-天冬氨酸,和天冬酰胺-谷氨酰胺。
如本文中所讨论的,在抗体或免疫球蛋白分子的氨基酸序列的微小变化都被认为包括在本发明中,条件是在所述氨基酸序列中的变化维持至少75%,更优选至少80%、90%、95%和最优选99%。具体地,保守氨基酸置换是预期的。保守置换是那些在它们的侧链相关的氨基酸家族内发生的置换。遗传编码的氨基酸一般分为下列家族:(1)酸性氨基酸是天冬氨酸、谷氨酸;(2)碱性氨基酸是赖氨酸、精氨酸、组氨酸;(3)非极性氨基酸是丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸,和(4)不带电荷的极性氨基酸是甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸、酪氨酸。亲水性氨基酸包括精氨酸、天冬酰胺、天冬氨酸、谷氨酰胺、谷氨酸、组氨酸、赖氨酸、丝氨酸和苏氨酸。疏水性氨基酸包括丙氨酸、半胱氨酸、异亮氨酸、亮氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、色氨酸、酪氨酸和缬氨酸。氨基酸的其它家族包括(i)丝氨酸和苏氨酸,其是脂肪族羟基家族;(ⅱ)天冬酰胺和谷氨酰胺,其是含酰胺家族;(ⅲ)丙氨酸、缬氨酸、亮氨酸和异亮氨酸,其是脂肪族家族;及(iv)苯丙氨酸、色氨酸和酪氨酸,其是芳香族家族。例如,可以合理地预期,用异亮氨酸或缬氨酸对亮氨酸的分离的置换,用谷氨酸替换天冬氨酸,用丝氨酸替换苏氨酸,或用结构相关的氨基酸对氨基酸进行类似的置换,不会对所得分子的结合或性质具有重大影响,特别是如果置换不涉及框架位点内的氨基酸。氨基酸的改变是否产生功能肽可容易地通过测定多肽衍生物的比活性来确定。测定法在本文详细描述。抗体或免疫球蛋白分子的片段或类似物可通过那些本领域普通技术人员容易地制备。片段或类似物的优选的氨基和羧基末端存在于功能性结构域的边界附近。结构和功能结构域可以通过核苷酸和/或氨基酸序列数据与公开或私有的序列数据库的比较来鉴定。优选地,使用计算机化的比较方法来鉴定已知结构和/或功能的其它蛋白中存在的序列基序或预测的蛋白构象结构域。鉴定折叠成已知三维结构的蛋白序列的方法是已知的。bowie等science253:164(1991)。因此,前述实施例证明,本领域技术人员可以识别可用于限定根据本发明的结构和功能结构域的序列基序和结构构象。
优选的氨基酸取代是那些:其(1)减少对蛋白水解的易感性,(2)减少对氧化的易感性,(3)改变对形成蛋白复合物的结合亲和力,(4)改变结合亲和力,和(4)赋予或修饰这些类似物的其它物理化学或功能性质的取代。类似物可以包括天然存在的肽序列之外序列的各种突变蛋白。例如,单个或更多个氨基酸取代(优选保守的氨基酸取代)可以在天然存在的序列中进行,优选在形成分子间接触的一个或更多个结构域以外的多肽部分中。保守的氨基酸取代应该基本上不改变亲本序列的结构特征(例如,替换的氨基酸应不容易打破发生在亲本序列中的螺旋,或破坏表征亲本序列的其它类型的二级结构)。本领域认可的多肽二级和三级结构的实例描述于proteins,structuresandmolecularprinciples(creighton,ed.,w.h.freemanandcompany,newyork(1984))、introductiontoproteinstructure(c.brandenandj.tooze,eds.,garlandpublishing,newyork,n.y.(1991))和thornton等nature354:105(1991)。
如本文所用的术语“标记”或“标记的”指可检测的标记物的掺入,例如,放射性标记的氨基酸的掺入或可通过标记的亲和素(例如,含有荧光标记物的链霉亲和素或可通过光学或量热法来检测的酶活性)检测的生物素基团与多肽的连接。在某些情况下,标记或标记物还可以是治疗性的。标记多肽和糖蛋白的各种方法是本领域已知的并且可以使用。用于多肽的标记的实例包括但不限于下列:放射性同位素或放射性核素(例如,3h、14c、15n、35s、90y、99tc、111in、125i、131i)、荧光标记(例如,fitc、罗丹明、镧系元素磷光体)、酶标记(例如辣根过氧化物酶、p-半乳糖苷酶、萤光素酶、碱性磷酸酶)、化学发光、生物素基团、由次级报告基因识别的预先确定的多肽表位(例如,亮氨酸拉链对序列、二级抗体结合位点、金属结合结构域、表位标签)。在一些实施方案中,标记通过各种长度的间隔臂连接以减少潜在的空间位阻。如本文所用的术语“药物试剂或药物”指当适当地施用于患者时能够诱导所需的治疗效果的化学化合物或组合物。
本文中其它化学术语根据本领域的常规用法使用,例如通过themcgraw-hilldictionaryofchemicalterms(parker,s.,ed.,mcgraw-hill,sanfrancisco(1985))示例的。
如本文所用的,“基本上纯”指目标种类以主要种类存在(即,以摩尔计其比组合物中的任何其它个别种类更丰富),并且优选基本上纯化的级分是其中所述目标种类占存在的所有大分子种类的至少约50%(以摩尔计)的组合物。
通常,基本上纯的组合物将包含存在于所述组合物中的所有大分子种类的多于大约80%,更优选大于约85%、90%、95%和99%。最优选地,所述目标种类纯化至基本上同质(组合物中的污染物种类不能通过常规的检测方法检测到),其中所述组合物基本上由单个大分子种类组成。
术语患者包括人类和兽医对象。
抗体
本文提供了识别细胞表面表达的人和/或食蟹猴tlr4/md-2受体的抗tlr4抗体。所述抗体能够阻断,例如中和tlr4配体例如lps诱导的受体激活和后续的细胞内信号传导。本发明的抗体包括结合人和食蟹猴tlr4/md-2受体复合物并独立于md-2的存在还结合tlr4的抗体。
本文所述的抗tlr4抗体是这样的抗体,其在γ重链恒定区中包括至少一个特定氨基酸取代,使得所述抗tlr4抗体相比未改变的抗体引起抗原依赖性效应器功能的改变,同时保持对抗原的结合。在抗tlr4抗体的优选实施方案中,γ重链恒定区的eu氨基酸位置325用丝氨酸取代并且γ重链恒定区的eu氨基酸位置328用苯丙氨酸取代,使得改变的人igg1抗体的γ重链恒定区的eu氨基酸位置325至328包含氨基酸序列skaf(seqidno:42)。
在一个实施方案中,所述识别人和食蟹猴tlr4/md2复合物的抗tlr4抗体具有抑制lps诱导的促炎性细胞因子产生的能力。例如在人全血和诸如在pct公开号wo2005/065015和wo2007/110678中描述的那些hutlr4/md2转染的hek293细胞测定中确定抑制。
本发明还包括与本文所述抗tlr4抗体结合相同表位的抗体。例如本发明的抗tlr4抗体特异性结合人和/或食蟹猴tlr4/md-2复合物,其中所述抗体结合人和/或食蟹猴tlr4上在seqidno:23(人)和seqidno:24(食蟹猴)的残基289和375之间包括一个或更多个氨基酸残基的表位。例如,tlr4抗体特异性结合包括选自下列残基的表位:seqidno:23(人)和/或seqidno:24(食蟹猴)的至少残基328和329;seqidno:23(人)和/或seqidno:24(食蟹猴)的至少残基349至351;和seqidno:23(人)和/或seqidno:24(食蟹猴)的至少残基369至371。
在本领域内已知的各种方法可被用于生产针对给定的靶诸如,例如,toll样受体、人和/或食蟹猴tlr4/md-2复合物或当未复合md-2时的tlr4,或针对其衍生物、片段、类似物同源物或直系同源物的多克隆或单克隆抗体。(参见,例如antibodies:alaboratorymanual,harlowe,andlaned,1988,coldspringharborlaboratorypress,coldspringharbor,ny,通过引用并入本文)。
通过熟知的技术纯化抗体,如使用蛋白a或蛋白g的亲和层析法,其主要提供免疫血清的igg级分。随后,或可选地,所述特定抗原是所寻求的免疫球蛋白的靶或其表位,可以固定在柱上以通过免疫亲和层析纯化免疫特异性抗体。免疫球蛋白的纯化讨论于,例如d.wilkinson(thescientist,publishedbythescientist,inc.,philadelphiapa,vol.14,no.8(april17,2000),pp.25-28)。
优选地,本发明的抗tlr4抗体是单克隆抗体。例如通过使用pct公开号wo2005/065015、wo2007/110678和/或wo2009/101479中描述的方法生成单克隆抗tlr4抗体。例如通过使用本文提供的实施例中描述的方法生成抗tlr4抗体。还例如通过用在其表面表达高水平的给定靶的细胞转染子的组合免疫balb/c小鼠生成抗tlr4抗体。然后针对所选靶的反应性筛选从骨髓瘤/b细胞融合体获得的杂交瘤。
例如使用杂交瘤方法,诸如kohlerandmilstein,nature,256:495(1975)所描述的那些来制备单克隆抗体。在杂交瘤方法中,小鼠、豚鼠或其它合适的宿主动物典型地用免疫试剂免疫以引起产生或能够产生特异性结合免疫试剂的抗体的淋巴细胞。可选地,所述淋巴细胞可以在体外免疫。
免疫试剂将典型地包括蛋白抗原,其片段或其融合蛋白。通常,如果需要人起源的细胞,则使用外周血淋巴细胞,或如果需要非人哺乳动物来源,则使用脾细胞或淋巴结细胞。然后使用合适的融合试剂例如聚乙二醇将淋巴细胞与永生化的细胞系融合,以形成杂交瘤细胞(goding,monoclonalantibodies:principlesandpractice,academicpress,(1986)pp.59-103)。永生化的细胞系通常转染哺乳动物细胞,特别是啮齿类、牛和人起源的骨髓瘤细胞。通常利用大鼠或小鼠骨髓瘤细胞系。可以在优选包含抑制未融合的永生化的细胞的生长或存活的一种或更多种物质的合适的细胞培养基中培养杂交瘤细胞。例如,如果亲本抗体缺少酶次黄嘌呤鸟嘌呤磷酸核糖转移酶(hgprt或hprt),用于杂交瘤的培养基典型地将包括次黄嘌呤、氨基喋呤和胸腺嘧啶核苷(“hat培养基”),这些物质阻止hgprt缺陷型细胞的生长。
优选的永生化的细胞系是那些有效融合,支持所选抗体产生细胞的稳定的高水平抗体表达,并且对培养基例如hat培养基敏感的细胞系。更优选的永生化的细胞系是鼠骨髓瘤系,其可以例如从索尔克研究所细胞配送中心(salkinstitutecelldistributioncenter),sandiego,california和美国典型培养物保藏中心(theamericantypeculturecollection),manassas,virginia获得。还描述了用于产生单克隆抗体的人骨髓瘤和小鼠-人异源骨髓瘤细胞系。(参见kozbor,j.immunol.,133:3001(1984);brodeur等,monoclonalantibodyproductiontechniquesandapplications,marceldekker,inc.,newyork,(1987)pp.51-63))。
然后可以测定杂交瘤细胞在其中培养的培养基针对抗原的单克隆抗体的存在。优选地,由杂交瘤细胞产生的单克隆抗体的结合特异性通过免疫沉淀或通过体外结合测定,例如放射免疫测定(ria)或酶联免疫吸附测定(elisa)来确定。这些技术和测定是本领域已知的。单克隆抗体的结合亲和力可以例如通过munson和pollard,anal.biochem.,107:220(1980)的斯卡查德分析来确定。此外,在单克隆抗体的治疗性应用中,重要的是鉴定对靶抗原具有高度特异性和高结合亲和力的抗体。
鉴定所需的杂交瘤细胞后,克隆可以通过限制稀释法进行亚克隆和通过标准方法培养。(参见goding,monoclonalantibodies:principlesandpractice,academicpress,(1986)pp.59-103)。用于此目的的合适的培养基包括,例如,dulbecco改良的eagle培养基和rpmi-1640培养基。可选地,杂交瘤细胞可以如在哺乳动物腹水中体内培养。
由亚克隆分泌的单克隆抗体,可以通过常规免疫球蛋白纯化方法,诸如例如蛋白a-琼脂糖、羟基磷灰石层析、凝胶电泳、透析或亲和层析从培养基或腹水液中分离或纯化。
还可以通过重组dna方法,诸如在美国专利号4,816,567中描述的那些方法制备单克隆抗体。使用常规方法(例如,通过使用能够特异性结合编码鼠抗体重链和轻链的基因的寡核苷酸探针)可以容易地分离和测序编码本发明的单克隆抗体的dna。本发明的杂交瘤细胞充当这些dna的优选来源。一旦被分离,dna可以置入表达载体,其然后转染入宿主细胞例如猿猴cos细胞、中国仓鼠卵巢(cho)细胞或不以其它方式产生免疫球蛋白的骨髓瘤细胞,以获得在重组宿主细胞中单克隆抗体的合成。该dna也可以被修饰,例如,通过用人重链和轻链恒定结构域代替同源鼠序列来取代编码序列(参见美国专利号4,816,567;morrison,nature368,812-13(1994))或者通过共价连接非免疫球蛋白多肽的编码序列的全部或部分到免疫球蛋白编码序列。这种非免疫球蛋白多肽可以用本发明的抗体恒定结构域取代,或可以用本发明抗体的一个抗原结合位点的可变结构域取代,以产生嵌合二价抗体。
本发明的单克隆抗体包括人源化抗体或人抗体。这些抗体适合用于施用给人而不产生针对所施用的免疫球蛋白的人的免疫应答。抗体的人源化形式是嵌合免疫球蛋白、免疫球蛋白链或其片段(例如fv、fab、fab’、f(ab')2或抗体的其它抗原结合子序列),其主要由人免疫球蛋白的序列构成,并包含源自非人免疫球蛋白的最少序列。例如通过按照winter和同事的方法(jones等,nature,321:522-525(1986);riechmann等,nature,332:323-327(1988);verhoeyen等,science,239:1534-1536(1988)),通过用人抗体的相应序列取代啮齿动物cdr或cdr序列来进行人源化。(还参见美国专利号5,225,539)。在一些情况下,人免疫球蛋白的fv框架残基被相应的非人残基替换。人源化抗体还包含,例如既不见于受体抗体也不见于导入的cdr或框架序列的残基。通常,人源化抗体包含基本上至少一个并且通常两个可变结构域的全部,其中所有或基本上所有的cdr区对应非人免疫球蛋白的那些cdr区,并且所有或基本上所有的框架区是人免疫球蛋白共有序列的那些框架区。人源化抗体任选地还包含至少一部分免疫球蛋白恒定区(fc),通常是人免疫球蛋白的恒定区(jones等,1986;riechmann等,1988;和presta,curr.op.struct.biol.,2:593-596(1992))。
全人抗体是其中轻链和重链的整个序列包括cdr源自人基因的抗体分子。这些抗体本文称为“人抗体”或“全人抗体”。可以通过使用三源杂交瘤技术、人b细胞杂交瘤技术(参见kozbor,等,1983immunoltoday4:72),以及产生单克隆抗体的ebv杂交瘤技术(参见cole,等,1985in:monoclonalantibodiesandcancertherapy,alanr.liss,inc.,pp.77-96)制备单克隆抗体。可以利用单克隆抗体并可以通过使用人杂交瘤(参见cote,等,1983.procnatlacadsciusa80:2026-2030)产生单克隆抗体或通过用eb病毒体外转化人b细胞(cole,等,1985in:monoclonalantibodiesandcancertherapy,alanr.liss,inc.,pp.77-96)产生单克隆抗体。
此外,还可以使用额外的技术,包括噬菌体展示文库产生人抗体。(参见hoogenboom和winter,j.mol.biol.,227:381(1991);marks等,j.mol.biol.,222:581(1991))。类似地,可通过将人免疫球蛋白基因座引入其中内源免疫球蛋白基因已经部分或完全灭活的转基因动物,例如,小鼠来制造人抗体。在受到攻击时,观察到人抗体产生,其在各方面非常类似于在人中所见,包括基因重排,装配和抗体库。此方法描述于,例如美国专利号5,545,807、5,545,806、5,569,825、5,625,126、5,633,425、5,661,016,和marks等,bio/technology10,779-783(1992);lonberg等,nature368856-859(1994);morrison,nature368,812-13(1994);fishwild等,naturebiotechnology14,845-51(1996);neuberger,naturebiotechnology14,826(1996);以及lonberg和huszar,intern.rev.immunol.1365-93(1995)。
另外可以使用转基因非人动物产生人抗体,所述动物被修饰以便在对抗原的攻击应答时产生全人抗体而非动物的内源抗体。(参见pct公布w094/02602)。编码非人宿主重和轻免疫球蛋白链的内源基因已丧失能力,并且编码人重链和轻链免疫球蛋白的活性基因座插入到宿主的基因组中。例如,使用包含所需人dna区段的酵母人工染色体掺入人基因。然后通过杂交包含比修饰的全互补物少的中间转基因动物获得作为后代的提供所有所需修饰的动物。这种非人动物的实例是称为xenomouse™的小鼠,如公开于pct公布wo96/33735和wo96/34096。此动物产生b细胞,其分泌全人免疫球蛋白。抗体可直接从目标免疫原免疫后的动物获得,作为,例如多克隆抗体的制备物,或者可选地从动物来源的永生化b细胞例如产生单克隆抗体的杂交瘤获得。此外,编码具有人可变区的免疫球蛋白的基因可以回收和表达以直接获得抗体,或者可进一步修饰以获得抗体类似物,诸如,例如,单链fv(scfv)分子。
产生缺少内源免疫球蛋白重链表达的非人宿主(示例为小鼠)的方法的实例公开于美国专利号5,939,598。其可以通过一种方法获得,所述方法包括:从胚胎干细胞中至少一个内源重链基因座缺失j区段的基因,以防止基因座重排,并防止重排的免疫球蛋白重链基因座转录物的形成,所述缺失通过包含编码可选择标记基因的靶向载体实现;并从胚胎干细胞产生转基因小鼠,其体细胞和生殖细胞包含编码可选择标记的基因。
用于产生目标抗体诸如人抗体的一个方法公开于美国专利号5,916,771。该方法包括将包含编码重链的核苷酸序列的表达载体导入一种培养的哺乳动物宿主细胞,将包含编码轻链的核苷酸序列的表达载体导入另一种哺乳动物宿主细胞,并融合两种细胞以形成杂交细胞。所述杂交细胞表达含有重链和轻链的抗体。
在此方法的一个进一步的改进中,用于鉴定免疫原上临床相关表位的方法和用于选择以高亲和力特异性结合相关表位的抗体的相关方法公开于pct公布wo99/53049。
所述抗体可以通过含有编码上述单链抗体的dna区段的载体来表达。
这些可以包括载体、脂质体、裸dna、佐剂辅助的dna、基因枪、导管等。载体包括化学缀合物,诸如描述于wo93/64701,其具有靶向部分(例如,细胞表面受体的配体)和核酸结合部分(例如,聚赖氨酸);病毒载体(例如,dna或rna病毒载体);融合蛋白,诸如描述于pct/us95/02140(wo95/22618),其是包含靶部分(例如,特异针对靶细胞的抗体)和核酸结合部分(例如,鱼精蛋白)的融合蛋白;质粒;噬菌体等。载体可以是染色体的,非染色体的或合成的。
优选的载体包括病毒载体、融合蛋白和化学缀合物。反转录载体包括莫洛尼鼠白血病病毒。优选dna病毒载体。这些载体包括痘载体诸如正痘或禽痘载体,疱疹病毒载体诸如单纯疱疹i病毒(hsv)载体(参见geller,a.i.等,j.neurochem,64:487(1995);lim,f.,等,indnacloning:mammaliansystems,d.glover,ed.(oxforduniv.press,oxfordengland)(1995);geller,a.i.等,procnatl.acad.sci.:u.s.a.90:7603(1993);geller,a.i.,等,procnatl.acad.sciusa87:1149(1990)),腺病毒载体(参见legallasalle等,science,259:988(1993);davidson,等,nat.genet3:219(1993);yang,等,j.virol.69:2004(1995)),以及腺病毒相关病毒载体(seekaplitt,m.g.等,nat.genet.8:148(1994))。
痘病毒载体将基因导入细胞胞浆。禽痘病毒载体仅导致核酸的短期表达。腺病毒载体,腺相关病毒载体和单纯疱疹病毒(hsv)载体优选用于将核酸导入神经细胞。腺病毒载体导致比腺相关病毒(约4个月)(其转而短于hsv载体)更短期的表达(约2个月)。所选具体载体将取决于靶细胞和处理条件。导入可以通过标准技术,例如感染、转染、转导或转化。基因转移模式的实例包括例如裸dna、capo4沉淀、deae葡聚糖、电穿孔、原生质体融合、脂质转染、细胞显微注射和病毒载体。
可以利用所述载体针对基本上任何期望的靶细胞。例如,立体定位注射可以用来引导载体(例如,腺病毒,hsv)至期望的位置。此外,该粒子可以通过使用微泵输注系统,如synchromed输注系统进行脑室内(icv)输注来递送。基于本体流动的方法,称为对流,也被证明在递送大分子到大脑的延伸区域是有效的并可用于将载体递送至靶细胞。(参见bobo等,proc.natl.acad.sci.usa91:2076-2080(1994);morrison等,am.j.physiol.266:292-305(1994))。可以使用的其它方法包括导管、静脉内、肠胃外、腹膜内和皮下注射,以及口服或其它已知的施用途径。
双特异性抗体是对至少两种不同抗原具有结合特异性的抗体。在本发明情况下,结合特异性之一是对诸如tlr4、md2、人和/或食蟹猴tlr4/md2的复合物或其任何片段的靶。所述第二结合靶是任何其它抗原,并且有利地是细胞表面蛋白或受体或受体亚基。
用于制备双特异性抗体的方法是本领域已知的。传统上,双特异性抗体的重组生产基于两对免疫球蛋白重链/轻链的共表达,其中两条重链具有不同的特异性(milsteinandcuello,nature,305:537-539(1983))。因为免疫球蛋白重链和轻链的随机分配,这些杂交瘤(四价体瘤(quadroma))产生10种不同抗体分子的潜在混合物,其中只有一种具有正确的双特异性结构。正确分子的纯化通常通过亲和层析步骤来完成。类似方法公开于1993年5月13日发表的wo93/08829和traunecker等,emboj.,10:3655-3659(1991)。
具有所需结合特异性的抗体可变结构域(抗体-抗原结合位点)可以融合到免疫球蛋白恒定结构域序列。融合优选用免疫球蛋白重链恒定结构域,其包含铰链、ch2和ch3区的至少一部分。其优选具有第一重链恒定区(ch1),所述第一重链恒定区(ch1)包含对于存在于至少一个融合物中的轻链结合必需的位点。将编码免疫球蛋白重链融合物以及,如果需要,免疫球蛋白轻链的dna插入分开的表达载体,并共转染到合适的宿主生物体。对于生成双特异性抗体的进一步的细节,参见例如,suresh等,methodsinenzymology,121:210(1986)。
根据wo96/27011描述的另一种方法,一对抗体分子之间的界面可以被工程改造以最大化从重组细胞培养物中回收的异二聚体的百分比。优选的界面包含抗体恒定结构域的ch3区的至少一部分。在该方法中,来自第一抗体分子界面的一个或更多个小氨基酸侧链用更大的侧链(例如酪氨酸或色氨酸)替换。与一条或更多条大侧链相同或相似大小的补偿性“空腔”是通过用较小的氨基酸侧链(例如,丙氨酸或苏氨酸)替换大氨基酸侧链,在二级抗体分子的界面上产生的。这提供了对于提高异源二聚体相对其它不想要的终产物例如同二聚体的产率的机制。
用于从抗体片段生成双特异性抗体的技术在文献中已有描述。例如,可使用化学连接来制备双特异性抗体。产生的双特异性抗体可用作用于酶的选择性固定化的试剂。
制备并直接从重组细胞培养物中分离双特异性抗体片段的各种技术也已有描述。例如,已使用亮氨酸拉链产生双特异性抗体。kostelny等,j.immunol.148(5):1547-1553(1992)。来自fos和jun蛋白的亮氨酸拉链肽通过基因融合被连接到两个不同抗体的fab'部分。抗体同二聚体在铰链区还原,以形成单体,然后重新氧化以形成抗体异源二聚体。此方法也可用于产生抗体同二聚体。由hollinger等,proc.natl.acad.sci.usa90:6444-6448(1993)描述的“双抗体”技术已提供了用于制造双特异性抗体片段的替代机制。该片段包含通过接头连接到轻链可变结构域(vl)的重链可变结构域(vh),所述接头太短使得同一条链上的两个结构域之间不能配对。因此,一个片段上的vh和vl结构域被迫与另一片段的互补vl和vh结构域配对,由此形成两个抗原结合位点。通过使用单链fv(sfv)二聚体制备双特异性抗体片段的另一种策略也有报道。参见,gruber等,j.immunol.152:5368(1994)。
也考虑具有超过两价的抗体。例如,可制备三特异性抗体。tutt等,j.immunol.147:60(1991)。
示例性双特异性抗体可以结合两个不同表位,至少其中之一源于本发明的蛋白抗原。可选地,免疫球蛋白分子的抗抗原臂可与结合白细胞上触发分子的臂组合,以使细胞防御机制聚焦于表达特定抗原的细胞,所述触发分子诸如t细胞受体分子(例如cd2、cd3、cd28或b7),或对于igg的fc受体(fcyr),诸如fcyri(cd64)、fcyrii(cd32)和fcyriii(cd16)。双特异性抗体也可用于引导细胞毒性剂,到表达特定抗原的细胞。这些抗体拥有抗原结合臂和结合细胞毒剂或放射性核素螯合剂诸如eotube、dpta、dota或teta的臂。另一种目标双特异性抗体结合本文所述的蛋白抗原,并进一步结合组织因子(tf)。
异源缀合物抗体也在本发明的范围之内。异源缀合物抗体由两种共价连接的抗体构成。例如已经提出,此类抗体使免疫系统细胞靶向不想要的细胞(参见美国专利号4,676,980),并用于治疗hiv感染(参见wo91/00360;wo92/200373;ep03089)。设想该抗体可在体外使用合成蛋白质化学中已知的方法,包括那些涉及交联剂的方法制备。例如,可以使用二硫化物交换反应或通过形成硫醚键来构建免疫毒素。用于此目的的合适的试剂实例包括亚氨基硫醇和甲基-4-巯基丁酰亚胺酯(mercaptobutyrimidate)以及,例如,在美国专利号4,676,980中公开的那些。
在效应器功能方面修饰本发明的抗体也可以是希望的,以便增强,例如,抗体在治疗与异常的lps信号传导相关的疾病和病症中的有效性。例如,可以将一个或更多个半胱氨酸残基引入fc区,从而允许在该区域中形成链间二硫键。由此生成的同二聚体抗体可具有改善的内化能力和/或提高的补体介导的细胞杀伤和抗体依赖性细胞毒性(adcc)。(参见caron等,j.expmed.,176:1191-1195(1992)和shopes,j.immunol.,148:2918-2922(1992))。可选地,可以工程改造抗体,以具有双重fc区,并且可以从而具有增强的补体裂解和adcc能力。(参见stevenson等,anti-cancerdrugdesign,3:219-230(1989))。
本发明还涉及包含缀合于细胞毒性剂诸如毒素(例如酶促活性的细菌、真菌、植物或动物来源的毒素或它们的片段),或放射性同位素(即放射缀合物)的抗体的免疫缀合物。
可以使用的酶活性毒素及其片段包括白喉毒素a链,白喉毒素的非结合活性片段,外毒素a链(来自绿脓杆菌),蓖麻毒素a链,相思子毒素a链,蒴莲素a链,α-帚曲毒蛋白,油桐蛋白,石竹素蛋白,美洲商陆蛋白(papi,papii,及pap-s),苦瓜抑制剂,麻疯树毒蛋白,巴豆毒素,肥皂草(sapaonariaofficinalis)抑制剂,白树毒素,mitogellin,restrictocin,酚霉素,伊诺霉素和单端孢霉烯。可获得用于产生放射性缀合抗体的各种放射性核素。实例包括212bi、131i、131in、90y和186re。
抗体与细胞毒性剂的缀合物可以使用各种双功能蛋白偶联剂制备,例如n-琥珀酰亚氨基-3-(2-吡啶基二巯基)丙酸酯(spdp)、亚氨基硫杂环戊烷(it)、亚氨酸酯的双功能衍生物(如二亚胺代己二酸二甲酯盐酸盐)、活性酯类(如二琥珀酰亚胺基辛二酸酯)、醛类(如戊二醛)、双-叠氮化合物(如双(对-叠氮基苯甲酰基)己二胺)、双-重氮衍生物(如双-(对-重氮苯甲酰基)-乙二胺)、二异氰酸酯(如甲苯2,6-二异氰酸酯),和双-活性氟化合物(如1,5-二氟-2,4-二硝基苯)。例如,蓖麻毒素免疫毒素可如vitetta等,science238:1098(1987)所述制备。碳-14标记的1-异硫氰酸苯甲基-3-甲基二亚乙基三胺五乙酸(mx-dtpa)是用于将放射性核苷酸与抗体偶联的示例性螯合剂。(参见w094/11026)。
那些本领域技术人员将认识到,大量的各种可能的部分可偶联到本发明所得到的抗体。(参见,例如,“conjugatevaccines”,contributionstomicrobiologyandimmunology,j.m.cruseandr.e.lewis,jr(eds),cargerpress,newyork,(1989),其全部内容通过引用并入本文)。
偶联可以通过任何将两个分子结合的化学反应完成,只要抗体与其它部分保留它们各自的活性。这种连接可以包括很多化学机制,例如共价结合、亲和力结合、嵌入、配位结合和络合。但是,优选的结合是共价结合。共价结合可通过现有侧链的直接缩合或通过外部桥接分子的掺入来实现。很多二价或多价连接剂可用于将蛋白分子,例如本发明的抗体,偶联到其它分子。例如,代表性的偶联剂可以包括有机化合物,诸如硫酯、碳二亚胺、琥珀酰亚胺酯、二异氰酸酯、戊二醛、重氮苯类和六亚甲基二胺。这个列表并不旨在穷尽本领域中已知的各类偶合剂,而更是较常见的偶联剂的示例。(参见killen和lindstrom,jour.immun.133:1335-2549(1984);jansen等,immunologicalreviews62:185-216(1982);以及vitetta等,science238:1098(1987)。)。
优选的接头在文献中有描述。(参见,例如,ramakrishnan,s.等,cancerres.44:201-208(1984)描述了mbs(m-马来酰亚胺苯甲酰基-n-羟基琥珀酰亚胺酯)的使用。)还参见,美国专利号5,030,719,其描述了通过寡肽接头的方式偶联至抗体的卤代乙酰肼衍生物的使用。特别优选的连接物包括:(i)edc(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐;(ⅱ)smpt(4-琥珀酰亚胺氧羰基-α-甲基-α-(2-吡啶基二硫代)-甲苯(piercechem.co.,目录(21558g));(ⅲ)spdp(琥珀酰亚胺基-6-[3-(2-吡啶基二硫代)丙酰胺基]己酸酯(piercechem.co.,目录号21651g);(ⅳ)磺基-lc-spdp(磺基琥珀酰亚胺6[3-(2-吡啶基二硫代)-丙酰胺]己酸酯(piercechem.co.,目录号2165-g);以及(v)缀合到edc的磺基nhs(n-羟基磺基琥珀酰亚胺:piercechem.co.,目录号24510)。
上面描述的接头包含具有不同属性的组分,从而导致缀合物具有不同的物理-化学性质。例如,烷基羧酸酯的磺基-nhs酯比芳族羧酸酯的磺基-nhs酯更稳定。包含接头的nhs酯比磺基-nhs酯溶解度更小。此外,接头smpt包含具有空间位阻的二硫键,并可以形成具有增加的稳定性的缀合物。二硫键连接,在一般情况下比其它连接更不稳定,因为二硫键连接在体外裂解,导致更少的缀合物可用。特别是磺基-nhs可以增强碳二亚胺偶联的稳定性。当与磺基-nhs结合使用时,碳二亚胺偶联(如edc)形成的酯对水解比单独的碳二亚胺偶联反应更有抵抗力。
本文所公开的抗体还可配制作为免疫脂质体。包含抗体的脂质体通过本领域已知的方法制备,例如描述于epstein等,proc.natl.acad.sci.usa,82:3688(1985);hwang等,proc.natlacad.sci.usa,77:4030(1980);以及美国专利号4,485,045和4,544,545。具有增强的循环时间的脂质体公开于美国专利号5,013,556。
特别有用的脂质体可以使用包含磷脂酰胆碱、胆固醇和peg衍生化的磷脂酰乙醇胺(peg-pe)的脂质组合物通过反相蒸发法生成。脂质体通过规定孔径的过滤器挤出,以获得具有所需直径的脂质体。本发明的抗体的fab的'片段可如martin等,j.biol.chem.,257:286-288(1982)所述通过二硫键交换反应缀合到脂质体。
抗tlr4抗体的使用
将理解的是,根据本发明的治疗实体的施用将与合适的载体、赋形剂和其它掺入制剂的试剂一起施用,以提供改善的转移、递送、耐受等。许多合适的制剂可以见于所有药剂师已知的处方集:remington’spharmaceuticalsciences,第15版,mackpublishingcompany,easton,pa(1975)),特别是其中blaug,seymour的第87章。这些制剂包括,例如,粉剂、糊剂、软膏、凝胶剂、蜡剂、油剂、脂质、包含脂质(阳离子或阴离子)的囊泡(如lipofectin™)、dna缀合物、无水吸收糊剂、水包油和油包水乳剂、聚乙二醇乳剂(各种分子量的聚乙二醇)、半固体凝胶以及包含聚乙二醇的半固体混合物。任何上述混合物可以适合于根据本发明的治疗和疗法,条件是在制剂中的活性成分不被制剂灭活并且制剂与施用途径在生理上是相容的和可耐受的。还参见,baldrickp.“pharmaceuticalexcipientdevelopment:theneedforpreclinicalguidance.”regul.toxicolpharmacol.32(2):210-8(2000),wangw.“lyophilizationanddevelopmentofsolidproteinpharmaceuticals.”int.j.pharm.203(1-2):1-60(2000),charmanwn“lipids,lipophilicdrugs,andoraldrugdelivery-someemergingconcepts.”jpharmsci.89(8):967-78(2000),powell等“compendiumofexcipientsforparenteralformulations”pdajpharmscitechnol.52:238-311(1998)以及其中对于关于药剂师熟知的制剂、赋形剂和载体的额外信息的引用。
本发明的治疗制剂,其包括本发明的抗tlr4抗体,用于治疗或减轻与免疫相关病症相关的症状。本发明还提供了治疗或减轻与免疫相关病症相关的症状的方法。通过使用标准的方法鉴定对象,例如,患有(或处于发展风险中)免疫相关病症的人患者来执行治疗方案。例如,本发明的抗tlr4抗体是在自身免疫性疾病和/或炎性病症的治疗中有用的治疗工具。在某些实施方案中,考虑使用调节,例如,抑制、中和或干扰tlr信号传导的抗tlr4抗体用于治疗自身免疫性疾病和/或炎性病症。
自身免疫性疾病包括,例如,获得性免疫缺陷综合症(aids,其是具有自身免疫成分的病毒性疾病)、斑秃、强直性脊柱炎、抗磷脂综合征、自身免疫性阿狄森氏病、自身免疫性溶血性贫血、自身免疫性肝炎、自身免疫性内耳病(aied)、自身免疫性淋巴增生综合征(alps)、自身免疫性血小板减少性紫癜(atp)、白塞氏病、心肌病、口炎性腹泻-疱疹样皮炎;慢性疲劳免疫功能障碍综合征(cfids)、慢性炎症性脱髓鞘性多发性神经病(cipd)、瘢痕性类天疱疮、冷凝集素病、crest综合征、克罗恩氏病、degos氏病、幼年型皮肌炎、盘状狼疮、原发性混合型冷球蛋白血症、纤维肌痛-纤维肌炎、格雷夫斯病、格林-巴利综合征、桥本氏甲状腺炎、特发性肺纤维化、特发性血小板减少性紫癜(itp)、iga肾病、胰岛素依赖型糖尿病、幼年型慢性关节炎(still氏病)、幼年类风湿性关节炎、梅尼埃氏病、混合性结缔组织病、多发性硬化、重症肌无力、恶性贫血、结节性多动脉炎、多软骨炎、多腺体综合征、风湿性多肌痛、多发性肌炎和皮肌炎、原发性丙种球蛋白血症、原发性胆汁性肝硬化、银屑病、银屑病关节炎、雷诺氏现象、莱特尔氏综合征、风湿热、类风湿性关节炎、结节病、硬皮病(进行性系统性硬化症(pss),也被称为系统性硬化症(ss))、干燥综合征、僵人综合征、系统性红斑狼疮、多发性大动脉炎、颞动脉炎/巨细胞动脉炎、溃疡性结肠炎、葡萄膜炎、白癜风和韦格纳肉芽肿。
炎性病症包括,例如,慢性和急性炎性病症。炎性病症的例子包括阿耳茨海默氏病、哮喘、特应性变态反应、变态反应、动脉粥样硬化、支气管哮喘、湿疹、肾小球肾炎、移植物抗宿主病、溶血性贫血、骨关节炎、败血症、中风、组织和器官移植、血管炎、糖尿病性视网膜病和通气机诱导的肺损伤。
例如,抗tlr4抗体可用于治疗微生物产物(如lps)诱导的急性炎症和脓毒症和由此急性炎症引起的加重,诸如,例如,慢性阻塞性肺疾病和哮喘(参见o’neill,curr.opin.pharmacol.3:396-403(2003),通过引用以其整体在此并入)。这些抗体还可以用于治疗神经退行性自身免疫性疾病。(lehnardt等,proc.natl.acad.sci.usa100:8514-8519(2003),由此通过引用以其整体并入)。
此外,本发明的抗体也可以用作治疗剂治疗疾病,诸如,例如,骨关节炎,其由应激引起,例如,细胞应激,这反过来又诱导内源性可溶的“应激”因子触发tlr4。内源可溶性应激因子包括,例如hsp60(参见ohashi等,j.immunol.164:558-561(2000))和纤连蛋白(参见okamura等,j.biol.chem.276:10229-10233(2001))以及硫酸肝素、透明质酸、gp96、β-防御素-2或表面活性蛋白a(参见例如,johnson等,crit.rev.immunol.,23(1-2):15-44(2003),其每个都由此通过引用以其整体并入)。本发明的抗体,还可以用于治疗各种与应激相关的疾病,例如,置于呼吸机、通气机和其它呼吸辅助装置的对象和患者相关的细胞应激。例如,本发明的抗体还可用于治疗通气机诱导的肺损伤(“vili”),也称为通气相关性肺损伤(“vali”)。
其中抑制tlr4功能可能是有益的其它疾病领域包括,例如,慢性炎症(例如,与过敏性状况和哮喘相关的慢性炎症)、自身免疫性疾病(例如,炎性肠病)和动脉粥样硬化(参见o’neill,curr.opin.pharmacol.3:396-403(2003),在此通过引用以其整体并入本文)。
这些免疫相关病症相关的症状包括例如炎症、发热、全身不适、发热、疼痛、常常定位于发炎区域、快速脉搏、关节疼痛或酸痛(关节痛)、呼吸急促或其它异常呼吸模式、寒战、精神错乱、定向力障碍、躁动、头晕、咳嗽、呼吸困难、肺部感染、心力衰竭、呼吸衰竭、水肿、体重增加、粘液脓性复发、恶病质、喘鸣、头痛和腹部症状诸如例如腹痛、腹泻或便秘。
结合用于诊断或治疗特定免疫相关病症的任何已知方法来确定治疗的功效。免疫相关病症的一种或更多种症状的减轻表明抗体赋予临床益处。
用于筛选具有所需的特异性的抗体的方法,包括但不限于酶联免疫吸附测定(elisa)和本领域内已知的其它免疫学介导的技术。
针对靶诸如tlr2、cd14、tlr4、md2、tlr4/md-2复合物或任何toll样受体(或其片段)的抗体可以用于本领域内已知的与这些靶的定位和/或定量有关的方法,例如,用于测量这些靶在适当的生理样品中的水平,用于诊断方法,用于蛋白成像等)。在一个给定的实施方案中,任何这些靶,或其衍生物、片段、类似物或同源物的特异性的抗体,包含抗体衍生的抗原结合结构域,用作药理学活性化合物(下文称为“治疗剂”)。
本发明的抗tlr4抗体可用于使用标准技术,诸如免疫亲和、层析或免疫沉淀分离特定靶。本发明的抗tlr4抗体(或其片段)可在诊断上用于监测组织中蛋白水平,作为临床测试程序的一部分,例如,以确定给定治疗方案的功效。可以通过将抗体偶联(即物理连接)到可检测物质来促进检测。可检测物质的实例包括各种酶、辅基、荧光材料、发光材料、生物发光材料和放射性材料。合适的酶的实例包括辣根过氧化物酶、碱性磷酸酶、β半乳糖苷酶或乙酰胆碱酯酶;合适的辅基复合物的实例包括链霉亲和素/生物素和亲和素/生物素;合适的荧光材料的实例包括伞形酮、荧光素、异硫氰酸荧光素、罗丹明、二氯三嗪胺荧光素、丹磺酰氯或藻红蛋白;发光材料的实例包括鲁米诺;生物发光材料的实例包括萤光素酶、萤光素和水母发光蛋白,以及合适的放射性材料的实例包括125i、131i、35s或3h。
本发明的抗体,包括多克隆、单克隆、人源化和全人抗体,可以用作治疗剂。这样的试剂通常用于治疗或预防对象中与给定靶的异常表达或激活相关的疾病或病理。抗体制剂,优选一种对其靶抗原具有高特异性和高亲和力的抗体制剂,施用于对象,并通常由于其与靶标结合而具有效果。抗体的施用可以废除或抑制或干扰靶的信号传导功能。抗体的施用可以废除或抑制或干扰靶与其天然结合的内源性配体的结合。例如,抗体结合靶并中和lps诱导的促炎性细胞因子的产生。
本发明的抗体的治疗有效量通常涉及实现治疗目标所需要的量。如上面所指出的,这可以是抗体和其靶抗原之间的结合相互作用,其在某些情况下,干扰靶发挥功能。施用所需的量将进一步取决于抗体对其特异性抗原的结合亲和力,并且也将取决于所施用的抗体从其施用于的其它对象的自由体积耗尽的速率。用于本发明的抗体或抗体片段的治疗有效给药的共同范围可以是通过非限制性实例的方式,从约0.1mg/kg体重至约50mg/kg体重。共同给药频率范围可以为,例如,每天两次至每周一次。
可以以药物组合物的形式施用本发明的抗体或其片段,用于多种疾病和病症的治疗。例如在remington:thescienceandpracticeofpharmacy19thed.(alfonsor.gennaro,等,editors)mackpub.co.,easton,pa.:1995;drugabsorptionenhancement:concepts,possibilities,limitations,andtrends,harwoodacademicpublishers,langhorne,pa.,1994;以及peptideandproteindrugdelivery(advancesinparenteralsciences,vol.4),1991,m.dekker,newyork中提供了在制备此类组合物中涉及的原则和考虑,以及组分选择中的指导。
其中,使用抗体片段时,特异性结合到靶蛋白的结合结构域的最小抑制性片段是优选的。例如,基于抗体的可变区序列,可设计肽分子保留结合靶蛋白序列的能力。此类肽可以化学合成和/或通过重组dna技术产生。(参见,例如marasco等,proc.natl.acad.sci.usa,90:7889-7893(1993))。制剂还可以包含一个以上的对于被治疗的具体适应症所必需的活性化合物,优选具有互补活性彼此没有不利地影响那些。可选地,或另外地,所述组合物可包含增强其功能的试剂,诸如,例如,细胞毒性剂、细胞因子、化疗剂或生长抑制剂。这类分子以对于预定目的有效的量适合地存在于组合中。
活性成分也可以包埋在微胶囊中,所述微胶囊通过如下制备:例如,通过凝聚技术或通过界面聚合,例如,羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊,分别在胶体药物递送系统(例如脂质体、白蛋白微球、微乳液、纳米粒子和纳米胶囊)或在粗乳液中。
要用于体内施用的制剂必须是无菌的。这容易地通过使用无菌滤膜过滤来实现。
可以制备缓释制剂。缓释制剂的合适实例包括包含抗体的固体疏水性聚合物的半渗透性基质,其中基质以定型产品的形式,例如薄膜或微胶囊。缓释基质的实例包括聚酯,水凝胶(例如,聚(2-羟乙基-甲基丙烯酸酯),或聚(乙烯醇)),聚交酯(美国专利号3,773,919),l-谷氨酸和γ-乙基-l-谷氨酸的共聚物,不可降解的乙烯-乙酸乙烯酯,可降解的乳酸-乙醇酸共聚物诸如luprondepottm(由乳酸-乙醇酸共聚物和醋酸亮丙瑞林构成的可注射的微球),和聚-d-(-)-3-羟基丁酸。虽然聚合物诸如乙烯-乙酸乙烯酯和乳酸-乙醇酸能够释放分子超过100天,但是某些水凝胶释放蛋白持续较短的时间段。
根据本发明的抗体可用作用于检测样品中给定靶(或其蛋白片段)的存在的试剂。在一些实施方案中,所述抗体包含可检测标记。抗体是多克隆的,或更优选地,单克隆的。使用完整抗体或其片段(例如fab、scfv或f(ab)2)。关于探针或抗体的术语“标记的”,旨在涵盖通过偶联(即物理连接)可检测物质至探针或抗体的探针或抗体的直接标记,以及通过与直接标记的另一种试剂的反应性的探针或抗体的间接标记。间接标记的实例包括使用荧光标记的二级抗体检测初级抗体,和用生物素末端标记的dna探针,使得它可以用荧光标记的链霉亲和素检测。术语“生物样品”旨在包括从对象分离的组织、细胞和生物流体,以及对象内存在的组织、细胞和流体。因此包括在术语“生物样品”的使用内的是血液和血液的级分或成分,包括血清、血浆或淋巴。即,本发明的检测方法可用于在体外和体内检测生物样品中分析物mrna、蛋白或基因组dna。例如,用于检测分析物mrna的体外技术包括northern杂交和原位杂交。用于检测分析物蛋白的体外技术包括酶联免疫吸附测定(elisa)、western印迹、免疫沉淀和免疫荧光。用于检测分析物基因组dna的体外技术包括southern杂交。用于进行免疫测定的方法描述于,例如“elisa:theoryandpractice:methodsinmolecularbiology”,vol.42,j.r.crowther(ed.)humanpress,totowa,nj,1995;“immunoassay”,e.diamandisandt.christopoulus,academicpress,inc.,sandiego,ca,1996;和“practiceandtheoryofenzymeimmunoassays”,p.tijssen,elseviersciencepublishers,amsterdam,1985。此外,用于检测分析物蛋白的体内技术包括引入对象标记的抗分析物蛋白抗体。例如,所述抗体可标记有放射性标记物,其在对象中的存在和位置可以通过标准成像技术来检测。
药物组合物
本发明的抗体或可溶性嵌合多肽(本文也称为“活性化合物”)及其衍生物、片段、类似物和同源物可以掺入适合于施用的药物组合物。此类组合物典型地包含抗体或可溶性嵌合多肽和药学上可接受的载体。如本文所用的,术语“药学上可接受的载体”旨在包括任何和所有溶剂、分散介质、包衣、抗细菌和抗真菌剂、等渗剂和吸收延迟剂等,与药物施用相容。合适的载体描述于该领域中的标准参考文献最近版本的remington’spharmaceuticalsciences,在此通过引用并入。这些载体或稀释剂的优选实例包括,但不限于,水、盐水、林格氏溶液、葡萄糖溶液和5%人血清白蛋白。也可使用脂质体和非水性载体,如固定油。用于药学活性物质的这些介质和试剂的使用是本领域熟知的。除非在任何常规介质或试剂与活性化合物不相容的情况下,否则其在组合物中的使用是预期的。补充的活性化合物也可以掺入组合物。
本发明的药物组合物被配制成与其预期施用途径相容。施用途径的实例包括肠胃外,例如,静脉内、皮内、皮下、口服(例如,吸入)、经皮(即,局部)、经粘膜和直肠施用。用于肠胃外、皮内或皮下应用的溶液或悬浮液可包括以下组分:无菌稀释剂诸如注射用水、盐水溶液、固定油、聚乙二醇、甘油、丙二醇或其它合成溶剂;抗菌剂诸如苄醇或对羟基苯甲酸甲酯;抗氧化剂诸如抗坏血酸或亚硫酸氢钠;螯合剂诸如乙二胺四乙酸(edta);缓冲剂诸如醋酸盐、柠檬酸盐或磷酸盐,和用于调整张力的试剂,诸如氯化钠或葡萄糖。ph可以用酸或碱,诸如盐酸或氢氧化钠调节。肠胃外制剂可以封装在由玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。
适于注射使用的药物组合物包括无菌水溶液(其中水可溶)或分散体和用于无菌注射溶液或分散体的临时制备的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水、聚氧乙烯蓖麻油eltm(basf,parsippany,n.j.)或磷酸缓冲盐水(pbs)。在所有情况下,组合物必须是无菌的,并且应该是达到存在易注射性程度的流体。它必须在制造和储存条件下是稳定的,并且必须防止微生物诸如细菌和真菌的污染作用下保存。载体可以是包含例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等),及其合适的混合物的溶剂或分散介质。可以保持适当的流动性,例如,通过使用包衣如卵磷脂,通过在分散体的情况下保持所需颗粒大小以及通过使用表面活性剂。防止微生物的作用可以通过各种抗细菌和抗真菌剂来实现,例如对羟基苯甲酸酯类、氯丁醇、苯酚、抗坏血酸、硫柳汞等。在许多情况下,在组合物中将优选包括等渗剂,例如糖类,多元醇诸如甘露醇、山梨醇,氯化钠。可注射组合物的延长吸收可以通过在组合物中包含延迟吸收的试剂,例如,单硬脂酸铝和明胶来实现。
可通过在适当的溶剂中以所需量掺入活性化合物以及上面列举的成分之一或组合,根据需要,然后过滤灭菌来制备无菌注射液。通常,通过将活性化合物掺入到含有基本分散介质的和来自上述列举的那些所需其它成分的无菌媒介物来制备分散体。在用于制备无菌注射液的无菌粉末的情况下,制备方法是真空干燥和冷冻干燥,从其先前无菌过滤的溶液获得活性成分加上任何额外所需成分的粉末。
口服组合物一般包括惰性稀释剂或可食用载体。它们可以封装在明胶胶囊中或压成片剂。对于口服治疗施用目的,活性化合物可以与赋形剂掺合并以片剂、锭剂或胶囊的形式使用。口服组合物也可以使用流体载体制备用作漱口水,其中在该流体载体中的化合物经口应用并涮洗及吐出或吞下。药学上相容的粘合剂和/或佐剂材料可以包含作为组合物的一部分。所述片剂、丸剂、胶囊剂、锭剂等可含有任何以下成分或类似性质的化合物:粘合剂如微晶纤维素、黄蓍胶或明胶;赋形剂如淀粉或乳糖,崩解剂如藻酸、primogel或玉米淀粉;润滑剂如硬脂酸镁或sterotes;助流剂如胶体二氧化硅;甜味剂如蔗糖或糖精;或调味剂如薄荷、水杨酸甲酯或橙调味剂。
对于通过吸入施用,化合物从加压容器或分配器以气溶胶喷雾的形式递送,所述加压容器或分配器包含合适的推进剂,例如气体如二氧化碳,或喷雾器。
全身施用也可是通过经粘膜或经皮手段。对于经粘膜或经皮施用,在制剂中使用对待渗透的障碍合适的渗透剂。此类渗透剂通常是本领域已知的,并且包括,例如,用于经粘膜施用,去垢剂,胆汁盐和夫西地酸衍生物。经粘膜施用可通过使用鼻喷雾剂或栓剂来实现。对于经皮施用,将活性化合物配制成如本领域通常已知的软膏、药膏、凝胶或乳膏。
所述化合物也可以以栓剂的形式制备(例如,与常规的栓剂基质一起,例如可可脂和其它甘油酯)或用于直肠递送的滞留型灌肠剂。
在一个实施方案中,与载体一起制备活性化合物,所述载体将保护化合物免于快速从体内消除,诸如控释制剂,包括植入物和微囊化递送系统。可以使用可生物降解的、生物相容的聚合物,例如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。制备这类制剂的方法对于那些本领域技术人员将是显而易见的。该材料也可以从alzacorporation和novapharmaceuticals,inc.商购获得。脂质体悬浮液(包括用针对病毒抗原的单克隆抗体靶向受感染细胞的脂质体)也可以用作药学上可接受的载体。可以根据本领域技术人员已知的方法制备这些,例如如描述于美国专利号4,522,811。
以剂量单位形式配制口服或胃肠外组合物以易于施用和剂量的均匀性是特别有利的。如本文所用剂量单位形式是指适合作为单一剂量用于待治疗对象的物理上离散的单位;每个单位含有预定量的经计算与所需的药物载体联合以产生的期望的治疗效果的活性化合物。对于本发明的剂量单位形式的说明是由活性化合物的独特性质和要实现的特定治疗效果以及配制这种活性化合物用于个体的治疗的所属领域中固有的限制来决定,并直接取决于活性化合物的独特性质和要实现的特定治疗效果以及配制这种活性化合物用于个体的治疗的所述领域中固有的限制。
所述药物组合物连同施用说明书可以被包括在容器、包装或分配器中。
本发明将在下面的实施例中进一步描述,其不限制权利要求中描述的本发明的范围。
实施例
实施例1稳定的食蟹猴tlr4和人tlr4/md-2tlr4转染子的产生
稳定的食蟹猴tlr4和人tlr4/md-2的转染子在基于下面描述的序列的cho-k1细胞中产生。
>人tlr4氨基酸序列
>食蟹猴tlr4氨基酸序列1
对于cho-k1细胞,将编码n-末端c-myc表位标签的人tlrcdna和食蟹猴tlr4cdna克隆入pcdna3.1(-)hygro(invitrogen),并且将编码c-末端c-myc和蛋白c表位标签的人md-2cdna克隆入pcdna3(invitrogen)。根据制造商的指南,使用fugene6™试剂(roche)将人tlr4和人md2构建体共转染入cho细胞。在包含500μg/mlg418和250μg/ml潮霉素b(两者均来自invitrogen)的培养基中选择抗生素抗性细胞。根据制造商的指南使用fugene6™试剂(roche)将食蟹猴tlr4构建体转染入cho细胞,并如上述培养。
为了选择表达人tlr4/md-2复合物或食蟹猴tlr4的细胞,将1x107cho细胞/ml在补充1%bsa和10μg/ml抗蛋白c单克隆抗体(roche)或10μg/ml抗tlr4蛋白1c6单克隆抗体(novimmunesa)的1xpbs中孵育。将细胞洗涤一次并然后在相同的缓冲液中与pe-缀合的山羊抗小鼠igg(h+l)抗体(1:200稀释;anwara)一起孵育。随后将细胞与抗pe微珠(miltenyibiotec)一起孵育,并经过midimacsls柱。洗脱保留在柱上的细胞并放回培养基进行抗生素选择。继续分选的轮次,直至获得均一阳性的表达人tlr4/md-2复合物和食蟹猴tlr4的细胞群体。
实施例215c1抗体的cdr随机化和细胞表面选择
人源化的抗tlr4抗体15c1(如美国专利申请号11/151,916,现在颁布为美国专利7,674,884中所述,本文显示为下面的seqidno:43和4)进行序列随机化以获得结合食蟹猴和/或人tlr4的抗体并能够中和lps诱导的tlr4介导的促炎性细胞因子产生的抗体。
>15c1vh氨基酸序列
>15c1vl氨基酸序列
将人源化15c1抗体的vh(seqidno:43)和vl(seqidno:4)区克隆入ravn等(nucleicacidsres.2010nov;38(21):e193)中描述的pnds载体。简而言之,使用5'的ncoi限制性位点和3'的xhoi限制性位点将vh区克隆入pelb前导肽序列的框架内。然后,使用在5'的sali限制性酶和在3'的noti限制性酶将vl区插入到接头序列的框架内,以形成编码在其c-末端部分融合到6xhis和c-myc标签和piii蛋白的15c1scfv的构建体。
然后将在重链(seqidno:44)或轻链(seqidno:48)的cdr3中的5个残基的延伸随机化以生成6个文库(文库大小范围从5x107至2x108)。生成的不同文库显示在下表3和表4中,其中x表示任意氨基酸。
表3.15c1cdrh3随机文库。
表4.15c1cdrl3随机文库。
使用这些文库进行5轮选择并使用scfv周质提取物对具有所希望的活性的变体进行筛选。简而言之,15c1修饰的scfv噬菌体文库(1012pfu)的等分试样用包含3%(w/v)脱脂乳的pbs在室温下在旋转混合器上封闭一小时。然后封闭的噬菌体在37℃/5%co2下在先前已用包含2%(w/v)脱脂乳的pbs封闭的cho细胞上(在t75培养瓶中80%汇合度)去选择(deselected)一小时。去选择的噬菌体然后在表达食蟹猴tlr4的cho细胞上在室温孵育3小时并温和摇动。然后用pbs将细胞洗涤十次。通过添加1ml的75mm柠檬酸洗脱结合的噬菌体,随后用280μltris-hclph9中和。然后将10ml指数生长的tg1添加到t75培养瓶中并在37℃孵育1小时并缓慢摇动。将感染的tg1的等分试样系列稀释以滴定选择输出。感染的tg1在3000rpm离心15分钟并重悬在0.5ml2xty-ag(包含100μg/ml氨苄青霉素和2%葡萄糖的2xty培养基)并涂布在2xtyag琼脂bioassay板上。在30℃孵育过夜后,将10ml2xtyag添加到板上,并且从表面刮下细胞并转移到50ml聚丙烯管中。将包含50%甘油的2xtyag添加到细胞悬浮液中以获得17%甘油的最终浓度。选择轮次的等分试样保持在-80℃。
实施例315c1scfv变体的筛选
构建和操作人scfv文库的一般方法描述于vaughan等,(nat.biotech.1996,14:309-314),通过引用以其整体并入本文。根据下列方法针对食蟹猴tlr4筛选15c1scfv变体的文库。
用于筛选的scfv周质制备物
在膜上表达食蟹猴tlr4的cho细胞上经过5轮选择后,将单克隆挑入每孔包含0.9ml的2xtyag培养基(0.1%葡萄糖)的深孔微量滴定板中并在37℃生长5-6h(250rpm)。然后添加每孔100μl在2xty培养基中0.2mm的iptg,以给出0.02mmiptg的终浓度。然后将板在30℃孵育过夜并以250rpm摇动。将深孔板以2500rpm离心10分钟并小心移除上清液。在150μltes缓冲液(50mmtris/hc1(ph8),1mmedta(ph8),20%蔗糖,补充有完全蛋白酶抑制剂,roche)中重悬沉淀。通过添加150μl稀释的tes缓冲液(1:5tes:水稀释)产生低渗休克并在冰上孵育30分钟。然后将板以4000rpm离心10分钟以去除细胞和碎片。然后将上清液小心转移到另一个微量滴定板中并保持在冰上用于在筛选测定中立即测试。
用于筛选的单克隆噬菌体制备物
将单克隆挑取到每孔包含150μl的2xtyag培养基(2%葡萄糖)微量滴定板中并在37℃(100-120rpm)生长5-6h。将m13k07辅助噬菌体添加到每孔以获得10的感染复数(即,培养基中的每个细胞10个噬菌体)并在37℃(100rpm)孵育1小时。生长后,板以3200rpm离心10分钟。小心去除上清液,将细胞重悬在150μl2xtyak培养基中并在30℃生长过夜(120rpm)。然后将板以3000rpm离心10分钟,并且然后通过peg沉淀浓缩包含噬菌体的上清液。简而言之,通过添加1/3体积的冷peg800020%,nacl2.5m到包含噬菌体的上清液中沉淀噬菌体。混合物在冰上孵育1h并然后在4℃以8000rpm离心15分钟。噬菌体沉淀重悬在500μlte缓冲液中。
scfv筛选
简而言之,在筛选测定前24小时,将cho-k1细胞和表达食蟹猴tlr4的稳定转染的cho-k1以每孔5000个细胞(在50μldmemf12,10%fcs,2mmgln中)的密度分配到fmat®384孔光学板(appliedbiosystems)中。在第0天,细胞与小体积的scfv周质制备物(每孔40μl)和10μl5-hisalexafluor647缀合物(1:200稀释,qiagen)混合。1-8小时的孵育期后,在8200细胞检测系统分析仪(appliedbiosystems)中测量细胞的荧光。保留结合表达食蟹猴tlr4的cho-k1而不结合野生型cho-k1细胞的scfv克隆并进行进一步的分析。所选的克隆是1a1、1a6、1b12、1c7、1c10、1c12、1d10、1e11和1g12。
结合食蟹猴和人tlr4的单克隆噬菌体
105个cho细胞或表达食蟹猴tlr4的cho细胞在磷酸缓冲盐水,2%牛血清白蛋白中与通过fmat选择的表达scfv(1a1、1a6、1b12、1c7、1c10、1c12、1d10、1e11、1g12)的不同浓度的沉淀的单克隆噬菌体一起孵育。作为对照,亲本15c1scfv也表达作为单克隆噬菌体用于结合测试。然后洗涤细胞并在相同的缓冲液中与单克隆抗体一起对m13、fd、f1丝状噬菌体-fitc(1:50,acrisantibodies)孵育。最终使用facscalibur流式细胞仪(bdbiosciences)分析细胞。图1显示在抗体染色后这些细胞的facs分析,其揭示1a1、1a6、1b12、1c7、1c10、1c12、1d10、1e11和1g12识别单独表达食蟹猴tlr4的细胞,与15c1相反,其不结合这些细胞。此外,这些结果表明所测试的scfv对食蟹猴tlr4蛋白是特异性的,因为它们不结合天然cho细胞。
类似地,105个cho细胞或表达人tlr4/md2复合物的cho细胞在磷酸缓冲盐水,2%牛血清白蛋白中与表达如上所述scfv的不同浓度的沉淀的单克隆噬菌体一起孵育。图2显示抗体染色后这些细胞的facs分析,其揭示1e11识别表达人tlr4/md2复合物的细胞,类似于15c1但不是1a1、1a6、1b12、1c7、1c10、1c12、1d10和1g12。这些结果表明1a1、1a6、1b12、1c7、1c10、1c12、1d10和1g12scfv对于食蟹猴tlr4是特异性的,并且1e11对人和食蟹猴tlr4是交叉反应性的。
实施例4将scfv转型(reformat)成igg形式和igg结合食蟹猴和人tlr4
转型,生产和纯化
用特异性寡核苷酸扩增所选的scfv(1a1、1a6、1b12、1c7、1c10、1c12、1d10、1e11、1g12)的vh和vl序列,在5'端引入前导肽序列。将扩增的vh和vl序列克隆入哺乳动物表达载体,分别与人igg1恒定和k恒定结构域在框架内。在转染入哺乳动物细胞之前通过测序验证构建体。
使用fugene6转染试剂(roche,basel,switzerland)将在它们适当的表达载体中的vh和vlcdna序列转染入哺乳动物细胞。简而言之,在6孔板中以每孔6x105细胞的浓度在2ml包含胎牛血清的培养基中培养peak细胞。使用fugene6转染试剂根据制造商的说明书将编码候选vh和vl序列的表达载体共转染入细胞。转染一天后,吸干培养基,并将3ml新鲜的无血清培养基添加到细胞并在37℃培养3天。经过三天的培养期后,收获上清液用于在蛋白g-sepharose4b快速流动柱(sigma,st.louis,mo)上根据制造商的说明书进行igg纯化。简而言之,来自转染的细胞的上清液与immunopure(g)igg结合缓冲液(pierce,rockfordil)在4℃孵育过夜。然后使样品经过蛋白g-sepharose4b快速流动柱并随后使用洗脱缓冲液纯化igg。洗脱的igg级分然后对pbs透析并且通过在280nm吸收对igg含量定量。通过sds-page验证纯度和igg完整度。
igg1转型的1e11抗体的核酸和氨基酸序列显示如下:
>1e11重链氨基酸序列
>1e11轻链氨基酸序列
>1e11轻链核酸序列
>1e11重链核酸序列
结合食蟹猴和人tlr4的单克隆抗体
105个cho细胞或表达食蟹猴tlr4的cho细胞在磷酸缓冲盐水,2%牛血清白蛋白中与通过fmat选择的不同浓度的纯化的抗体(1a1、1a6、1b12、1c7、1c10、1c12、1d10、1e11、1g12)一起孵育,用15c1作为对照。在磷酸缓冲盐水,2%牛血清白蛋白中洗涤细胞并在alexafluor®647山羊抗人igg(h+l)(1:200;invitrogen)中孵育。使用facscalibur流式细胞仪(bdbiosciences)分析细胞。图3显示在抗体染色后这些细胞的facs分析,其揭示1a1、1a6、1b12、1c7、1c10、1c12、1d10、1e11和1g12mab识别单独表达食蟹猴tlr4的细胞,与15c1相反,其不结合这些细胞。此外,这些结果证实这些抗体对tlr4蛋白是特异性的,因为它们不结合天然cho细胞。
用cho细胞和表达人tlr4/md2复合物的cho细胞进行类似实验。图4显示抗体染色后这些细胞的facs分析,其揭示1e11mab识别表达人tlr4/md2复合物的细胞,类似于15c1但是1a1、1a6、1b12、1c7、1c10、1c12、1d10和1g12mab不能结合人蛋白。1c12mab也能够结合人tlr4但相比1e11和15c1mab具有较低的效价。这些结果证实1e11和1c12是能够结合单独的或与md2复合的人和食蟹猴tlr4两者的交叉反应性单克隆抗体。这些结果还证实1a1、1a6、1b12、1c7、1c10、1d10和1g12是特异性的抗食蟹猴tlr4单克隆抗体。
实施例5抗tlr4抗体和tlr4之间互补位-表位特异性的分析
图5显示抗体互补位/tlr4表位潜在氨基酸接触(其确定抗体/tlr4特异性)的图解表示。人tlr4和食蟹猴tlr4在已知对于结合重要的区域仅具有一个不同氨基酸(参见irenedunne-siegrist等jbiolchem,2007nov30;282(48):34817-27)。有效地,人tlr4在位置349具有赖氨酸(带正电的氨基酸),而食蟹猴tlr4在此位置具有谷氨酸(带负电氨基酸)。这些结果表明在所选抗体的重链氨基酸103和tlr4的氨基酸349之间发生盐桥。此外,交叉反应性抗体(1e11和1c12)在位置103具有天冬酰胺或谷氨酰胺,其可以充当对谷氨酸的氢供体和对赖氨酸的氢受体。这些特异性氨基酸可以允许抗体对人和食蟹猴tlr4具有交叉反应性。
在1e11抗体中位置103进行定点诱变以引入n103d突变。然后如先前所述使用fugene6转染试剂(roche,basel,switzerland)将包含验证的1e11n103d的vh序列的载体与vl序列共转染入哺乳动物细胞。然后105cho细胞或表达食蟹猴tlr4的cho细胞在磷酸缓冲盐水,2%牛血清白蛋白中与不同浓度的纯化的抗体(1e11和1e11n103d)一起孵育。在磷酸缓冲盐水,2%牛血清白蛋白中洗涤细胞并在alexafluor®647山羊抗人igg(h+l)(1:200;invitrogen)中孵育并最终使用facscalibur流式细胞仪(bdbiosciences)分析细胞。图6显示进行抗体染色后的这些细胞的facs分析结果,其揭示1e11和1e11n103dmab均识别单独表达食蟹猴tlr4的细胞。但是1e11n103dmab对食蟹猴的结合相比1e11显著更低。类似地,105个cho细胞或表达人tlr4/md2复合物的cho细胞在磷酸缓冲盐水,2%牛血清白蛋白中与不同浓度的纯化的抗体(1e11和1e11n103d)一起孵育并然后通过facs监测抗体对这些细胞的结合。图7表示进行抗体染色后的这些细胞的facs分析,其揭示1e11和1e11n103dmab两者均识别表达人tlr4的细胞并具有相同的效价。总之,这些结果表明位置103对于1e11对人和食蟹猴tlr4的结合是关键的。更精确地,这些数据指示可以设计cdrh3基序以便引入抗tlr4抗体的物种交叉反应性。
表5抗tlr4抗体的交叉反应性
cdrh3基序=carkdsg[n,q,d][y,l]fpy(seqidno:54)
实施例6通过纯化的抗体对lps诱导的tlr4:nfκb下游信号传导级联的抑制。
将表达人tlr4/md2复合物的thp1-blue™-cd14细胞(invivogen)以105细胞/孔在30μlhek-blue检测培养基(invivogen)中接种96孔板。tlr4抗体在30μl培养基中稀释到合适的浓度并添加到细胞在37℃30分钟。然后将以10ng/ml稀释在30μl培养基中的lps添加到细胞,并置于37℃孵育24h。使用酶标仪在650nm测量吸收。图8显示通过所选mab(1e11、15c1、1c12和1g12)对lps诱导的tlr4下游信号传导级联的抑制结果。1e11显示lps诱导的tlr4信号传导的抑制效价与15c1相当。1c12显示相比1e11更低的抑制能力,并且1g12不影响lps诱导的人tlr4下游信号传导级联,证实其对于食蟹猴tlr4的特异性。
实施例71e11抗体的cdr随机化和细胞表面选择
交叉反应性1e11抗体序列(seqidno:40的重链序列和seqidno:41的轻链序列)与15c1具有相同的结合和阻断效价。此抗体进行序列随机化以便获得相比亲本抗体和15c1具有更高亲和力的结合人和食蟹猴tlr4并能够中和lps诱导的tlr4介导的促炎性细胞因子产生的抗体。
>1e11轻链氨基酸序列
>1e11重链氨基酸序列
>1e11轻链核酸序列
>1e11重链核酸序列
将1e11抗体的vh(seqidno:1)和vl(seqidno:2)区克隆入ravn等(nucleicacidsres.2010nov;38(21):e193)中描述的pnds载体。简而言之,使用5'的ncoi限制性位点和3'的xhoi限制性位点将vh区克隆入pelb前导肽序列的框架内。然后,使用在5'的sali限制性酶和在3'的noti限制性酶将vl区插入到接头序列的框架内,以形成编码在其c-末端部分融合到6xhis和c-myc标签和piii蛋白的15c1scfv的构建体。然后将在重链(seqidno:25)或轻链(seqidno:48)的cdrh1中的5个残基随机化以生成5个文库(文库大小范围从5x107至2x108)。生成的不同文库显示在下表6和表7中,其中x表示任意氨基酸。
表61e11cdrh1随机文库。
表71e11cdrl3随机文库。
使用这些文库进行5轮选择并使用scfv周质提取物对具有所希望的活性的变体进行筛选。简而言之,1e11修饰的scfv噬菌体文库(1012pfu)的等分试样用包含3%(w/v)脱脂乳的pbs在室温下在旋转混合器上封闭一小时。封闭的噬菌体然后在37℃/5%co2下在先前已用包含2%(w/v)脱脂乳的pbs封闭的cho细胞上(在t75培养瓶中80%汇合度)去选择(deselected)一小时。去选择的噬菌体然后与浓度递增的15c1抗体混合并在表达人tlr4的cho细胞上在室温孵育3小时并温和摇动。然后用pbs将细胞洗涤十次。通过添加1ml的75mm柠檬酸洗脱结合的噬菌体,随后用280μltris-hclph9中和。然后将10ml指数生长的tg1添加到t75培养瓶中并在37℃孵育1小时并缓慢摇动。将感染的tg1的等分试样系列稀释以滴定选择输出。感染的tg1在3000rpm离心15分钟并重悬在0.5ml2xty-ag(包含100μg/ml氨苄青霉素和2%葡萄糖的2xty培养基)并涂布在2xtyag琼脂bioassay板上。在30℃孵育过夜后,将10ml2xtyag添加到板上,并且从表面刮下细胞并转移到50ml聚丙烯管中。将包含50%甘油的2xtyag添加到细胞悬浮液中以获得17%甘油的最终浓度。选择轮次的等分试样保持在-80℃。在膜上表达人tlr4的cho细胞上与15c1竞争经过5轮选择后,将50个单克隆挑入每孔包含0.9ml的2xtyag培养基(0.1%葡萄糖)的深孔微量滴定板中并在37℃生长5-6h(250rpm)。然后纯化编码scfv的质粒并通过sanger测序进行分析。
实施例8亲和力成熟的1e11变体的鉴定。
在最后一轮选择后分离的克隆进行测序和分析。比对后,鉴定了cdrh1和cdrl3中共有的序列。然后选择具有特异性氨基酸共有序列的富集的scfv序列。1e11.c1、1e11.c2、1e11.c3、1e11.c4、1e11.c5和1e11.c6scfv具有特异性cdrh1序列。也鉴定了具有特异性cdrl3序列的1e11.e1、1e11.e2、1e11.e3、1e11.e4和1e11.e5scfv。用特异性寡核苷酸扩增所选的scfv的vh和vl序列,在5'端引入前导肽序列。将扩增的vh和vl序列克隆入哺乳动物表达载体,分别与人igg1恒定和k恒定结构域在框架内。在转染入哺乳动物细胞之前通过测序验证构建体。igg1转型的1e11.c1抗体的核酸和氨基酸序列显示如下:
>1e11.c1轻链氨基酸序列
>1e11.c1重链氨基酸序列
>1e11.c1轻链核酸序列
>1e11.c1重链核酸序列
使用fugene6转染试剂(roche,basel,switzerland)将在它们适当的表达载体中的vh和vlcdna序列转染入哺乳动物细胞。简而言之,在6孔板中以每孔6x105细胞的浓度在2ml包含胎牛血清的培养基中培养peak细胞。使用fugene6转染试剂根据制造商的说明书将编码候选vh和vl序列的表达载体共转染入细胞。转染一天后,吸干培养基,并将3ml新鲜的无血清培养基添加到细胞并在37℃培养3天。经过三天的培养期后,收获上清液用于在蛋白g-sepharose4b快速流动柱(sigma,st.louis,mo)上根据制造商的说明书进行igg纯化。简而言之,来自转染的细胞的上清液与immunopure(g)igg结合缓冲液(pierce,rockfordil)在4℃孵育过夜。然后使样品经过蛋白g-sepharose4b快速流动柱并随后使用洗脱缓冲液纯化igg。洗脱的igg级分然后对pbs透析并且通过在280nm吸收对igg含量定量。通过sds-page验证纯度和igg完整度。通过竞争性elisa评价1e11变体的相对结合效价。简而言之,15c1抗体在96孔maxisorp板中包被过夜并然后用pbs-bsa封闭。将15c1参考抗体和亲和力成熟的1e11变体以固定浓度添加到板中,并进行样品的3.5倍系列稀释。然后,将人tlr4/md2复合物的可溶性组氨酸标签形式以固定浓度添加到板中。在37℃孵育1小时后,洗涤板并分配5-his-hrp抗体溶液,此步骤随后是在37℃1小时的额外孵育时间。最终,洗涤板并添加tmb进行比色反应,由h2so4溶液终止酶促反应。根据在450nm的吸收确定结果。通过用参考ec50除以亲和力成熟的变体ec50计算相对结合效价(表8)。
所有选择的在它们的cdrh1具有突变的mab(1e11.c1、1e11.c2、1e11.c3、1e11.c4、1e11.c5、1e11.c6)对于结合人tlr4为阳性,相比亲本抗体15c1具有范围3-17倍增加的相对结合效价(图9和表8)。所选的在它们的cdrl3具有突变的mab(1e11.e1、1e11.e2、1e11.e3、1e11.e4和1e11.e5)对于结合人tlr4也为阳性,相比亲本抗体15c1具有范围2-5倍增加的相对结合效价(图10和表8)。
为了测试通过组合重和轻链变体的叠加的结合效果,选择具有修饰的cdrh1的1e11.c2变体,其具有最高的结合效价。此变体的重链与1e11.e1、1e11.e3、1e11.e4和1e11.e5的轻链(其在cdrl3中进行修饰)结合。将1e11.c2vh区和1e11.e1、1e11.e3、1e11.e4和1e11.e5的vl克隆入如上述的哺乳动物表达载体中。表达和纯化后,新的1e11变体称为1e11.c2e1、1e11.c2e3、1e11.c2e4和1e11.c2e5,通过竞争性elisa测试以确定它们的结合效价。
所有选择的mab(1e11.c2e1、1e11.c2e3、1e11.c2e4和1e11.c2e5)对于结合人tlr4为阳性,相比亲本抗体15c1具有范围29-40倍增加的结合效价(图11和表8)。
表8通过elisa确定的结合人tlr4的抗体ec50值和1e11亲和力成熟的变体的相对结合效价增加
还用食蟹猴tlr4进行结合测试。有意思的是,cdrh1(c1、c2、c3、c4、c5和c6)中的突变增加1e11修饰的抗体对食蟹猴tlr4的结合,但是cdrl3(el、e2、e3、e4和e5)中的突变降低或几乎消除抗体对此分子的结合(表9和图12)。
表9亲和力成熟的抗tlr4抗体的交叉反应性
因此,取决于其cdr组成并基于相对结合效价和tlr4交叉反应性有可能预测抗体结合特异性。
有效地,具有由cdr1序列gysitggys(seqidno:25)或具有共有序列g(fn)pi(r/g/w)(y/f/g)gys(seqidno:110)的cdr1;cdr2序列ihysgyt(seqidno:26);具有arkdsg(n/q/d/e)(x1)(x2)py(seqidno:111)的cdr3(其中x1和x2每个独立地是任何疏水氨基酸)构成的重链cdr,和由cdr1序列qsisdh(seqidno:37);cdr2序列yas(seqidno:38);和cdr3序列qqghsfplt(seqidno:39)构成的轻链cdr的抗体是人/食蟹猴tlr4交叉反应性的。
具有由具有共有序列g(f/y)pi(r/g/w)(y/f/g)gys(seqidno:110)的cdr1;cdr2序列ihysgyt(seqidno:26);具有arkdsg(n/q/d/e)(x1)(x2)py(seqidno:111)的cdr3(其中x1和x2每个独立地是任何疏水氨基酸)构成的重链cdr,和由cdr1序列qsisdh(seqidno:37);cdr2序列yas(seqidno:38);和cdr3序列qsisdh(seqidno:39)或具有共有序列qqg(y/n)(d/e)(f/y)pxt(seqidno:112)(其中x是任何疏水氨基酸)的cdr3构成的轻链cdr的抗体是人/食蟹猴tlr4交叉反应性的,相比15c1亲本抗体具有增加的对人tlr4的结合效价。
实施例9tlr4的lps激活的抑制
lps诱导的tlr4的激活导致nf-κb信号传导途径的激活。为了测试此信号传导途径的抑制,使用表达人tlr4/md2复合物的thp1-blue™-cd14细胞(invivogen),并用具有nfκb响应元件的报告基因稳定转染。在此测定中如早先所述测试tlr4抗体。图13显示通过所选mab(15c1和1e11.e2)对lps诱导的tlr4下游信号传导级联的抑制结果。有意思的是,尽管相比亲本15c1,1e11.e2的结合效价增加2倍,此抗体相比15c1不显示对lps诱导的tlr4信号传导的增加的抑制效价。
在体内,通过lps的tlr4激活导致由巨噬细胞产生il-6。为了测试1e11、1e11.c2和1e11.c2e3从体内到体外的效价,如先前所述产生这些抗体并在人和食蟹猴全血测定中测试。此实验包括测量当lps激活的tlr4被阻断时il-6产生的抑制。
简而言之,在等量的rpmi1640中稀释血液并分布在u底96孔板中。在rpmi1640中制备抗体稀释液(20µg/ml和305pg/ml之间的9个浓度,终浓度)并一式三份添加到血液中。1小时后,将lps(在rpmi0.1%fcs中0.25ng/ml终浓度)添加到孔中并在37℃和5%co2中孵育24h。孵育后,小心收获上清液并冷冻用于进一步的分析。根据与luminex200读板器一起使用的milliplex试剂盒的说明书测量上清液中il-6水平。获得原始数据并通过milliplex分析软件进行分析。
在人全血测定中,1e11.c2和1e11.c2e3的ic50分别是70ng/ml和50ng/ml。相比具有约220ng/ml的ic50的亲本抗体15c1,这些抗体在阻断人tlr4方面分别好3倍和5倍(图14)。对于1e11.c2有意思的是,在结合效价中的17倍增加转化为阻断效价中的3倍增加,而对于1e11.c2e3,结合效价中的40倍增加与阻断效价中的5倍增加相关联。
在食蟹猴中,用2个动物样品进行的全血测定,1e11.c2抗体阻断通过lps的tlr4激活,具有约500ng/ml的ic50(图15)。
其它实施方案
尽管已结合其详细说明对本发明进行了描述,前述说明意在举例说明并且不限制本发明的范围,其由所附权利要求的范围定义。其它方面、优点和修饰均在下列权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!