芬布芬体内代谢产物及衍生物作为糖尿病相关靶点调节剂的用途的制作方法
本发明属于生物医药领域,涉及芬布芬体内代谢产物及衍生物的用途,具体而言,涉及芬布芬体内代谢产物及衍生物或其药学上可接受的盐、酯、酰胺在制备糖尿病相关靶点调节剂中的应用,芬布芬体内代谢产物及衍生物或其药学上可接受的盐、酯、酰胺可作用于gpr受体,促进胰岛β细胞分泌胰岛素,还作用于ppar受体,促进葡萄糖的利用以及胰岛素的增敏。
背景技术:
糖尿病是一种能量代谢疾病,主要分为1型糖尿病(胰岛素依赖型糖尿病)和2型糖尿病(非-胰岛素依赖型糖尿病)。目前全球约有3.66亿糖尿病患者,占世界人口的6.4%,其中2型糖尿病患者约占糖尿病患者总数的90~95%。
糖尿病可以通过饮食调节和锻炼治疗。当这些不能缓解症状时,需要进行药物治疗。目前糖尿病的药物治疗方法包括:双胍类如二甲双胍,能够减少肝脏中葡萄糖的形成;磺酰脲类如格列本脲,能够刺激胰腺β细胞分泌更多的胰岛素;噻唑烷二酮类如吡格列酮,通过激活氧化物酶体增殖物激活受体γ(ppar-γ)增强胰岛素的生物效用;α-葡萄糖苷酶抑制剂如阿卡波糖,能够抑制肠道内葡萄糖的生成;胰高血糖素样肽-1(glp-1)类似物如利拉鲁肽,能够促进胰腺的β细胞分泌胰岛素;二肽基肽酶iv(dpp-iv)抑制剂如西格列汀,能够抑制体内glp-1的降解。但是,现有的治疗糖尿病的方法都有一定的缺陷。例如胰岛素注射剂和磺酰脲类,可能引起低血糖和体重增加副作用;二甲双胍类、α-葡萄糖苷酶抑制剂和glp-1类似物可能引起胃肠道副作用;ppar-γ激动剂可能引起体重增加和水肿副作用;dpp-iv抑制剂可能引起咽上部炎、头疼和感染副作用。针对多个领域的研究正在进行,以期为市场带来更有效的新型降血糖药物。
游离脂肪酸受体(ffar)是近几年去孤儿化的g蛋白偶联受体(gpcrs)。目前已确定的游离脂肪酸受体有g蛋白偶联受体40(gpr40)家族,包括gpr40(也称游离脂肪酸受体1,ffa1)、gpr41(也称也称游离脂肪酸受体3,ffa3)、gpr43(也称游离脂肪酸受体2,ffa2)以及其它家族的gpr84、gpr120。gpr40是在寻找新的促生长激素神经肽—甘丙肽受体(galr)亚型时发现的孤儿型gpcr,在胰腺β细胞和分泌胰岛素的细胞系中高度表达。gpr40能结合如软脂酸,硬脂酸,油酸,亚油酸和亚麻酸等血浆中的游离脂肪酸实现多种生理机能。例如长链游离脂肪酸与gpr40结合后激活gpr40,诱导细胞内钙离子水平升高,增强葡萄糖刺激的胰岛素的分泌(gsis)。gpr40调节剂还能发挥肠促胰岛素作用来促进gsis,此外也可与多种治疗糖尿病药物联合使用。基于以上,gpr40激动剂可治疗糖尿病以及相关适应症,尤其是2型糖尿病,肥胖胰岛素抵抗,葡萄糖耐受不良,以及其他适应症。以gpr受体为潜在的治疗靶点,发现和改造具有gpr受体激动活性的化合物以促进胰岛素分泌具有重要的研究价值和应用前景。
目前公开了一系列gpr40调节剂的专利申请,其中包括wo2004041266,wo2005087710,wo2005051890,wo2006083781,wo2007013689,wo2008066097,wo2009054390,wo2010085525等。
过氧化物酶体增殖剂激活受体(peroxisomeproliferators-activatedreceptors,ppars)是核激素受体家族中的配体激活受体,在不同的物种中已经发现了它的3种亚型,控制许多细胞内的代谢过程,属于配体诱导核受体。pparα在肝脏、骨骼肌、肾脏、心脏和血管壁中高度表达,在脂肪和软骨中的表达量相对较低。pparβ在体内广泛表达,在脑、胃、结肠内相对高水平表达。pparγ主要在脂肪细胞内表达,它是调节脂肪细胞分化的重要转录因子。pparγ被激活以后可以促进白脂肪细胞分化成众多的小脂肪细胞而降低了大脂肪细胞的数量。研究表明小的脂肪细胞相对于大细胞来说具有更高的胰岛素敏感度,从而能更好地利用葡萄糖。另外,近年来的分子生物学实验已经确定pparγ是胰岛素增敏剂噻唑烷二酮类药物(thiazolidinediones,tzds)作用的靶点。这类药物与pparγ结合以后可以激活该受体,从而调控一系列重要的生理过程。一方面激活的pparγ可以促进脂肪组织中某些与葡萄糖转运和利用相关基因的表达,如胰岛素受体,和葡萄糖转运子4(glut-4)等;另一方面可以抑制体内肿瘤坏死因子(tnfα)和肥胖蛋白(leptin)的分泌,减轻这两种蛋白产生的胰岛素抵抗,从而起到降低血糖的效果。可见pparγ的激活与葡萄糖的吸收和利用之间有着非常密切的联系,因此,pparγ调节剂已成为一类糖尿病治疗药物。
目前公开了一系列ppar调节剂的专利申请,其中包括wo2008143254、wo2002080936、wo2011059053、cn201310221364.8、cn201310130440.4、cn200780101081.2等,ppar介导的血糖调节机制已成为目前研究的热点。
芬布芬中文别名:苯布芬;联苯丁酮酸;苯酮酸;3-(4-联苯羰基)丙酸;3-(4-苯基苄基)丙酸;4-(联苯-4-基)-4-氧代丁酸等。英文名称:fenbufen。英文别名:gamma-oxo-[1,1'-biphenyl]-4-butanoicacid;gamma-oxo(1,1'-biphenyl)-butanoicacid;4-(4-biphenyl)-4-oxobutyricacid;4-(4-biphenylyl)-4-oxobutyricacid;3-(4-phenylbenzoyl)propionicacid;1’-biphenyl-4-butanoicacid;gamma-oxo-(3-(4-biphenylylcarbonyl)-propionicacid等。分子式:c16h14o3。分子量:254.28。cas:36330-85-5,其结构式如下:
芬布芬为长效非甾体消炎镇痛药。临床结果表明,芬布芬的消炎、镇痛作用比阿司匹林强,毒性比吲哚美辛小,胃肠道副作用小于阿司匹林及其他非甾体消炎镇痛药(slobodaae,tolmanel,osterbergac,etal.thepharmacologicalpropertiesoffenbufen.areview[j].arzneimittel-forschung,1980,30(4a):716-721)。
然而,到目前为止芬布芬体内代谢产物及衍生物或其药学上可接受的盐、酯、酰胺未用作糖尿病相关靶点调节剂,调节胰岛素分泌或增加胰岛素敏感性。
技术实现要素:
本发明的目的是提供药物芬布芬体内代谢产物及衍生物或其药学上可接受的盐、酯、酰胺的用途。
所述的芬布芬体内代谢产物及衍生物如通式(i)所示:
(i)
其中:
x不存在或存在时为o、s、se、
y不存在或存在时为o、s、se、
z不存在或存在时为o、s、se、
r为h、d等,但不限于举例范围;
r1~r4相同或不同,并各自为h、d、f、cl、br、oh、od、取代或未取代的c1-c6烷基、取代或未取代的c1-c6烷基-o-等,但不限于举例范围;
r5~r13相同或不同,并各自为h、d、f、cl、br、cn、cf3、oh、od、取代或未取代的c1-c6烷基、取代或未取代的c1-c6烷基-o-、取代或未取代的c1-c6烷基-co-、取代或未取代c1-c6烷基-s(o)n-、no2、nh2、nh(c1-c4烷基)、n(c1-c4烷基)2、conh2、conh(c1-c4烷基)、con(c1-c4烷基)2、取代或未取代的c3-c10碳环、含碳原子及1-4个选自n、o、s及s(o)n的杂原子的3至10元杂环基等,但不限于举例范围;
r14~r17相同或不同,并各自为h、d、f、cl、br、取代或未取代的c1-c6烷基、取代或未取代的c3-c10碳环等,但不限于举例范围;
r18~r19相同或不同,并各自为h、d、f、cl、br、oh、od、取代或未取代的c1-c6烷基、取代或未取代的c1-c6烷基-o-等,但不限于举例范围;
n在出现时为0、1或2;
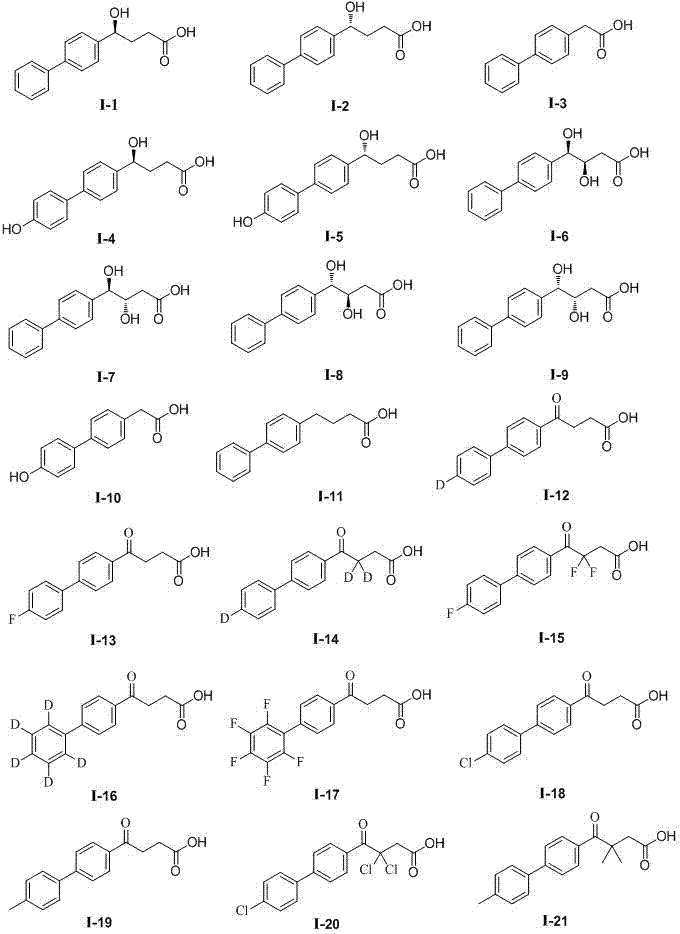
通式(i)所定义的芬布芬体内代谢产物及衍生物或其药学上可接受的盐、酯、酰胺,该化合物选自:
(s)-4-([1,1'-联苯]-4-)-4-羟基丁酸(i-1);
(r)-4-([1,1'-联苯]-4-)-4-羟基丁酸(i-2);
2-([1,1'-联苯]-4-)乙酸(i-3);
(s)-4-羟基-4-(4'-羟基-[1,1'-联苯]-4-)丁酸(i-4);
(r)-4-羟基-4-(4'-羟基-[1,1'-联苯]-4-)丁酸(i-5);
(3r,4r)-4-([1,1'-联苯]-4-)-3,4-二羟基丁酸(i-6);
(3s,4r)-4-([1,1'-联苯]-4-)-3,4-二羟基丁酸(i-7);
(3r,4s)-4-([1,1'-联苯]-4-)-3,4-二羟基丁酸(i-8);
(3s,4s)-4-([1,1'-联苯]-4-)-3,4-二羟基丁酸(i-9);
2-(4'-羟基-[1,1'-联苯]-4-)乙酸(i-10);
4-([1,1'-联苯]-4-)丁酸(i-11);
4-(4'-氘代-[1,1'-联苯]-4-)-4-氧代丁酸(i-12);
4-(4'-氟-[1,1'-联苯]-4-)-4-氧代丁酸(i-13);
3,3-二氘代-4-(4'-氘代-[1,1'-联苯]-4-)-4-氧代丁酸(i-14);
3,3-二氟-4-(4'-氟-[1,1'-联苯]-4-)-4-氧代丁酸(i-15);
4-氧代-4-(2',3',4',5',6'-五氘代-[1,1'-联苯]-4-)丁酸(i-16);
4-氧代-4-(2',3',4',5',6'-五氟-[1,1'-联苯]-4-)丁酸(i-17);
4-(4'-氯-[1,1'-联苯]-4-)-4-氧代丁酸(i-18);
4-(4'-甲基-[1,1'-联苯]-4-)-4-氧代丁酸(i-19);
3,3-二氯-4-(4'-氯-[1,1'-联苯]-4-)-4-氧代丁酸(i-20);
3,3-二甲基-4-(4'-甲基-[1,1'-联苯]-4-)-4-氧代丁酸(i-21)等;
化合物不限于举例范围。
本发明所提供的通式(i)所示的芬布芬体内代谢产物及衍生物的一个用途是:芬布芬体内代谢产物及衍生物或其药学上可接受的盐、酯、酰胺在制备预防或治疗与gpr受体功能相关状况的药物中的应用。
所述的gpr受体包括gpr40、gpr41、gpr43、gpr84、gpr119和gpr120等,但不限于举例范围。
本发明所提供的通式(i)所示的芬布芬体内代谢产物及衍生物的一个用途是:芬布芬或其药学上可接受的盐、酯或酰胺在制备预防或治疗与ppar受体功能相关状况的药物中的应用。
所述的ppar受体包括pparα、pparδ、pparγ等。
本发明所提供的通式(i)所示的芬布芬体内代谢产物及衍生物的一个用途是:芬布芬体内代谢产物及衍生物或其药学上可接受的盐、酯、酰胺在制备胰岛素调节剂药物中的用途。
本发明所提供的通式(i)所示的芬布芬体内代谢产物及衍生物的一个用途是:芬布芬体内代谢产物及衍生物或其药学上可接受的盐、酯、酰胺在制备促进组织对葡萄糖摄取和利用的药物中的用途。
本发明所提供的通式(i)所示的芬布芬体内代谢产物及衍生物的一个用途是:芬布芬体内代谢产物及衍生物或其药学上可接受的盐、酯、酰胺在制备胰岛素增敏剂药物中的用途。
所述的盐包括通式(i)所示的芬布芬体内代谢产物及衍生物形成的无机盐或有机盐。
所述的酯包括通式(i)所示的芬布芬体内代谢产物及衍生物与醇形成的酯。
所述的酰胺包括通式(i)所示的芬布芬体内代谢产物及衍生物与氨、伯胺、仲胺等形成的酰胺,包括甲胺、乙胺、丙胺、二甲胺、二乙胺、二丙胺、乙醇胺、二乙醇胺、环己胺等,但不限于举例范围
所述的无机盐包括通式(i)所示的芬布芬体内代谢产物及衍生物形成的li盐、na盐、k盐、mg盐、zn盐、ca盐、fe盐等,但不限于举例范围。
所述的有机盐包括通式(i)所示的芬布芬体内代谢产物及衍生物与有机碱形成的氨盐、伯胺盐、仲胺盐、叔胺盐、季胺盐,有机碱的优选实例,包括三甲胺、三乙胺、吡啶、甲基吡啶、2,6-二甲基吡啶、乙醇胺、二乙醇胺、三乙醇胺、环己胺、二环己基胺、n,n′-二苄基亚乙基二胺等,但不限于举例范围。
所述的酯包括通式(i)所示的芬布芬体内代谢产物及衍生物与c1-c30烷基醇、取代的c1-c30烷基醇、c3-c10碳环醇或取代的c3-c10碳环醇、多元醇(羟基数目大于等于2)等形成的酯,但不限于举例范围。
所述的相关状况是选自下述所成组群:认知疾患、骨质疏松、炎性疾患、糖尿病(sharman,bhagats,singhchundawatt.recentadvancesindevelopmentofgpr40modulators(ffa1/ffar1):anemergingtargetfortype2diabetes[j].minireviewsinmedicinalchemistry,2017,17(11):947-958;jonesrm,leonardjn,buzarddj,etal.gpr119agonistsforthetreatmentoftype2diabetes[j].expertopinionontherapeuticpatents,2009,19(10):1339-1359;cornalllm,mathaiml,hryciwdh,etal.gpr120agonismasacountermeasureagainstmetabolicdiseases[j].drugdiscoverytoday,2014,19(5):670-679)、肥胖(desprésjp,lemieuxi,almérasn.abdominalobesityandthemetabolicsyndrome[m]overweightandthemetabolicsyndrome.springerus,2006:137-152;seedorfu,assmanng.theroleofpparalphainobesity[j].nutrition,metabolism,andcardiovasculardiseases:nmcd,2001,11(3):189-194)、高血糖症、葡萄糖耐受不良、胰岛素阻抗、高血胰岛素症(hants,williamsk,sattarn,etal.analysisofobesityandhyperinsulinemiainthedevelopmentofmetabolicsyndrome:sanantonioheartstudy[j].obesity,2002,10(9):923-931)、高血胆固醇症、高血压、高血脂蛋白症、高血脂症、高血三酸甘油脂症、异常血脂症(charltonm.obesity,hyperlipidemia,andmetabolicsyndrome[j].livertransplantation,2009,15(s2))、脂肪肝(marchesinig,bugianesie,forlanig,etal.nonalcoholicfattyliver,steatohepatitis,andthemetabolicsyndrome[j].hepatology,2003,37(4):917-923)、代谢症候群、x症候群、心血管疾病(huangjv,greysoncr,schwartzgg.ppar-γasatherapeutictargetincardiovasculardisease:evidenceanduncertaintythematicreviewseries:newlipidandlipoproteintargetsforthetreatmentofcardiometabolicdiseases[j].journaloflipidresearch,2012,53(9):1738-1754)、动脉粥状硬化症、肾病、酮酸中毒(yootw,sungkc,shinhs,etal.relationshipbetweenserumuricacidconcentrationandinsulinresistanceandmetabolicsyndrome[j].circulationjournal,2005,69(8):928-933)、血栓疾患、肾病变、糖尿病性神经病变、糖尿病性视网膜病变、性功能异常、皮肤病变、消化不良、低血糖症、癌症及水肿;grundysm,cleemanji,danielssr,etal.diagnosisandmanagementofthemetabolicsyndrome[j].circulation,2005,112(17):2735-2752;grundysm,brewerhb,cleemanji,etal.definitionofmetabolicsyndrome[j].circulation,2004,109(3):433-438)等,但不限于举例范围。
所述的药物可通过口服、注射、喷射、滴鼻、滴眼、渗透、吸收、物理或化学介导的方法导入机体如肌肉、皮肉、皮下、静脉、粘膜组织、或是被其他物质混合或包裹后导入机体等,但不限于举例范围。
需要的时候,在上述药物中还可以加入一种或多种药学上可接受的载体。所述载体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂等,但不限于举例范围。
用芬布芬或其药学上可接受的盐、酯为活性成分制备的药物可以制成注射剂、片剂、粉剂、颗粒剂、胶囊、口服液、膏剂、霜剂等多种形式,但不限于举例范围。上述各种剂型的药物均可以按照药学领域的常规方法制备。
发明的详细说明
除非另有说明,否则说明书和权利要求书中的术语具有下述含义。
“c1-c4烷基”可以提及例如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基等,但不限于举例范围。
“c1-c6烷基”可以提及如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、新戊基、己基等,但不限于举例范围。
“c1-c30烷基”可以提及如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、新戊基、正己基、正庚基、正辛基、正壬基、正葵基等,但不限于举例范围。
“多元醇”可以为乙二醇、丙三醇、苯二酚、苯三酚、单糖、寡聚糖、多聚糖、多聚醇等,但不限于举例范围。
“c3-c10碳环”可以提及例如环丙烷、环丁烷、环戊烷、环己烷等饱和碳环;环丁烯、环戊烯、环己烯等不饱和碳环及苯环等芳香碳环,但不限于举例范围。
“杂环基”可以提及例如5-10元(单环、双环或三环)杂环基,构成杂环的原子除了含有碳原子外,还含有一种或两种选自n、s、o的1至4个杂原子,优选5-10元非芳香杂环或5-10元芳香杂环等。具体地,非芳香杂环,例如四氢呋喃、四氢吡喃、吡咯烷基、噁唑烷基、咪唑烷基、哌啶基、哌嗪基、吗啉基等;芳香杂环,例如噻吩基、呋喃基、吡啶基、噻唑基、嘧啶基、吡唑基、咪唑基等,但不限于举例范围。
“杂环”可以提及例如5-10元杂环,构成杂环的原子除了含有碳原子外,还含有一种或两种选自n、s、o的1至4个杂原子,优选5-10元非芳香杂环或5-10元芳香杂环等。具体地,非芳香杂环,例如四氢呋喃、四氢吡喃、吡咯烷基、噁唑烷基、咪唑烷基、哌啶基、哌嗪基、吗啉基等;芳香杂环,例如噻吩基、呋喃基、吡啶基、噻唑基、嘧啶基、吡唑基、咪唑基等,但不限于举例范围。
“取代的”指基团中的一个或多个氢原子,优选为最多5个,更优选为1至3个氢原子彼此独立地被相应数目的取代基取代。不言而喻,取代基仅处在它们的可能的化学位置,本领域技术人员能够在不付出过多努力的情况下确定(通过实验或理论)可能或不可能的取代。例如,具有游离氢的氨基或羟基与具有不饱和(如烯属)键的碳原子结合时可能是不稳定的。
附图说明
图1通式(i)所示的芬布芬体内代谢产物及衍生物的结构
具体实施例
以下生物学测试实施例描述解释本发明。
本发明测试例中具体条件的实验方法通常按常规条件或按照商品制造厂商所建议的条件。未注明具体来源的试剂,为市场购买的常用试剂。
测试例1:本发明中化合物的体内降糖活性可以通过使用如下所述的测定系统测定。
正常小鼠口服糖耐量表明gpr40抑制剂dc260126和pparγ抑制剂t0070907单独用药能部分抑制芬布芬体内代谢产物i-2的降血糖效果,gpr40抑制剂dc260126和pparγ抑制剂t0070907联合用药能完全抑制芬布芬体内代谢产物i-2的降血糖效果
正常小鼠口服糖耐量试验(ogtt):10周龄清洁级icr小鼠(青龙山动物实验中心,江苏南京),体重20~24g,雄性,随机分为5组,组1:空白对照组(空白溶媒:0.5%的羧甲基纤维素),组2:i-2(100mg/kg),组3:i-2(100mg/kg)联合dc260126组(10mg/kg),组4:i-2(100mg/kg)联合t0070907组(10mg/kg),组5:i-2(100mg/kg)联合dc260126(10mg/kg)和t0070907组(10mg/kg),每组8只,实验前小鼠禁食不禁水12小时,各组均口服灌胃给药,断尾取血,测定血糖值。然后5组小鼠分别灌胃给药,30min后测定血糖值记为0min,之后立即灌胃给予葡萄糖(2g/kg),并于15,30,60,120min测定血糖值。结果见表1。
表1:化合物对正常小鼠口服糖耐量的影响(±sd,n=8)
测试例2:本发明中化合物的体内降糖活性可以通过使用如下所述的测定系统测定。
糖尿病c57bl/6小鼠口服糖耐量表明gpr40抑制剂dc260126和pparγ抑制剂t0070907单独用药能部分抑制芬布芬体内代谢产物i-2的降血糖效果,gpr40抑制剂dc260126和pparγ抑制剂t0070907联合用药能完全抑制芬布芬体内代谢产物i-2的降血糖效果
糖尿病c57bl/6小鼠口服糖耐量试验(ogtt):糖尿病c57bl/6小鼠,体重30~36g,雄性,随机分为5组,组1:空白对照组(空白溶媒:0.5%的羧甲基纤维素),组2:i-2(100mg/kg),组3:i-2(100mg/kg)联合dc260126组(10mg/kg),组4:i-2(100mg/kg)联合t0070907组(10mg/kg),组5:i-2(100mg/kg)联合dc260126(10mg/kg)和t0070907组(10mg/kg),每组8只,实验前小鼠禁食不禁水12小时,各组均口服灌胃给药,断尾取血,测定血糖值。然后5组小鼠分别灌胃给药,30min后测定血糖值记为0min,之后立即灌胃给予葡萄糖(1.5g/kg),并于15,30,60,120min测定血糖值。结果见表2。
表2:化合物对糖尿病c57bl/6小鼠口服糖耐量的影响(±sd,n=8)
测试例3:本发明中化合物的体内降糖活性可以通过使用如下所述的测定系统测定。
正常小鼠口服糖耐量试验表明gpr40抑制剂dc260126和pparγ抑制剂t0070907单独用药能部分抑制芬布芬衍生物i-12的降血糖效果,gpr40抑制剂dc260126和pparγ抑制剂t0070907联合用药能完全抑制芬布芬体内代谢产物及衍生物i-12的降血糖效果
正常小鼠口服糖耐量试验(ogtt):10周龄清洁级icr小鼠(青龙山动物实验中心,江苏南京),体重20~24g,雄性,随机分为5组,组1:空白对照组(空白溶媒:0.5%的羧甲基纤维素),组2:i-12(100mg/kg),组3:i-12(100mg/kg)联合dc260126组(10mg/kg),组4:i-12(100mg/kg)联合t0070907组(10mg/kg),组5:i-12(100mg/kg)联合dc260126(10mg/kg)和t0070907组(10mg/kg),每组8只,实验前小鼠禁食不禁水12小时,各组均口服灌胃给药,断尾取血,测定血糖值。然后5组小鼠分别灌胃给药,30min后测定血糖值记为0min,之后立即灌胃给予葡萄糖(2g/kg),并于15,30,60,120min测定血糖值。结果见表3。
表3:化合物对正常小鼠口服糖耐量的影响(±sd,n=8)
测试例4:本发明中化合物的体内降糖活性可以通过使用如下所述的测定系统测定。
糖尿病c57bl/6小鼠口服糖耐量试验表明gpr40抑制剂dc260126和pparγ抑制剂t0070907单独用药能部分抑制芬布芬衍生物i-12的降血糖效果,gpr40抑制剂dc260126和pparγ抑制剂t0070907联合用药能完全抑制芬布芬体内代谢产物及衍生物i-12的降血糖效果
糖尿病c57bl/6小鼠口服糖耐量试验(ogtt):糖尿病c57bl/6小鼠,体重30~36g,雄性,随机分为5组,组1:空白对照组(空白溶媒:0.5%的羧甲基纤维素),组2:i-12(100mg/kg),组3:i-12(100mg/kg)联合dc260126组(10mg/kg),组4:i-12(100mg/kg)联合t0070907组(10mg/kg),组5:i-12(100mg/kg)联合dc260126(10mg/kg)和t0070907组(10mg/kg),每组8只,实验前小鼠禁食不禁水12小时,各组均口服灌胃给药,断尾取血,测定血糖值。然后5组小鼠分别灌胃给药,30min后测定血糖值记为0min,之后立即灌胃给予葡萄糖(2g/kg),并于15,30,60,120min测定血糖值。结果见表4。
表4:化合物对糖尿病c57bl/6小鼠口服糖耐量的影响(±sd,n=8)
- 还没有人留言评论。精彩留言会获得点赞!