CYP2D6*10基因多态性检测体系及其试剂盒的制作方法
本发明涉及一种检测cyp2d6*10基因多态性的方法和检测产品,属于生物
技术领域:
。
背景技术:
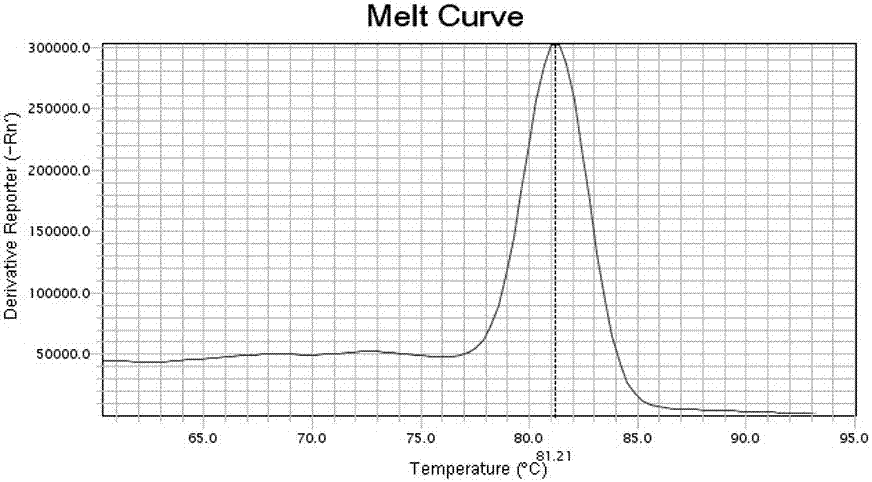
:异喹胍4’-羟化酶(cyp2d6)是细胞色素p450超家族(cytochromep450s,cyp)的第二亚家族中的重要成员。人群中cyp2d6的活性呈现强代谢者(em)、中间代谢者(im)、弱代谢者(pm)和超强代谢者(um)四态分布的现象。目前已发现cyp2d6有100多种突变基因,它的突变类型决定酶代谢活性。cyp2d6基因多态性决定了药物代谢强度的差异,并影响临床用药品种和剂量的选择。cyp2d6除参与代谢一些内源性物质和某些环境中毒性化合物外,还参与20-30%的临床常用药物的代谢,包括β受体阻滞剂、多种抗心律失常药、抗高血压药、抗抑郁、抗精神病药、镇痛药、镇咳药等。中国人群中cyp2d6最常见的导致酶活性降低的等位基因为cyp2d6*10,与野生型cyp2d6*1相比,其外显子1上发生100c>t的点突变,引起该酶第34位脯氨酸(p)被丝氨酸(s)所替代所致,导致im表型。目前主要采用一代测序、flp、等位基因特异的寡核苷酸杂交、等位基因特异的pcr和基因芯片等技术,但是操作过程繁琐,需要更换反应管而易发生污染,多需要电泳和多步后处理,影响检测结果的准确性。或仪器设备昂贵,难以大规模推广应用。因此,开发一种检测cyp2d6*10基因多态性的产品,以实现更高灵敏度、更低成本、更方便快捷的cyp2d6*10基因多态性检测是非常有必要的。技术实现要素:本发明要解决的技术问题是提供一种灵敏度和特异性高,样品需求量少,可以快速便捷准确地进行cyp2d6*10基因多态性检测的cyp2d6*10基因多态性检测体系及其试剂盒。本发明为解决上述技术问题提出的一种技术方案是:一种cyp2d6*10基因多态性检测体系,包括用于检测cyp2d6*10基因位点的上下游引物,荧光染料sybrgreeni,以及肽核酸;所述上游引物的核苷酸序列如seqidno.1所示,所述下游引物的核苷酸序列如seqidno.2所示;所述肽核酸的核苷酸序列与cyp2d6*1野生型基因位点完全互补且核苷酸序列如seqidno.3所示。上述上下游引物进行了lna修饰。上述上下游引物在反应体系中的最终浓度为0.1~0.3μm/l。上述上游引物在反应体系中的最终浓度为0.17μm/l,所述下游引物在反应体系中的最终浓度为0.25μm/l。上述肽核酸在反应体系中的最终浓度为1~1.5μm/l。上述肽核酸在反应体系中的最终浓度为1.25μm/l。本发明为解决上述技术问题提出的一种技术方案是:一种采用上述检测体系的cyp2d6*10基因多态性检测产品。本发明为解决上述技术问题提出的一种技术方案是:一种cyp2d6*10基因多态性检测试剂盒,包括pcr检测液和sybrgreeni混合液;所述pcr检测液包括用于检测cyp2d6*10基因位点的上游引物、下游引物和肽核酸;所述上游引物的核苷酸序列如seqidno.1所示,所述下游引物的核苷酸序列如seqidno.2所示,所述肽核酸的核苷酸序列与cyp2d6*1野生型基因位点完全互补且核苷酸序列如seqidno.3所示。上述上下游引物进行了lna修饰;所述上下游引物在反应体系中的最终浓度为0.1~0.3μm/l;所述肽核酸在反应体系中的最终浓度为1~1.5μm/l。上述cyp2d6*10基因多态性检测试剂盒还包括阳性对照a、阳性对照b和阴性对照;所述阳性对照液a是浓度为100ng/μl的包含cyp2d6*1基因位点的野生型质粒溶液;所述阳性对照液b是浓度为100ng/μl的包含cyp2d6*10基因位点的突变型质粒溶液;所述阴性对照液是不含cyp2d6基因的基因组dna溶液。本发明具有积极的效果:(1)本发明采用pna钳制实时定量pcr检测法,仅需1对引物和1条pna,通过熔解曲线分析,即可将cyp2d6*10基因突变型与野生型区分开。通过一步反应,可解决pcr扩增、突变富集及定量整个过程,无需诸如电泳、杂交、酶切等后续步骤,大大简化了实验过程,整个反应过程在密封管内完成,最大限度地减少了污染的可能,降低假阳性率。(2)本发明的cyp2d6*10基因多态性检测方法及其试剂盒,仅需一对引物和一条肽核酸便可同时检测cyp2d6*10纯合子突变和杂合子突变,灵敏度高。灵敏度可达到0.1%~0.5%,与常规pcr的浓度相比,本发明容易地检测出非常低浓度样本的cyp2d6*10位点的基因型,克服了taqman探针法需要使用特异性探针进行检测的缺点,满足大样本量临床筛查的要求。(3)本发明选择sybrgreeni作为荧光染料,价格低廉,大大降低检测成本。附图说明图1是采用实施例的试剂盒检测阳性对照a的野生型cyp2d6*1基因位点特异性产物峰tm值。图2是采用实施例的试剂盒检测阳性对照b的突变型cyp2d6*10基因位点特异性产物峰tm值。具体实施方式下面通过实施例对本发明进行具体的描述,有必要在此指出的是以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,该领域的技术人员可以根据上述本
发明内容对本发明作出一些非本质的改进和调整。下述实施例中,若非特意表明,所用的试剂均为分析纯,所用试剂均可从商业渠道获得。文中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著的科学出版社2002年出版的《分子克隆实验指南》一书中所述的条件,或按照制造商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。一、试剂盒的组成。本实施例的cyp2d6*10基因多态性检测试剂盒,包括pcr检测液、sybrgreeni混合液、阴性对照、阳性对照a和阳性对照b。试剂盒各成分如表1所示。表1试剂盒成分表成分分装组成pcr检测液1管cyp2d6*10位点引物、肽核酸sybrgreeni混合液1管——阳性对照a1管含野生型cyp2d6*1基因位点的质粒阳性对照b1管含突变型cyp2d6*10基因位点的质粒阴性对照1管不含cyp2d6*10基因的基因组dna溶液上述表1中试剂盒组分的说明如下:1)sybrgreeni混合液的主要成分包括dna聚合酶、超纯水、dntps混合液、sybrgreeni、缓冲液等(由bioer公司提供,货号:b255l1)。2)pcr检测液包括:用于检测cyp2d6*10基因位点的上下游引物和与野生型cyp2d6*1位点完全互补的肽核酸。本实施例对上下游引物进行了lna修饰。即在寡核苷酸链中引入一个lna碱基,并通过调整lna碱基在引物中的位置来调节最佳熔点(tm)和杂交的特异性。经过修饰后的引物具有更高的tm值,能够更好与突变模板结合,修饰后的实时定量pcr引物,长度较短,可以增加设计的灵活性。本实施例在pcr检测液中加入少量肽核酸(pna),不足以完全抑制野生型基因扩增,此时野生型的tm值无变化,扩增效率较未加入pna时明显降低,而对突变型基因扩增无影响,但其tm下降明显,二者的tm差值增大,此时可通过溶解曲线分析将两种类型的基因区分开。3)阳性对照液a是浓度为100ng/μl的含野生型cyp2d6*1基因位点质粒的溶液。4)阳性对照液b是浓度为100ng/μl的含突变型cyp2d6*10基因位点质粒的溶液。5)阴性对照液是不含cyp2d6*10基因的基因组dna溶液。野生型质粒的获取为野生型质粒常规构建步骤:设计位于突变位点两侧的引物,扩增含对应位点的野生型产物,构建入质粒,挑选并测序验证。突变型质粒的获取为纯合子突变质粒常规构建步骤:设计一条覆盖相应多态性位点并将等位碱基引入到引物序列中的特异引物,与相对应的上游或下游野生型引物配对,扩增含相应位点的目的片段产物,构建入质粒,挑选并测序验证。二、引物、肽核酸设计。本发明设计的引物长度为18~22bp,产物长度200~220bp.针对野生型序列的特异性肽核酸pna片段与其中cyp2d6*1基因位点序列完全互补,长度为15~20bp。如表2所示。表2引物肽核酸序列表位置检测类别seqno.sequence(5’—3’)cyp2d6*10上游引物1gtagtgaggcaggtatggcyp2d6*10下游引物2tgggcaacctgctgcatgtcyp2d6*10肽核酸3tgcacgctacycaccag引物和肽核酸由上海百力格生物技术有限公司合成,按照引物说明书由干粉稀释成工作母液,再由母液配置成检测工作液,引物和肽核酸混合液均由母液加入灭菌超纯水稀释而成。本发明中肽核酸pna在反应体系中的浓度至关重要,0.25~8.0μmol/l浓度范围内,当pna浓度低于3.75μmol/l时,野生型模板的熔解曲线上出现野生特异性扩增峰,表明野生型基因背景未完全抑制,此时无法判断是否存在突变基因;当pna浓度在3.75~4.0μmol/l时,突变型模板经pcr扩增后的熔解曲线可观察到突变峰,而野生型只有引物二聚体峰,即野生型模板完全被抑制无法扩增;随着pna浓度的增加,可观察到无论是野生型还是突变型模板的扩增效率均逐渐降低,当pna浓度高于引物40倍,达8.0μmol/l时,所有的模板均受抑制而无任何扩增峰存在。三试剂盒的使用方法。1、样本dna提取采用试剂盒(axygenmultisourcegenomicdnaminiprepkit)提取样本血液样本dna,或者采用康为世纪生物科技有限公司的口腔拭子基因组dna提取试剂盒(货号:cw0530s)抽提口腔黏膜样本dna,具体的操作参见试剂盒产品说明书。2、样本dna质量检测。获得样本dna后,通过thermo-fisher核酸蛋白定量仪(nanodrop2000)测定浓度和纯度,控制样本质量,最终加入反应体系中的样本。od260/od280的比值在1.8~2.0之间的可获得最优反应结果,浓度稀释为5~20ng/μl。3、pcr反应。采用本实施例的cyp2d6*10基因多态性检测试剂盒试进行检测,反应体系的体积为10μl,其中pcr检测液2μl,sybrgreeni混合液5μl,模板dna1μl,超纯水2μl。(反应体系的体积还可以是20μl,在配制时将10μl反应体系中的组分翻倍即可)。1)配制10μl的检测pcr反应体系:检测pcr反应体系:分别取2μlpcr检测液,5μlsybrgreeni混合液,2μl超纯水,1μl模板(如果是dna样本,浓度5~20ng/μl),并设置重复。反应体系中的模板分别指对应的样本dna,阳性对照,阴性对照。2)pcr反应程序。各反应体系在abi实时荧光定量pcr扩增仪(stepone)上进行实时荧光pcr反应,最优反应程序如表3所示。表3pcr反应程序表优选地,pcr扩增的条件为:预变性阶段的条件95℃,1min;循环1,40个循环,条件为95℃15s,70℃pna结合10s,引物退火及延伸温度60℃,时间为1min;;循环2条件为4℃保温。反应结束后立即进行溶解曲线分析:95℃持续15s,冷却至65℃保持1min,并以0.3℃/s的速度逐渐升温至95℃持续15s。仪器软件自动分析出ct值,即sybrgreeni检测荧光信号显著高于背景信号时的循环数。4、pcr结果判定。1)试剂盒有效性的判定。阳性对照a:阳性对照fam信号通道所有的扩增曲线有明显的指数增长期,且ct值均阳性≤30;溶解曲线分析,pcr产物的tm值为(89.1±0.5)℃。阳性对照b:阳性对照fam信号通道所有的扩增曲线有明显的指数增长期,且ct值均阳性≤30;溶解曲线分析,pcr产物的tm值为(81.2±0.6)℃。阴性对照:阴性对照fam信号通道所有的扩增曲线无明显的指数增长期,或溶解曲线上无特异性产物峰。2)多态性结果的判定。通过以上步骤,确定实验结果有效的前提下,再对样本的结果进行判定。按照样本溶解曲线tm值与野生型阳性对照溶解曲线tm值的差值对样本检测结果进行判读,确定样本基因型。a.若检测液检测的fam信号通道的扩增曲线有明显的指数增长期,且|tm(阳性a)-tm(样本)|≤5,产物峰tm值类似于图1所示,则检测样本为cyp2d6*1野生型基因位点。b.若检测液检测的fam信号通道的扩增曲线有明显的指数增长期,且|tm(阳性a)-tm(样本)|≥5,产物峰tm值类似于图2所示,则检测样本为cyp2d6*10突变型基因位点。显然,上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而这些属于本发明的精神所引伸出的显而易见的变化或变动仍处于本发明的保护范围之中。序列表<110>上海赛安生物医药科技股份有限公司<120>cyp2d6*10基因多态性检测体系及其试剂盒<130>无<160>3<170>siposequencelisting1.0<210>1<211>18<212>dna<213>人工序列(无)<400>1gtagtgaggcaggtatgg18<210>2<211>19<212>dna<213>人工序列(无)<400>2tgggcaacctgctgcatgt19<210>3<211>17<212>dna<213>人工序列(无)<400>3tgcacgctacycaccag17当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种基于HRM检测基因多态性的引物组合物的应用的制作方法与工艺
- MDR1基因多态性检测体系及其试剂盒的制作方法与工艺
- GSTP1基因多态性检测体系及其试剂盒的制作方法与工艺
- 一种检测MTHFR基因rs1801131多态位点基因型的方法及试剂盒与流程
- 检测10个位点耳聋基因多态性的SNaPshot试剂盒的制造方法与工艺
- 一种检测人类CYP2C19基因多态性的方法及试剂盒与流程
- CDA基因多态性检测体系及其试剂盒的制造方法与工艺
- 检测22个位点耳聋基因多态性的SNaPshot试剂的应用的制造方法与工艺
- 检测22个位点耳聋基因多态性的SNaPshot试剂盒的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺