一种吲哚化合物、其制备方法及应用与流程
本发明属于药物合成技术领域,涉及一种吲哚化合物、其制备方法及其在制药方面的应用。
背景技术:
吲哚分子骨架是天然产物和药物分子中广泛存在的分子片段,目前有很多方法用来合成吲哚类衍生物,例如经典的fisher吲哚合成法;正是由于吲哚的广泛存在性和独特的生理活性,通过反应将各类官能团引向吲哚分子,从而得到具有较高生物活性的吲哚化合物,是目前研究的热点。
炎症是由一种或者多种疾病引起的,对于炎症的治疗,早期人们多使用糖皮质激素类甾体抗炎药(steroiaanti-inflammatorydrugs,saids)。saids能有效控制感染性炎症和非感染性炎症,并能有效消除炎症造成的功能性障碍,但长期使用saids易引起肾上腺皮质的功能衰退等副作用。
20世纪50年代,随着曲非哇酸应用于临床,首次提出了非甾体抗炎药(non-steroiaanti-inflammatorydrugs,nsaids)。其后涌现出一大批具有优良抗炎镇痛作用的非甾体抗炎药,如目前广泛应用于临床的吲哚美辛、布洛芬等。nsaids应用于临床多年,其抗炎作用己被人们广泛认可,在美国用于临床的nsaids有18种,正在研究中的有100种以上,该类药物在医药产量中一直处于领先地位。nsaids具有良好的抗炎、解热和镇痛作用,已成为处方药和非处方药需求量最大的药物。尽管nsaids应用广泛,但是它的安全性一度受到严峻考验,尤其在药物性肝损伤的不良反应方面。
针对现有nsaids对肝脏方面的严重损伤,发掘低毒高效抗炎药物势在必行。一般认为可以食用的天然产物对人体的伤害相对化学合成的产物小,从可食用的天然产物中寻找低毒高效的化合物成为研究的热门。
美拉德反应是非酶褐变反应,广泛存在于自然界中。美拉德反应复杂,产物众多,很多产物具有抗炎、抗氧化、抗癌等多种生物学活性。由于美拉德反应生成的希夫碱不稳定,使美拉德反应更加复杂。
目前,由于大多数吲哚环的反应条件比较苛刻,反应试剂或催化剂昂贵,并且所得到的产物化学选择性和立体选择性比较差,阻止了这些方法的广泛应用。因此寻找一种反应试剂较容易获得,反应条件温和的制备具有抗炎作用的吲哚化合物的方法是一个研究热点。
技术实现要素:
(一)要解决的技术问题
为了解决现有技术的上述问题,本发明提供一种新型的吲哚化合物,该化合物具有抗炎作用,且对体外肝细胞的毒性低于常用药地塞米松。本发明还提供该吲哚化合物的制备方法及应用。
(二)技术方案
为了达到上述目的,本发明采用的主要技术方案包括:
一种吲哚化合物,其结构式如下所示
如上所述的吲哚化合物(i)的化学式为c29h32n4o7。
一种如上所述化合物的制备方法:将溶于溶剂的色氨酸与核糖混合,通过惰性气体保护下进行反应,之后在室温下加入还原剂进行还原反应,还原反应结束后,通过色谱分离纯化,得到淡黄色粉末状固体。
如上所述的溶剂为加酸或碱能使核糖和色氨酸溶解的溶液。如氢氧化钠、氢氧化钾溶液、甲酸等溶液或加碱或酸的有机溶液。
进一步地,所述加碱的有机溶液可为氢氧化钾或氢氧化钠中的一种或者两种溶于醇的溶液等。
如上所述的制备方法,优选地,所述色氨酸与核糖的用量比为摩尔比1~5:5~1。
如上所述的制备方法,优选地,所述还原剂为硼氢化钾或硼氢化钠。
如上所述的制备方法,优选地,所述还原剂与所述色氨酸的摩尔比为1~6:1,所述还原反应的时间为12~48h。
其中,所述还原剂与所述色氨酸的摩尔比为1~6:1,就是说还原剂的用量为色氨酸的摩尔数的1~6倍。
如上所述化合物的制备方法,还可通过加入乙二醛,再在通过惰性气体保护下进行反应,这样能有效提高产率。
如上所述的制备方法,优选地,所述惰性气体保护下进行反应为在温度为45~70℃,进行搅拌反应,搅拌时间为1~20h,搅拌速率为300~1000rpm。
如上所述的制备方法,优选地,所述还原反应结束后,先采用透析袋为100da或200da进行透析,当透析袋中的透析液电导率小于10μs时,结束透析,之后萃取。
进一步地,萃取后,蒸干萃取液,加水溶解,再进行色谱分离纯化。
如上所述的制备方法,优选地,所述色谱分离纯化中可采用c18柱分离纯化,其中,所述色谱的液相条件为:
流动相a:体积比为0.05%~0.3%的甲酸水或乙酸水;
流动相b:纯甲醇或乙腈;
流速:6~20ml/min;
洗脱条件为0-5min,80~90%的流动相a:20~10%的流动相b;6-25min,从80~90%的流动相a:20~10%的流动相b到20~10%的流动相a:80~90%的流动相b;26-30min,20~10%的流动相a:80~90%的流动相b;31-35min,0%的流动相a:100%的流动相b;36-38min,80~90%的流动相a:20~10%的流动相b,收集分子量为549的峰;
收集到的样品采用所述流动相b占与所述流动相a和流动相b的体积比为30~70%的色谱中进行等度洗脱,收集洗脱后的样品进行浓缩、冻干得到淡黄色粉末状固体。
本发明还包括一种如上所述的吲哚化合物(i)的药学上可接受的盐或其衍生物。
对于药学上可接受的(即生理上可接受的无毒)盐,例如,所述的吲哚化合物(i)的盐可以如下形成:使化合物(i)与一定量的酸或碱在介质中(如盐在其中沉淀的介质)反应,或者在水性介质中反应,然后冷冻干燥。文献中论述了通常认为适于与碱性或酸性药物化合物形成药用盐的酸和碱,例如bergeetal,journalofpharmacruticalsciences.66,1-19,1977论述了药学上可接受的盐。在一个实施方案中,酸加成盐选自盐酸盐,氢溴酸盐,氢碘酸盐,硫酸盐,硫酸氢盐,硝酸盐,磷酸盐,磷酸氢盐,乙酸盐,苯甲酸盐,琥珀酸盐,糖酸盐(saccharate),富马酸盐,马来酸盐,乳酸盐,柠檬酸盐,酒石酸盐,葡糖酸盐,右旋樟脑磺酸盐,甲磺酸盐,乙磺酸盐,苯磺酸盐,对甲苯磺酸盐和双羟萘酸盐。在一个实施方案中,碱加成盐包括金属盐(如钠,钾,铝,钙,镁和锌盐)和铵盐(如异丙胺,二乙胺,二乙醇胺盐)。其它的盐(如三氟乙酸盐和草酸盐)可以用于制备式(i)化合物及其药学上可接受的盐,也包含在本发明的范围之内。酸和碱加成盐可以由本领域技术人员通过在适当的溶剂中以适当的酸或碱处理化合物(i),然后结晶和过滤、冷冻干燥来制备。
进一步地,所述吲哚化合物(i)的吲哚环上的取代基团被h、cl、br、f或-och3等基团取代后形成的衍生物。
本发明还包括一种抗炎或消炎的药物,其活性成分包含如上所述的吲哚化合物(i)、上述化合物的各种晶型、衍生物或其药学上可接受的盐和一种或多种药学上可接受的载体进行混合,制成抗炎或消炎药物。
如上所述药学上可接受的载体是指药学领域常规的药物载体,例如:稀释剂、赋形剂如水等,填充剂如淀粉、蔗糖等;黏合剂如纤维素、藻酸盐、明胶和聚乙烯吡咯烷酮;湿润剂如甘油等;崩解剂如琼脂、碳酸钙和碳酸氢钠;吸收促进剂如季铵化合物;表面活性剂如十六烷醇;吸附载体如高岭土和皂黏土;润滑剂如滑石粉、硬脂酸钙和镁、聚乙二醇等,另外还可加入其它辅剂如香味剂、甜味剂等。
上述的抗炎或消炎的药物,所述药物可制成各种剂型,包括注射剂、囊剂、片剂、丸剂、散剂或颗粒剂。
(三)有益效果
本发明的有益效果是:
本发明提供的具有很好抗炎活性的新的吲哚化合物(i),是首次报道,具有抗炎作用,且对体外肝细胞的毒性低于常用药地塞米松。其制备方法简单,反应试剂易得,反应条件温和。获得的吲哚化合物在体外细胞实验中可以显著降低炎症因子水平,具有较好的抗炎活性;对人体正常细胞lo2的毒性较地塞米松小。其吲哚化合物(i)对脂多糖(lps)引起的小鼠胸腔巨噬细胞(raw264.7)的炎症因子有明显的降低作用,抗炎效果好,可用于制备抗炎或消炎的药物。
附图说明
图1为制备分离纯化结果图,其中a为实施例1中的分离纯化结果图,b为实施例2中的分离纯化结果图;
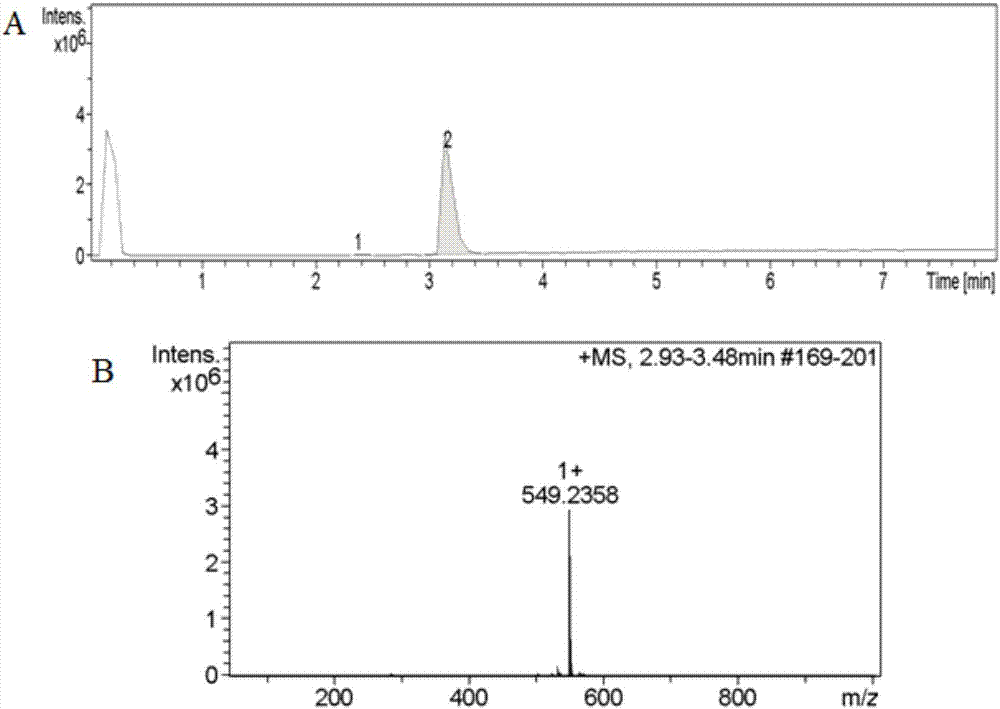
图2为化合物i的液质图谱,其中,a为液相图,b为质谱图;
图3为化合物i的核磁图谱,其中,a为1h-nmr,b为13c-nmr;
图4为对细胞的毒性试验结果,其中,a为对lo2细胞的存活率,b为对巨噬细胞的存活率;
图5为对巨噬细胞分泌细胞因子的影响结果,其中,a为分泌no的浓度,b为分泌il-6的浓度,c为分泌tnf-α的浓度。
具体实施方式
本发明利用色氨酸和核糖的美拉德反应,通过还原美拉德产物,使反应产物由c=n还原为c-n,使产物稳定,得到一种具有较高抗炎活性对肝细胞毒性较低的吲哚化合物(i)。本发明中采用可溶于溶剂的色氨酸与核糖进行反应,其中溶剂为加酸或碱能使核糖和色氨酸溶解的溶液,如氢氧化钠溶液、氢氧化钾溶液、甲酸等溶液;或加酸或碱的有机溶剂,进一步地,可采用加碱的醇溶液就是将碱(如氢氧化钾或氢氧化钠的一种或者两种)溶于醇溶液中,其中,所述碱的用量为可以溶解色氨酸的质量,可以适当提高一点。其中的色氨酸和核糖可以先分别溶解然后混合在一起,也可以混合在一起再进行溶解,反应条件为在惰性气体如氮气等保护下进行,本发明中采用的加热搅拌的温度为45~70℃,用于充分反应。用透析袋透析是为了充分除去盐离子,便于后续色谱柱或柱层析分离纯化,萃取使获得的物质进一步纯化。
美拉德反应也称羰氨反应,是一种广泛存在于食品加工中的非酶促褐变反应,美拉德反应复杂,产物众多,具有独特的生理活性。色氨酸是含有吲哚环的氨基酸,是人体必需的氨基酸之一,在生物体内具有重要的生理功能。d-核糖是重要的五碳醛糖,也是重要的药物中间体,用于多种核酸类药物的生产。核糖的性质更加活泼,更容易进行美拉德反应,生成有活性的物质,糖分子骨架碳原子数目越少,反应越迅速。核糖和色氨酸发生羰氨缩合生成希夫碱,希夫碱含有碳氮双键,结构不稳定。本发明通过加入硼氢化钾或硼氢化钠还原碳氮双键,生成较为稳定的碳氮单键,使具有活性的反应产物更加稳定。
进一步地,为了增加反应物的产量,可在色氨酸与核糖的反应中加入乙二醛,不仅加快了反应速度,还能提高产物的含量。最优选的,当色氨酸:核糖:乙二醛的摩尔数用量比为2:1:1,产量可实现最大化。
为了更好的解释本发明,以便于理解,下面结合附图,通过具体实施方式,对本发明作详细描述。
实施例1:新型吲哚化合物的制备
10mmol(2.04g)色氨酸溶于15ml甲醇中,滴入含有0.58克koh的10ml无水甲醇碱溶液,搅拌使色氨酸溶解;加入10mmol(1.5g)溶于15ml无水甲醇的核糖,在惰性气氛氮气保护下,65℃下500rpm磁力搅拌反应2h后,在室温下加入30mmol(1.62g)硼氢化钾,反应24h。结束后蒸干甲醇,加入去离子水后用盐酸调ph到7.0,过滤,过滤用于除去沉淀、杂质,滤液用200da的透析袋透析,采用电导笔测得电导率小于10μs时,停止透析,之后加入正丁醇进行萃取。取上层的正丁醇萃取液进行蒸干后,加60ml蒸馏水溶解,过0.22μm膜,滤液用制备色谱分离制备目标样品,流动相为0.15%的甲酸水(a)和甲醇(b)。制备收集得到样品浓缩冻干,得到目标产物记为化合物ⅰ。
其中,在用制备色谱分离制备目标样品的步骤中,制备色谱为watersprep150,柱子为waterssunfiretmprepc18obdtm5μm19*250mmcolumn,色谱液相条件为流动相a:0.15%甲酸水,流动相b:纯甲醇;流速:10ml/min。
洗脱方法:0-5min,85%体积a:15%体积b;6-25min,从85%体积a:15%体积b到15%体积a:85%体积b;26-30min,15%体积a:85%体积b;31-35min,0%体积a:100%体积b;36-38min,85%体积a:15%体积b。收集25.0-25.5min之间的分子量为549(+)的物质的峰,如图1a所示。其中,分子量549(+)是表示实际分子量应该是548,但是在质谱中会有离子吸附,所以要比实际的分子量大1,收集分子量为549(+)的峰。
收集到的样品采用30%的体积流动相a:70%体积的流动相b进行等度洗脱,即进行二次分离纯化,也就是说,将收集到的样品进行第二次制备色谱的分离纯化,进一步去除杂质,流动相仍然采用流动相a:0.15%甲酸水,流动相b:纯甲醇;洗脱方法采用一直为30%的体积流动相a:70%体积的流动相b进行洗脱。收集洗脱后的样品后减压蒸馏浓缩,冷冻干燥得到淡黄色粉末状固体,即为产物化合物ⅰ,其中,冷冻干燥可采用christalpha2-4冻干机。
经过大量实验证明,当进行二次液相洗脱纯化时,采用流动相a与流动相b的体积比为70~30%:30~70%进行等度洗脱,都可有效去除杂质,即洗脱时一直采用30~70%体积流动相a:70~30%流动相体积b进行洗脱,其中,a+b=100%,也就是说采用流动相b占流动相a和流动相b的体积比为30~70%的制备色谱中进行等度洗脱。
实施例2:吲哚化合物的制备
20mmol色氨酸和10mmol核糖溶于45ml甲醇中,滴入含有1.16克koh的20ml无水甲醇,在惰性气氛氮气保护下,60℃,800rpm磁力搅拌反应4h,室温下加入1.62g硼氢化钠反应24h。结束后蒸干甲醇,加入去离子水后用盐酸调ph到7.0,过滤,除去沉淀,滤液用100da的透析袋透析24h,采用电导笔测得电导率小于10μs停止透析,之后用正丁醇萃取。将萃取液正丁醇溶液蒸干后加70ml蒸馏水溶解,过0.22μm膜,用制备色谱分离柱制备目标样品,流动相为0.1%的乙酸水(a)和甲醇(b)。制备收集得到样品浓缩冻干,得到目标产物化合物ⅰ。
其中,制备色谱为smartsep-1000,制备柱是研创generallgc1852520(5μm20*250mm),色谱液相条件为流动相a:体积比为0.1%的乙酸水,流动相b:纯甲醇;流速:20ml/min。
洗脱方法:0-5min,85%体积a:15%体积b;6-25min,从85%体积a:15%体积b到15%体积a:85%体积b;25-30min,15%体积a:85%体积b;31-35min,0%体积a:100%体积b;36-40min,85%体积a:15%体积b。收集分子量为549(+)的物质的峰,其出峰时间为22.691min,如图1b所示。
收集到的样品采用70%流动相a:30%流动相b的制备色谱进行等度洗脱即进行二次制备色谱分离纯化,收集样品浓缩、冷冻干燥得到淡黄色粉末状固体。
当流动相b采用乙腈时,也可分离纯化获得化合物(i)。
实施例3:吲哚衍生物的结构鉴定
(1)将实施例1制备得到的浓缩冻干后的目标产物化合物ⅰ溶于水中(1mg/ml),使用高效液相色谱对其进行检测。
高分辨质谱仪:agilent1290/maxisimpact机型,检测条件为:色谱柱:sb-c18反相色谱柱,rrhd1.8μm2.1×50mm;柱温:25℃。检测条件为:离子源:esi+;毛细管电压:3.5kv;锥孔电压:2kv;质荷比扫描范围:0~1000m/z。检测波长:220nm;流动相a:0.1%甲酸水,流动相b:纯甲醇;流速:0.2ml/min;洗脱条件为0-1min,85%体积a:15%体积b;2-3min,从85%体积a:15%体积b到15%体积a:85%体积b;4-8min,15%体积a:85%体积b;9-10min,85%体积a:15%体积b。
按照以上高效液相色谱的方法配制样品和流动相,进样后,样品经sb-c18反相色谱柱分离后,样品中物质按照极性从强到弱的次序依次进入高分辨质谱仪内,经电喷雾离子化后电离,带电粒子进入离子肼质量分析器,检测带电粒子。液质图谱如图2所示。
根据高分辨率质谱得到该化合物ⅰ的ms(ei):549.59(+),则其实际分子量应为548.59,推断出分子式为:c29h32n4o7。
(2)采用brukeravanceiiihd600核磁共振仪鉴定物质结构,将样品溶于氘代甲醇,分别用1h/13c-nmr进行检测,检测结果如图3所示,其中a为核磁共振氢谱(1h-nmr),b为核磁共振碳谱(13c-nmr)。
esi-msm/z:549[m+h]+;1hnmr(600mhz,cd3od)7.52(2h,t,j=7.8),7.34(1h,d,j=8.2),7.29(1h,d,j=8.2,7.13(1h,t,j=7.0),7.06(2h,m),6.96(2h,m),5.32(1h,s),4.27(1h,m),4.19(2h,m),3.86(1h,t,j=7.1),3.71-3.53(4h,m),3.40(2h,m),3.32(1h,m),3.19(2h,m),3.05(1h,m)ppm.;
13cnmr(150mhz,cd3od);δ:177.17,171.53,138.66,137.85,128.59,128.53,127.85,124.37,123.31,122.38,120.65,119.75,119.32,119.01,112.76,112.30,111.58,108.54,75.47,74.60,67.64,66.27,64.23,59.48,57.55,43.67,41.62,27.25ppm.。即获得化合物ⅰ的化学结构为:
其化学名称为2-(1-羧基-2-(1h-吲哚-3-基)乙基)-1-(1,2,3-三羟基丙基)-1,2,3,4,6,7,12,12b-八氢吡嗪并[1',2':1,2]吡啶并[3,4-b]吲哚-6-羧酸,其属于非甾体药物。
实施例4:本发明化合物的抗炎活性
1.1细胞系及试剂
人正常肝细胞lo2购于北京北纳创联生物技术研究院,小鼠胸腔巨噬细胞(raw264.7)来自广州中医药大学,细胞培养条件:采用含有10%胎牛血清(fbs)的gibco高糖dmem完全培养基置于37℃,5%co2培养箱内培养。
1.2吲哚化合物ⅰ对lo2和巨噬细胞生长的影响
lo2细胞经pbs洗涤计数后种100μl于96孔板(1×105个/ml),raw264.7细胞经过计数后种100μl于96孔板(1×105个/ml)。lo2细胞中分别加入25、50和100μg/ml的吲哚化合物ⅰ及相同浓度的地塞米松(dxm),raw264.7细胞加入25、50和100μg/ml的吲哚化产物化合物ⅰ,以50μg/ml的地塞米松(dxm)作为阳性对照,37℃5%co2培养箱内孵育24小时后去掉上清液,加入100μldmem培养液和10μlmts溶液,继续孵育4h,用瑞士帝肯酶标仪(infinitem200pro,tecan)于490nm检测细胞活力。细胞活力按下式计算:存活率=(实验组平均吸光值/空白组平均吸光值)×100%。
结果如图4a所示,为25μg/ml、50μg/ml及100μg/ml的化合物ⅰ对lo2细胞的存活率为100%,结果表明化合物ⅰ在100μg/ml及以下对人正常干细胞没有毒害作用,而50μg/ml的dxm对lo2细胞都有一定的毒害作用,100μg/ml的dxm处理过的lo2细胞只有60%的存活率。lo2细胞实验结果表明化合物ⅰ对人正常肝脏细胞的毒性作用小于常用消炎药地塞米松。
巨噬细胞(raw264.7细胞)加化合物ⅰ处理后对细胞活力的影响,结果如图4b所示,说明raw264.7细胞加化合物ⅰ处理后,没有降低细胞活力,所以,后续实验化合物ⅰ的浓度不超过100μg/ml。
1.3化合物ⅰ对巨噬细胞分泌no的影响
小鼠胸腔巨噬细胞(raw264.7细胞)经计数后接种于96孔板中,每孔细胞数约为1×105个,细胞悬液每孔为100μl。铺板12h后,加入用含有2μg/ml脂多糖(lps)的dmem培养基稀释不同浓度(25、50和100μg/ml)的吲哚化合物ⅰ100μl,干预24h后,收集上清液于1.5ml的ep管中,-20℃冰箱保存备用。用含有2μg/ml脂多糖(lps)的dmem培养基100μl为对照,记为lps,dmem培养基100μl作为空白,含有2μg/ml脂多糖(lps)的不同浓度(25,50和100μg/ml)的dxm作为阳性对照,对小鼠胸腔巨噬细胞(raw264.7细胞)进行同样的处理。按照no检测试剂盒(上海碧云天生物技术有限公司)的说明进行操作:根据标准曲线中的no含量计算样品中的no含量。
结果如图5a所示,结果表明,加入化合物ⅰ处理后的raw264.7细胞分泌的no含量随着化合物ⅰ浓度升高而下降,说明化合物ⅰ具有较好抑制no因子效果,25μg/ml化合物ⅰ抑制no因子分泌的效果作用甚至远远大于100μg/ml的dxm。
1.4吲哚化合物ⅰ对巨噬细胞分泌细胞因子il-6和tnf-α的影响
采用不同浓度的吲哚化合物ⅰ对raw264.7细胞的处理实验步骤方法同1.3中,收集上清液采用欣博盛生物公司elisa-kit,进行白细胞介素-6(il-6)和肿瘤坏死因子(tnf-α)的测定,检测方法步骤按试剂盒说明书进行操作。
测得的il-6浓度如图5b所示,tnf-α浓度如图5c所示,图中不同字母代表显著性差异(p<0.05)。
结果表明,加入化合物ⅰ处理后的raw264.7细胞分泌的il-6含量随着化合物ⅰ浓度升高而下降,说明化合物ⅰ具有较好的抑制il-6因子效果,与no效果相似,25μg/ml抑制no因子分泌的效果甚至远远大于100μg/ml的dxm。
加入化合物ⅰ处理后的raw264.7细胞分泌的tnf-α含量随着化合物ⅰ浓度升高而下降,效果与同浓度的dxm差不多,说明化合物ⅰ具有抑制tnf-α因子的效果。
实施例5制剂
1、片剂:按照本领域已知的方法制备片剂,每片含有下述成分:本发明的吲哚化合物i50mg、乳糖70mg、硬脂酸镁4mg和聚乙烯吡咯烷酮6mg,合计130mg。如果需要,片剂可用羟丙基甲基纤维素、滑石和着色剂进行膜包覆。
2、胶囊:按照本领域已知的方法制备胶囊,每个胶囊含有下述成分:本发明的吲哚化合物i50mg、乳糖75mg、玉米淀粉20mg、硬脂酸镁2mg和聚乙烯吡咯烷酮3mg,合计150mg。
注射剂、丸剂、散剂或颗粒剂等按照本领域已知的方法添加吲哚化合物i及辅料进行制备。
以上所述,仅是本发明的较佳实施例而已,并非是对本发明做其它形式的限制,任何本领域技术人员可以利用上述公开的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!