一种茶树叶肉原生质体的分离与纯化方法与流程
本发明涉及一种分离与纯化方法,更具体的说涉及一种茶树叶肉原生质体的分离与纯化方法,属于植物原生质体技术领域。
背景技术:
茶树(camelliasinensisl.)是我国重要的叶用木本经济作物,也是世界三大无酒精饮料之一的资源植物。由于茶叶富含儿茶素、咖啡碱和茶氨酸等多种有价值的特征性次生代谢产物,茶树分子生物学研究日趋深入,伴之大量功能基因被纷纷鉴定与克隆。然而,由于茶树遗传转化体系的建立一直难以真正突破,模式植物拟南芥、烟草中又缺少一些茶树特有物质的代谢通路,因此功能基因的研究明显滞后。近年来,原生质体瞬时表达系统在蛋白亚细胞定位、蛋白相互作用、基因表达调控及亚细胞器制备等研究方面得到了广泛应用;因而,原生质体瞬时表达系统可能是茶树功能基因研究的另一个重要突破口。
原生质体瞬时表达系统建立的前提是高得率、高活力原生质体的分离和纯化。目前,以茶树花瓣为材料分离得到了原生质体;然而,茶树花瓣的取材极具时效性,在很大程度上制约了原生质体的应用。叶片是原生质体分离的良好材料,然而茶树叶片蜡质厚、多酚含量高,原生质体难以分离,目前尚未有叶肉原生质体分离的报道。
技术实现要素:
本发明针对现有的茶树叶片原生质体分离难、完整性差及花瓣原生质体提取具时效性等问题,提供一种茶树叶肉原生质体的分离与纯化方法。
为实现上述目的,本发明的技术解决方案是:一种茶树叶肉原生质体的分离与纯化方法,其特征在于,包括以下步骤:步骤一、采集茶树种子苗完全展开的第一叶叶片,蒸馏水清洗表面,70%乙醇消毒3min,然后无菌水冲洗5次,吸水纸吸干,接着将叶片浸入原生质体漂洗液,原生质体预分离30min;步骤二、将经过步骤一的叶片用70%(v/v)乙醇消毒的刀片去除主脉和叶缘,切成5mm2小块,迅速置于灭菌小瓶中,并按材料:酶解液=1:10比例加入酶解液;步骤三、步骤二的灭菌小瓶用parafilm膜封口后置于控温摇床上并在70rpm、25℃的黑暗条件下孵育,待灭菌小瓶中的溶液变绿时,吸取少量溶液于显微镜下观察原生质体释放情况;步骤四、步骤三中叶片酶解16-18h后,将溶液依次通过70mm不锈钢滤筛和40μm细胞筛,收集滤液于离心管,用原生质体漂洗液冲洗70mm不锈钢滤筛和40μm细胞筛,将滤液合并,滤液于200g离心3min,去除上清液,轻柔加入原生质体漂洗液悬浮原生质体,200g离心3min,收集滤液,原生质体清洗重复一次,弃掉上清液,按1:1比例加入原生质体漂洗液重悬;步骤五、取另一支灭菌试管,加入与原生质体漂洗液同体积的原生质体分层液,然后轻柔吸出步骤四中原生质体悬浮液,缓慢置于原生质体分层液上,并50g离心30s或静置5min,原生质体悬浮液和分层液间出现一条清晰、肉眼可见的绿色条带,即为纯化后的原生质体。
所述步骤二中的原生质体分离液由以下组分配制而成:0.4-0.7m甘露醇,10mm氯化钙,20mm2-(n-吗啉代)乙烷磺酸(ph5.7),20mm氯化钾,0.8-3.0%(w/v)纤维素酶r-10,0.6-3.0%(w/v)离析酶r-10,0.1%(w/v)牛血清蛋白,1%(w/v)pvpp,2mm抗坏血酸,0.45μm过滤灭菌。
所述的原生质体分离液由以下组分配制而成:0.6m甘露醇,10mm氯化钙,20mm2-(n-吗啉代)乙烷磺酸(ph5.7),20mm氯化钾,1.5%(w/v)纤维素酶r-10,2.5%(w/v)离析酶r-10,0.1%(w/v)牛血清蛋白,1%(w/v)pvpp,2mm抗坏血酸,0.45μm过滤灭菌。
所述步骤四中的原生质体漂洗液由以下组分配制而成:0.4-0.7m甘露醇,10mm氯化钙,20mm2-(n-吗啉代)乙烷磺酸(ph5.7),20mm氯化钾,0.1%(w/v)牛血清蛋白,1%(w/v)pvpp,2mm抗坏血酸,0.45μm过滤灭菌。
所述步骤五中的原生质体分层液为由optidensitytm样本密度分离液和原生质体漂洗液配制而成的25%(v/v)碘克沙醇。
与现有技术相比较,本发明的有益效果是:
本方法以茶树种子苗幼嫩叶片为材料分离、纯化原生质体,幼叶材料获取容易、原生质体分离与纯化操作简单且常年可进行,经酶解分离与密度梯度纯化后的原生质体得率较高、完整性好;为利用原生质体进行蛋白亚细胞定位、蛋白相互作用、基因表达调控及亚细胞器制备等研究奠定了基础。
说明书附图
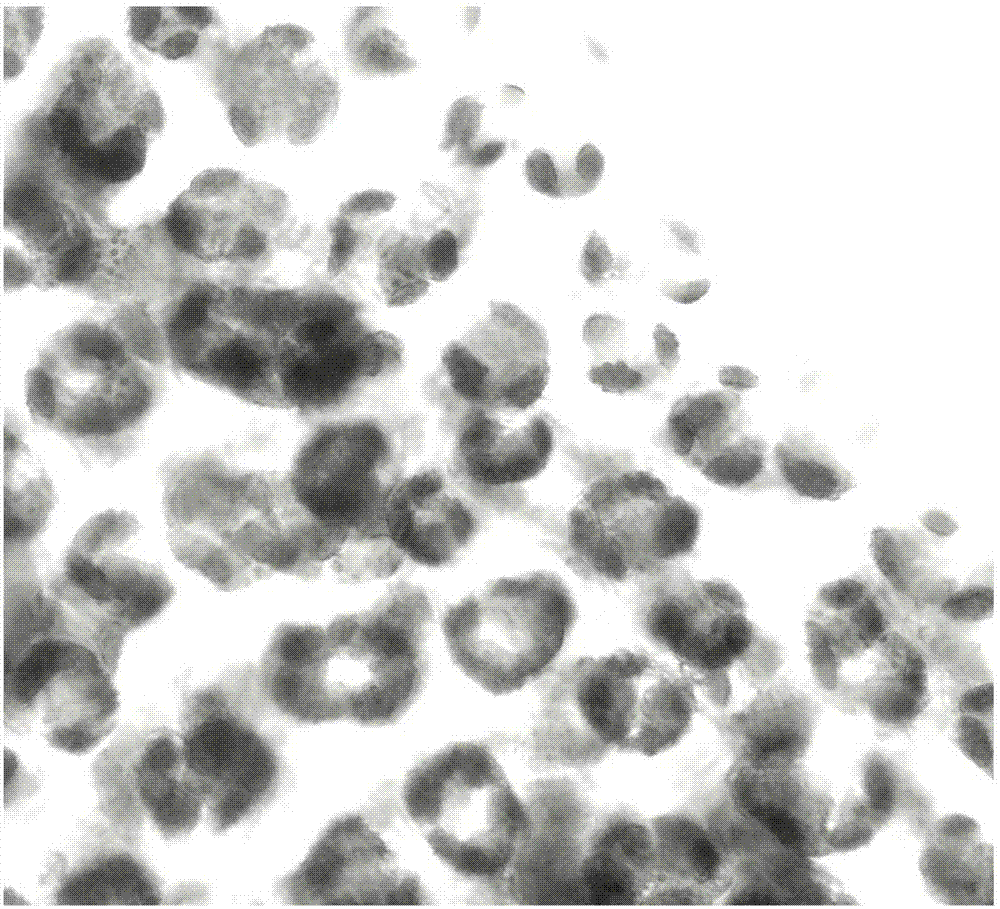
图1是本发明中尚未完全分离的原生质体。
图2是本发明中分离中的原生质体。
图3是本发明中纯化后富集的原生质体条带。
图4是本发明中完全分离的原生质体。
具体实施方式
以下结合具体实施方式对本发明作进一步的详细描述。
参见图1至图4,一种茶树叶肉原生质体的分离与纯化方法,具体包括以下步骤:
步骤一、采集茶树种子苗完全展开的第一叶叶片,蒸馏水清洗表面,再用70%乙醇消毒3min,然后无菌水冲洗5次,再用吸水纸吸干;接着将叶片浸入原生质体漂洗液,原生质体预分离30min。叶片表面消毒,防止后续实验污染;原生质体预分离可提高酶解效率。
步骤二、将经过步骤一的叶片用70%乙醇消毒的锋利刀片去除主脉和叶缘,并切成5mm2小块,然后迅速置于灭菌小瓶中;并按材料:酶解液=1:10比例加入酶解液。此处的机械分离叶片有利于加速酶解,提高酶解效率。
步骤三、步骤二的灭菌小瓶用parafilm膜封口后置于控温摇床上并在70rpm、25℃的黑暗条件下孵育,待轻摇灭菌小瓶溶液变绿时,枪头吸取少量溶液于显微镜下观察原生质体释放情况。叶片在合适条件下酶解,有利于原生质体释放;溶液变绿,表明原生质体大量释放。
步骤四、步骤三中叶片酶解16-18h后,将酶解溶液依次通过70mm不锈钢滤筛和40μm细胞筛,然后收集滤液于离心管;再用原生质体漂洗液冲洗70mm不锈钢滤筛和40μm细胞筛,再将滤液合并,并200g离心3min;接着用枪头小心去除上清液,再轻柔加入原生质体漂洗液悬浮原生质体,接着200g离心3min,然后收集滤液;接着再将原生质体清洗重复一次,并弃掉上清液,再加入少量原生质体漂洗液重悬。此步骤能够去除未完全酶解的细胞团,清除酶解液中残留的酶成分,收集游离的原生质体。
步骤五、取另一支灭菌试管,加入与原生质体漂洗液同体积的原生质体分层液,然后轻柔吸出步骤四中原生质体悬浮液,缓慢置于原生质体分层液(25%(v/v)碘克沙醇)上,并50g离心30s或静置5min。原生质体悬浮液和分层液间出现一条清晰、肉眼可见的绿色条带,即为纯化后的原生质体;此时镜检发现大多数原生质体绿色、圆形、内容物丰富。此步骤利用密度梯度纯化原生质体,原生质体悬浮液中0.6m甘露醇与25%(v/v)碘克沙醇形成界面。
具体的,所述步骤二中的酶解液由以下组分配制而成:0.4-0.7m甘露醇,10mm氯化钙,20mm2-(n-吗啉代)乙烷磺酸(ph5.7),20mm氯化钾,0.8-3.0%(w/v)纤维素酶r-10,0.6-3.0%(w/v)离析酶r-10,0.1%(v/v)牛血清蛋白,1%(v/v)pvpp,2mm抗坏血酸,0.45μm过滤灭菌,且溶液现用现配。更进一步的,所述的酶解液由以下组分配制而成:0.6m甘露醇,10mm氯化钙,20mm2-(n-吗啉代)乙烷磺酸(ph5.7),20mm氯化钾,1.5%(w/v)纤维素酶r-10,2.5%(w/v)离析酶r-10,0.1%(v/v)牛血清蛋白,1%(v/v)pvpp,2mm抗坏血酸,0.45μm过滤灭菌,且溶液现用现配。
具体的,所述步骤三中的灭菌小瓶用parafilm膜封口后置于控温摇床上并在70rpm、25℃的黑暗条件下孵育16-18h。
具体的,所述步骤四中的原生质体漂洗液由以下组分配制而成:0.4-0.7m甘露醇,10mm氯化钙,20mm2-(n-吗啉代)乙烷磺酸(ph5.7),20mm氯化钾,0.1%(v/v)牛血清蛋白,1%(v/v)pvpp,2mm抗坏血酸,0.45μm过滤灭菌;即原生质体漂洗液成分与不添加纤维素酶和离析酶的酶解液相同。
具体的,所述步骤五中的原生质体分层液为由optidensitytm样本密度分离液(60%碘克沙醇)和原生质体漂洗液配制而成的25%(v/v)碘克沙醇。
参见图1至图4,实施例一,
一种茶树叶肉原生质体分离与纯化的方法,其步骤如下:
步骤一、采集茶树种子苗完全展开的第一叶叶片,蒸馏水清洗表面,再用70%乙醇消毒3min,然后无菌水冲洗5次,再用吸水纸吸干;接着将叶片浸入原生质体漂洗液,原生质体预分离30min。
步骤二、将经过步骤一的叶片用经过70%乙醇消毒的锋利刀片去除主脉和叶缘,并切成5mm2小块,然后迅速置于灭菌小瓶中;并按材料:原生质体分离液=1:10比例加入原生质体分离液。此处所述的原生质体分离液由以下组分制制成的:0.6m甘露醇,10mm氯化钙,20mm2-(n-吗啉代)乙烷磺酸(ph5.7),20mm氯化钾,0.8-3.0%(w/v)纤维素酶r-10,0.6-3.0%(w/v)离析酶r-10,0.1%(v/v)牛血清蛋白,1%(v/v)pvpp,2mm抗坏血酸,0.45μm过滤灭菌;且该原生质体分离液现用现配。
步骤三、步骤二的灭菌小瓶用parafilm膜封口后置于控温摇床上并在70rpm、25℃的黑暗条件下孵育16-18h;待灭菌小瓶中的原生质体溶液变绿时,枪头吸取少量原生质体溶液于显微镜下观察原生质体释放情况。具体纤维素酶和离析酶浓度的变化结果见下表:
由上表可知,纤维素酶1.5%、离析酶2.0-2.5%时,茶树叶片叶肉原生质体分离多且完整性好;但进一步比较发现,离析酶2.5%时,原生质体分离所需时间短,更有利于原生质体活力的保持。
同时,参见图1、2和4,酶解12h,细胞壁开始降解(图1);酶解14h,细胞壁破裂,原生质体欲游离出来(图2);酶解16-18h,原生质体游离增多,且大多数为圆形、完整的原生质体(图4)。
步骤四、将原生质体溶液依次通过70mm不锈钢滤筛和40μm细胞筛,然后收集滤液于离心管;再用原生质体漂洗液冲洗70mm不锈钢滤筛和40μm细胞筛,再将滤液合并,并200g离心3min;接着用枪头小心去除上清液,再轻柔加入原生质体漂洗液悬浮原生质体,接着200g离心3min,然后收集滤液;接着再将原生质体清洗重复一次,并弃掉上清液,再加入少量原生质体漂洗液重悬。此处的原生质体漂洗液成分与添加纤维素酶和离析酶的原生质体分离液相同。
步骤五、取另一支灭菌试管,加入与原生质体漂洗液同体积的原生质体分层液,然后轻柔吸出步骤四中原生质体悬浮液,缓慢置于原生质体分层液(25%(v/v)碘克沙醇)上,并50g离心30s或静置5min。原生质体悬浮液和分层液间出现一条清晰、肉眼可见的绿色条带,具体参见图3,即为纯化后的原生质体;此时镜检发现大多数原生质体绿色、圆形、内容物丰富,具体参见图4。
本方法以茶树种子苗幼嫩叶片为材料分离、纯化原生质体,采用酶解法分离得到叶肉原生质体;利用密度梯度法对原生质体进行了纯化,获得了高得率、高活力的原生质体。与现有技术相比,本发明幼叶材料获取容易、原生质体分离与纯化操作简单且常年可进行;经酶解分离与密度梯度纯化后的原生质体得率较高、完整性好,因此建立了高效的原生质体制备体系,为利用原生质体瞬时表达系统开展基因功能研究奠定了基础。
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,上述结构都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!