一种双功能离子螯合磁性载体及其应用的制作方法
本发明属于酶纯化和固定化技术领域,具体的说就是一种基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体及其应用。
背景技术:
可得然胶(curdlan)是一种新型的微生物胞外多糖,对可得然胶进行的长期毒性检测试验表明其对人体是安全无毒害的(spicerejf,goldenthalei,ikedata.toxicologicalassessmentofcurdlan.foodchemtoxicol.1999;37(4):455-479.),并且可得然胶具有许多特殊的理化性质,能够溶解于碱性水溶液,但不溶于水,这些特性使其在食品工业中,在1996年被美国fda准许将其作为食品的稳定剂、增稠剂应用于食品配料中(demleitners,krausj,franzg.synthesisandantitumouractivityofsulfoalkylderivativesofcurdlanandlichenan.carbohyres.1992;226:224-252.);在制药工业中,基于可得然胶在水中不溶的特性,对其进行化学修饰,如羧甲基化、硫酸化、磷酸化等均能提高其溶解性和生物活性,由此产生的多糖衍生物具有抗肿瘤,抗hiv等生物活性,并具有抗菌和免疫调节作用。(ichiyamak,reddysbg,zhanglf,chinwx,muschint,heinigl,etal.sulfatedpolysaccharide,curdlansulfate,efficientlypreventsentry/fusionandrestrictsantibody-dependentenhancementofdenguevirusinfectioninvitro:apossiblecandidateforclinicalapplication.plosneglectropd.2013;7(4):e2188.)几年来,可得然胶的研究重点集中于在其产物,结构特点,及在食品生物医药工业方面的应用。(zhangrr,lius,&edgarkj.regioselectivesynthesisofcationic6-deoxy-6-(n,n,n-trialkylammonio)curdlanderivatives.carbohydpolym.2016;136:474-484.)但目前仍未有关于可得然胶在蛋白纯化和固定化方面的报道。可得然胶表面含有大量的-oh基团,可以与螯合配基共价结合;亲和配基无非特异性吸附,机械强度较高且粒度分布比较均匀。且具有高度的特异性,高度的亲水性,适当的孔径和表面积,可利用的化学基团足够多等特点,可以用于金属螯合固定化中的固相载体。
固定化金属螯合层析法已经成为纯化蛋白的主要方法,在基因重组蛋白中得到了广泛的应用,除了应用在蛋白质检测、分离纯化(imsoonthornruksas,noisap,parnpair,ketudat-cairnsm.asimplemethodforproductionandpurificationofsolubleandbiologicallyactiverecombinanthumanleukemiainhibitoryfactor(hlif)fusionproteininescherichiacoli.jbiotechnol.2011;151:295-302.),还应用于蛋白质的定向固定化、联用技术应用、蛋白质的的复性与纯化。此外还应用于核酸的分离纯化等领域(kowalskae,bartnickif,pelsk,strzalkaw.theimpactofimmobilizedmetalaffinitychromatography(imac)resinsondnaaparmerselection.analbioanalchem.2014;406:5495-5499.)。其原理是利用金属离子与氨基酸表面的残基的配位鳌合作用来纯化与金属离子有亲和作用的蛋白质。不同金属离子可与不同蛋白质相互作用,最常用的金属离子主要有:cu2+、zn2+、co2+、ni2+、mg2+和ca2+等。在某种意义上,金属离子可直接决定蛋白质分离纯化的效果。不同的酶具有不同的离子耐受性,本发明载体对特定金属离子不耐受酶的纯化是一个新的研究方向。金属鳌合载体对固定到表面的蛋白质构象影响小(schmidel,kellerta,dienesz,etal.reversibleorientedsurfaceimmobilizationoffunctionalproteinsonoxidesurfaces.analchem.1997;69(11):1979-1985.),而且具有配基简单、吸附量大、分离条件温和、通用性强、载体可重复利用等特点。磁性颗粒作为固相载体内核,可以利用载体的磁响应性特点,吸附目标蛋白质后在外磁场作用下即可与原体系分离,再经洗脱即可得到纯化的目标蛋白质(caom,liz,wangj,gew,yuet,lir,colvinvl,yuww.foodreltatedapplicationofmagneticironoxidenanoparticles:enzymeimmobilization,proteinpurification,andfoodanalysis,trendsfoodscitech.2012;27(1):47-56.),使得金属鳌合亲和层析在外源蛋白纯化中应用越来越广泛。各种配体如次氨基三乙酸(nta)、ida(亚氨基二乙酸)、ted(三羧甲基乙二胺)常被用于金属离子结合(chanwang,boli,jingao.separationandidentificationofzinc-chelatingpetidesfromsesameprotein.foodchem.2012;134:1231-1238.)。一般用来纯化组氨酸标签的商业柱为商品镍柱ni-nta,这是一种共价偶联至三齿螯合剂上的可得然纯化介质,这种螯合剂可通过四个结合点与ni2+结合形成螯合物,从而纯化带有his标签的融合蛋白,且不会发生ni2+渗漏。ni-nta也存在许多缺点:这种方法所使用的试剂价格昂贵,特异性弱,纯化过程中杂蛋白较多(zhouh,lijx,xiesy,zangmx.expressionandpurificationoftheoutershellproteinvp2ofthe4thserotypebluetonguevirus,andpreparationofmonoclonalantibodiesagainstthisprotein.processbiochem.2017;61:119-123.)。另外nta相较于其他的螯合配体来说毒性很大,且价格不便宜,使用范围受到了限制。而ida高亲和力层析柱可用于纯化多种重组表达系统的表达产物,如经细菌、酵母、昆虫和哺乳动物细胞等表达系统表达的his标签标记的融合蛋白,ida螯合金属离子纯化介质可在天然、变形或杂交条件下纯化his标签重组蛋白,并且实施起来比较容易。
传统酶固定化一般认为是通过酶分子上的氨基酸残基(如赖氨酸残基)随机固定在载体上,这可能会导致酶多个位点和载体结合,破坏了酶天然构象或者出现位阻障碍而妨碍底物进入到酶的活性位点,最终使固定化酶活性大幅度下降(linpc,weinrichd,waldmannh.proteinbiochips:orientedsurfaceimmobilizationofprotein.macromolchemphys.2010;211(2):136-144.)。hernandez等认为传统的固定方法并不是完全随机的固定而可能是目标蛋白取向很难改变,蛋白质固定化方向难以把握(hermandezk,fernandez-lafuenter.controlofproteinimmobilization:couplingimmobilizationandsite-directedmutagenesistoimprovebiocatalystorbiosensorperformance.enzymemicrobtech.2011;48(2):107-122.)。而定向固定化能够按照设定的位置把酶固定在载体上,这更有利于保护酶催化功能,具有更重要的研究与应用价值。采用定向固定化的方法固定化酶,可使酶特定位点直接或间接(miladib,eimarjoua,boeufg,etal.orientedimmobilizationofthetobaccoetchvirusproteaseforthecleavageoffusionproteins.jbiotchnol.2012;158(3):97-103.)与载体结合,酶活性位点位于载体外侧,天然构象基本保持不变,有利于底物进入到酶活性位点,显著提高固定化酶的活力。
木聚糖酶是一类以内切方式降解木聚糖分子中β-1,4-木糖苷键的酶系,可将木聚糖降解成低聚木糖和木糖,在半纤维多聚糖资源的利用以及工业应用方面有巨大潜力(landarani-isfahania,taheri-kafrania,aminim,mirkhaniv,moghadamm,soozanipoura,razmjoua.xylanaseimmobilizedonnovelmultifunctionalhyperbranchedpolyglycerol-graftedmagneticnanoparticles:anefficientandrobustbiocatalyst.langmuir.2015;31(33):9219–9227.)。木聚糖酶的应用,多采用游离酶催化形式,因而在应用过程中,游离酶存在稳定性差,难于重复利用,酶与产物难于分离的缺点,因此木聚糖酶的应用受到了一定的限制。与游离酶相比,定向固定化木聚糖酶可以较长时间内重复酶解反应,反应条件和储藏条件都比游离酶范围更广,从而提高酶的使用效率,增加产物收率,降低生产成本。
技术实现要素:
本发明的目的在于提供一种基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体及其应用。
实现上述目的,本发明采用技术方案为:
一种双功能离子螯合磁性载体,双功能载体为磁性可得然微球经活化、螯合,得到具有固定化、纯化功能的双功能离子螯合磁性载体;其中,磁性可得然微球为以fe3o4纳米颗粒为内核,可得然胶反向包埋为外壳,合成得双功能离子螯合磁性载体。
所述磁性可得然微球以环氧氯丙烷为活化剂活化,ida为螯合配基螯合,再与离子进行螯合,得双功能载体。
将上述所得载体与木聚糖酶模型酶混合固定,即得到载体固定的木聚糖酶。
所述木聚糖酶为来自于土壤宏基因组库筛选得到。
所述木聚糖酶为seqidno:1序列中的碱基序列所示。
seqidno:1
atgacgatccaaccaggcacgggctacaacaacggctatttctactcttactggaacgacggtcatggtggtgttacctatactaatggccctggtggccagttcagcgtcaattggagcaattccggcaacttcgttggtggtaaaggctggcagccgggcaccaagaataaggtgattaactttagcggttcctacaatccgaatggcaacagctacctgagcgtgtacggctggagccgtaatccgctgattgaatactatatcgtggagaactttggtacgtacaacccgtccaccggtgccaccaaactgggtgaggttactagcgatggtagcgtgtatgatatctatcgcacccagcgtgttaatcaaccgtcgattattggtacggcgaccttttatcaatactggagcgtgcgtcgcaaccaccgttctagcggcagcgtcaacaccgcaaaccactttaatgcgtgggctcagcagggtttgaccctgggtacgatggactaccaaatcgtcgcggtcgaaggttatttcagcagcggttctgcaagcatcaccgttagcgtcgactaa
一种双功能离子螯合磁性载体的制备方法:
1)fe3o4纳米颗粒的制备:按照三价铁、二价铁1.75:1的比例,分别加入35ml0.5mol/l的fecl3和20ml0.5mol/l的fecl2溶液于烧杯中,搅拌混匀,置于50℃水浴中,快速滴入2mol/l的氨水溶液调节溶液酸碱度到ph10.0±0.2,升温至80℃恒温保持1h,然后用ddh2o洗涤数次,强磁铁吸附,弃去上清液,最后将磁流体保存于4℃ddh2o中备用;
2)磁性可得然微球的制备:油相:三颈瓶中加入36ml甲苯、14ml三氯甲烷混匀,加入0.5mlspan-80混匀,快速搅拌,预热至55℃;水相:将6%可得然胶加热溶于上述获得12.5ml磁流体中,超声扩散,采用反向包埋法迅速转移至油相中,快速搅拌,使可得然胶在油相中分散均匀,55℃搅拌10min,冰浴冷却,乙醚、丙酮、10%乙醇清洗三次,ddh2o大量冲洗,真空干燥;
3)磁性可得然微球的环氧化处理:取5g上述获得磁性可得然微球分散于25ml2mol/lnaoh溶液中(内含nabh42mg/ml),1ml环氧氯丙烷于37℃摇床中振荡,陆续滴加5mlnaoh和3ml环氧氯丙烷,37℃摇床活化24h,反应结束后,用ddh2o冲洗微球,于ddh2o中浸泡12h;
4)磁性可得然微球的ida化:将充分洗涤过的微球加入到2mol/l,15mlna2co3溶液中,加入1gida,于37℃摇床中振荡至24h反应结束后,用ddh2o冲洗,浸泡过夜,载体保存于4℃ddh2o中备用;
5)金属离子的螯合:取ida化的磁性可得然微球,在此基础上经guanidine-hcl,aceticacid、水、sds、edta处理后,加入一定量的金属离子溶液,室温下振荡,随后以ddh2o洗涤,即得目标载体。
将重组大肠杆菌表达来自土壤宏基因组库的木聚糖酶与上述载体混合,混合后用乙酸-乙酸钠缓冲溶液洗涤,得到固定的纯化木聚糖酶。
步骤5)中金属离子为钙离子。
步骤5)中用于纯化的载体金属离子浓度为4%,用于固定化的载体金属离子浓度为6x10-2mol/l。
一种固定化木聚糖酶的制备方法,利用所述载体与木聚糖酶混合即实现对木聚糖酶的固定。
与现有的金属螯合载体相比,本发明所具有的优点在于:
1)本发明采用可得然胶作为金属螯合载体固体基质从而固定化和纯化蛋白,可得然胶无毒性,具有独特的生物医学活性,在食品行业中可作为添加剂、增稠剂等,在生物医学行业可用于抗肿瘤、抗hiv;结构上来讲,具有配位螯合功能,含有大量游离的-oh,孔径分布范围小,粒度均匀,表面有密度适宜的可反应的活性基团,便于连接螯合基,对生物大分子的非特异性小;实验证明,在相同的条件下,可得然胶金属螯合载体螯合的酶量是传统琼脂糖金属螯合载体的1.5倍,磁响应性也高于传统的琼脂糖、壳聚糖等金属螯合载体,是固定化领域的一种新型的微生物胞外多糖材料。
2)本发明中涉及的木聚糖酶是从土壤宏基因组库中筛选出来的具有更广ph域、对金属离子、有机溶剂耐受性更强,km值更低的高效木聚糖酶。
3)本发明所制备的载体既能用于固定化,又能用于纯化。固定化方面的应用,赋予了固定化酶高稳定性、高磁性、高重复性,大大提高了酶的适用范围,可方便的进行催化反应;蛋白纯化方面,优于商品ni-nta,能实现无非特异性吸附,亲和力强,杂蛋白少,一次纯化即可获得较好的纯化效果。通常,对于酶的提取及分离纯化通常需要经过多个步骤,将质粒转入表达宿主,诱导剂低温诱导,富集菌体经超声波等破碎手段获得粗酶液。粗酶液上如ni-nta等纯化柱,经多种缓冲液过柱,最后获得纯化蛋白,过程繁琐且往往不能保证其纯化效果。本发明中的基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体的利用大大节省了纯化酶的获取过程,无需过柱,离心等复杂过程。将载体置于破碎菌体中,利用磁响应性即可将带有纯化酶的载体与菌体分离,经洗脱液洗脱即可得到目标纯化蛋白,且根据不同蛋白与不同金属的结合力不同,通过更换载体螯合的金属离子可达到对不同目标蛋白高效、特异结合得目的。
4)本发明方法制备的木聚糖酶与游离酶相比活性更高、ph适应性更宽、温度稳定性更高、对有机溶剂的耐受性更强、对金属离子的耐受性更强、储藏稳定性更高、而且操作稳定性更好。
附图说明
图1是本发明实施例提供的光学显微镜下观察到的磁性可得然微球的表征,其中黑色微粒为纳米磁性氧化铁小颗粒被可得然胶反向包埋成为内核图。
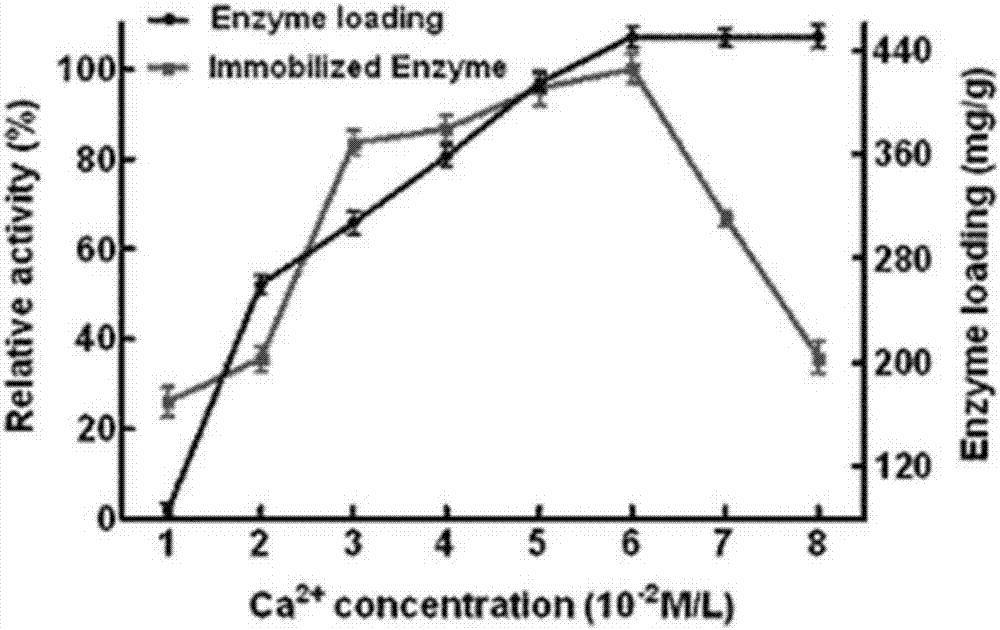
图2是本发明实施例提供的不同量金属离子ca2+加入对固定木聚糖酶的固定量和相应固定化木聚糖酶酶活的影响图。
图3是本发明实施例提供的不同固定化时间对固定木聚糖酶的固定量和相应固定化木聚糖酶酶活的影响图。
图4是本发明实施例提供的不同固定化ph对固定木聚糖酶的固定量和相应固定化木聚糖酶酶活的影响图。
图5是本发明实施例提供的不同的给酶量对固定木聚糖酶的固定量和相应固定化木聚糖酶酶活的影响图。
图6是本发明实施例提供的木聚糖酶游离酶和固定酶在不同温度下相应酶活的比较图。
图7是本发明实施例提供的木聚糖酶游离酶和固定酶在不同温度下保温后相应温度的热稳定性比较图。
图8是本发明实施例提供的木聚糖酶游离酶和固定酶在不同ph下相应酶活的比较图。
图9是本发明实施例提供的木聚糖酶游离酶和固定酶在不同ph下保温后的ph稳定性比较图。
图10是本发明实施例提供的木聚糖酶游离酶和固定酶的不同有机溶剂中保温后相应酶活的比较图。
图11是本发明实施例提供的固定化木聚糖酶重复10次反应的稳定性研究图。
图12是本发明实施例提供的固定化木聚糖酶储存35d剩余酶活性研究图。
图13是本发明实施例提供的商品纯化柱ni-nta和本发明载体纯化木聚糖酶效果对比图(m:marker;1:木聚糖酶粗酶液;2:本载体一次纯化;3:本载体二次纯化;4:本载体三次纯化;5:ni-nta一次纯化;6:ni-nta二次纯化;7:ni-nta三次纯化)。
具体实施方式
下面结合说明书附图对本发明作进一步的解释说明。
本发明制备的基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体,能用于固定化,又能用于纯化。固定化方面的应用,赋予了固定化酶高稳定性、高磁性、高重复性,大大提高了酶的适用范围,可方便的进行催化反应;蛋白纯化方面,优于商品ni-nta,能实现无非特异性吸附,亲和力强,杂蛋白少,一次纯化即可获得较好的纯化效果。另一方面利用载体的磁响应性特点,吸附目标蛋白质后在外磁场作用下即可与原体系分离,再经洗脱即可将蛋白质与载体分离而得到目标蛋白质,可以实现酶的一步洗脱,一步分离。对于底物为不溶性的酶的重复利用提供了新的选择。而且本载体可以重复多次利用,而不会影响到蛋白纯化和固定化的效果。因此,本发明将在酶定向固定化载体合成,酶纯化和固定化技术领域具有广阔的应用前景。
本发明提出的制备蛋白吸附力强、非特异性吸附弱,能同时纯化并固定化酶的双功能金属螯合磁性载体的方法,并用于同时纯化并固定化来自土壤宏基因组库的木聚糖酶。利用载体的磁响应性特点,能在外加磁场下轻易地将固定化酶从反应体系中分离出来。本载体对于实现有不溶性底物(如多聚糖)的一类固定化酶的回收和重复利用具有重要参考价值。另外,由于纯化介质利用的金属离子可选择钙离子等多种离子,对于ni2+不耐受酶的纯化提供了新的选择。
实施例1:宏基因组中木聚糖酶基因的克隆表达
1)pany2-xylanase构建
以来自沈阳农业大学植物园林下土壤的宏基因组总dna为模板,利用taqdna聚合酶,以xy11-f(5’-ttaactttaagaaggagatatacatatgacgatccaaccaggcacnggntacaayaay-3’)和xy11-r(5’-gctcttagtggtggtggtggtggtggtcgacgctaacggtgatgctngcaganccnct-3’)为引物扩增土壤中的xylanase基因。以pany2质粒为模板,利用pfudna聚合酶,以pany2-for(5’-gtcgaccaccaccaccaccaccactaagagctcctgcagttggctgctgccaccgc-3’)和pany2-rev(5’-atgtatatctccttcttaaagttaaacaaaattatttctagagggaaaccgttgtg-3’)为引物扩增pany2载体。将上述分别扩增获得片段利用重组酶连接后转入大肠杆菌jm109得到pany2-xylanase。
2)pany2-xylanase木聚糖酶的表达
将获得的阳性克隆pany2-xylanase转入大肠杆菌bl21(de3),利用tb培养基进行富集培养,0.2mmol/liptg,22℃,过夜低温诱导木聚糖酶表达。将上述菌液离心富集菌体,ddh2o清洗后,重悬于0.1mol/l磷酸缓冲液中(ph7.0),超声4min,12000xg离心10min得到木聚糖酶粗酶液,该酶液中含seqidno:1所示的碱基序列。
seqidno:1
atgacgatccaaccaggcacgggctacaacaacggctatttctactcttactggaacgacggtcatggtggtgttacctatactaatggccctggtggccagttcagcgtcaattggagcaattccggcaacttcgttggtggtaaaggctggcagccgggcaccaagaataaggtgattaactttagcggttcctacaatccgaatggcaacagctacctgagcgtgtacggctggagccgtaatccgctgattgaatactatatcgtggagaactttggtacgtacaacccgtccaccggtgccaccaaactgggtgaggttactagcgatggtagcgtgtatgatatctatcgcacccagcgtgttaatcaaccgtcgattattggtacggcgaccttttatcaatactggagcgtgcgtcgcaaccaccgttctagcggcagcgtcaacaccgcaaaccactttaatgcgtgggctcagcagggtttgaccctgggtacgatggactaccaaatcgtcgcggtcgaaggttatttcagcagcggttctgcaagcatcaccgttagcgtcgactaa
实施例2:基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体的制备
1)fe3o4纳米颗粒的制备:按照fe3+:fe2+=1.75:1.00的比例,分别加入35ml0.5mol/l的fecl3和20ml0.5mol/l的fecl2溶液于烧杯中,搅拌混匀,置于50℃水浴中,快速滴入2mol/l的氨水溶液调节溶液酸碱度到ph10.0±0.2,液体由棕色变为黑色,升温至80℃恒温保持1h,然后用ddh2o洗涤数次,强磁铁吸附,弃去上清液,最后将磁流体保存于4℃ddh2o中备用。
2)磁性可得然微球的制备:采用反向包埋法制备。油相:三颈瓶中加入36ml甲苯、14ml三氯甲烷混匀,加入0.5mlspan-80混匀,预热至55℃。水相:将6%可得然胶加热溶于12.5ml磁流体中,超声扩散,迅速转移至油相中,快速搅拌,使可得然在油相中分散均匀,55℃搅拌10min,减缓搅拌速度,自然冷却,乙醚、丙酮、10%乙醇清洗三次,ddh2o大量冲洗,ddh2o中浸泡4℃备用。
3)磁性可得然微球的环氧化处理:取5g载体磁性可得然微球置于25ml的2mol/l的naoh溶液中(内含nabh42mg/ml),1ml环氧氯丙烷于37℃摇床中振荡,2h内陆续滴加5mlnaoh和3ml环氧氯丙烷,37℃摇床活化24h。反应结束后,用大量ddh2o冲洗微球,于ddh2o中浸泡12h。
4)磁性可得然微球的ida化:将充分洗涤过的载体加入到15ml浓度为2mol/l的na2co3溶液中,加入1gida,于37℃摇床中振荡24h,以大量ddh2o冲洗,浸泡过夜,载体保存于4℃ddh2o中备用。
5)金属离子的螯合:取ida化的可得然载体,在此基础上经2体积6mol/lguanidine-hcl,0.2mol/laceticacid(此溶液ph不必调整)、2体积水、2体积5%sds、2体积水、5体积100mmol/ledta、2体积的水,加入6x10-2mol/l(固定化用)或4%(纯化用)氯化钙离子溶液,室温下振荡,随后以大量ddh2o洗涤,即得目标载体。用光学显微镜进行磁性可得然微球进行表征分析。结果如图1所示。
实施例3:基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体定向固定化木聚糖酶
准确称取10.0mg基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体于50ml锥形瓶中,加入10ml1.5mg/ml木聚糖酶溶液(溶于0.lmol/lph5.0磷酸缓冲液),室温下振荡4h,用0.lmol/l乙酸-乙酸钠缓冲溶液洗涤数次至上清液中检测不到游离酶,即得固定化的木聚糖酶。并且对固定化酶的固定条件和固定化效果进行了研究。
1)测定了基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体对酶的固载量:
固载量的计算公式为:
式中:c0-反应前木聚糖酶的浓度(mg/ml);v0-固定前溶液的体积(ml);c1-反应后木聚糖酶的浓度(mg/ml),v0-固定前溶液的体积(ml);m-所取微球的质量(g);q0-吸附量(mg/g)
2)酶活性的测定:
游离酶活力的测定:在试管内加入0.25ml11mg/ml的木聚糖酶溶液,置于50℃水浴锅中平衡10min,再加入经同样平衡过的2.0ml木聚糖溶液(浓度10.0mg/ml),精确保温10min后,立即加入5ml的dns试剂,振荡3-5s,以终止酶解反应;沸水浴加热5min,用自来水冷却至室温,加水定容至25ml,振荡3-5s,以标准空白样为空白对照,在540nm处利用酶标仪测定吸光度a值。固定化酶活的测定:准确称取10.0mg固定化酶(用2.0ml缓冲溶液作补充),采用与游离酶相同的方法与条件测定活性。为便于考察变量(给酶量、ph、温度等)对酶活的影响,以同组试验中酶活最高值为100,进行数据处理。
3)固定木聚糖酶条件的研究
(1)固定化载体的钙离子加入量的影响:取基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体,改变加入ca2+的量(1-8x10-2mol/l),制备吸附不同ca2+量的螯合载体,再以此载体固定木聚糖酶,测其酶活并计算木聚糖酶的固定量。结果如图2所示,双功能离子螯合磁性载体的最佳钙离子添加量为6x10-2mol/l。
(2)固定化时间的影响:取基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体(6x10-2mol/lca2+)加入木聚糖酶溶液,改变固定化时间为1、2、3、4、5、6h,测定不同反应时间固定化酶活及木聚糖酶的固定量。结果如图3所示,双功能离子螯合磁性载体的最佳固定化时间为4h。
(3)ph对固定化酶活力的影响:在ca2+为6x10-2mol/l、不同ph(4、5、6、7、8、9、10)的缓冲液中固定化4h,制备固定化酶,研究缓冲液的ph与固定化酶相对酶活力及木聚糖酶固定量的关系。结果如图4所示,双功能离子螯合磁性载体的最佳固定化ph为5。
(4)给酶量对固定化酶的影响:在ca2+为6x10-2mol/l、固定化时间4h、ph5的条件下,取双功能离子螯合磁性载体,通过改变添加酶液的量(1.0-2.6mg/ml)得到不同给酶量的固定化酶,测定固定化酶活及木聚糖酶固定量。结果如图5所示,双功能离子螯合磁性载体的最佳给酶量为2.4mg/ml。
4)固定化对酶最适温度的影响
将固定化酶和游离酶分别在于不同温度(30、40、50、60、70、80、90℃)下分别测定其酶活,以最高酶活为100%,计算各温度下的酶的相对活力,确定其最适温度。结果如图6所示,结果表明,游离酶和固定化酶的最适反应温度均为50℃。
5)固定化对酶热稳定性的影响
将固定化酶和游离酶分别在30、40、50、60、70、80、90℃范围内的不同温度条件下,保温30min,测定其酶活力。以最高活性为100%,计算各温度下酶的相对活力,确定其温度稳定性。结果如图7所示,固定酶的热稳定性远好于游离酶。在保温30min后,各个温度固定化酶的酶活性均高于自由酶的酶活性。
6)固定化对酶最适ph的影响
将固定化酶和游离酶分别在不同ph值3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0的底物中测定酶活力,以最高活性为100%,计算各温度下酶的相对活力,确定其温度稳定性。结果如图8所示。游离酶对底物反应的最适ph值为5.0,而固定化酶的最适ph值为4,且ph表现出了更宽的ph适应域。
7)固定化对酶ph稳定性的影响
将固定化酶和适当稀释的游离酶分别在不同ph值3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0条件下,50℃保温30min取出,在标准ph和温度下测定其残余活性,根据其残余活性比较其ph稳定性。结果如图9所示。固定化酶的ph稳定性远高于游离酶。
8)固定化对酶有机溶剂耐受性的影响
将固定化酶和适当稀释的游离酶分别在10%乙醇、25%乙醇、50%乙醇,10%丙酮、25%丙酮、50%丙酮,10%丁醇、25%丁醇或50%丁醇条件下,50℃保温30min取出,在标准ph和温度下测定其残余活性,根据其残余活性比较其ph稳定性。结果如图10所示。不同浓度的有机溶剂中处理30min,测定其酶活力,从图中可知,固定化酶的有机溶剂耐受性明显提高。
9)固定化对酶在不同金属离子存在下活性的影响
取上述固定化酶和适当稀释的游离酶,在10mmol/l不同的金属离子溶液中,50℃保温30min,在标准ph和温度下测定其残余活性,根据其残余活性比较其ph稳定性。结果如表1所示。固定化酶的金属离子耐受性明显高于游离酶。
表1木聚糖酶游离酶和固定酶在不同金属离子中保温后相应酶活的比较(重复三次取平均值)
10)固定化酶的操作稳定性
操作稳定性是衡量固定化酶是否具有实用性的重要指标之一。分别取10.0g两种固定化酶的微球,取2ml木聚糖为底物,酶解温度为50℃,酶解ph为4.0,用dns法测定反应液的吸光度,然后将第一次用过的微球用缓冲溶液洗涤数次,洗涤后套用进行第二次酶解实验,连续操作10次,计算固定化酶剩余酶活力。结果如图11所示。随着操作次数的增加,酶活力呈现下降的趋势,这是因为酶经过几次使用之后,尤其是结合不够紧密的酶就会发生脱落,重复利用后酶活性就会下降,重复5次操作之后,相对酶活力仍有76%,相较于其他文献,操作重复性大大提高。
11)固定化酶的储藏稳定性
取游离酶和上述获得固定酶在无反应物条件下,定期取样测定其酶活力,以各自初始活力为100%,计算残余活性,根据其在储存过程中残余活性的变化比较其稳定性。结果如图12所示。木聚糖酶在经过固定后其储存稳定性明显高于游离酶。在35d后,游离酶剩余酶活为63.94%,固定化酶为81.98%.
12)固定化对酶促动力学参数的影响
配制不同的玉米芯木聚糖底物(2mg/ml-10mg/ml),在最适条件下测定其酶反应速度,使用双倒数作图法计算其米氏常数km值和最大速度vmax值。结果如表2所示,固定化酶的底物亲和力小于游离酶。这是由于固定化酶附近微环境的底物浓度较游离酶稍低,且扩散阻力也使得km增大。
表2木聚糖酶游离酶和固定酶的不同km值和vmax值
实施例4:比较商品ni-nta和基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体纯化蛋白的效果
1)基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体纯化柱的制备:取ida化的磁性可得然载体,在此基础上经2体积6mol/lguanidine-hcl,0.2mol/laceticacid(此溶液ph不必调整)、2体积水、2体积5%sds、2体积水、5体积100mmol/ledta、2体积的水、2体积4%氯化钙、9体积的水、3体积20%乙醇处理,得到基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体纯化柱。
2)制备缓冲液:
a液,1xtris-hcl缓冲液ph8.0,含有10mmol/l咪唑
b液,1xtris-hcl缓冲液ph8.0,含有20mmol/l咪唑
c液,1xtris-hcl缓冲液ph8.0,含有250mmol/l咪唑
3)用ni-nta和基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体纯化木聚糖酶
(1)ni-nta纯化木聚糖酶:50%的琼脂糖珠,颠倒重悬混匀,取1ml混悬液加入层析柱中,水分靠重力过滤除去,得到0.5ml柱床体积的琼脂糖珠。加入5倍柱床体积的a液(2.5ml)平衡琼脂糖珠。收集细菌,以适当体积的a液重悬,超声破碎,高速离心除去细胞碎片,取上清分批加入上述层析柱,过滤流出的液体为穿透液;以10倍柱床体积的b液,洗涤琼脂糖珠,过滤流出的液体为洗涤液;以6倍柱床体积的c液,洗脱蛋白过滤流出的液体为洗脱液。
(2)基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体菌体纯化木聚糖酶:用a液悬浮,超声破碎仪破碎后,收集可溶性上清。双功能离子螯合磁性载体离心后,用a液洗涤两次。加入细菌可溶性上清,在冰水中轻微混匀1.5h,使重组蛋白充分地与介质结合偶联;12000xg,离心10s后,用b液充分洗涤两次,弃上清。12000xg,离心10s后,用c洗涤三次,上清为含有纯化蛋白的洗脱液。
将同一批木聚糖粗酶液分别利用商品ni-nta及基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体进行纯化,每个柱子分别纯化三次,对比其纯化效果。纯化效果如图13所示。从图中泳道对比可以看出,采用基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体纯化蛋白,经过一次提纯,就得到了蛋白的单一条带,这表明基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体非特异吸附很小,亲和性好,纯化后几乎没有杂质蛋白;而商品ni-nta纯化后的蛋白中仍含有一些杂质蛋白,且ni-nta的第二次纯化效果大大下降,杂蛋白条带明显,第三次纯化后需进行ni柱重生。由实验过程得知,采用基于可得然胶的蛋白纯化/固定化双功能离子螯合磁性载体的蛋白,利用载体的磁响应性特点,能在外加磁场下轻易地分离出来,洗脱起来更容易。
本发明虽然已以较佳实施例公开如上,但其并不是用来限定本发明使用,任何领域技术人员在不脱离本发明的精神和范围内,都可以利用上述揭示的方法和技术内容对本发明技术方案作出可能的变动和修改,如cu2+、zn2+、co2+、ni2+、mg2+和ca2+金属离子均已得到验证具备本发明功能。因此,凡是未脱离本发明技术方案技术方案的内容,依据本发明的技术实质对其进行的任何简单修改,均属于本发明技术方案的保护方案。
- 还没有人留言评论。精彩留言会获得点赞!