一种耐热裂解酶MMPpgh和编码此酶的多核苷酸的制作方法
本发明属于生物技术领域,具体涉及一种耐热裂解酶mmppgh以及编码此酶的核酸序列。
背景技术:
裂解酶为噬菌体感染宿主后表达释放的一类细胞壁水解酶,通过水解细胞壁肽聚糖而使细菌裂解,并释放出子代噬菌体。根据作用于细胞壁肽聚糖共价键位点不同,可以将噬菌体裂解酶分为三类,葡萄糖苷酶(glucoseidase)、酰胺酶(amidase)、内肽酶(endopeptidase),它们分别水解氨基糖之间的糖苷键,n-乙酰胞壁酸和l-丙氨酸之间的酰胺键以及肽交联桥。
目前,很多裂解酶的结构得到了深入研究,分歧杆菌噬菌体裂解酶蛋白分为3个区域,典型的c-端区,与噬菌体内肽酶的c-端细胞壁结合区功能相关;中心区域,包含一个与肽聚糖水解酶相关的结构及n-端区域,常为一系列编码肽酶功能的蛋白,它们每个结构域类型均有明显差别,研究已发现6种可能的n-端肽酶结构区,5种酰胺酶/糖苷酶结构区和4种c-端细胞壁结合结构区,可能出现的组合至少120种,其中绝大多数结构分布包含一个n-端肽酶结构区,一个中心酰胺酶/胞壁质酶或糖苷转移酶区及c-端区,但是有一个例外,myrnagp243没有c-端结合区。
近年来,随着抗生素大量滥用,逐渐出现了很多耐药性菌株带来的各种问题,人们迫切需要研究新型的抗菌试剂,而细菌的天敌噬菌体给人们提供了一个全新的思路,使人们逐渐开始多方面探索噬菌体裂解酶的抗菌作用。其中裂解酶作为新型抗菌制剂,能够对细菌进行防治、治疗并具有独特的优点。首先,噬菌体裂解酶不会对动物产生毒副作用,因为它只能作用于病原菌宿主而对其他细菌不产生作用。其次,噬菌体裂解酶的催化结构作用于病原宿主菌的细胞壁肽聚糖,病菌对它不会产生耐药性,同时能够与抗生素联合用药,共同发挥作用。nelson等人实验证明通过重组噬菌体裂解酶纯化能够预防和治疗a型链球菌引起的小鼠粘膜感染。裂解酶能高效裂解细菌,可以抑制细菌的生长,使其有望取代传统的抗生素治疗,特别是对多重耐药性致病菌,也可作为抑菌剂使用于环境的杀菌。
技术实现要素:
本发明旨在提供一种耐热裂解酶mmppgh,该裂解酶能够抑制革兰氏阳性和阴性细菌的生长,其在37~75℃范围内具有催化活性,其来源于亚栖热菌(meiothermus)噬菌体mmp17,该耐热裂解酶mmppgh的氨基酸序列如seqidno:1所示,或具有与seqidno:1所示的氨基酸序列至少90%的相同性的多肽、类似物或衍生物。
本发明的另一个目的是提供编码耐热裂解酶mmppgh的多核苷酸,其核苷酸序列如seqidno:2所示,或其互补序列,或具有与seqidno:2所示的核苷酸序列至少80%相同性的多核苷酸及其互补序列。
本发明的有益效果:
本发明提供的耐热裂解酶能高效裂解细菌,可以抑制细菌的生长,使其有望取代传统的抗生素治疗,特别是对多重耐药性致病菌,也可作为抑菌剂使用于环境的杀菌。
目前报道的裂解酶多为常温型裂解酶,在常温下具有较高活性,本发明所述裂解酶在37~75℃范围内均具有催化活性,在56~65℃催化活性最高,可适用于高温环境的杀菌,其核苷酸序列可用于构建生产此裂解酶的基因工程菌株。
附图说明
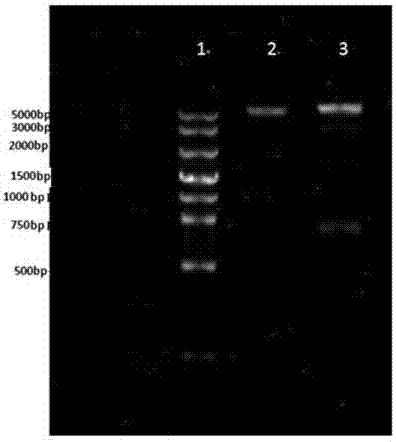
图1是本发明耐热裂解酶mmppgh基因pcr产物电泳示意图,其中泳道1为marker,泳道2为阴性对照,泳道3为mmppgh基因pcr产物,其大小为633bp;
图2是本发明中重组质粒mmppgh/pet28a双酶切图谱示意图,其中泳道1为marker,泳道2为未经双酶切的重组质粒mmppgh/pet28a条带;泳道3为重组质粒mmppgh/pet28a双酶切后的两个条带;
图3是本发明中耐热裂解酶mmppgh的蛋白表达检测示意图,泳道1为genstarm221-01蛋白marker,泳道2、3为诱导后的表达菌株超声破碎后的上清液;
图4是本发明耐热裂解酶mmppgh蛋白的纯化结果检测示意图,其中泳道1为genstarm221-01蛋白marker,泳道2为总蛋白,泳道3为空载总蛋白,泳道4为挂柱透过液,泳道5为30mm咪唑洗脱液,泳道6为150mm咪唑洗脱液,泳道7为750mm咪唑洗脱液;
图5是本发明中温度对耐热裂解酶mmppgh活性的影响结果示意图;
图6是本发明不同ph值对耐热裂解酶mmppgh活性的影响结果示意图。
具体实施方式
下面通过实施例对本发明作进一步详细说明,但本发明的内容并不局限于此,本实施例中方法如无特殊说明的均按常规方法操作,所用试剂如无特殊说明的采用常规试剂或按常规方法配置的试剂。
实施例1:耐热裂解酶mmppgh的克隆和表达
1、裂解酶基因的扩增,(以meiothermustg17的噬菌体mmp17基因组dna为模板)
(1)嗜热噬菌体mmp17裂解酶mmppgh基因的扩增所用引物序列如下:
正向引物:5'-ccggaattcatgcgcatcgttcatccc-3'
反向引物:5'-cccaagcttttgcaatgcgcgatttgt-3';
(2)扩增体系如下:
表1:扩增反应体系
(3)扩增条件如下:
将反应体系混匀,先在95℃预变性3min,然后在95℃变性40s,58℃退火30s,72℃延伸40s,30个循环后,72℃延伸8min。反应完后取产物3μl,在1%琼脂糖凝胶中进行电泳分析(见图1),mmppgh基因pcr产物大小为633bp。
2、裂解酶基因mmppghpcr产物的胶回收
(1)在电泳仪中灌制1.0%琼脂糖凝胶;
(2)将待分离纯化的pcr产物点样电泳,于适当位置停止电泳;
(3)在紫外灯下切下含该目的片断的凝胶,转移到1.5ml的ep管中;
(4)用百泰克生物公司胶回收试剂盒进行目的片段的回收,回收方法按说明书操作进行。3、重组表达载体的构建
为了把目的基因片断连接到表达载体pet28a,就需要使目的片断带有粘性末端的片断,即带有酶切位点;
(1)带有粘性末端线性载体pet28a的制备
为了将目的基因片断连接到表达载体pet28a上,就需要使目的片断带有粘性末端的片断,即带有酶切位点;同样,为了使目的片断能插入载体中,也需要使载体带有粘性末端,并且使它们的酶切位点相同。
a、质粒抽提:用质粒提取试剂盒(百泰克),操作步骤如下:
①菌种活化:无菌接种环蘸取-80℃冻存的菌种保存液,三线法接种于氨苄lb平板,37℃培养12-16小时;
②增菌并收集菌体:取氨苄青霉素5μl(终浓度100μg/ml)加入5mllb培养基中;用接种环挑取阳性克隆,接种于amp+-lb培养基中;然后放入37℃培养箱中,摇床培养,过夜;去3ml培养的菌液,5000rpm,室温离心5min,使菌体沉淀,弃上清液;
③用250μl溶液p1(含rna酶)重悬菌体沉淀,涡旋振荡至彻底悬浮;
④加250μl的溶液p2,温和地上下翻转8次使菌体充分裂解,直到溶液变得清亮;
⑤加400μl溶液p3,立即温和地上下翻转7次,室温放置5分钟,室温13,000rpm离心10分钟,小心取上清;
⑥将吸附柱安置于收集管上,将上一步所得上清液加入吸附柱ac中(吸附柱放入收集管中,溶液太多分可分两次加入),13,000rpm离心1分钟,弃滤液;
⑦加入500μl去蛋白液pe,13,000rpm离心60秒,弃滤液;
⑧加入500μl漂洗液wb,13,000rpm离心60秒,弃滤液;
⑨重复步骤⑦一次,13,000rpm离心60秒,弃滤液,空柱13,000rpm离心2分钟,室温放置5分钟,除去残留乙醇;
⑩取出吸附柱ac,放入一个干净的离心管中,在吸附膜的中间部位加70μl洗脱缓冲液eb(65℃预热),室温放置1分钟,13,000rpm离心1分钟洗脱质粒。
(2)耐热裂解酶mmppgh基因片段和pet-28a质粒的双酶切
①酶切体系如下:
表2:酶切体系
②反应条件:37℃烘箱酶切5h左右,回收mmppgh基因片段和酶切后的pet-28a质粒。(3)重组表达载体的构建、mmppgh蛋白的诱导表达和纯化
①将前面实验得到的带有粘性末端的线性载体pet28a和mmppgh裂解酶基因片段,通过连接转化并用菌落pcr、酶切鉴定(见图2)及测序验证,即可得到重组表达载体。
②耐热裂解酶mmppgh蛋白在大肠杆菌中的诱导表达
将构建好的重组载体mmppgh/pet28a转化至e.colirosetta菌株,得到表达菌株pet28a-mmppgh/rosetta;含重组质粒的菌株经培养过夜,菌液按1%比例接种到kan+(终浓度50μg/ml)的lb液体培养基,37℃摇床培养至其od值0.6-0.8;取出5ml菌液用作对照实验;向余下的菌液加入异丙基-β-d-硫代半乳糖苷iptg(终浓度为1mm),放入37℃、28℃,80rpm摇床诱导培养6小时,取样5ml。
4、耐热裂解酶mmppgh蛋白sds-page检测
将取出的5ml菌液,6000rpm,离心10min,弃上清,加入终浓度为30mm咪唑溶液悬浮菌体,超声波破碎菌体(功率25%,打3s,停4s,共3min),98℃热裂解10min使菌体破释放菌体内蛋白;配制sds-page胶,浓缩胶5%,分离胶12%;按照顺序上样进行电泳(浓缩胶80v,30min;分离胶120v,120min);将sds-page胶取出,加入r-250考马斯亮蓝染色液,沸水浴30min;染色完成后,进行脱色液脱色,脱色2次每次沸水浴30min,观察结果并拍照分析(见图3)。
5、耐热裂解酶mmppgh重组蛋白的纯化
利用上述方法大量诱导含重组质粒mmppgh/pet28a的rossetta菌株,菌液经离心收集大肠杆菌菌体(4℃,4,500rpm,20min)。用30mm咪唑溶液悬浮菌体后进行超声波破碎,4℃,13,000rpm离心10min,上清用镍柱进行手工纯化,先用10倍柱体积ddh2o清洗柱子,再用10倍柱体积30mm咪唑平衡柱子,样品上柱,分别用10倍柱体积的(150mm、500mm、750mm)咪唑洗脱柱子,再用10倍柱体积ddh2o清洗柱子,最后用20%无水乙醇填充柱子,用缓冲液(50mmtris-hcl,ph7.9)透析,酶2小时更换一次透析液,共透析10小时,纯化的重组蛋白组分进行sds-page检测(见图4)。
6、耐热裂解酶mmppgh重组蛋白的浓度及活性测定
(1)bradford法测定裂解酶mmppgh重组蛋白的浓度
取干净的4ml离心管,按顺序标号,空白、标1、标2、标3、标4、标5、标6。分别加入标准蛋白溶液(1mg/ml的标准蛋白bsa溶液)、待测样品溶液、ddh2o、考马斯亮蓝g-250储存液,混匀。用紫外分光光度计测其波长为600nm处的吸光度值,以浓度为0mg/ml的bsa溶液作为空白对照。以蛋白浓度为横坐标,od600值为纵坐标,绘制标准曲线。计算公式:待测样品蛋白浓度(mg/ml)=测定样品的od600值/标准蛋白的od600值×标准蛋白的浓度×稀释倍数得标准曲线方程为:y=0.0253x+0.0053(r2=0.9967),将纯化后得裂解酶mmppgh测其od600吸光值,测得od值为0.122,计算得到蛋白浓度为0.231mg/ml。
(2)folin-酚法测定裂解酶mmppgh对酪蛋白水解酶活测定
①标准曲线制备
取干净的50ml离心管,按顺序标号,空白、标1、标2、标3、标4、标5。将100μg/ml酪氨酸(ml)标准液与不同体积的ddh2o配成不同标准浓度,总体积为10ml;分别吸取上表中不同浓度的酪氨酸溶液1ml,各加入0.4mol/l碳酸钠溶液5ml,再加入购买的福林试剂1ml;摇匀后放置于40℃水浴锅中,保温发色20min,测量od值600并记录;得到标准曲线方程y=0.0107x-0.0336(r2=0.9961)。
计算公式y=a×n×4/10(公式:y:样品的酶活力,单位u/ml;a:样品测得的od值,代入标准曲线后计算得到的酪氨酸微克数;n:酶液的稀释倍数;10:反应时间为10min,以1min计;4:反应试剂的总体积,ml)
酶活单位定义:1ml酶液,在一定温度和ph条件下,1min水解酪素产生1μg酪氨酸为一个酶活单位,以u/ml表示。
②酶活测定
吸取样品稀释液1ml,置于40℃水浴锅中预热2min,然后加入经同样预热的2%酪蛋白1ml,精确保温10min,时间到后,立即再各加入0.4mol/l的三氯乙酸2ml,以终止反应,继续置于水浴锅中保温20min,使得残余蛋白质沉淀。注射器吸取含有沉淀的溶液,将溶液使用0.45μm滤膜过滤,然后吸取滤液1ml,再加入0.4mol/l碳酸钠5ml,已稀释的福林试剂1ml摇匀,40℃保温发色20min后进行光密度(od)测定。
测定结果:od600值为0.215,代入标准曲线方程y=0.0107x-0.0336(r2=0.9961)计算得到酪氨酸含量23.2μg。将所得酪氨酸含量值代入公式y=a×n×4/10,计算得到酶活为223u/ml。
实施例2:耐热裂解酶mmppgh部分酶学性质及酶活性实验
1、耐热裂解酶mmppgh最适作用温度、ph值及金属离子对耐热裂解酶mmppgh的影响
为研究裂解酶mmppgh最适作用温度,ph值及金属离子对裂解酶的影响,采用培养至对数期的tg17菌液;将对数生长期的tg17菌液,4500rpm离心20min后,弃上清。沉淀以10mlpbs(ph7.4)悬浮后,超声破碎,离心得沉淀,将沉淀重新使用5mlpbs悬浮。此时tg17细胞壁均为细胞碎片,以此作为裂解酶mmppgh的反应底物。测得tg17反应底物的初始od600值=0.241。
(1)耐热裂解酶mmppgh的最适催化温度
将纯化后的裂解酶mmppgh加入制备好的tg17反应底物中,然后置于不同温度反应5h,反应温度分别是37℃、45℃、50℃、56℃、65℃、70℃、75℃。根据反应前后od600的变化量确定其最适催化温度(图5),如图5所示,其催化温度范围为37-75℃,在65℃催化活性最高,可见耐热裂解酶mmppgh具有明显的高温催化活性。
(2)耐热裂解酶mmppgh的最适催化ph
将纯化的裂解酶mmppgh加入制备好的tg17底物中,分别在不同ph值的磷酸盐缓冲液中,相同温度(最适作用温度)下,作用时间5小时,根据反应前后od600的变化量确定其最适ph(图6),如图6所示,其最适催化ph为7-8。
2、耐热裂解酶mmppgh对菌株生长的影响
按1%接种量,接种e.coli、沙门氏菌、金黄色葡萄球菌和耐药性肺炎克雷伯菌到lb液体培养基中,37℃150rpm培养至对数生长期。吸取20μl纯化后的mmppgh酶液与80μl处于对数生长期的菌液混合,37℃恒温培养50min后,将反应后的混合液稀释到合适的倍数,涂布平板,过夜培养后,统计实验组与空白对照组平板单菌落数,计算致死率。空白对照组为20μlddh2o代替酶液。
将反应后的混合液稀释后涂布平板,由涂布结果知,每组实验组和空白对照组平板上的单菌落数并不一致,计算后得大肠杆菌致死率为52.2%;沙门氏菌致死率为87.5%;金黄色葡萄球菌致死率为53.9%,耐药性肺炎克雷伯菌致死率为89.4%(表3)。
表3:裂解酶mmppgh对不同菌株生长的影响结果
3、不同金属离子对酶活的影响
将纯化的裂解酶mmppgh加入制备好的tg17底物中,混合液中加入不同金属离子mn2+、ca2+、mg2+、zn2+、cu2+、k+,并保持离子浓度为2mmol/l,最适作用温度和最适ph条件下,作用时间5小时,测定od600值。其中空白实验组中使用ddh2o代替金属离子。我们把能提高酶活的金属离子称为没得激活剂。反之,则称酶的抑制剂。mg2+、zn2+对酶有激活作用,尤其是mg2+离子。而ca2+、k+、mn2+对酶有抑制作用(表4)。
表4:金属离子对mmppgh酶活的影响
序列表
<110>昆明理工大学
<120>一种耐热裂解酶mmppgh和编码此酶的多核苷酸
<160>4
<170>siposequencelisting1.0
<210>1
<211>210
<212>prt
<213>噬菌体mmp17(phagemmp17)
<400>1
metargilevalhispropheproglnproalaargalaargvalasp
151015
alaglypheleuaspproargtyrproglntrpargargalaalagly
202530
leualaproalagluhisthrglyvalasptyrasnleuvalglythr
354045
serglyaspalaaspleuglytyrprovalvalalametalaaspgly
505560
ilevalarghisalaargalahisargiletrpglyasnilevalleu
65707580
leugluhisproglnleuglyleutrpserglntyralahisleutyr
859095
glnleualavalaspalaglyglngluiletrpalaglygluproleu
100105110
glyserileglyargglyaspproargalapropheleualahisleu
115120125
hisphegluileargthrargproleuproalaaspasntrpprogly
130135140
metasnlysthralailelysgluglytyrleuaspprogluthrtrp
145150155160
leulysglnhismetalathrgluargargphethrargglnglyleu
165170175
valleutrpleuproaspglylyshissermetproglylysthrile
180185190
valasnleuaspaspprothrleuvalhisvalargthrasnargala
195200205
leugln
210
<210>2
<211>636
<212>dna
<213>噬菌体mmp17(phagemmp17)
<400>2
atgcgcatcgttcatcccttcccccaacctgcccgagcccgcgtagacgcgggcttttta60
gatccccgctatccccagtggcgacgggcagctgggctggccccggctgaacacacaggg120
gtggactacaacctggtaggcaccagcggtgatgctgacctgggttatccggtggtagca180
atggccgatggcattgttcggcatgcccgtgcgcaccgcatttggggaaatatcgttctg240
ctcgagcatccccaattgggcctgtggagccagtacgcccatctgtaccagttggccgta300
gatgcagggcaggaaatctgggccggggaaccgctgggcagcatcggcaggggggaccct360
cgagctcccttcctggcccacctgcatttcgagatacgcacgcgtccgctccccgccgac420
aactggccggggatgaacaaaactgcgataaaggagggatatctggatccggaaacatgg480
tggctgaagcagcatatggcgaccgagcggcggttcacccggcaggggctcgtcctgtgg540
ttgccagatggaaaacacagtatgcctggcaagacaatcgtcaatctagacgatccaacg600
ttagtgcatgtgcgtacaaatcgcgcattgcaatag636
<210>3
<211>27
<212>dna
<213>人工序列(artificial)
<400>3
ccggaattcatgcgcatcgttcatccc27
<210>4
<211>27
<212>dna
<213>人工序列(artificial)
<400>4
cccaagcttttgcaatgcgcgatttgt27
- 还没有人留言评论。精彩留言会获得点赞!