番茄基因SlSAUR58在调控番茄生长和抗旱性中的应用的制作方法
本发明涉及一种本发明涉及植物基因工程和分子育种领域,尤其涉及番茄基因slsaur58在调控番茄生长和抗旱性中的应用。
背景技术:
番茄是世界上栽培最为普遍的蔬菜之一,在我国蔬菜生产与消费中占有重要地位。因此番茄的产量、质量、抗逆性等性状吸引了全世界许多人进行研究。番茄的营养生长过剩会浪费过多地土地和肥料,同时过剩地营养生长会抑制生殖生长;而随着全球水资源日益匮乏,干旱逆境越来越成为限制番茄产量和质量的重要逆境。目前对于调控番茄营养生长和干旱逆境的关键基因还较少涉及,同时调控番茄营养生长和干旱逆境的基因还没有报道。激素信号在番茄的生长和逆境调控中发挥十分重要地作用,生长素、细胞分裂素等激素在番茄营养生长过程中行使重要调控作用,尽管生长素是最早被鉴定出来的一类植物激素,它可以通过调控细胞分裂、膨大及分化来影响植株生长发育的许多过程。近几十年的研究使人们对生长素信号传导途径以及分子水平上的调控机制有了比较深入的了解。但是有关生长素原初反应基因中的数量最多的一个基因家族smallauxin-uprnas(saurs)在生长素信号传导途径的作用尚不清楚。saurs在植物抗逆过程中的功能研究尚未涉及。番茄slsaur家族基因是一类生长素原初响应基因,有99个家族成员,其中slsaur58是一个组氨酸富集的saur蛋白,具有组织表达特异性,是一个在番茄叶片中优势表达的基因。
技术实现要素:
本发明提供了一种番茄基因slsaur58在调控番茄生长和抗旱性中的应用。该基因过量表达能抑制番茄的营养生长,提高番茄的抗旱性。
本发明采用以下技术方案:番茄基因slsaur58在调控番茄生长和抗旱性中的应用,所述番茄基因slsaur58的核苷酸序列如seqidno.1所示。
进一步的,上述应用具体为:通过遗传转化手段将番茄基因组中的slsaur58基因进行过量表达,番茄植株的抗旱性增强,营养生长减弱;将番茄基因组中的slsaur58基因进行抑制表达,番茄植株的抗旱性减弱,营养生长增强。
与现有技术相比,本发明具有以下有益效果:
本发明通过遗传转化手段,将slsaur58基因在番茄中过量或抑制表达,通过一系列实验证明,与野生型和干涉表达植株相比,slsaur58基因过量表达转基因番茄的株高降低,叶片数目和面积减小,营养生长受到抑制,但抑制该基因表达能增加植株生物学产量,促进植株的营养生长过程。与此同时,本发明发现过表达slsaur58基因可使得植株的抗旱性显著提高,证实了其在番茄抗性品种选育中的作用。
附图说明
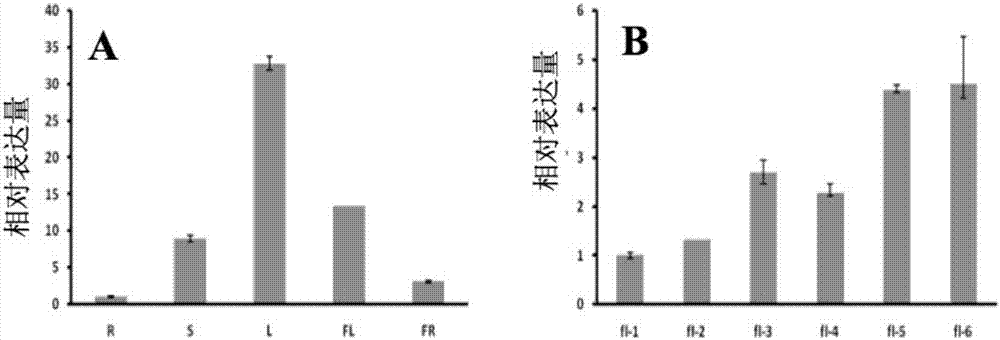
图1为实施例1中利用qrt-pcr分析番茄基因slsaur58在番茄的不同器官及花的不同时期的时空表达特性:其中,(a)为slsaur58在番茄不同器官中的表达模式,r:根,s:茎,l:叶,fl:花,fr:果实。(b)为slsaur58在番茄花的不同发育时期的表达。fl-1到fl-6分别代表番茄花粉母细胞时期、四分体时期、单核小孢子早期、单核小孢子中后期、双核小孢子时期、花粉成熟期这6个发育时期的花蕾。方差利用±sds表示,三次生物学统计。
图2为slsaur58启动子时空表达模式分析。其中,(a)为slsaur58启动子序列的分离。箭头所指条带1299bp,是目的条带slsaur58启动子片段;(b)为荧光下洋葱表皮细胞中绿色荧光蛋白瞬时表达信号,具有启动子活性;(c)为对应的白场下洋葱表皮细胞;(d-h)为转化pbgwfs7.0::pslsaur58-gus-gfp载体到拟南芥中,筛选得到的t2代阳性植株的不同器官的gus组织化学分析。d:花序;e:根;f:茎;g:叶片;h:角果。
图3为番茄品种“micro-tom”中slsaur58过表达植株slsaur58基因表达水平分析。其中,(a)为利用qrt-pcr检测slsaur58不同过量表达株系中的表达水平;(b)slsaur58在slsaur58不同干涉表达株系中的表达水平。方差利用±sds表示,三次生物学统计。
图4slsaur58过表达以及抑制表达影响番茄品种‘micro-tom’的营养生长。其中,(a)和(b)为野生型和转基因过表达番茄的叶片和植株形态比较,(c)、(d)、(e)为过表达株系(y58-3)、rnai表达株系(58i-4)以及野生型植株(wt)平均株高、单叶面积和平均单株鲜重的比较。**代表显著性分析时p值<0.01,有显著性差异。
图5slsaur58不同转基因番茄植株的花粉活力及花的长度统计。(a-d)对过表达株系yfp58-3(a)、yfp58-4(b)、干涉株系58i-4(c)以及野生型对照(wt)的成熟花粉进行亚历山大染色并拍照。(e)过表达株系yfp58-3、yfp58-4、干涉株系58i-4与对照的花粉活力统计,(f)过表达株系yfp58-3、yfp58-4、干涉株系58i-4与对照花的长度比较。方差利用±sds表示,三次生物学统计。
图6为干旱胁迫对番茄“micro-tom”叶片中slsaur58表达的影响
图7为番茄“micro-tom”slsaur58过表达株系yfp58-3对干旱逆境的响应。其中,(a)为离体叶片不同时期的失水率;(b)为利用叶绿素荧光仪测定干旱处理20d后叶片的叶绿素荧光;*代表显著性分析时p值<0.05,有显著性差异。
图8番茄品种“ailsacrag”过量表达slsaur58不同株系表达以及植株生长。其中(a)为过表达不同株系slsaur58的表达变化;(b)为过表达株系s58-18株系与野生型对照(wt)植株生长比较。
图9为slsaur58过表达影响番茄品种‘ailsacrag’的营养生长。植株生长20至60dslsaur58过表达植株的株高、叶片面积、叶片数目、鲜重及干重比较。
具体实施方式
本发明利用生物信息学的手段首次在全基因组的水平上分离鉴定了番茄中的小生长素诱导表达rna(smallauxin-upregulatedrna,saur),通过进一步的分析,发现一组富含组氨酸的saur基因,包括slsaur58与slsaur59,组氨酸含量分别为22.5%与17.4%,串联重复分布在6号染色体上。slsaur58具有组织表达特异性,是一个在番茄叶片中优势表达的基因。本发明将slsaur58基因在番茄中过量和干涉表达,通过表型观察和抗旱性实验等一系列实验发现,基因slsaur58番茄过量表达植株与野生型相比,植株矮化,叶片面积减小,营养生长被抑制,但是抗旱性提高,同时,本发明还发现slsaur58可以与细胞分裂素响应蛋白type-arr和aba响应蛋白pp2c互作,分别通过细胞分裂素和aba途径调控番茄的营养生长和抗旱性响应。
针对基因slsaur58调控植物生长的适用范围,本发明提供了矮生番茄“micro-tom”,普通栽培番茄“ailsacrag”等基因型的验证试验,发现在不同基因型中,slsaur58基因参与调控番茄的生长与干旱响应过程。其中,番茄品种“micro-tom”、加工型番茄品种“ailsacrag”均来自于美国uc-davis番茄种质资源库。
本发明番茄slsaur58基因的编码的核苷酸序列如seqidno:1所示,氨基酸序列如seqidno:2所示,启动子序列如seqidno:3所示。
本发明所述的番茄生长包括番茄的叶片发育、株高、生物学产量等营养生长过程。
实施例1slsaur58基因在番茄不同组织和器官中的时空表达
以番茄品种“micro-tom”的根、茎、叶、花和果实的cdna为模板,检测slsaur58在番茄不同部位的时空表达,slsaur58-s:
ccaatactggaagacaccc(seqidno:4);slsaur58-a:
cacaaacaccaccatcacc(seqidno:5)。如图1所示slsaur58在番茄根中的表达最低;在叶片中的表达最高,能达到根中表达的30多倍。进一步对slsaur58在番茄6个时期的花中的表达进行检测发现,随着花的发育,slsaur58的表达呈逐渐上升的趋势。
实施例2slsaur58对干旱胁迫的响应模式
将生长至4周左右的番茄“micro-tom”植株置于湿度为40%的培养箱中,进行缺水处理,在缺水处理后的第0d、3d、6d和9d时,对相同叶位的叶片进行取材进行定量分析。qrt-pcr分析发现,在干旱处理的番茄植株的叶片中(图7),slsaur58的表达量显著性的上升,在干旱处理后的6d,slsaur58的表达量达到最高值,是对照的6倍左右,干旱胁迫能明显的诱导slsaur58的表达。
实施例3slsaur58基因的启动子分析
本研究在番茄sgn数据库中分离了slsaur58上游2000bp的启动子序列,在plantcare网站中对这个启动子的顺式作用元件进行预测,结果发现,在slsaur58的启动子中包含了生长素诱导(tga-element)、aba(abre)以及ga(gare-motif)响应元件。
本研究进一步设计了特异性引物:p58-s(seqidno:6)和(p58-aseqidno:7),扩增分离了slsaur58基因上游1302bp的启动子序列(包含以上激素相关元件)(图2a),构建了slsaur58的启动子载体,即pslsaur58::gus-gfp-pbgwfs7.0,发现slsaur58的基因上游的1300bp启动子序列能启动绿色荧光蛋白的表达,说明分离得到的slsaur58的启动子序列具有启动活性如图2b和c。通过浸花法将所构建载体转化到拟南芥中,自交后获得t2代阳性植株,对其不同器官的gus组织化学分析,观察slaur58启动子启动gus蛋白在拟南芥中不同组织和器官中的表达如图2d-h。
slsaur58启动子能启动gus蛋白在拟南芥的不同部位遍在表达,但在不同组织与器官中表达水平存在显著差异,在角果中的表达相对较低,在拟南芥根、茎、叶以及花器官中均有较高表达,且在叶片的叶脉中表达更高。
实施例4番茄slsaur58过量和干涉表达番茄植株的获得
(1)slsaur58过量表达番茄植株的获得
过量表达载体构建:slsaur58cds序列的扩增:利用trizol试剂从番茄‘micro-tom’4片真叶的幼苗中提取总rna,再利用高保真酶kod-plus-neo(toyobo公司)从叶片的cdna模板中扩增slsaur58基因序列,由于需要表达pb7ywg2.0-yfp载体的绿色荧光蛋白,slsaur58的cds片段在扩增时需要将终止密码子替换掉,利用topo异构酶连接入门载体时扩增目标片段的上游引物5’端应加‘cacc’四个碱基。扩增slsaur58上游引物:5’-cacctgtaacaatgggtagtggag-3’(seqidno:8)下游引物:5’-taaaccccaggccttatagc-3’(seqidno:9),pcr扩增程序参照kod-plus-neo说明书。利用pentrtmdirectional
(2)番茄slsaur58amirna干涉载体的构建
首先在wmd中blast比对,获得候选序列,以植物中的microrna164为骨架,对筛选出的干涉片进行改装。筛选设计出的slsaur58amirna干涉片段如seqidno:10,将设计好的干涉片段与植物表达载体pcambi1301一并送到上海英捷维基生物公司进行片段合成及载体构建,最终得到p35s::pcambia1301::slsaur58-amirnai载体。将目的载体转化农杆菌gv1301,通过农杆菌介导法转入番茄中,进行pcr和gus检测筛选阳性株系,过表达植株pcr检测所用上游引物:5’-agttcaccttgatgccgttc-3’(seqidno:11),下游引物:5’-ttaaactcgtaaacctcag-3’(seqidno:12)。干涉植株所用的pcr检测引物是在pcambia1301骨架上的hptii基因设计的通用检测引物,上游引物为:5’-gatgttggcgacctcgtatt-3’(seqidno:13)下游引物为:5’-cgttatgtttatcggcactttg-3’(seqidno:14),鉴定3株以上单拷贝插入的纯合过量表达转基因番茄。
(3)lsaur58基因番茄过量和干涉表达转基因植株分子鉴定
取slsaur58转基因不同株系的叶片,提取总rna,进行荧光实时定量pcr检测,检测转基因植株中slsaur58的表达上升的水平。利用pcr和gus检测从slsaur58转化“micro-tom”株系中筛选出slsaur58过表达株系有11个株系,通过qrt-pcr的检测slsaur58基因表达,slsaur58过量表达株系中过表达水平最显著的是yfp58-4,过量表达了约5倍;从转化p35s::pcambi1301-ath-mir164a-saur58i干涉载体得到转基因株系中筛选出7个阳性株系,下调表达最明显的是58i-4,下调表达到小于对照的10%。
以上结果证明本实验所采用的实验材料确实是slsaur58基因过量或干涉表达的。
实施例5slsaur58基因对番茄生长和抗旱性的调控
按照实施例3的方法,将slsaur58过表达载体转化到番茄品种“micro-tom”中,获得slsaur58过量和抑制表达的转基因t2代番茄幼苗,种植于人工气候室内,在转基因植株生长过程中,对其鲜重、干重、叶片面积、株高等指标进行观察测量。研究发现slsaur58过量表达使番茄品种“micro-tom”出现植株矮化,叶片变小卷曲的表现。在植株生长不同时期,对不同转基因型进行株高统计发现,slsaur58干涉表达株系58i-4的株高与对照都没有明显的差异,但是过表达株系yfp58-3的株高在生长到20d,40d和60d时,都极显著性地低于对照。另外,在植株生长到30d左右时,对slsaur58过表达植株的叶片进行观测发现,slsaur58过表达植株的叶片面积明显比对照和干涉表达植株的叶片面积小(图4)。值得注意的是,无论在过表达还是抑制表达植株中,花粉活力以及花粉萌发率均不受影响,植株能够正常地着果(图5),说明slsuar58特异性地调控植株的营养生长。
为了检测番茄转基因植株抗旱性,将生长至4周左右的番茄“micro-tom”转基因植株与野生型对照置于湿度为40%的培养箱中,进行缺水处理,每个转基因株系不少于20棵番茄苗,并同时进行三次生物学重复,约20d的缺水处理之后,对slsaur58过表达株系yfp58-3和yfp58-4进行了离体叶片失水率的统计,结果发现,slsaur58过表达株系yfp58-3和yfp58-4的叶片失水率比对照低,当叶片离体12h后,失水率同对照比,达到显著差异(图7a),说明过量表达slsaur58可提高番茄气孔的敏感性,及时关闭气孔,从而提高抗旱性;同时,本研究还发现在缺水处理20d左右后,对yfp58-3过表达株系叶片的叶绿素荧光进行检测,发现其光合效能明显高于对照(图7b)。
按照实施例3的方法,slsaur58过表达载体同样地转化到番茄品种“ailsacrag”中,如图8所示,出现了与在“micro-tom”番茄中相似的表型,在植株生长的20d开始,每隔10d进行一次观察统计,发现从植株生长的20d至60d,slsaur58过表达植株s58-15和s58-16两个株系的株高和叶片数目相比与野生型始终发生显著性降低,而分别从30d和40d开始,过表达植株的鲜重和叶片面积比对照显著性降低,本研究再次证明slsaur58对营养生长影响非常显著(图9)。
综合以上研究,本发明发现了slsaur58参与调控番茄茎的伸长、叶片生长、鲜重增加等营养生长过程以及番茄植株的抗旱性。
序列表
<110>浙江大学
<120>番茄基因slsaur58在调控番茄生长和抗旱性中的应用
<160>14
<170>siposequencelisting1.0
<210>1
<211>390
<212>dna
<213>未知(unknown)
<400>1
atgggtagtggagatcacaaacaccaccatcaccatttgaatttccatgttcaagtgcat60
ctacctcacatccattttcaccatcaccatcatcatcaacacgaacatggtataaaagaa120
attatgggcatcccaaaggggtgtcttccagtattggtaggtcatgatggagaagaacaa180
cacaagttcataatcccagtgatatacatcaaccatccactttttacacaattgttaaaa240
ggtaatgaagaagaatgtgaacttcatcatgatggacctatgaatatcccttgtcatgtc300
gaagaatttcgatacgttgaaggtatgatcgacaaagaaactcatgccaccggacatcat360
aaccaccatgcttggtgctataaggcctga390
<210>2
<211>129
<212>prt
<213>未知(unknown)
<400>2
metglyserglyasphislyshishishishishisleuasnphehis
151015
valglnvalhisleuprohisilehisphehishishishishishis
202530
glnhisgluhisglyilelysgluilemetglyileprolysglycys
354045
leuprovalleuvalglyhisaspglyglugluglnhislyspheile
505560
ileprovaliletyrileasnhisproleuphethrglnleuleulys
65707580
glyasnglugluglucysgluleuhishisaspglyprometasnile
859095
procyshisvalgluglupheargtyrvalgluglymetileasplys
100105110
gluthrhisalathrglyhishisasnhishisalatrpcystyrlys
115120125
ala
<210>3
<211>1302
<212>dna
<213>未知(unknown)
<400>3
gggagtagagtaagaggaaatggtgaagtggggtaaaaaaatactttatactttatttta60
taatttttaaaaaaatactttttctagtttaattgtgcgaaagctattctttttagttta120
tttttaaaaacatctttataaattgaaaaataggttgatctgaatttattgttaaccctt180
aatgaaaagtttaattttataaaaaatcatattccaaacctttaacaatcctaatcatgg240
cttgaaagtcataataattaaatttgagcctaattgaatttagttacacgtttaattgag300
aagaaatggttatacttttcaactctgaagggaagattaagaattgtatgttatttatag360
atgcaattataatttataaggtaatctttttaaaattcttcctctcttttttttcaaata420
tatttttcatagacaaagcaaactttttcttaccttccaaaattttgcaattgttagcac480
tccacgtatgtactctttcaatgttttttataccaaatttttgtcttgtatttcgtgtaa540
tcatataattgctaatcaaaaaaatgcaaataaaattctgtttttttgtctaatagctaa600
ctttaatttcgtggtaggataaattaatccatcattaaaaaaaattataaatcaatttaa660
gtaacaataatattgtttaattggaagcttcatattgactttttttttttatatatatat720
tctagttataattattgaatatatttttaccaaaaaatatttataatttagacaaactta780
tctacatgtttaataaccgtataattatatttgttttacccaaataattaatttattttt840
ttaaaaaaatacattctaacgacctatgtaattatcagattgtgtaattactaatattac900
aaatgagcgggtaatgacacatcattttttcaaataataatatatttaaaatcacaaact960
ttaatttttttttttttgaaaaattggtaaccaagtaaaaaggttcacatgaattaaaat1020
tgatgagtattagtagttatcaatttagacttttcaatattttatatatctcaaataata1080
atatatttaaaatcacaaactttaatttatttttttttgaaaaattggtaaccaagtaaa1140
aaggttcacatgaattaaaattgatgagtattagtagttatcaatttagacttttcaata1200
ttttatatatcacattacaatatgcccttttacatattcaaaacaagtcctttatccttg1260
cctatataaacaccaatctttaccattcaacaacaccctcaa1302
<210>4
<211>19
<212>dna
<213>未知(unknown)
<400>4
ccaatactggaagacaccc19
<210>5
<211>19
<212>dna
<213>未知(unknown)
<400>5
cacaaacaccaccatcacc19
<210>6
<211>29
<212>dna
<213>未知(unknown)
<400>6
caccgggagtagagtaagaggaaatggtg29
<210>7
<211>25
<212>dna
<213>未知(unknown)
<400>7
ttgagggtgttgttgaatggtaaag25
<210>8
<211>24
<212>dna
<213>未知(unknown)
<400>8
cacctgtaacaatgggtagtggag24
<210>9
<211>20
<212>dna
<213>未知(unknown)
<400>9
taaaccccaggccttatagc20
<210>10
<211>129
<212>dna
<213>未知(unknown)
<400>10
ggggtaccgggtgagaatctccatgttgatgtgaggtagatgcacttaaccaacaaacac60
gaaatccgtctcatttgcttattaagtgcacctaaatcacatcaacatgagctcttcacc120
ctctagagc129
<210>11
<211>20
<212>dna
<213>未知(unknown)
<400>11
agttcaccttgatgccgttc20
<210>12
<211>19
<212>dna
<213>未知(unknown)
<400>12
ttaaactcgtaaacctcag19
<210>13
<211>20
<212>dna
<213>未知(unknown)
<400>13
gatgttggcgacctcgtatt20
<210>14
<211>22
<212>dna
<213>未知(unknown)
<400>14
cgttatgtttatcggcactttg22
- 还没有人留言评论。精彩留言会获得点赞!