一种二苯并呋喃衍生物及其制备方法和用途与流程
本发明涉及一种二苯并呋喃衍生物及其制备方法和用途。
背景技术:
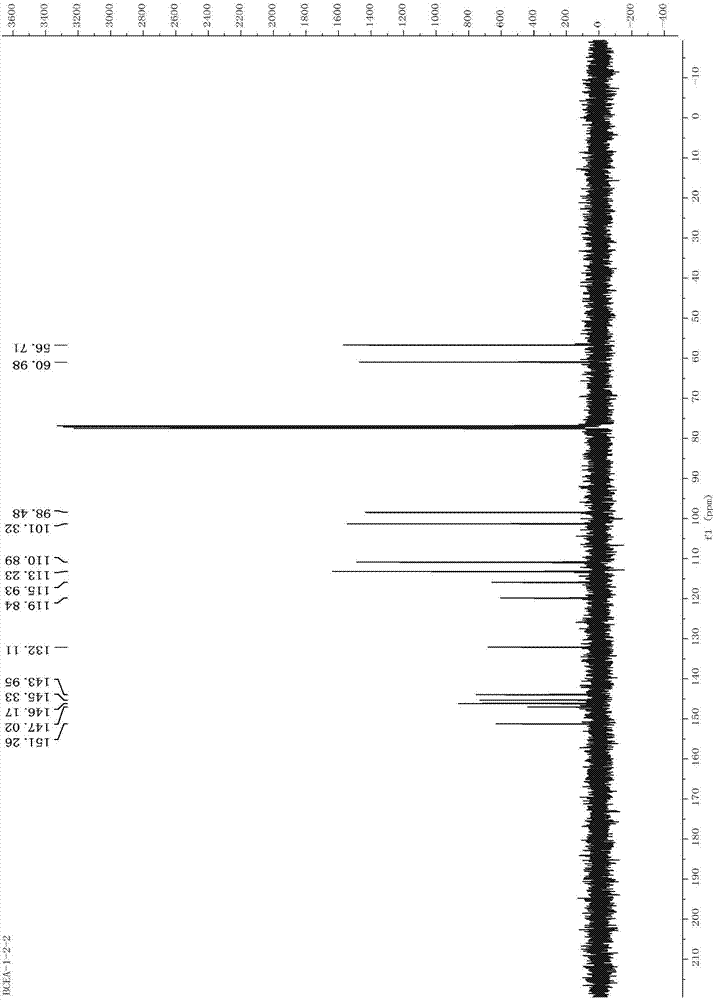
:龙须藤(bauhiniachampioni(benth.)benth)为豆科羊蹄甲属木质藤本植物,别名为羊蹄藤、乌郎藤、过岗圆龙、九龙藤、五花血藤、梅花入骨丹、燕子尾等,分布于浙江、江西、福建、广东、广西、湖南、湖北、贵州等省区,其性平、苦涩、无毒,具有祛风除湿、行气活血的功效,临床用于治疗风湿性关节炎、腰腿疼、跌打损伤等症,民间主要用于治疗胃脘痛、风湿关节痛、急慢性腰腿痛等。虽然龙须藤植物具有较好的疗效,但并未得到充分的研制与开发利用。进一步明确龙须藤的成分,为日后进一步利用龙须藤植物资源,研制出具有明确药效的药物奠定了一定的理论基础。技术实现要素:为了解决上述问题,本发明提供了一种二苯并呋喃衍生物及其制备方法和用途。本发明提供了式ⅰ所示的化合物、或其立体异构体、或其药学上可接受的盐、或其溶剂合物、或其前体药物、或其代谢产物:本发明提供了一种制备式ⅰ所示化合物的方法,它包括以下步骤:(1)取龙须藤根茎,粉碎,加入乙醇,冷浸提取,得提取液,浓缩,得浸膏;(2)将浸膏加入水中,萃取,浓缩,得提取物;(3)取步骤(2)所得提取物,采用硅胶柱色谱,以氯仿为洗脱剂进行洗脱,收集洗脱液得fr.1;(4)取组分fr.1,采用ods反相色谱柱,依次以甲醇:水=50:50、55:45、65:35为洗脱剂进行梯度洗脱,于65:35洗脱收集得fr.1c;(5)取组分fr.1c,采用sephadexlh-20柱,以甲醇洗脱,收集得洗脱液;(6)取步骤(5)所得洗脱液,经制备型hplc,以50%乙腈作为洗脱剂,收集洗脱液得式ⅰ所示的化合物。步骤(1)中,所述乙醇的体积分数为50%~100%,优选为90%。步骤(1)中,所述龙须藤根茎与乙醇的质量体积比为1:1.5~2.5kg/l,优选为1:2kg/l。步骤(1)中,所述冷浸提取的次数为3次,每次3天。步骤(2)中,所述浸膏与水的质量体积比为1:2.5~3.5kg/l,优选为1:3kg/l。步骤(2)中,所述萃取是依次用石油醚和乙酸乙酯萃取;所述提取液是由乙酸乙酯萃取液浓缩得到。步骤(6)中,所述收集洗脱液是收集保留时间11.95-12.50min的洗脱液。前述化合物、或其立体异构体、或其药学上可接受的盐、或其溶剂合物、或其前体药物、或其代谢产物在制备治疗类风湿性关节炎药物中的应用。本发明提供了一种药物,它是以前述化合物、或其立体异构体、或其药学上可接受的盐、或其溶剂合物、或其前体药物、或其代谢产物,加上药学上可接受的辅料制备而成的制剂。本发明提供了一种全新的式ⅰ所示化合物,该化合物具有较好的抗类风湿性关节炎作用,为临床上筛选和/或制备抗类风湿性关节炎药物提供了一种新的选择。显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。附图说明图1为化合物i的1hnmr(400mhz,cd3od)谱图;图2为化合物i的13cnmr(100mhz,cd3od)谱图;图3为化合物i的hsqc(100mhz,cd3od)谱图;图4为化合物i的hmbc(100mhz,cd3od)谱图;图5为化合物i的1h-1hcosy(100mhz,cd3od)谱图;图6为化合物i的noesy(100mhz,cd3od)谱图;图7为化合物i对滑膜细胞的增殖抑制作用;图8为大鼠造模后情况;图9为各组大鼠给药后的精神状况;图10为各组大鼠的足肿胀-足趾厚度情况;图11为各组大鼠的足肿胀情况;图12为各组大鼠滑膜组织病变情况;图13为各组大鼠滑膜组织的病理切片图(he染色×200)(注:红色箭头表示血管扩张充血,黄色箭头表示炎症细胞浸润)。具体实施方式本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。1)药材与试剂龙须藤于2011年4月采集于福建省福州市闽侯县(e119.22,n25.88),经福建中医药大学药学院中药教研鉴定卢伟教授鉴定为豆科羊蹄甲属植物龙须藤bauhiniachampioni(benth.)benth。凭证标本存放于福建中医药大学药学院标本室。石油醚、氯仿、甲醇、丙酮、乙醇、乙酸乙酯(ar,广东西陇化学试剂厂);柱层析用硅胶及薄层层析用硅胶(青岛海洋化工厂分厂);葡聚糖lh-20凝胶(amershamblosclences公司);xad-2大孔树脂(天津南开大学化工厂);薄层色谱板(merck公司);反相硅胶(merck公司);f12培养基、胰蛋白酶、磷酸盐缓冲液、胎牛血清和双抗(均购自hyclone公司);噻唑蓝(美国sigma公司);醋酸泼尼松(浙江仙琚制药股份有限公司,国药准字h33021207,批号:130649);牛ii型胶原、完全弗氏佐剂、不完全弗氏佐剂(美国chondrex公司);生理盐水(福州海王福药制药有限公司);高效切片石蜡(上海华申康复器材有限公司);苏木素-伊红染液(南京建成科技有限公司);二甲苯(国药集团化学试剂有限公司产品);中性树胶(上海华申康复器材有限公司)。2)主要仪器brukerav-400mhz核磁共振仪(瑞士bruker公司);finnigan-mat-95-ms质谱仪(美国thermofinnigan公司);varian7.0tfticr-ms高分辨质谱仪(美国varian公司);avatar360红外光谱仪(美国nicolet公司);液相色谱spd-10a检测器和lc-6ad恒流泵(日本岛津公司);自动部分收集器(上海青浦沪西仪器有限公司);显微熔点测定仪(河南豫华仪器有限公司xt5-10型);eyelan-1001型旋转蒸发仪(日本东京理化有限公司);十万分之一电子天平(美国mettlertoledo公司xs105du型);电子天平(奥豪斯仪器(常州)有限公司nvl2101b型);kq-500de型数控超声波清洗器(昆山市超声仪器有限公司);紫外分析暗箱(武汉药科新技术开发有限公司yoko-zx);离心机(金坛市富华仪器有限公司fuhe800型);恒温水浴锅(常州国华电器有限公司hh-4);干燥箱(上海浦东荣丰科学仪器有限公司101a-0型);电子调温电热套(天津市泰斯特仪器有限公司98-1-b型)。多功能酶标仪(中国tecan公司);co2恒温细胞培养箱(美国thermofisherscientific公司);超净工作台(苏州安泰空气技术有限公司);倒置显微镜(日本olympus公司);通风橱(北京东联哈尔仪器制造有限公司hdl型);足趾容积测量仪(安徽正华生物仪器设备有限公司zh-yls-7b型);生物组织自动脱水机(湖北孝感宏业医用仪器有限公司ts-12d+型);生物组织石蜡包埋机(湖北孝感亚光医用电子技术有限公司yb-6lf型);生物组织摊拷片机(湖北孝感亚光医用电子技术有限公司yt-7fb型);切片机(德国leica公司rm2235型);电热恒温鼓风干燥箱(上海精宏实验设备有限公司dhg-9023a型)。实施例1本发明化合物的制备1、提取(1)取龙须藤根茎63kg,粉碎为粗粉,用120l浓度为90%的乙醇溶液浸泡,冷浸提取3次,每次3天。合并提取液,减压浓缩,得龙须藤乙醇提取物浸膏2650g。(2)将2650g乙醇提取物浸膏用8l水分散混匀,依次用石油醚和乙酸乙酯萃取,减压浓缩并真空干燥后,得到乙酸乙酯部位提取物(435.0g)。2、化合物的分离与纯化取乙酸乙酯部位提取物435.0g,采用硅胶柱色谱(100-200目)分离纯化,混合拌样,用氯仿进行洗脱,梯度洗脱程序具体见表1表1梯度洗脱程序氯仿:甲醇(v/v)洗脱单位(bv)组分(fr.1-5)100:06fr.1取组分fr.1(21.4g),采用中低压制备柱(ods反相色谱柱),采用甲醇-水体系(50:50-100:0),进行梯度洗脱,具体洗脱程序见表2,得到1.3g组分fr.1c。fr.1c(1.3g)经sephadexlh-20柱,以甲醇洗脱,收集全部洗脱液,再使用制备型hplc,以50%乙腈作为洗脱剂,收集保留时间11.95-12.50min段的洗脱液,得到化合物ⅰ(25.1mg)。表2梯度洗脱程序甲醇:水(v/v)洗脱单位(bv)组分(fr.1a-1e)50:506fr.1a55:458fr.1b65:358fr.1c3、结构鉴定根据上述方法制备得到的化合物ⅰ为无色无定型粉末。esi-msm/z:259[m-h]-;该化合物分子式为:c14h12o5,不饱和度为9。在红外ir光谱中,振动吸收峰为3379,1602,1586和1467cm-1,表明该化合物存在羟基和苯基。紫外光谱在263,295,305和328处存在吸收,与二苯并呋喃紫外吸收特征相符,且不饱和度与该结构一致(shiuetal.,2009;linetal.,2010)。在化合物的1h-nmr(400mhz,cd3od)谱中,显示有四个位于低场区的芳香质子信号,包括:δh6.96(1h,d,j=8.2hz)和7.36(1h,d,j=8.2hz)相互耦合,以及另外两个单氢信号δh7.27(1h,s)和7.17(1h,s)。此外δh4.28(3h,s),4.00(3h,s)的存在也说明了该结构中含有2个甲氧基,具体见图1。由化合物的13c-nmr(100mhz,cdcl3)数据推测该化合物有15个碳原子存在,其中包括三个甲氧基上的碳信号,具体见图2。加之上述红外、紫外以及氢谱数据,表明该结构是由两个苯环组成的,两个苯环占据8个不饱和度,剩余1个不饱和度为五元杂环,可判定该结构母核为二苯并呋喃,且苯基上被2个甲氧基和2个羟基取代。通过该化合物的hmbc谱可知,h-1(δh7.17)与c-3(δc145.3)和c-4a(δc151.2)相关,h-4(δh7.27)与c-2(δc143.9)和c-9b(δc115.9)相关,具体见图4。通过noesy谱可知,h-1与2-och3上的氢(δh3.98)相关,h-8(δh6.96)与7-och3上的氢(δh4.28)相关,具体见图5。另外,通过1h-1hcosy可知,h-9(δh7.36)与h-1相关,具体见图6。综上:h-1,2-och3,3-oh和h-4连接与同一苯环上,且该苯环上的甲氧基和羟基为邻位双取代。另一苯环上,两个单氢信号耦合,所以6-0h与7-och3为邻位取代。结合上述波谱信息,最终确定该化合物结构如下:实验例1抗类风湿性关节炎活性通过mtt法检测化合物对滑膜细胞的增殖抑制活性。滑膜细胞培养于rpmi1640培养液(含有10%胎牛血清、浓度为100μg/ml的青霉素及链霉素、1mmol/l的l-谷氨酰胺)中,37℃、5%co2饱和湿度培养箱中孵育至对数生长期。取对数增长期的滑膜细胞接种至96孔板(细胞浓度为1x105/ml)。待细胞贴壁生长13h后,加入不同浓度梯度的9个待测样品及阳性对照药甲氨蝶呤各100μl,阴性对照组加入等体积的给药培养基。共同孵育48h后,每孔加入10μl的mtt溶液(5mg/ml),继续培养4h后吸去上清液。加入100μl的dmso,结晶物充分溶解后于490nm波长下测定各孔光吸收值,以阴性对照组的吸光度值作对照来计算药物对滑膜细胞的生长抑制率。结果显示,化合物i对滑膜细胞具有抑制作用,具体见图7。图7为化合物i对滑膜细胞的增殖抑制作用(与空白组比较,*p<0.05,**p<0.01)实施例2抗类风湿性关节炎的药效学研究动物:spf级健康大鼠,wistar,雄性,六周龄,体重180-200g,购自上海斯莱克实验动物有限责任公司[合格证号:scxk(沪)2012-0002]。福建中医药大学实验动物中心spf级实验室喂养,光/暗周期为12/12h,温度为25.0±0.5℃,相对湿度50%-70%。1、牛ii型胶原诱导型关节炎大鼠(cia)模型的建立具体造模方法:将牛ii型胶原(2mg/ml)与完全弗氏佐剂(cfa)等体积混合,研磨制成胶原乳剂。于大鼠尾基部2cm处皮下注射胶原乳剂0.2ml/只,并于第7天在大鼠尾基部3cm处注射(牛ii型胶原与不完全弗氏佐剂(ifa)等体积的混合乳液)0.1ml/只进行二次免疫。模型成功与否通过关节炎指数(arthritisindex,ai)进行评估,得分大于1表示造模成功,具体评分标准如下表所示。表3关节炎指数评分标准2、分组给药分组:wistar雄性大鼠,取10只为空白对照组,剩余大鼠均注射胶原乳剂复制模型,二次免疫后,挑选关节炎指数在6-12之间的大鼠将其均分为4组,每组10只,分别为:模型对照组、阳性对照组、给药组b。给药方法:采用关节腔注射给药方法,每日1次,连续16天,(1)阳性对照组:每天给予醋酸泼尼松注射液(0.8mg·kg-1);(2)给药组b:每天分别给予化合物i(10mg·kg-1);(3)正常对照组、模型对照组:每天灌服等体积的生理盐水。观察大鼠的运动情况,饮食情况,身体各部位肿胀程度;并于给药后当天开始测定大鼠的体重,每隔3天测定一次。3、足肿胀度的测量从实验第1天,用记号笔在大鼠右后足裸关节周围作上记号并拉直,放入足趾容积测量仪内,使液面与记号线重合,以测量未注射胶原乳液时足趾容积并记录。从造模后第3天起,隔日测量一次大鼠造模后右足肿胀程度并记录。开始给药后,给药当天即开始记录,后每隔3天测一次足趾容积。足趾肿胀度用造模后与造模前足趾容积的差值表示。4、滑膜组织病理学检查(1)取材大鼠于最后一次给药后,腹腔注射10%的水合氯醛1ml/100g麻醉,腹主动脉取血,处死老鼠后,取下右膝关节,沿膝关节正中纵行切开皮肤直至暴露出以膝关节为中心约0.3cm×0.3cm的区域,用有齿镊提起髌骨,沿髌骨上缘约0.13-0.14cm处向下切割直至股骨,再分别沿髌骨两侧向下分离至胫骨,此时即打开了膝关节腔,可见由髌骨下缘向上延缓有一层平滑光亮呈淡黄色的滑膜组织。将剥离出滑膜组织的膝关节放入4%多聚甲醛中固定。(2)制作病理切片1)固定:将带有滑膜组织的膝关节于4%多聚甲醛固定液中常温放置48h。2)48h后,取出组织用自来水冲洗6h;然后将固定后的滑膜组织从膝关节上修剪下来。3)脱水:70%乙醇25min→80%乙醇25min→90%乙醇25min→95%乙醇25min→100%乙醇ⅰ20min→100%乙醇ⅱ20min→100%乙醇ⅲ20min。4)透明:二苯甲ⅰ20min→二苯甲ⅱ30min。5)浸蜡:石蜡加热到65℃,软蜡20min→硬蜡ⅰ20min→硬蜡ⅱ30min。6)包埋:将液态石蜡倾入包埋模具中,将浸蜡的滑膜组织埋入熔蜡中;盖上包埋盒凹槽用熔蜡填满。最后待熔蜡凝固后,将蜡块取出备用。7)切片:切片厚度为5μm并进行切片,展片,后捞片,再烘片(60℃)过夜。8)he染色:先水化,二苯甲ⅰ5min→二苯甲ⅱ5min→100%乙醇4min→95%乙醇4min→85%乙醇4min→75%乙醇4min→过蒸馏水。苏木素染色30min→蒸馏水洗5min→1%盐酸乙醇分化5s→蒸馏水洗10min→0.5%伊红染色0.5min→蒸馏水洗30s→85%乙醇5min→90%乙醇5min→95%乙醇5min→100%乙醇ⅰ5min→100%乙醇ⅱ5min→二苯甲ⅰ10min→二苯甲ⅱ10min→中性树胶封片。(3)观察在光镜下进行观察,并进行组织形态学分析。(4)统计学方法测定数据均以表示,采用spss18.0统计软件进行单因素方差分析,组间比较采用t检验,以p<0.05为差异有统计学意义。5、实验结果(1)化合物对大鼠体征的影响:空白对照组大鼠随时间延长体重逐渐增加,精神状况好,被毛有光泽,活动灵活,反应灵敏,无异常状态出现。cia模型对照组大鼠经初次免疫后第二天尾部出现红肿、充血;二次免疫后第2天尾部出现红肿、充血、溃烂,第4天逐渐开始结痂(如图8所示);第5天,大鼠陆续开始发病,模型大鼠足趾、踝关节及膝关节多处开始出现红肿,足垫明显增厚,并日益加重,有些大鼠足趾甚至变形,无法负重,关节功能活动障碍,大鼠精神状态差,毛发干枯,活动迟缓,爬行困难,反应迟钝,进食量降低,体重下降,但无死亡。阳性药组及化合物各给药组大鼠给药后上述症状均有所缓解。如图9、图10、图11所示。(2)化合物对大鼠关节炎指数的影响:模型对照组关节炎指数与空白对照组相比明显增高(p<0.01),说明了cia大鼠模型复制成功。模型对照组的关节炎指数在给药第一天后仍有增高,其后关节炎指数趋于稳定,但在给药第13天时开始关节炎指数开始出现了减低,但仍高于第一天给药时的关节炎指数。阳性对照组在给药第4天、第7天、第10天、第13天、第16天时的关节炎指数均显著低于模型对照组(p<0.01);给药组b在第10天、第13天、第16天时的关节炎指数均明显低于模型对照组(p<0.01或p<0.05),具体结果见表4。表4各组大鼠的关节炎指数情况注:ⅰ为空白对照组,ⅱ模型对照组,ⅲ阳性对照组,ⅳ给药组b。模型对照组与空白对照组相比,△p<0.05,△△p<0.01;与模型对照组比,*p<0.05,**p<0.01。(3)化合物对大鼠足肿胀度的影响:模型对照组足肿胀度与空白对照组相比显著增高(p<0.01),说明了cia大鼠模型复制成功。模型对照组的足肿胀度在给药第一天后仍有增高,其后足肿胀度趋于稳定,但在给药第13天时开始足肿胀度开始出现了减低,但仍高于第一天给药时的足肿胀度。阳性对照组在给药第4天、第7天、10天、第13天、第16天时的足肿胀度均显著低于模型对照组(p<0.01);而在给药第7天时给药组b的足肿胀度均明显低于模型对照组(p<0.01或p<0.05),在给药第10天、第13天、第16天时给药组b的足肿胀度均明显低于模型对照组(p<0.01或p<0.05)。具体结果见表5、图10、图11。表5各组大鼠的足肿胀情况注:ⅰ为空白对照组,ⅱ模型对照组,ⅲ阳性对照组,ⅳ给药组b。模型对照组与空白对照组相比,△p<0.05,△△p<0.01;与模型对照组比,*p<0.05,**p<0.01。(4)化合物对大鼠滑膜组织的影响:与空白对照组相比,模型大鼠的组织病理学观察可见关节滑膜组织增生、肥厚,衬里覆多层滑膜细胞,大量炎症细胞浸润,血管扩张充血。阳性对照组的组织病理学观察与正常组相近。给药组b的滑膜组织增生不明显,少量炎症细胞浸润;低剂量组见少量滑膜组织增生,少量炎症细胞浸润及少量血管充血。具体见图10、图12、13。本研究采用雄性wistar大鼠复制cia模型。模型对照组大鼠的关节炎指数、足肿胀度与空白对照组相比有显著性差异,且关节腔滑液明显增多,滑膜组织变得肥厚,组织病理学观察发现模型对照组大鼠关节滑膜细胞增生明显、大量炎症细胞浸润、充血水肿,这些均表明cia模型复制成功;另外,化合物i能明显降低cia模型大鼠的关节炎指数及足肿胀度,抑制滑膜组织增生、炎症细胞浸润,抑制滑膜炎发生。试验结果表明,本发明化合物具有较好的抗类风湿性关节炎作用,为临床上筛选和/或制备抗类风湿性关节炎药物提供了一种新的选择。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种具有抗氧化活性的芳基苯并呋喃类化合物及其制备方法和应用与流程
- 一种含苯并双环酮与乙氧磺隆的除草组合物及其应用的制造方法与工艺
- 一种6‑氯呋喃[3,2‑B]吡啶的合成方法与流程
- 一类苯并吡喃类化合物及其应用的制造方法与工艺
- 一种以二苯并环庚烯为核心的化合物及其在有机电致发光器件上的应用的制造方法与工艺
- 一种含苯并双环酮与乙草胺的除草组合物及其应用的制造方法与工艺
- 一种含苯并双环酮与噁草酮的除草组合物及其应用的制造方法与工艺
- 分解二噁英前体的催化剂筛选系统及其使用方法与流程
- 一种无卤热固性树脂组合物以及含有它的预浸料、层压板和印制电路板的制造方法与工艺
- 一种以二联二苯并五元杂环为骨架的有机化合物及其在OLED上的应用的制造方法与工艺