ERBB2靶向抗体的制作方法
本发明涉及抗体领域,特别是结合erbb2酪氨酸激酶的新表位的抗体。
现有技术
癌症是一个通用术语,其全体地定义了局部生长和/或侵入和/或扩散(转移)到远端器官的被转化的细胞的快速增殖。癌症是全球的主要死亡原因,其大部分是由于转移引起的,乳腺癌是第五大杀手(http://www.who.int/mediacentre/factsheets/fs297/en/index.html)。
对生长因子的异常应答在人类肿瘤的自然史中起主要作用。受体酪氨酸激酶(rtk)的erbb家族包括在参与到组合性二聚体受体组合中时进行信号传导的4个成员(从表皮生长因子受体erbb1或her-1到erbb-4或her-4)。erbb2(也被称为her2或neu-erb)是共有的(且优选的)异二聚化配偶体和信号传导放大的主协调器和整合器(integrator)。因此,异常erbb信号传导参与人肿瘤包括星形细胞瘤、头和颈鳞状细胞癌、乳腺癌、卵巢癌和前列腺癌以及黑素瘤和肉瘤的发病机制。最经常由基因扩增引起的erbb2过表达可以在大约30%的与侵入性的临床过程相关并且预测到较差预后的乳腺癌中通过免疫组织化学法检测。
当被几种天然生长因子时(包括神经调节蛋白(nrg1),也被称为调蛋白(hrg))接触时,erbrtk受体被磷酸化并且引发癌基因细胞内信号传导级联反应,最值得注意的是分别参与细胞增殖和细胞存活的ras-raf-mapk-erk途径和pi3k-akt途径。
除了其他方法之外,针对受体分子的胞外结构域的抗体提供了非常成功的靶向erbb2途径的策略。治疗抗体诸如原型曲妥珠单抗
不幸的是,ttz只在携带其中erbb2原癌基因被过表达和/或扩增的乳腺癌病变的患者中是临床上有效的。为了鉴别这些患者,国际良好临床实践指南规定使用ivd有保证的免疫组织化学试剂盒。当染色达到3+强度(高,环状样均匀染色)或至少2+(例如不完整的环状形式和/或跨病变的不同区域的不均匀性)时,患者符合接受ttz治疗的条件,但在该后一种情况中,基因必须被扩增,如通过细胞遗传学方法(http://www.cap.org/apps/docs/committees/immunohistochemistry/summary_of_recommendations.pdf)评估。
相比而言,绝大多数(大约70%)的所有其他乳腺癌患者(erbb21+/2+;非扩增的)无法利用抗体介导的erbb2受体阻断。此外,甚至诊断时erbb2高的肿瘤可能继发地失去erbb2来逃避治疗性抗-erbb2压力(tortoraj.natl.cancerinst.2011;43:95-8),导致复发/进展后不符合条件的患者的数量增加。将抗体治疗的应用范围扩展到这种异类的低erbb2组中的至少一些患者将是极为期望的。
为了这个目的,人们可能想要开发另外的针对erbb2的抗体。这些抗体必须具有补充和/或代替可得的治疗抗体(主要是ttz和ptz)、和/或与其协同的能力。理想地,这些新抗体应该在高erbb2环境和低erbb2环境中均具备所述能力,使得一方面可以对ttz敏感的肿瘤发挥累加效应,且另一方面克服由于低erbb2表达引起的针对治疗的原发和继发性耐受。
尽管几个研究组已经描述了许多针对erbb2的单克隆抗体,在大部分情况中它们的体外和体内抗肿瘤性质尚未被详细评估。例如,digiesig等人.(hybridoma1992,11(4),519-527)描述了针对癌基因gp185her2的胞外结构域的鼠mab的产生和表征。lombardia等人(proteinexpr.purif.2005,44(1)10-15)和galeffip等人.(j.translationalmedicine2006,4(39),1-13)描述了针对erbb-2的单链抗体在大肠杆菌(e.coli)、植物和无细胞系统中的表达。这些igg的编码dna序列以及分子、生物化学、生物学和抗增殖性质(如果存在的话)是未知的。
因此,本发明的目的是提供除ttz和ptz之外的抗体,所述抗体可以单独地或与ttz和ptz组合地用于治疗癌症,特别是用于改善erbb2高/扩增性和erbb2低/非扩增性乳腺癌细胞和小鼠异种移植物中的erbb2受体阻断。
发明概述
发明人已经鉴定、表征和人源化了一种结合位于erbb2的细胞外结构域的表位的独特的新抗体。感兴趣的是,这个表位与ttz和ptz所识别的表位不同。所述结合的独特性质使得能够以用现有技术的治疗抗体不可获得的新的和出乎预料的方式累加的/协同的干扰受体介导的信号传导和下游生物学作用。新抗体能够在其中预期ttz具有低临床效力的、表达低erbb2水平的肿瘤中诱导肿瘤消退。此外,新抗体与ttz和ptz通过在过表达erbb2的肿瘤和低erbb2肿瘤中以累加方式诱导肿瘤消退而协同。
因此,本发明的主题是一种结合erbb2受体的独特表位或其片段,并且包含以下的抗体:
a)重链可变(vh)结构域,所述重链可变(vh)结构域与seqidno:1中的互补决定区(cdr,加粗加下划线型)具有至少80%同一性
和
b)轻链可变(vl)结构域,所述轻链可变(vl)结构域与seqidno:2中的互补决定区(cdr,加粗加下划线型)具有至少80%同一性。
vh序列(seqidno:1)
vl序列(seqidno:2)
令人惊讶的是,本发明的抗体具有在体外和体内以与ttz和ptz二者协同的方式和在针对ttz和ptz之一或二者为难治性的肿瘤中抑制erbb2保持性肿瘤生长的能力。
为本发明的主题的、被称为mabw6/800的抗体不同于ttz和ptz。这种抗体可单独或与ttz和ptz组合用于治疗癌症来改善erbb2高/扩增性和erbb2低/非扩增性乳腺癌细胞和小鼠异种移植物中的erbb2受体阻断。
发明详述
如本文中使用的,两个多肽序列之间的“序列同一性”指序列之间,优选地跨seqidno:1和/或seqidno:2中的cdr序列编码的氨基酸序列的整个长度的相同的氨基酸的百分比。本发明的优选的多肽序列具有至少80%,更优选85%,甚至更优选90%、93%、95%、96%、97%、98%或99%的序列同一性。
术语抗体包括具有该抗体的至少一个抗原结合位点和/或显示相同生物活性的“片段”或“衍生物”。此外,本发明的抗体优选包含至少一个免疫球蛋白重链和至少一个免疫球蛋白轻链。免疫球蛋白链包含可变结构域和任选地恒定结构域。可变结构域可以包含互补决定区(cdr),例如cdr1、cdr2和/或cdr3区,以及框架区。
本发明的抗体可以是天然和/或合成来源的任何抗体,例如哺乳动物来源的抗体。优选地,恒定结构域—如果存在的话—是人恒定结构域。可变结构域优选是哺乳动物可变结构域,例如人源化或人可变结构域。
根据本发明的抗体可以是多克隆抗体或单克隆抗体。优选单克隆抗体。具体地,本发明的抗体优选选自由重组抗体、人源化或完全人抗体、嵌合抗体、多特异性抗体组成的组,特别是双特异性抗体或其片段。
单克隆抗体可以通过任何合适的方法诸如
抗体的人源化形式可以根据本领域已知的方法诸如嵌合或cdr移植生成。用于产生人源化抗体的可选择的方法是本领域众所周知的,并且在例如ep-a10239400和wo90/07861中描述。人抗体还可以通过体外方法获得。合适的实例包括但不限于噬菌体展示、酵母展示等。
根据本发明,“嵌合抗体”涉及包含来自不同物种(诸如例如小鼠和人)的多肽的抗体。嵌合抗体的产生在例如wo89/09622中描述。
优选地,本发明的抗体是如上文描述的重组单克隆人源化抗体,包含与上文描述的cdr具有至少80%同一性的重链可变(vh)结构域和轻链可变(vl)结构域,其中vh的其余氨基酸序列与seqidno:1至少80%相同且vl的其余氨基酸序列与seqidno:2或seqidno:3至少80%相同。
本发明的优选的多肽序列具有至少80%,更优选85%,甚至更优选90%、93%、95%、96%、97%、98%或99%的序列同一性。
vl序列(seqidno:3)
其中cdr是粗体加下划线型。
根据优选实施方案,上文描述的抗体或其片段包含与seqidno:1具有100%同一性的重链可变(vh)结构域和与seqidno:2或seqidno:3具有100%同一性的轻链可变(vl)结构域。
根据优选实施方案,抗体或其片段可以是fab片段、fab’片段、f(ab')片段、fv片段、双抗体(diabody)、小模块免疫药物(smallmodularimmunopharmaceutical)(smip)、亲和抗体(affibody)、亲和多聚体(avimer)、纳米抗体、结构域抗体或scfv。
“亲和多聚体”涉及使用例如体外外显子改组和噬菌体展示工程化的多聚体结合蛋白或肽。多个结合结构域被连接,产生与单表位免疫球蛋白结构域相比更大的亲和力和特异性。
“纳米抗体”或单结构域抗体涉及由单个单体可变抗体结构域组成的抗体片段。
“亲和抗体”分子是被工程化以特异性结合大量靶蛋白的小的高亲和力蛋白。
本发明的抗体可以优选为igg1、igg2、igg3、igg4、igm、iga1、iga2、igasec、igd和ige抗体类型。将理解,所生成的抗体不需要初始具有这种同种型,而是所生成的抗体可以具有任何同种型并且抗体可以是同种型转换的。
本发明的抗体或抗体片段是任选地为了治疗目的而去免疫的(deimmunized)。对本领域技术人员将是明显的是,本发明的抗体可以进一步与用于例如药物靶向和成像应用的其他部分偶联。这种偶联可以在抗体或抗原表达后通过化学方法导向至附接位点,或者偶联产物可以在dna水平被工程化到本发明的抗体或抗原中。
因此,为了诊断目的,本发明的抗体或抗原片段可以被标记,即偶联至标记基团。合适的标记包括放射性标记、荧光标记、合适的染料基团、酶标记、染色体基因、化学发光基团、生物素基团、由第二报告物识别的预定的多肽表位等。
那些标记的抗体或抗体片段可以特别地在免疫组织化学测定中使用或用于体内分子成像。
对于治疗目的,本发明的抗体或抗体片段可以与效应基团,特别是治疗效应基团诸如放射性基团或细胞毒性基团缀合。
标记基团或效应基团可以通过多种长度的间隔臂(spacerarm)附接以减少潜在的位阻。
根据另一方面,本发明涉及编码本发明的抗体或其片段的核酸分子,或者在严格条件下能够杂交至该核酸分子的核酸。编码上文描述的抗体、抗体片段或其衍生物的本发明的核酸分子可以是例如dna、cdna、rna或合成产生的dna或rna、或包含单独的或组合的任何那些核酸分子的重组产生的嵌合核酸分子。核酸分子还可以是对应于整个基因的基因组dna、或其大部分或其片段和衍生物。在本发明的特别优选的实施方案中,核酸分子是cdna分子。
术语“在严格条件下杂交”意指,两个核酸片段在例如sambrook等人,"expressionofclonedgenesine.coli"inmolecularcloning:alaboratorymanual(1989),coldspringharborlaboratorypress,newyork,usa中描述的标准化杂交条件下彼此杂交。这种条件是例如在约45℃在6.0xssc中杂交,然后是在50℃用2.0xssc、优选在65℃用2.0xssc,或在50℃用0.2xssc、优选在65℃用0.2xssc的洗涤步骤。
本发明的另一方面涉及包含本发明的核酸分子的载体。所述载体可以是例如噬菌体、质粒、病毒或逆转录病毒载体。逆转录病毒载体可以是能够复制的或复制缺陷的。优选地,本发明的载体是一种表达载体,其中核酸分子可操作地连接至允许在原核和/或真核宿主细胞中转录和任选地表达的一个或更多个控制序列。
本发明还涉及包含本发明的载体的宿主。所述宿主可以是原核或真核细胞或非人转基因动物。存在于宿主中的本发明的多核苷酸或载体可以整合到宿主的基因组中,或者其可被保持在染色体外。
宿主可以是任何原核或真核细胞,诸如细菌、昆虫、真菌、植物、动物、哺乳动物或优选地,人类细胞。优选的真菌细胞是例如酵母(saccharomyces)属的那些,特别是酿酒酵母(s.cerevisiae)种的那些。
另外,本发明涉及用于制备抗体的方法,包括在允许合成所述抗体的条件下培养本发明的宿主和从所述培养物回收所述抗体。
本发明另外的方面涉及药物组合物,所述药物组合物包含本发明的抗体或其片段、本发明的核酸分子、载体、宿主或通过本发明的方法获得的抗体。如本文中使用的,术语“组合物”包含至少一种本发明的化合物。优选地,这样的组合物是治疗/药物组合物或诊断组合物。
本发明的诊断组合物可以用于评估如本文中定义的过度增殖性疾病的发作或疾病状态。
组合物优选地包含药学上可接受的载体、稀释剂和/或赋形剂。
合适的药学载体、赋形剂和/或稀释剂的实例是本领域周知的并且包括磷酸盐缓冲盐水溶液、水、乳液诸如油/水乳液、各种类型的润湿剂、无菌溶液等。包含这种载体、赋形剂和/或稀释剂的组合物可以通过周知的常规方法配制。
合适的组合物的施用可以通过不同方式进行,例如通过静脉内、腹膜内、皮下、肌肉内、局部、皮内、鼻内或支气管内施用。优选的是静脉内、肌肉内和/或皮下施用。
这些药物组合物可以以适合的剂量施用至受试者。剂量方案可由主治医师和临床因素确定。
本发明的组合物可以被局部或全身施用。用于肠胃外施用的制剂包括无菌水性溶液或非水性溶液、悬浮液和乳液。非水性溶剂的实例是丙二醇、聚乙二醇、植物油诸如橄榄油、以及可注射的有机酯诸如油酸乙酯。水性载体包括水、醇/水溶液、乳液或悬浮液,包括盐水和缓冲的介质。肠胃外媒介物包括氯化钠溶液、林格氏葡萄糖、葡萄糖和氯化钠、乳酸林格氏溶液或不挥发性油(fixedoil)。静脉内媒介物包括流体和营养补充物、电解质补充物(诸如基于林格氏葡萄糖的那些)等。还可以存在防腐剂和其他添加剂,诸如,例如抗微生物剂、抗氧化剂、螯合剂和惰性气体等。此外,根据药物组合物的预期用途,本发明的药物组合物可以包含另外的剂。
根据特别优选的实施方案,组合物包含另外的活性剂,诸如另外的抗体或抗体片段。
优选地,本发明的抗体和组合物用于与至少一种另外的抗肿瘤剂组合使用。所述组合例如在抑制异常细胞生长方面是有效的。许多抗肿瘤剂是目前本领域已知的。通常,该术语包括能够预防、缓解和/或治疗过度增殖性紊乱的所有剂。特别优选的是诱导细胞凋亡的抗肿瘤剂。
优选地,抗肿瘤剂选自由抗体、小分子、纳米颗粒、抗代谢物、烷化剂、拓扑异构酶抑制剂、靶向微管的剂、激酶抑制剂、蛋白合成抑制剂、免疫治疗剂、激素或其类似物、dna纳米结合剂和/或mtor抑制剂组成的组。
可以与本文提供的抗体组合使用的抗肿瘤剂的具体实例包括例如吉非替尼(gefitinib)、拉帕替尼(lapatinib)、舒尼替尼(sunitinib)、培美曲塞(pemetrexed)、贝伐单抗(bevacizumab)、西妥昔单抗(cetuximab)、伊马替尼(imatinib)、阿仑单抗(alemtuzumab)、曲妥珠单抗(trastuzumab)、帕妥珠单抗(pertuzumab)、利妥昔单抗(rituximab)、埃罗替尼(erlotinib)、硼替佐米(bortezomib)和类似物,特别是曲妥珠单抗和帕妥珠单抗。将在本文描述和请求保护的组合物中使用的其他特定抗肿瘤剂包括例如化学治疗剂诸如紫杉醇(paclitaxel)、蒽环霉素类(anthracyclines)、氟嘧啶、长春花-生物碱、铂盐,特别是卡培他滨、柔红霉素、道诺霉素、更生霉素、多柔比星、表柔比星、伊达比星、依索比星、博来霉素、马磷酰胺、异环磷酰胺、阿糖胞苷(cytosinearabinoside)、双氯乙基硝基脲(bis-chloroethylnitrosurea)、白消安、丝裂霉素c、放线菌素d、光神霉素、强的松、羟孕酮、睾酮、他莫昔芬、达卡巴嗪、甲基苄肼(procarbazine)、六甲蜜胺、五甲蜜胺、米托蒽醌、安吖啶、苯丁酸氮芥、甲基环己基硝基脲、美法仑、环磷酰胺、6-巯基嘌呤、6-硫鸟嘌呤、阿糖胞苷(cytarabine)(ca)、5-氮胞苷、羟基脲、脱氧助间型霉素(deoxycoformycin)、4-羟基过氧环磷酰胺、5-氟尿嘧啶(5-fu)、5-氟脱氧尿苷(5-fudr)、氨甲蝶呤(mtx)、秋水仙碱、紫杉醇、长春新碱、长春花碱、依托泊苷、三甲曲沙(trimetrexate)、替尼泊苷(teniposide)、顺铂和己烯雌酚(des)。
本发明的抗体和组合物可以与包含上文描述的活性剂的另外的治疗组合物和/或辐照和/或放射治疗组合施用。
根据优选实施方案,本发明的组合物用于在治疗和/或预防过度增殖性疾病,特别是赘生性疾病或癌症中使用。组合物还可以用于制造用于治疗和/或预防过度增殖性疾病,特别是赘生性疾病或癌症的药物。
如本文中定义的,过度增殖性疾病包括任何瘤形成,即任何异常的和/或不受控的组织新生长。如本文中使用的,术语“不受控的组织新生长”可取决于生长调节的功能异常和/或丢失。过度增殖性疾病包括肿瘤疾病和/或癌症,诸如转移性或侵入性癌症。
过度增殖性疾病优选选自与erbb2表达、过表达或活动过度相关、与其相伴或由其引起的紊乱,诸如癌症,特别是黑素瘤、乳腺癌、卵巢癌、肾癌、胃肠癌/结肠癌、肺癌、肾的透明细胞癌、前列腺癌和/或肉瘤。具体地,对于这些肿瘤,已经证明了erbb2在促进癌症发展和生长中的作用,并且因此抑制该蛋白可以提供某些益处。
本发明还涉及治疗疾病的方法,其中本发明的抗体被施用至哺乳动物,且其中所述疾病与erbb2的表达或活性的异常水平(特别但非排外地是,当erbb2表达经ivd免疫组织化学测试为低至中等(http://www.cap.org/apps/docs/committees/immunohistochemistry/summary_of_recommendations.pdf)(例如通过ihc为1+/2+),且erbb2基因不被扩增,使得施用ttz不合适且临床上无效时)直接或间接相关。
本发明的又另一方面涉及诊断受试者中与erbb2相关的癌症的方法,包括
(a)使来自受试者的细胞与前述权利要求中任一项的抗体或其抗原结合部分离体或体内接触,和
(b)测量针对细胞上的erbb2的结合水平,其中与erbb2的异常高水平的结合指示受试者具有与erbb2相关的癌症。
依据本发明,“异常高”意指与不具有癌症的健康受试者相比较高的erbb2结合水平。
优选地,受试者是动物,更优选哺乳动物,且特别优选人类。
附图简述
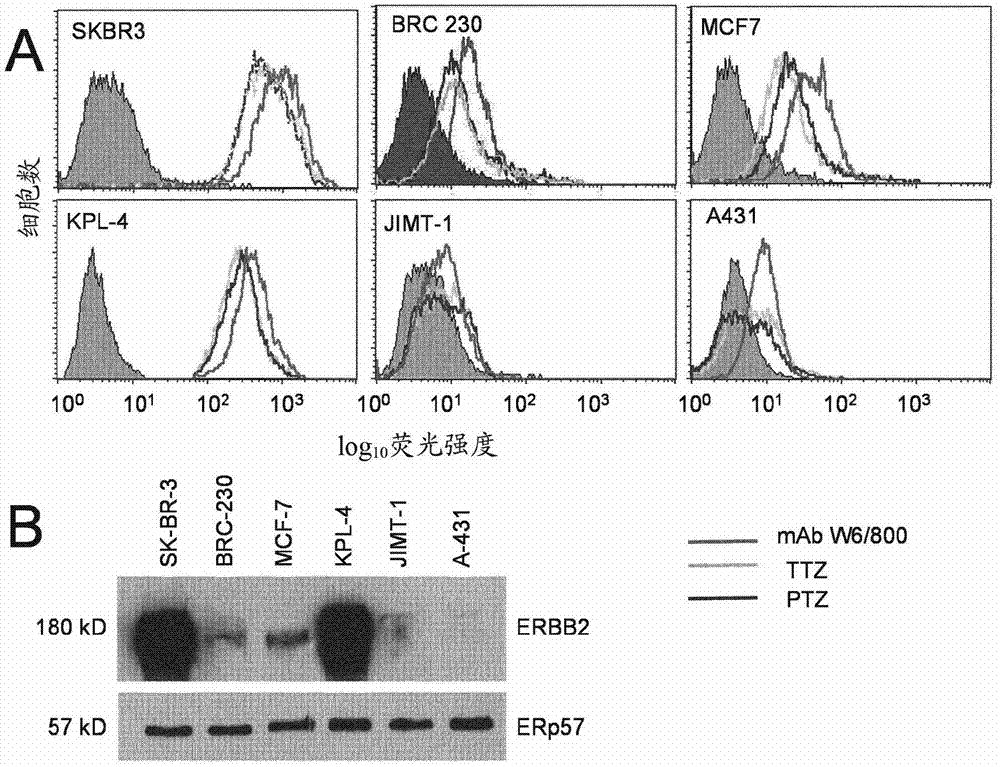
图1比较了mabw6/800、ttz和ptz结合已知表达不同水平的erbb2,从过表达到不可检测的表达的乳腺癌细胞的能力。
图2示出了,mabw6/800结合与ttz和ptz表位不同且拓扑学上独特的erbb2胞外结构域表位。
图3示出了,mabw6/800对过表达erbb2的bt-474乳腺癌细胞发挥抗增殖作用。此外,当组合使用时,与ttz和ptz彼此协同相比,mabw6/800与ttz和ptz更好地协同。
图4示出了,与ptz和ttz不同,mabw6/800对低erbb2的brc230乳腺癌细胞具有抗增殖作用。在这种低erbb2环境中,mabw6/800的抗增殖作用是累加的,并且与ttz和ptz的那些抗增殖作用协同。
图5示出了,mabw6/800比ttz更好且与ptz类似地抑制裸小鼠中低erbb2的brc230肿瘤异种移植物的生长。
图6示出了,与ttz和ptz组合的mabw6/800比ttz/ptz组合更好地抑制裸小鼠中低erbb2的brc230肿瘤异种移植物的生长。
图7示出了,将mabw6/800cdr移植到人类ig主链上产生人源化抗体,该人源化抗体以类似ttz和亲代鼠mab的程度结合乳腺癌细胞。
实验部分
mabw6/800从杂交瘤细胞系的产生:常规程序。
材料和方法:每隔一周,对4-周龄balb/c雌性小鼠通过腹膜内注射用人erbb2受体转染的nih/3t3细胞(1x107),免疫三次。最后一次免疫后5天,取出脾细胞以便与鼠非分泌型骨髓瘤细胞系ns-1进行体细胞融合(
实施例1:mabw6/800的特征。
材料和方法:mabw6/800是一种igg2a。ig序列seqidno:4和seqidno:5
(seqidno:4)
(seqidno:5)
通过来自杂交瘤总细胞rna的逆转录和用已描述的简并引物对的pcr扩增获得(wangz等人.jimmunolmethods2000;233:167-77)。
通过流式细胞术测试从杂交瘤培养物纯化的mabw6/800以及ttz和ptz(从用于体内临床使用的商业制剂获得)以获得其结合表达不同水平的erbb2的乳腺癌细胞系的能力,以确定结合方式是类似的还是不同的(图1a)。这些乳腺癌细胞还使用针对erbb2的多克隆抗体通过蛋白质印迹法评估(图1b)。在图1a中,将靶细胞与三种mab(10μg/ml)平行地孵育30min、洗涤两次并随后与针对小鼠ig(鼠w6/800)或人类ig(人源化ttz和ptz)的异硫氰酸荧光素(fitc)-标记的二抗的最佳预先确定的稀释液孵育30min,并在becton&dickinsonfacscan流式细胞仪中读取。在图1b中,将来自所指示的代表性细胞系的非离子型去垢剂可溶的提取物(100μg/泳道总细胞蛋白)通过sds-page分离并电印迹到硝酸纤维素滤膜(filter)上。将滤膜切成两条,每条分别装载以针对erbb2的mab3d5(thermoscientific)和针对erp57的多克隆抗体(内部产生),作为均衡对照(equalizationcontrol)。
结果:
ttz、ptz和mabw6/800结合所有测试的细胞系。不同细胞中erbb2表达的相对水平由流式细胞术通过三种mab一致地评估(图1a),并且与在蛋白质印迹法中通过第四种独特的抗体独立评估的水平一致(图1b)。内部阴性对照被包括,其中一抗是具有无关特异性的鼠igg2。这些以灰色阴影的柱状图示出(图1a)。只示出了用鼠ig染色的背景,因为对照人类ig的信号是可叠加的。因此,mabw6/800在某些方面表现得与ttz和ptz类似。
实施例2:mabw6/800结合与曲妥珠单抗表位和帕妥珠单抗表位不同且独特的erbb2表位。
材料和方法:将sk-br-3人乳腺癌细胞(5x105)用磷酸盐(0.01m)缓冲(ph7.4)盐水(0.9%)即pbs或包含200μg/mlmabw6/800、ttz或ptz的50μlpbs在冰上预孵育30分钟,如指示的。在预孵育结束时,测试异硫氰酸荧光素(fitc)-标记的mabw6/800(10μl,最佳预先确定的稀释液)的结合能力,如指示的。包括了识别不在乳腺癌细胞上表达的表位的不相关fitc-标记的鼠igg2抗体,如指示的。通过facscan(b&d)分析细胞。
结果:fitc-mabw6/800的结合被用未标记的mabw6/800的预孵育完全阻断(图2,左起第二幅图),但它不受与ttz和ptz预孵育的影响(其余的图)。同样,fitc-标记的ttz和ptz的结合分别被ttz和ptz专门地阻断,但不被mabw6/800阻断(未示出)。这些结果证明了,三种表位是不同的且是拓扑学上独特的。
实施例3:mabw6/800对过表达/扩增erbb2的细胞的抗增殖作用。
材料和方法:使过表达/扩增erbb2的bt-474人乳腺癌细胞(baselgaj等人.jclinoncol2010;28:1138-44)在rpmi0.2%fbs中生长18h。然后将fbs浓度调节到10%,并使细胞在缺乏和存在递增剂量的ttz、ptz和mabw6/800的情况下生长48小时。除了单一剂处理,还使细胞在双剂处理实验(double-agenttreatmentexperiment)中存在相同量的抗体的情况下生长。在实验的最后4h期间,将细胞与3h-胸苷孵育,然后裂解,并一式三份地评估tca-沉淀物计数,以确定dna的放射性前体掺入(图3)。
结果:mabw6/800作为单一剂与ttz和ptz类似地活跃,或者比ttz和ptz更活跃。但是,并且令人惊讶的是,与两种抗体的任一个彼此协同相比,它与二者更有效地协同(图3)。
实施例4:mabw6/800对erbb2低/非扩增性细胞的抗增殖作用。
材料和方法:使erbb2低/非扩增性brc230人乳腺癌细胞(amadori等人.breastcancerrestreatrep1993;28:251-60)如实施例3中生长和处理。3h-胸苷掺入按上文评估(图4)。
结果:mabw6/800是对低erbb2细胞唯一有效的体外单剂处理。此外,它确实与ttz和ptz协同(图4)。
实施例5:mabw6/800体内抑制肿瘤细胞生长。
材料和方法:将低erbb2的brc230人乳腺癌细胞(5x105)皮下注射到nu/cd1小鼠中(5只小鼠/组)。当异种移植物达到60mm3(时刻0),将小鼠随机分配以通过腹膜内注射(i.p.)接受pbs、ttz、ptz或mabw6/800。用测径器(caliper)监测跨所指示的时间的肿瘤生长。抗体以10mg/kg一周施用2次,持续3周(图5)。
结果:对不过表达erbb2的肿瘤异种移植物,mabw6/800与ptz一样有效,并且比ttz有效得多(图5)。
实施例6:mabw6/800、ttz和ptz在体内协同地抑制肿瘤细胞生长。
材料和方法:精确地如上文描述地建立和监测低erbb2的brc230人乳腺癌细胞的肿瘤异种移植物(图6)。用所指示的抗体组合(每种mab为10mg/kg)进行处理。
结果:在控制表达低erbb2水平的肿瘤异种移植物方面,mabw6/800-ttz组合比mabw6/800-ptz组合和ttz-ptz组合更有效(图6)。
实施例7:
材料和方法:将mabw6/800的重链和轻链的cdr移植到人类ig主链上。人源化形式的抗体可以根据本领域已知的方法诸如嵌合或cdr移植生成。用于产生人源化抗体的可选择的方法是本领域众所周知的,并且在例如ep-a10239400和wo90/07861中描述。人抗体还可以通过体外方法获得。合适的实例包括但不限于噬菌体展示、酵母展示等。
将人源化重链seqno.1和轻链seq.no.2或seq.no.3克隆到标准表达载体诸如pcdna3或类似的表达载体中,并共转染到cho细胞中。将细胞在erlenmeyer烧瓶中在37℃、5%co2的培养箱中的振荡器上以120rpm培养至少14天。将上清液通过标准蛋白a树脂纯化。在其结合sk-br-3乳腺癌细胞的能力方面,将从cho上清液纯化的对应于seq.no.1和seq.no.2的人源化w6/800抗体huw6/800与其亲代鼠抗体和ttz进行比较。进行流式细胞术实验,其中将三种抗体和具有无关特异性的对照igg2以相同浓度(10μg/ml)孵育30分钟,洗涤两次,并且然后通过与fitc-标记的针对人类ig或小鼠ig的二抗孵育显示,如所指示的(图7)。
结果:人源化抗体和ttz展示了相当的与sk-br-3细胞的结合,并且基本上失去了与抗鼠ig的反应性(图7),证明w6/800cdr成功地移植到人主链上。用两种不同的抗鼠ig制剂获得了类似的结果(未示出)。人源化抗体不与erbb2阴性细胞反应(未示出)。
序列表
<110>意大利乔凡尼洛伦齐尼生物化学研究所股份公司
<120>新颖的erbb2靶向抗体
<130>13919ptwo
<150>it102016000033776
<151>2016-04-01
<160>5
<170>bissap1.3
<210>1
<211>120
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>vh结构域人源化的mabw6/800
<220>
<221>结构域
<222>26..36
<223>cdr1
<220>
<221>结构域
<222>50..65
<223>cdr2
<220>
<221>结构域
<222>96..109
<223>cdr3
<400>1
glnvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysilesercyslysalaserglytyrthrpheserasntyr
202530
trpileglutrpvalargglnalaproglyglnglyleuglutrpmet
354045
glygluileleuproglyserglyserthrasntyrasnglulysleu
505560
lysglyargvalthrserthrargaspthrserileserthralatyr
65707580
metgluleuserargleuargseraspaspthrglyvaltyrtyrcys
859095
alaargglyglyglyasntyrprotyrtyrpheasptyrtrpglygln
100105110
glythrthrvalthrvalserser
115120
<210>2
<211>106
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>vl结构域人源化的mabw6/800
<220>
<221>结构域
<222>21..34
<223>cdr1
<220>
<221>结构域
<222>50..59
<223>cdr2
<220>
<221>结构域
<222>85..100
<223>cdr3
<400>2
aspileglnmetthrglnserproserthrleuseralaservalgly
151015
aspargvalthrilethrcyslysalaserglnaspvalglythrala
202530
valalatrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrtrpalaserthrarghisthrglyvalproserargphesergly
505560
serglyserglythrgluphethrleuthrileserserleuglnpro
65707580
aspaspphealaasptyrphecysglnglntyrsersertyrargthr
859095
pheglyalaglythrlysleugluilelys
100105
<210>3
<211>106
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>vl结构域人源化的mabw6/800
<220>
<221>结构域
<222>21..34
<223>cdr1
<220>
<221>结构域
<222>50..59
<223>cdr2
<220>
<221>结构域
<222>85..100
<223>cdr3
<400>3
alaileglnleuthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcyslysalaserglnaspvalglythrala
202530
valalatrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrtrpalaserthrarghisthrglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealaasptyrphecysglnglntyrsersertyrargthr
859095
pheglyalaglythrlysleugluilelys
100105
<210>4
<211>120
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>vh结构域鼠mabw6/800
<220>
<221>结构域
<222>26..36
<223>cdr1
<220>
<221>结构域
<222>50..65
<223>cdr2
<220>
<221>结构域
<222>96..109
<223>cdr3
<400>4
glnvalglnleuglnglnserglyalagluleumetlysproglyala
151015
servallysilesercyslysalathrglytyrthrpheserasntyr
202530
trpileglutrpvallysglnargproglyhisglyleuglutrpile
354045
glygluileleuproglyserglyserthrasntyrasnglulysleu
505560
lysglylysalathrphethralaaspthrserserasnthralatyr
65707580
metglnleuserserleuthrsergluaspserglyvaltyrtyrcys
859095
alaargglyglyglyasntyrprotyrtyrpheasptyrtrpglygln
100105110
glythrthrvalthrvalserser
115120
<210>5
<211>104
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>vl结构域鼠mabw6/800
<220>
<221>结构域
<222>21..34
<223>cdr1
<220>
<221>结构域
<222>50..59
<223>cdr2
<220>
<221>结构域
<222>85..100
<223>cdr3
<400>5
ilegluleumetthrglnserhislysphemetserthrservalgly
151015
aspargvalserilethrcyslysalaserglnaspvalglythrala
202530
valalatrptyrglnglnlysproglyglnserprolysleuleuile
354045
tyrtrpalaserthrarghisthrglyvalproaspargphethrgly
505560
serglyserglythraspphethrleuthrileserasnvalglnser
65707580
gluaspleualaasptyrphecysglnglntyrsersertyrargthr
859095
pheglyalaglythrlysleuglu
100
- 还没有人留言评论。精彩留言会获得点赞!
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法