Ω扩增的制作方法
本公开内容一般涉及与核酸扩增技术(naat)相关的组合物和方法。特别地,本公开涉及使用naat扩增的核酸检测的改进,优选强调回折引物介导的等温扩增技术。
以ascii文本文件形式提交序列表
将以下提交的ascii文本文件的内容通过引用以其整体并入本文:计算机可读形式(crf)的序列表(文件名:737962000140seqlist.txt,记录日期:2017年5月24日,大小:20kb)。
发明背景
由于lamp优于现有技术(如pcr)的优点,称为环介导等温扩增(lamp)的技术已成为诊断和测试行业中重要研究和开发的焦点。lamp是一种稳健的技术,可以在单个反应管中实施,只需最小限度的核酸处理。此外,lamp是等温扩增技术,因此不需要用于pcr的昂贵的热循环仪。lamp已经适用于许多应用,如snp检测。在美国专利7,175,985中公开了一种示例性的基于lamp的snp检测方法,其中即使在一个环状引物的5'端的单个错配也足以抑制扩增(参见例如美国专利7,175,985的实施例1)。这突出了在本领域中回折引物形成新的游离3'羟基(oh)(可由此发生互补链合成)的能力的重要性的观点。
自lamp开发以来,已经开发了许多相关技术和改进。smap与lamp类似,不同的是smap是不对称的。smap使用单个环状引物和“折叠”引物,该“折叠”引物可以折叠回自身而不是折叠到模板上。smap可与muts组合用于检测样品中的核酸多态性(参见例如wo2005/063977)。gear是lamp扩增的变型,其中两个回折引物折叠回下游互补序列,使得仅需要三个内部区域。gear也可以包括环加速引物,使得不需要侧翼“踢除物”加速引物。所有这些naat都是相关的,因为至少一个引物(通常是两个)在其5'末端具有折叠回到复制的核酸(模板序列)上的附加区域。当生成互补链时,它成为互补链中的游离3'端,其向回折叠并允许进一步扩增。回折引物生成新的游离3'oh(由此可发生进一步的链合成)的这种能力被认为是这些扩增反应中的重要特征。
这些回折扩增技术比pcr更复杂,因为每个扩增子通常需要具有六个(或甚至八个)同源区域的四个引物(或六个引物)。由于每个反应需要多个引物,这使这些技术的多路复用变得复杂。此外,使用链置换聚合酶禁止使用水解探针(例如,taqmantm),该链置换聚合酶依赖于扩增聚合酶的5'到3'外切核酸酶活性。回折扩增技术的连接产物混淆了凝胶上多个扩增靶标的分化。在一个多路化测定中,选择具有限制位点的扩增子,所述限制位点允许将连接产物拆分成可以在凝胶上容易地分离和鉴定的产物(h.iseki等人(2007))。然而,该测定需要附加的处理步骤。在另一个多路化测定中,使用双链探针,其在一条链中具有淬灭剂而在第二条链中具有荧光探针。在扩增过程中,链被置换,从而使荧光探针发荧光(biosensorsandbioelectronics30(2011)255–260)。该过程使制造复杂化,因为至少一个探针需要双链部分,并且需要针对每个检测反应设计特异性荧光探针。
因此,需要能改进通常使用naat扩增的核酸的检测的附加技术,特别是需要在无需附加的引物、同源区域或更复杂的探针的情况下改进回折扩增技术(其需要合成两条链)的检测的技术。
发明概述
所公开的发明提供了通过监测特异性检测探针与通用检测探针或化学物质之间的相互作用来实时监测靶dna的等温扩增的方法。当前的发明能够实时检测多个靶标的等温扩增。该方法通常包括提供包含靶核酸和特异性检测探针以及通用检测探针的反应混合物。通过特异性检测探针与通用检测探针之间的相互作用生成的信号实时监测靶核酸的等温扩增。特异性检测探针包含特异性探针序列,其可以是与靶特异性引物或探针的5'连接的任意序列。特异性探针序列还可以与提供的第二寡核苷酸杂交,第二寡核苷酸与特异性探针序列互补。所提供的第二寡核苷酸可以通过接头与特异性探针序列共价连接。接头可以阻断或可以不阻断聚合酶延伸。通用检测探针(通用荧光淬灭剂(fq)探针)包含两条寡核苷酸链,其中第一寡核苷酸链包含位于3'端的淬灭剂探针,并且其中通用fq探针的第二寡核苷酸链包含在5'端缀合的荧光团且其5'部分与第一寡核苷酸链互补。可选地,第一寡核苷酸链包含位于3'端的荧光团探针,并且其中通用fq探针的第二寡核苷酸链包含在5'端缀合的淬灭剂且在其5'部分与第一寡核苷酸链互补。在一些实施方案中,第二寡核苷酸链的3'部分含有完整序列或部分特异性探针序列或特异性探针互补序列。在一些实施方案中,第二寡核苷酸链的量与加入反应混合物中的第一寡核苷酸链的量的比例可小于1:1。dna聚合酶也可以加入到反应混合物中。可以测量由包含特异性探针和fq探针以及靶dna的反应混合物发射的荧光。在一些实施方案中,通用检测探针可以是单链寡核苷酸,其中该淬灭剂和荧光团可以在寡核苷酸的3'或5'端或中间进行标记。在另一个实施方案中,通用检测探针包含多于一组的寡核苷酸,其中该特异性检测探针触发寡核苷酸组的总连续相互作用以生成检测信号。在另一个实施方案中,特异性探针序列可以用作模板以与通用检测探针相互作用。
在链置换dna聚合酶的存在下,当含有模板特异性引物的特异性探针参与扩增反应时,生成特异性探针序列的互补序列。当与特异性探针序列互补的第二寡核苷酸已经与特异性探针序列杂交时,第二寡核苷酸将从特异性探针置换掉。与特异性探针序列互补的合成或置换序列将与通用fq探针相互作用,从而生成可检测的荧光信号。在另一个实施方案中,在扩增期间生成的特异性探针序列的互补序列将与通用检测探针相互作用以生成检测信号。可选地,与特异性探针序列互补的合成或置换序列含有某些结构特征如g-四联体或其他适体结合能力。检测这种核酸的结构特征的形成可以反映靶扩增反应的进程。
特异性探针序列的互补序列与通用fq探针之间的相互作用可以dna聚合酶非依赖性的,如在分子信标和阴阳探针的情况下。在这种情况下,特异性探针序列的互补序列与通用fq探针的杂交导致fq探针中荧光与淬灭部分之间的分离或结构变化,从而产生荧光信号。可选地,特异性探针序列的互补序列与通用fq探针之间的相互作用可以是dna聚合酶依赖性的。在这种情况下,特异性探针序列的新合成/置换的互补序列用作通用fq探针上的引物,并作为模板在fq探针上延伸,从而使淬灭部分从fq探针的荧光部分置换掉并产生荧光信号。在另一种情况下,特异性探针序列的新合成/置换的互补序列用作通用fq探针的模板,并在特异性探针序列上延伸以生成荧光信号变化。
特异性探针序列或置换序列的互补序列与通用探针之间的相互作用可用于进一步放大信号。特异性探针序列或置换序列的新合成的互补序列可以进行其他信号放大反应,如滚环扩增(rca)、指数扩增反应(expar)和fq侵入序列扩增。
本公开内容的另一方面是特异性探针序列附接至靶特异性引物,如环介导等温扩增(lamp)和相关的扩增技术(如smap和gear技术)中的fip或bip。在一些实施方案中,特异性探针序列标记的靶特异性引物和未标记的靶特异性引物均包括在反应混合物中。可以根据扩增和检测应用需要调节特异性探针序列标记的靶特异性引物的量与未标记的靶特异性引物的量的比例。
当引物在靶模板上延伸时,lamp(或smap和gear)技术要求回折引物(fip和bip)的5'区域,尤其是5'末端核苷酸通过与合成序列形成碱基对而退火。当合成这种链的互补链时,3'区域可以与相同链中的区域形成碱基对,并且3'末端核苷酸可以有效地用作引物以进行lamp规定的扩增。因此,在fip或bip的5'区域引入人工序列将导致3'末端区域具有互补人工序列,该互补人工序列被突出并且不退火至上游序列。这应该防止新合成的3'末端被用作链延伸的引物。
令人惊讶的是,在fip和bip的5'区域引入额外的人工序列仅对扩增效率具有最小的影响。与lamp、smap或gear技术相比,附接至回折引物的人工序列的5'区域是区别特征。我们称这种新技术为ω扩增技术。ω扩增技术独有的突出序列允许引入附加序列,该附加序列可用于检测(特别是用于多路反应)、进一步加速扩增反应和其他用途。
本公开内容的另一方面是改善回折引物扩增(lamp、gear、smap、ω)的速度和灵敏度。在一个实施方案中,在扩增反应中使用多于一组的踢除物引物(正向踢除物引物和反向踢除物引物)。在另一个实施方案中,踢除物引物在5'端具有附加序列和类似回折引物的行为,当在通过dna聚合酶扩增期间延伸踢除物引物时所述回折引物可以与相同链dna分子的下游杂交。在另一个实施方案中,在踢除引物的5'端的附加序列可以是可以加速或抑制扩增反应的任何人工序列。在另一个方面,环加速引物在5'末端具有附加序列,当环加速引物在dna聚合酶引发的回折引物扩增后延伸时,该附加序列可以与相同链dna分子的下游杂交。在另一方面,环加速引物的互补序列可用作引物以引发附加的反应和扩增。在另一方面,在环引物的5'末端的附加序列可以是可加速或抑制扩增反应的任何人工序列。在另一方面,可以将附加序列加入到茎引物中。附加序列可以与下游序列或任何人工序列杂交,只要它们可以帮助加速扩增反应。在另一方面,可以向反应中加入与fib或bip的折叠序列相同或与突出序列相同的附加引物。在另一方面,扩增反应混合物可包括先前提到的修饰和未修饰的引物。比例可用于调节扩增反应速度或灵敏度。例如,反应混合物中的环引物可以包括以下两种情况:在5'端具有额外的序列或在5'端没有附加序列。可以根据扩增和检测应用调整具有附加序列和没有附加序列的比例。
附图简述
该专利或申请文件包含至少一幅彩色附图。在请求并支付必要的费用后,官方将会提供带有彩色附图的本专利或专利申请公开物的副本。以下附图形成了本说明书的一部分并且被包括以进一步证实本公开文本的某些方面。本公开文本可以通过结合本文呈现的具体实施方案的详细描述,参考这些附图中的一个或多个而被更好的理解。
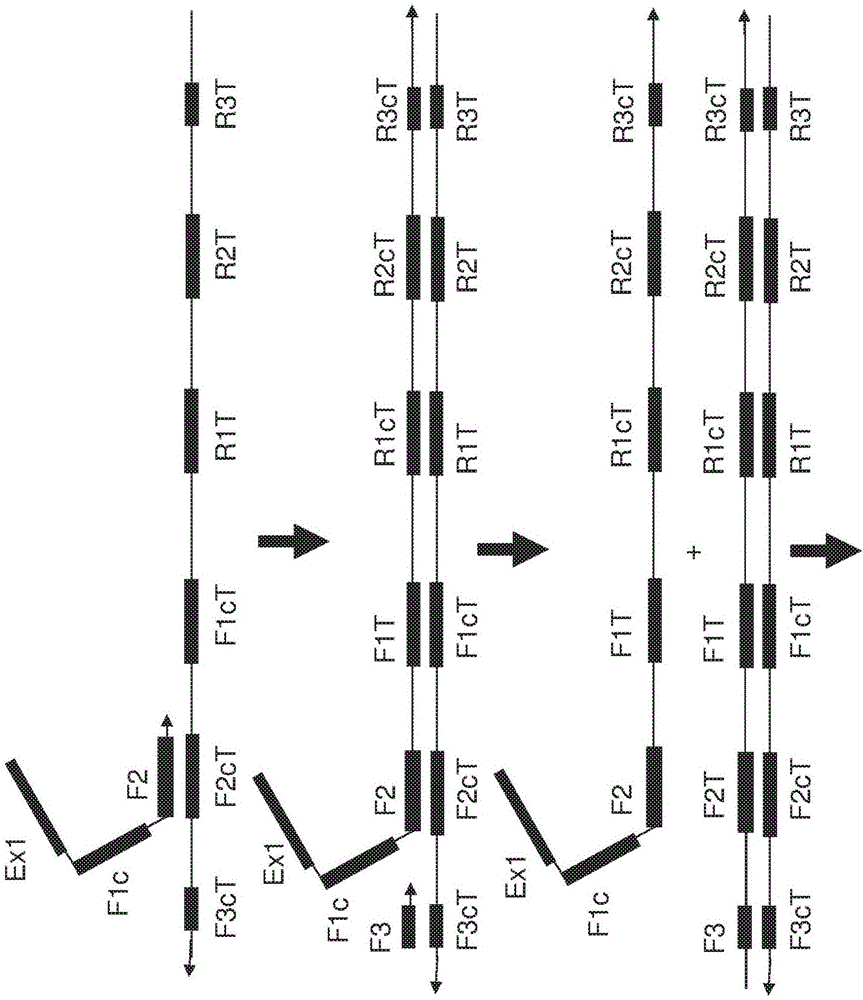
图1a和图1b显示了基于一种突出引物和一种回折引物的引物组的ω扩增的示例性实现。
图2a和图2b显示了基于一种突出引物和一种发夹引物的引物组的ω扩增的示例性实现。
图3显示了使用通用荧光fq探针和环引物作为特异性检测探针的ω扩增中的检测方法的示例性实现。在ω扩增反应期间,环引物的补体将被替换,然后与待延伸的通用fq探针杂交以剔除淬灭剂,以便生成荧光信号。
图4显示了使用通用荧光fq探针和环引物作为特异性检测探针的ω扩增中的检测方法的示例性实现。在扩增反应期间,环引物的新合成的补体将与待延伸的通用fq探针杂交以剔除淬灭剂,以便生成荧光信号。
图5显示了使用环引物作为检测探针的ω扩增中的检测方法的示例性实现。环引物的补体含有g-四联体序列。在ω扩增反应期间,环引物的补体将被替换以形成g-四联体结构,该g-四联体结构可以与所有种类的配体相互作用以生成检测信号。
图6显示了使用环引物作为通用fq探针的ω扩增中的检测方法的示例性实现。
图7显示了使用通用fq探针和环引物lb作为特异性检测探针的ω扩增中的检测方法的示例性实现。环引物的补体是在环引物的5'端与c3接头连接的fq侵入序列。在ω扩增反应期间,被替换的fq侵入序列将与通用fq探针杂交以踢掉脊盖,从而生成荧光信号。当脊盖踢掉后,侵入序列踢除物可以与脊杂交以通过聚合酶延伸,从而置换fq侵入序列。被置换的fq侵入序列可以与另一个通用fq探针杂交以使荧光信号放大循环。
图8显示了针对hpv18扩增和检测的示例性引物设计(seqidno:86)。
图9显示了与不含突出序列的lamp引物相比,用在第一(fip)、第二(bip)或两种引物上含有突出序列的ω引物进行的实时扩增的比较。
图10显示了与不含突出序列的lamp引物相比,使用含有突出序列的ω引物产生的pcr扩增产物的凝胶图像。泳道1:具有突出序列的ωfip,10nt长。泳道2:具有突出序列的ωbip,10nt长。泳道3:ωfip和bip均含有突出序列,10nt长。泳道4:lamp扩增作为对照。
图11显示了通过限制酶切割的ω扩增产物和lamp扩增产物的凝胶图像。泳道1:通过限制酶ecori切割采用10nt突出fip引物得到的ω扩增产物,该限制酶的识别位点位于e2位置(在fip的突出序列和回折序列之间插入的接合序列)。泳道2:通过限制酶ecori切割采用22nt突出bip引物得到的ω扩增产物,该限制酶的识别位点位于e2位置(在bip的突出序列与回折序列之间)。泳道3:通过限制酶ecori切割标准lamp扩增产物,该限制酶的识别位点位于e1位置(在fip的f1c与f2之间插入的接合序列)。泳道4:泳道3的平行实验。为了比较,泳道5至泳道8显示来自没有进行限制酶消化的泳道1至泳道4的扩增产物。
图12显示了通过在5'末端具有发夹结构的正向突出引物或在5'末端具有发夹结构的反向突出引物或两者进行ω扩增的示例性实现。
图13显示了通过在中间具有发夹结构的正向突出引物或在中间具有发夹结构的反向突出引物或两者进行ω扩增的示例性实现。
图14显示了使用一种类型的通用检测探针系统进行回折引物扩增中的信号检测方法的示例性实现。具有脊序列的通用检测探针(fq探针的第二链)在3'端用荧光标记,并且与脊序列杂交的脊盖(在5'端用淬灭剂标记的fq探针的第一链)相应地在5'端用淬灭剂标记。lamp扩增中环引物的特异性检测探针的反向互补被替换并在反应中变为单链,然后用作触发物(fq侵入序列)以替换脊盖,从而生成检测荧光信号。在通过触发物置换脊盖之后,触发物转而通过fq侵入序列踢除物引物延伸被置换,因此该触发物可用于下一轮信号生成。
图15显示了使用图14中描述的一种类型的通用检测探针系统进行回折引物扩增中的指数信号检测方法的示例性实现。脊在3'端用荧光或淬灭剂标记,并且与脊杂交的脊盖相应地在其5'端用淬灭剂或荧光标记。脊在其5'端包含触发物序列(灭活的触发物)的拷贝,并通过使其与其反向互补序列杂交而使其保持无活性。特异性探针或特异性探针的反向互补在反应中变为单链,用作触发物,并用通用引物(fq侵入序列踢除物)置换脊盖以将荧光染料与淬灭剂分离,从而生成信号。来自反应的触发物和非活性触发物通过通用引物延伸而被置换,因此两者均可用于下一轮信号生成。
图16显示了使用含有一种类型的含两种脊盖的通用检测探针系统进行回折引物扩增中的指数信号检测方法的示例性实现。脊在3'端用荧光或淬灭剂标记,并且与脊杂交的第一脊盖相应地在其5'端用淬灭剂或荧光标记。由反应生成的单链特异性探针或特异性探针的反向互补用作侵入序列触发物并且在侵入序列踢除物2的帮助下置换第二脊盖。侵入序列踢除物2的延伸不仅导致触发物的置换,而且还导致在侵入序列踢除物1的帮助下第一脊盖与脊的分离,这转而导致荧光染料与淬灭剂分离,从而生成信号。因此,来自反应的触发物和侵入序列踢除物2的延伸产物可用于下一轮信号生成。
图17显示了使用一种类型的通用检测探针系统进行回折引物扩增中的g-四联体基序介导的指数信号检测方法的示例性实现。脊在3'端用荧光或淬灭剂标记,并且与脊杂交的脊盖相应地在其5'端用淬灭剂或荧光标记。由反应生成的单链特异性探针或特异性探针的反向互补用作侵入序列触发物并且在侵入序列踢除物的帮助下置换脊盖,从而生成荧光。侵入序列踢除物包含部分g-四联体形成序列,并且侵入序列踢除物沿着脊的延伸完成了完整的g-四联体序列且导致g-四联体形成,这转而允许另一个侵入序列踢除物与脊杂交并且置换含有g-四联体的延长产物。因此,来自反应的触发物和侵入序列踢除物的含有g-四联体的延伸产物可用于下一轮信号生成。
图18显示了使用一种类型的通用检测探针系统进行回折引物扩增中的信号检测方法的示例性实现,所述通用检测探针系统的特征在于来自侵入序列踢除物的信号生成。当侵入序列触发物在系统中无活性时,侵入序列踢除物形成分子信标结构。在其5'端标记的荧光被液体淬灭剂淬灭或在其3'端附近内部标记的淬灭染料淬灭。当侵入序列触发物变得可用时,它用侵入序列踢除物置换盖。在此过程中,侵入序列踢除物变为线性且被延伸,使得5'部分为单链,这导致荧光信号增加。侵入序列触发物通过侵入序列踢除物延伸而被置换,因此可用于下一轮信号生成。
图19显示了使用一种类型的通用检测探针系统进行回折引物扩增中的信号检测方法的示例性实现,所述通用检测探针系统的特征在于含有脊和盖的探针。荧光染料在3'端标记,从而与嵌入淬灭剂染料或自淬灭剂引物作用(nucleicacidresearch2002,vol30,no9,e37),这两者都允许较低的荧光信号,其中盖部分和脊部分彼此杂交以形成发夹环结构。侵入序列触发物的存在导致通用引物沿着脊一直延伸到脊盖探针的5'端并置换盖部分。用荧光染料标记的单链显示通过嵌入淬灭剂染料或自淬灭剂引物而增加的荧光信号(nucleicacidresearch2002,vol30,no9,e37)。
图20显示了使用一种类型的通用检测探针系统进行回折引物扩增中的信号检测方法的示例性实现,所述通用检测探针系统的特征在于当脊未与脊盖杂交时能够自引发的脊。侵入序列触发物的存在导致盖的置换和脊的自引发。脊沿着其自身的延伸导致信号的生成以及下一轮的侵入序列触发物的再循环。
图21显示了使用一种类型的通用检测探针系统进行回折引物扩增中的信号检测方法的示例性实现,所述通用检测探针系统的特征在于在沿着侵入序列触发物延伸后能够自引发的脊。当侵入序列触发物存在于系统中时,它用作脊的模板。脊沿着侵入序列触发物的延伸生成可以折叠回位于脊上的反向互补序列的序列。因此,fq荧光/淬灭剂探针被置换并且在这种自折叠和延伸时生成信号。
图22显示了使用一种类型的通用检测探针系统进行回折引物扩增中的信号检测方法的示例性实现,所述通用检测探针系统的特征在于在沿着侵入序列触发物延伸后能够自引发的脊的备选设计。脊在侵入序列触发物结合区域内含有茎环结构。当侵入序列触发物存在于系统中时,它用作脊的模板。脊沿着侵入序列触发物的延伸生成可以折叠回位于环区域中的反向互补序列的序列。因此,fq荧光/淬灭剂探针被置换并且在这种自折叠和延伸时生成信号。
图23a显示了在基于如图14所示的形式的实时等温反应中使用通用检测探针的示例性实验结果。在含有0.1μm脊序列、0.1μm脊盖、0.8μm通用引物的25ul反应中检测到0nm(绿色)、0.8nm(黑色)、8nm(红色)、80nm(浅蓝色)和800nm(深蓝色)侵入序列触发物。反应在abisteponereal-timepcrinstrumenttm中60℃下进行48分钟,以60秒间隔测量fam荧光。
图23b显示了与使用特异性fq探针的lamp反应相比,使用如图9所示的通用检测探针的lamp反应的比较结果。
定义
如本文所用,术语“互补”或“互补性”用于指根据碱基配对规则相关的多核苷酸(例如,核苷酸序列,如寡核苷酸或靶核酸)。例如,序列“a-g-t”与序列“t-c-a”互补。互补性可以是“部分的”,其中根据碱基配对规则只有一些核酸的碱基是匹配的。或者,核酸之间可能存在“完整”或“完全”互补性。核酸链之间的互补性程度对核酸链之间的杂交效率和强度具有显著影响。这在扩增反应以及依赖于核酸之间结合的检测方法中特别重要。
如本文所用,术语“杂交”用于指互补核酸的配对。杂交和杂交强度(核酸之间缔合的强度)受到诸如核酸之间的互补程度、所涉及的条件的严格性,所形成的杂种的tm和核酸内的g:c比例等因素的影响。
如本文所用,术语“tm”用于指“解链温度”。解链温度是双链核酸分子群被一半地解离成单链的温度。用于计算核酸tm的方程是本领域公知的。如标准参考文献所示,当核酸在1mnacl的水溶液中时,tm值的简单估算可以通过以下方程计算:tm=81.5+0.41(g+c%)(参见例如,anderson和young,quantitativefilterhybridization,innucleicacidhybridization(1985))。其他参考文献包括更复杂的计算,其将结构和序列特征考虑在内以计算tm。
如本文所用,术语“严格性”用于指温度、离子强度和其他化合物的存在的条件,在这些条件下进行核酸杂交。在“高严格性”条件下,核酸碱基配对仅在具有高频率的互补碱基序列的核酸片段之间发生。因此,当希望彼此不完全互补的核酸杂交或退火在一起时,通常需要“弱”或“低”严格性的条件。
术语“寡核苷酸”包括单个“寡核苷酸”以及多个“寡核苷酸”,其被定义为包含两个或更多个脱氧核糖核苷酸或核糖核苷酸,优选至少5个核苷酸、更优选至少约10-15个核苷酸和更优选至少约15至30个核苷酸的分子。准确的大小将依赖于许多因素,而这些因素又依赖于寡核苷酸的最终功能或用途。寡核苷酸可以以任何方式生成,包括化学合成、dna复制、逆转录或其组合。因为单核苷酸以某种方式反应制备寡核苷酸,使得一个单核苷酸戊糖环的5'磷酸经由磷酸二酯连接在一个方向上附接至其邻近者的3'氧,所以如果其5'磷酸不与单核苷酸戊糖环的3'氧连接,则寡核苷酸的一端被称为“5'端”,如果其3'氧不与后续单核苷酸戊糖环的5'磷酸连接,则称为“3'端”。如本文所用,核酸序列,即使在较大寡核苷酸内部,也可以说具有5'和3'端。如果当沿着5'到3'方向的核酸链移动时第一区域的3'端在第二区域的5'端之前,则沿着核酸链的第一区域被称为在另一区域的上游。当两个不同的非重叠寡核苷酸退火至相同线性互补核酸序列的不同区域,并且一个寡核苷酸的3'端指向另一个寡核苷酸的5'端时,前者可称为“上游”寡核苷酸,后者称为“下游”寡核苷酸。术语“寡核苷酸”可以是dna和/或rna和/或其类似物和/或dnarna嵌合/或单链或双链/或部分双链和部分单链。术语寡核苷酸不表示对试剂的任何特定功能,相反,它一般用于涵盖本文所述的所有此类试剂。寡核苷酸可以起到各种不同的功能,例如,如果它能够与互补链杂交并且可以在核酸聚合酶存在下进一步延伸,则它可以起到引物的作用,如果它含有通过rna聚合酶识别的序列并且允许转录,则它可以提供启动子,它可以含有用于信号生成/放大的检测试剂,以及如果适当地定位和/或修饰,则它可以起到防止杂交或阻止引物延伸的作用。下面更详细地描述了本发明的特异性寡核苷酸。如本文所用,寡核苷酸实际上可以是任何长度,仅受其在扩增反应中或在检测扩增反应的扩增产物中的特定功能的限制。如本公开所预期的,寡核苷酸不仅由野生型染色体dna或其体内转录产物组成。可以以任何方式修饰寡核苷酸,只要给定的修饰与给定寡核苷酸的所需功能相容即可,所述给定寡核苷酸的所需功能可以容易地确定。修饰包括碱基修饰、糖修饰或骨架修饰。碱基修饰包括但不限于使用以下碱基以及腺嘌呤、胞苷、鸟苷、胸腺嘧啶和尿嘧啶:c-5丙炔、2-氨基腺嘌呤、5-甲基胞苷、肌苷以及dp和dk碱基。核苷亚基的糖基可以是核糖、脱氧核糖及其类似物,包括例如具有对呋喃核糖基部分的2'-o-甲基(2'-o-me)取代的核糖核苷。参见“methodforamplifyingtargetnucleicacidsusingmodifiedprimers,”(becker,majlessi,&brentano,2000,美国专利号6,130,038)。其他糖修饰包括但不限于2'-氨基、2'-氟代、(l)-α-苏式呋喃糖基(threofuranosyl)和五碳吡喃糖基(pentopuranosyl)修饰。核苷亚基可以通过连接如磷酸二酯连接、修饰的连接或通过非核苷酸部分来接合,所述非核苷酸部分不阻止寡核苷酸与其互补的靶核酸序列杂交。修饰的连接包括这些连接,其中标准磷酸二酯连接被不同的连接如硫代磷酸酯连接或甲基膦酸酯连接替换。例如,核碱基亚基可以通过用假肽骨架(如2-氨基乙基甘氨酸骨架,其通过羧甲基接头将核碱基亚基与中心仲胺偶联)替换dna的天然脱氧核糖磷酸骨架来接合。(具有假肽骨架的dna类似物通常称为“肽核酸”或“pna”,并且由nielsen等人,“peptidenucleicacids,”(nielsen,buchardt,egholm,&berg,1996,美国专利号5,539,082)公开。其他连接修饰包括但不限于吗啉代键。本发明考虑的寡核苷酸或寡聚物的非限制性例子包括含有双环和三环核苷和核苷酸类似物(lna)的核酸类似物。参见imanishi等人,“bicyclonucleosideandoligonucleotideanalogues,”(imanishi&obika,2001,美国专利号6,268,490);和wengel等人,“oligonucleotideanalogues,”(wengel&nielsen,2003,美国专利号6,670,461)。本发明考虑了任何核酸类似物,条件是修饰的寡核苷酸可以执行其预期功能,例如,在严格杂交条件或扩增条件下与靶核酸杂交或与dna或rna聚合酶相互作用,从而启动延伸或转录。在检测探针的情况下,修饰的寡核苷酸还必须能够在严格杂交条件下优先与靶核酸杂交。如下所述,可以使用封闭部分以多种方式封闭寡核苷酸(或其他核酸)的3'端。“封闭的”寡核苷酸不能通过dna或rna依赖性dna聚合酶向其3'端添加核苷酸来有效地延伸,以产生dna的互补链。因此,“封闭的”寡核苷酸不能是“引物”。
术语“引物”是指当置于引发引物延伸的条件下时能够充当合成的起始点的寡核苷酸。寡核苷酸“引物”可以天然存在,如在纯化的限制性消化中,或可以合成产生。选择引物以与模板的特异性序列的链“基本上”互补。引物必须充分互补以与模板链杂交以发生引物延长。引物序列不需要反映模板的确切序列。例如,非互补核苷酸片段可以附接至引物的5'端,引物序列的其余部分基本上与链互补。非互补碱基或更长的序列可以穿插在引物中,条件是引物序列与模板的序列具有足够的互补性以进行杂交,从而形成用于合成引物的延伸产物的模板引物复合物。
“杂交”方法包括使互补序列退火至靶核酸(待检测的序列;该序列的检测可以通过直接或间接方式)。含有互补序列的两种核酸聚合物彼此寻找彼此的能力和通过碱基配对相互作用退火的能力是公认的现象。在marmur和lane,proc.natl.acad.sci.usa46:453(1960)以及doty等人,proc.natl.acad.sci.usa46:461(1960)对“杂交”过程的初始观察之后,将过程完善为现代生物学的基本工具。关于互补性,对于一些诊断应用来说,确定杂交代表完全或部分互补性是重要的。例如,在希望仅检测病原体dna(如来自病毒、细菌、真菌、支原体、原生动物)的存在或不存在的情况下,唯一重要的是杂交方法确保当存在相关序列时杂交;可以选择如下条件,其中部分互补探针和完全互补探针都将杂交。然而,其他诊断应用可能要求杂交方法区分部分和完全互补性。检测遗传多态性可能是有意义的。例如,人血红蛋白部分地由四条多肽链组成。这些链中的两个是141个氨基酸(α链)的相同链,并且这些链中的两个是146个氨基酸(β链)的相同链。已知编码β链的基因显示出多态性。正常等位基因编码在第六位具有谷氨酸的β链。突变等位基因编码在第六位具有缬氨酸的β链。这种氨基酸差异具有深远的(当个体对于突变等位基因是纯合的时候最为深远)生理影响,其在临床上称为镰状细胞贫血。众所周知,氨基酸变化的遗传基础包括正常等位基因dna序列与突变等位基因dna序列之间的单个碱基差异。本文所用的核酸序列的补体是指当与核酸序列比对使得一个序列的5'端与另一个序列的3'端配对时,处于“反平行缔合”的寡核苷酸。天然核酸中不常见的某些碱基可包括在本发明的核酸中,并且包括例如肌苷和7-脱氮鸟嘌呤。互补性不必是完美的;稳定的双链体可能含有错配的碱基对或不匹配的碱基。核酸技术领域的技术人员可以考虑许多如下变量凭经验确定双链体稳定性,包括例如寡核苷酸的长度、寡核苷酸的碱基组成和序列、离子强度和错配碱基对的发生率。通过解链温度或“tm”测量核酸双链体的稳定性。
如本文所用,术语“标记”是指可用于提供可检测(优选可定量)信号并且可附接于核酸或蛋白质的任何原子或分子。标记可以提供通过荧光、放射性、比色法,重量分析法、x射线衍射或吸收、磁性、酶活性等可检测的信号。标记可以是带电荷的部分(正电荷或负电荷),或者可以是电荷中性的。
如本文所用,术语“回折引物”是指含有如下区域的引物,该区域当所述引物在通过dna聚合酶扩增期间延伸时含有可与相同链dna分子的下游杂交。示例性的回折引物包括但不限于lamp和gear扩增中的fip和bip引物、smap扩增中的折返引物和ω扩增中的突出引物。
如本文所用,术语“回折引物扩增”描述为使用一种或多于一种具有如下区域的引物的任何等温扩增,该区域当所述引物在通过dna聚合酶扩增期间延伸时,可与相同链dna分子的下游杂交。示例性的回折引物扩增包括但不限于lamp、smap、gear和ω。在一个实施方案中,回折引物可用于near反应。在这种情况下,near扩增也被算作回折引物扩增。
如本文所用,术语“发夹”描述了由多核苷酸形成的结构,其5'和3'区域形成大致的双螺旋。发夹引物是含有发夹结构作为引物的一部分或全部的引物,并且该发夹结构可以存在于引物的5'区域或内部区域。在3'端聚合酶延伸后,发夹序列的5'区域不会与相同的链下游序列杂交。
如本文所用,术语“突出引物或突出探针”是指用作含有三个区域的引物或探针的寡核苷酸。3'端的第一区域与靶dna杂交以进行聚合酶延伸。当该引物在通过dna聚合酶扩增期间延伸时,在突出引物或探针中间的第二区域可以与相同链dna分子的下游杂交。当该引物或探针在通过dna聚合酶扩增期间延伸时,称为突出序列的5'端的第三区域不与相同链dna分子的下游杂交。第三区域可以具有任何种类的折叠结构,或者可以是单链或双链,或者可以含有任何修饰的核苷酸。回折引物扩增中的任何引物(在其5’端加入额外序列)将被算作突出引物或突出探针,所述额外序列当该引物在通过dna聚合酶扩增期间延伸时不与相同链dna分子的下游杂交。在第一区域与第二区域之间可以包括附加的人工序列或任何非天然核苷酸。
如本文所用,术语“突出序列”是指位于突出引物或突出探针的5'端的寡核苷酸序列,该寡核苷酸序列当该引物在通过dna聚合酶扩增期间延伸时不与相同链dna分子的下游杂交。突出序列可包括天然或非天然核苷酸或修饰的核苷酸,如肌苷。突出序列可以是嵌合序列。突出序列可包括切口位点、启动子序列或可用于促进靶扩增和检测的任何其他功能序列或核苷酸。
当用于提及核酸区域时,术语“基本上单链”意指核酸区域主要以单链形式存在,这与双链区域相反,双链区域以通过链间碱基配对相互作用保持在一起的两条核酸链的形式存在。
当用于提及酶(如dna聚合酶)时,术语“热稳定的”表示酶在升高的温度下例如在约55℃或更高温度下是功能性或活性的(例如,可以进行催化)。
术语“靶核酸”是指核酸分子,其含有与至少一种探针寡核苷酸具有至少部分互补性的序列,并且还可以与侵入寡核苷酸具有至少部分互补性。靶核酸可包含单链或双链dna或rna。
如本文所用,术语“扩增子核酸”是指通过扩增反应由靶核酸生成的模板核酸链或补体的任何和全部拷贝。
术语“特异性探针序列”或“特异性检测序列”是指寡核苷酸或其互补序列或与其互补序列寡核苷酸配对的寡核苷酸,它与引物或探针的5'端连接并与通用检测探针或化学物质或寡核苷酸或其互补序列相互作用,由于该特异性检测序列中存在的序列或结构特征,其本身可被检测到。特异性检测序列可以具有采用阻止聚合酶延伸的部分进行的内部修饰。特异性检测序列可包括非天然核苷酸。
术语“特异性检测探针或检测探针”是指包含特异性检测序列的探针或引物,该特异性检测序列可用于通过监测来自特异性检测探针或检测探针的信号变化或特异性检测序列与通用检测探针之间的相互作用来监测扩增反应。在另一个实施方案中,特异性检测探针包含特异性检测序列,该特异性检测序列可以具有与特殊化学物质或配体相互作用以监测扩增反应的特殊结构特征。特殊结构特征的例子是g-四联体结构或适体结构,如atp适体。在ω扩增中,监测扩增可以直接监测检测探针信号变化,而不监测检测探针与通用检测探针之间的相互作用。例如,检测探针是在引物的5'端附接有通用fq探针的引物。在这种情况下,两条寡核苷酸链,其中第一寡核苷酸链包含位于3'端的淬灭剂探针,且通用fq探针的第二寡核苷酸链包含位于5'端的荧光团并在其5'部分与第一寡核苷酸链互补。通用fq探针的第二寡核苷酸链的3'区域将与作为引物的模板杂交,以通过链置换聚合酶延伸。
如本文所用,术语“通用fq探针”是指两条寡核苷酸链,其中第一fq寡核苷酸链包含淬灭剂部分且第二fq寡核苷酸链包含荧光团,或第一fq寡核苷酸链包含荧光团且第二fq寡核苷酸链包含淬灭剂部分。第一和第二寡核苷酸链是互补的,并且当退火时淬灭剂部分淬灭荧光团的荧光。构建第一链和第二链,使得第一链可以从第二链置换或相反,从而允许荧光团发荧光。在某些实施方案中,一条链退火至另一条链的3'部分,从而允许fq引物退火并置换退火至另一条链的3'部分的一条链。在某些实施方案中,通用fq探针的第一和第二寡核苷酸链是折叠回自身的单个寡核苷酸链的一部分。任何一条链可以包含二级结构或适体序列以促进其被fq侵入序列替换。第二寡核苷酸可以包含二级结构或修饰的核苷酸,以便fq侵入序列踢除物使用第二寡核苷酸作为模板延伸后被替换。
如本文所用,术语“通用检测探针”是指将直接或间接地与特异性探针序列相互作用的寡核苷酸。通用检测探针优选不与模板核酸相互作用。通用检测探针可以是单链或双链寡核苷酸。这些寡核苷酸可包括天然或非天然核苷酸。通用检测探针可具有二级结构,如茎环发夹结构。通用检测探针可包含一种或多于一种寡核苷酸。如果包含多于一种通用检测探针以便生成可检测的扩增信号,则特异性检测探针可以引发这些通用检测探针的总连续相互作用。特异性探针序列与通用检测探针之间的相互作用可以是聚合酶依赖性的或不依赖于聚合酶活性。当聚合酶涉及特异性探针序列与通用检测探针之间的相互作用时,特异性探针序列和通用检测探针均可用作引物或模板。通用检测探针的典型例子是通用fq探针,其可包括四个基本组件:通用引物(fq侵入序列踢除物)、触发物(fq侵入序列,特异性检测探针的一部分)、脊序列(第二链fq探针)和脊盖(fq探针的第一链)。触发物是指可以与脊相互作用并启动信号放大级联和检测反应的寡核苷酸。触发物是特异性检测探针序列的一部分或特异性检测探针序列部分的反向互补序列,或者它可以是在扩增期间生成或释放的任何序列。脊是含有fq侵入序列踢除物、fq侵入序列和脊盖(fq探针的第一链)的互补序列的寡核苷酸。当触发物未与脊杂交时,脊盖与脊杂交并防止fq侵入序列踢除物延伸。当触发物可用并与脊杂交时,将脊盖与脊分离,并且使fq侵入序列踢除物与脊杂交并通过具有链置换活性的dna聚合酶进行延伸。反过来,触发物被置换并与另一个未反应的脊杂交。一些形式可以经由茎环结构将单个寡核苷酸中的两个基本组件组合。一些形式的通用检测探针可能已经具有与作为脊的一部分或作为单独寡核苷酸的其互补序列杂交的触发物,以指数地放大荧光信号。一些形式的通用检测探针可以在脊和脊盖上携带荧光团和淬灭剂或相反,而其他形式可以在fq侵入序列踢除物中携带荧光团和淬灭剂,或者提供单独通用fq探针以生成荧光信号。一些形式可能在系统中仅携带荧光团而没有淬灭剂,并使用嵌入染料作为荧光淬灭剂(专利公开号:us2012/0282617a1)。
术语“fq侵入序列”是指在扩增过程中释放或生成的特异性探针序列的一部分。fq侵入序列与通用检测探针或通用fq探针相互作用,其中fq侵入序列退火至fq探针的第二链,从fq探针置换fq探针的第一链,并且转而将荧光团与淬灭剂分离,从而允许荧光团发荧光。可选地,fq侵入序列可用作模板以与通用检测探针相互作用从而生成检测信号。
术语“fq侵入序列踢除物”是指仅在fq侵入序列退火至fq探针的第二链之后才与fq探针的第二链杂交的特异性寡核苷酸。在链置换扩增条件下,fq侵入序列踢除物是一种引物,它使用fq探针的第二链作为模板从而进行延伸以替换fq侵入序列。可以循环新替换的fq侵入序列以启动另一轮信号生成。fq侵入序列踢除物可以附接荧光染料以生成可检测的放大信号。fq侵入序列踢除物可以在其5'端包含人工序列。fq侵入序列踢除物在其与fq探针的第二链杂交时可在其3'端附近包含错配。
术语“fq侵入序列踢除物替换”是指一种引物或探针或反应,其在fq侵入序列踢除物沿着fq探针的第二链延伸后将替换fq侵入序列踢除物。fq侵入序列踢除物替换可以在切口延伸替换反应、适体反应、链交换反应等基础上发生。
如本文所用,术语“序列变异”是指两个核酸之间的核酸序列的差异。例如,野生型结构基因和该野生型结构基因的突变形式可以通过存在单碱基取代和/或缺失或插入一个或多个核苷酸而在序列上变化。可以说这两种形式的结构基因在序列上彼此不同。可能存在结构基因的第二种突变形式。可以说第二种突变形式在序列上与野生型基因和该基因的第一种突变形式不同。
如本文所用,术语“置换”是指寡核苷酸或寡核苷酸的一部分通过在核酸合成过程中某些具有链置换活性的聚合酶的作用从与其互补序列的碱基配对相互作用中释放。
如本文所用,术语“核苷酸类似物或非天然核苷酸”是指修饰的或非天然存在的核苷酸,如7-脱氮嘌呤(例如7-脱氮-datp和7-脱氮-dgtp)、肌苷等。核苷酸类似物包括碱基类似物并包含修饰形式的脱氧核糖核苷酸以及核糖核苷酸。
本说明书和权利要求中的术语“样品”以其最广泛的含义使用。在一方面,它意味着包括试样或培养物(例如,微生物培养物)。在另一方面,它意味着包括生物和环境样品。“患者样品”包括从受试者采集的任何样品,并且可包括血液、唾液、脑脊髓液、胸膜液、乳汁、淋巴液、痰液、精液、粪便、拭子、支气管肺泡灌洗液、组织样品或尿。其他合适的患者样品和提取它们的方法是本领域技术人员公知的。从中采集样品的患者或受试者可以是人或非人动物。当样品没有明确称为患者样品时,该术语还包括从其他来源采集的样品。例子包括来自表面的拭子、水样(例如废水、海水、湖水、饮用水)、食品样品、化妆品、药品、发酵产品、细胞和微生物培养物以及在其中可进行微生物检测的其他样品。生物样品可以从家畜的所有各种家族以及未驯服的或野生动物中获得,包括但不限于诸如有蹄类动物、熊、鱼、兔类动物、啮齿动物等动物。
术语“靶核酸的来源”是指含有核酸(rna或dna)的任何样品。特别优选的靶核酸来源是生物样品,包括但不限于血液、唾液、脑脊髓液、胸膜液、乳汁、淋巴液、痰液、精液、粪便、拭子、支气管肺泡灌洗液、组织样品或尿。
如果一种寡核苷酸以比另一种寡核苷酸(或靶核酸序列)更高的摩尔浓度存在,则称该寡核苷酸相对于另一种寡核苷酸(或靶核酸序列)是“过量”存在的。当寡核苷酸如探针寡核苷酸相对于互补靶核酸序列的浓度过量存在于裂解反应中时,该反应可用于指示存在的靶核酸的量。通常,当过量存在时,探针寡核苷酸将以至少100倍摩尔过量存在;当靶核酸序列以约10飞摩尔或更低的量存在时,通常使用至少1皮摩尔的每种探针寡核苷酸。
“怀疑含有”第一和第二靶核酸的样品可含有靶核酸分子中的任一种、两者或两者都不含。
术语“聚合方法”是指能够促进向寡核苷酸添加核苷三磷酸的任何试剂。优选的聚合方法包括dna聚合酶。
如本文所用,术语“纯化的”或“纯化”是指从样品中去除污染物。
如本文所用,术语“重组dna分子”是指dna分子,其由通过分子生物学技术接合在一起的dna区段组成。
如本文所用,“核酸序列”是指寡核苷酸或多核苷酸及其片段或部分,其可以是单链或双链并且代表有义链或反义链。如本文所用,核酸可以是dna、rna及其嵌合体。核酸可以天然产生或人工合成。核酸可包括或完全由非天然存在的核苷酸组成,只要需要退火的区域可在反应条件下退火即可。举例来说,核酸可以具有部分或完全由硫代磷酸酯键形成的骨架。除非明确说明,否则构成本文公开的核酸的核苷酸的数目不受限制。例如,模板分子的核酸可以是完整的真核染色体。类似地,如本文所用,“氨基酸序列”是指肽或蛋白质序列。
如本文所用,“肽核酸”(“pna”)是指包含寡聚物的分子,其中已添加氨基酸残基,如赖氨酸和氨基。这些小分子也称为抗基因试剂,其通过与其核酸互补链结合来阻止转录物延长[nielsenpe等人(1993)anticancerdrugdes.8:53-63]。
发明详述
当回折引物在通过dna聚合酶扩增期间(其中可以发生附加的互补链合成)延伸时,回折引物扩增的各种实现都依赖于生成新的游离3'oh用于延伸。本文公开的组合物、反应、方法和试剂盒的某些方面基于以下令人惊讶的发现:当一个或多个回折引物在其5'端具有能防止这种用于延伸的新的游离3'oh的生成的一个或多个额外核苷酸时,回折引物扩增效率不会受到显著影响(尽管美国专利7,175,985的实施例1表明即使回折引物的5'末端的单核苷酸错配也能抑制扩增)。本申请的发明人惊奇地发现,可以在回折引物的5'末端添加突出序列,其中当该回折引物在通过dna聚合酶的回折引物扩增期间延伸时,突出序列不与相同链dna分子的下游杂交。这阻止了一种重要的扩增模式,因为复制后的回折引物由于存在突出序列而不能提供新的游离3'oh用于复制。然而,即使在相同dna链分子扩增的下游没有这种附加的3'oh延伸模式,本文公开的ω扩增反应可仍然与回折引物不具有突出序列的扩增反应几乎一样快。在某些方面,ω扩增的速度是在回折引物上没有任何突出序列的相应回折扩增的至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或甚至至少100%。
ω扩增区别于lamp、smap和gear,因为至少一个回折引物在其5'末端包含突出序列,该突出序列当该引物在通过dna聚合酶的扩增期间延伸时不与相同链dna分子的下游杂交。如本文所用,ω扩增反应是回折引物扩增反应的子集。在一些实施方案中,突出序列发现于扩增子核酸的一端(或两端)。当该引物在通过dna聚合酶的扩增期间延伸时突出序列优选不与相同链dna分子的下游杂交,或突出序列至少不退火至模板核酸的扩增部分附近的模板核酸。
突出序列为至少1、2、3、4、5、6、7、8、9、10、12、14、16、18、20、25、30、35、40、45、50、60、70、80、90、100、150或200个核苷酸。突出序列可以为少于500、450、400、350、300、250、200、150、100、90、80、70、60、50、45、40、35、30、25或20个核苷酸。在某些方面,突出序列的长度可以为1至100个核苷酸、2至75个核苷酸、3至50个核苷酸或4至30个核苷酸。突出序列可以具有如下任何序列,只要当该引物在ω扩增反应期间延伸时,该序列将不提供游离的3'oh以与相同链dna分子的下游杂交。举例来说,正向回折引物中的突出序列将不退火至模板第二链的f1t区域的紧邻3'区域。在一些实施方案中,突出序列包含g-四联体、t7启动子序列、切口位点或fq序列。在一些实施方案中,突出序列将是富含胍的(富含g的),因为富含g的突出序列可以加快ω扩增反应。在一些实施方案中,突出序列可具有包含修饰的核苷酸或非天然核苷酸的发夹结构。
突出序列是任意序列,因为当该引物在通过dna聚合酶的扩增期间延伸时,该任意序列将不与相同链dna分子的下游杂交。ω扩增技术独有的突出序列允许引入任何附加序列,该附加序列可用于检测(特别是用于多路反应)、进一步加速扩增反应和其他用途。
本公开内容的另一方面是改善回折引物扩增的速度和灵敏度。在一个实施方案中,本发明发现在扩增反应中使用的多于一组踢除引物(正向踢除引物和反向踢除引物)可以改善回折引物扩增灵敏度。在另一个实施方案中,踢除引物在5'端具有额外序列,该额外序列当踢除引物在通过dna聚合酶的扩增期间延伸时可以与相同链dna分子的下游杂交,这将提高反应速度并且还改善扩增灵敏度。在另一方面,本发明发现环加速引物在其5'端具有额外序列,该额外序列当环加速引物在通过dna聚合酶的回折引物扩增期间延伸时可与相同链dna分子的下游杂交。在另一方面,来自环加速引物的互补序列(它是在回折引物扩增反应期间合成的互补链)的游离3'oh可用作引物以引发附加的反应和扩增。在另一方面,可以将额外序列添加至茎引物(wo2010146349)。茎引物的额外序列可以与下游序列或任何人工序列杂交,只要它们可以帮助加速扩增反应。在另一方面,可以向反应混合物中加入额外的引物,该额外的引物与fib或bip的折叠序列的区域具有相同的序列,或者可以向反应中加入与突出序列相同的序列。在另一方面,对于相同的引物如fip作为例子,在具有突出序列fip和不具有突出序列fip引物的情况下扩增反应混合物均可包含fip引物。具有突出序列fip和不具有突出序列fip引物的比例可用于调节扩增反应速度或灵敏度。在另一方面,回折引物的折叠区域的gc含量可用于调节反应速度和灵敏度。gc含量在10%至20%、20%至30%、30%至40%、40%至50%、50%至60%、60%至70%、70%至80%之间,理想地在30%至40%之间。对于near扩增,可以将一种或两种引物设计为突出引物。切口位点将位于突出序列内。对于tma扩增,可以将一种或两种引物设计为突出引物。启动子序列将位于突出序列内。
本发明的另一方面是使用ω技术来检测突变。3'端特异性探针序列引物或探针的第一核苷酸将在突变位点上杂交,并且3'端特异性探针序列的第二核苷酸将与模板错配。当3'端第一和第二碱基与模板错配时,聚合酶将不能延伸特异性探针序列引物或探针,并且没有检测到扩增信号。然而,当第一核苷酸与模板匹配时,聚合酶将能够延伸特异性探针序列引物或探针并检测扩增信号。相同的原理可用于检测dna甲基化。
本文公开的组合物、反应、方法和试剂盒的附加方面基于可与本文公开的回折扩增反应一起使用的包括通用fq探针和g-四联体探针在内的新型检测方法。
如本文所用,模板核酸通常具有第一链,一链从5'到3'具有:任第选的f3模板序列(f3t,图1)、f2模板序列(f2t,图1)、f1模板序列(f1t,图1)、r1互补模板序列(r1ct,图1)、r2互补模板序列(r2ct,图1)和任选的r3互补模板序列(r3ct,图1)。模板核酸通常具有第二链,第二链从5'到3'具有:任选的r3模板序列(r3t,图1)、r2模板序列(r2t,图1)、r1模板序列(r1t,图1)、f1互补模板序列(f1ct,图1)、f2互补模板序列(f2ct,图1)和任选的f3互补模板序列(f3ct)。在一些情况下(例如,gear扩增),f1t和r1ct重叠或在相同区域中是一个(对于f1ct和r1t的相应情况也是如此,图1)。虽然模板核酸具有第一和第二链,但是当样品仅具有模板的第一链或第二链时,可以引发本文的扩增反应。
用于本文公开的反应的模板核酸包括但不限于cdna、基因组dna、dna-rna杂种、mrna、mirna、rrna、trna等。此外,模板核酸可以插入载体中(并且可以包括载体的一部分和插入片段的一部分)。用于本文公开的反应的靶核酸可以是纯化的或粗制的核酸或经化学合成的。此外,本文公开的反应可以用细胞中的靶核酸进行(原位)。可以使用细胞中的双链或单链核酸作为模板进行原位基因组分析。
当mrna(或其他rna)是模板核酸时,可以首先通过使用逆转录酶将mrna转化为rna-dna杂种或cdna。优选地,逆转录酶在反应条件下是活性的,因此可以包含在扩增反应混合物中。当在本文公开的扩增反应中使用的dna聚合酶具有逆转录酶活性时,可以在与扩增反应相同的条件下使用该dna聚合酶作为单一酶进行rna-dna杂交或cdna合成。例如,bcadna聚合酶或bstdna聚合酶是具有链置换活性以及逆转录酶活性的dna聚合酶。当然,本文公开的扩增反应也可以在rna-dna杂种形成之后或甚至在通过第二链合成形成完整的双链cdna之后进行,它们可以与扩增反应分开进行。
“扩增子核酸”是通过本文公开的扩增反应生成的模板核酸链的任何和所有拷贝。通过本文公开的扩增反应生成的模板核酸的第一引物依赖性拷贝是“主要扩增子”。由本文公开的扩增反应生成的主要扩增子的第一拷贝是“第一代扩增子”。本文公开的扩增反应生成的第一代扩增子的其他拷贝(和这些拷贝的拷贝等)是“下一代扩增子”。因此,扩增子核酸包括主要扩增子、第一代扩增子和下一代扩增子中的全部。
如本文所用,核酸可以是dna、rna及其嵌合体。核酸可以天然产生或人工合成。核酸可包括或完全由非天然存在的核苷酸组成,只要需要退火的区域可在反应条件下退火即可。举例来说,核酸可以具有部分或完全由硫代磷酸酯键形成的骨架。除非明确说明,否则构成本文公开的核酸的核苷酸的数目不受限制。例如,模板分子的核酸可以是完整的真核染色体。
在一些实施方案中,本发明涉及用于在核酸链置换扩增期间信号生成的方法,例如但不限于lamp、smap、near、nasba、tma、rca和expar。在一个方面,提供了监测靶dna的等温扩增的方法。该方法通常包括提供包含靶dna和一种或多种能够扩增靶dna的靶特异性引物的反应混合物。特异性探针序列与靶特异性引物的5'连接。特异性探针序列可以是任意序列。通过检测特异性探针序列与其他寡核苷酸或化学物质之间的相互作用以针对核酸模板扩增和检测来监测等温扩增。例如,还提供了通用fq探针,其中该探针包含两条寡核苷酸链,其中第一寡核苷酸链包含位于3'端的淬灭剂探针,并且其中通用fq探针的第二寡核苷酸链包含在5'端缀合的荧光团且其5'部分与第一寡核苷酸链互补。第二寡核苷酸链的3'部分含有特异性探针序列的全部或部分。第二寡核苷酸链的量与加入反应混合物中的第一寡核苷酸链的量的比例可小于1:1。dna聚合酶也可以加入到反应混合物中。可以测量由包含特异性探针和fq探针以及靶dna的反应混合物发射的荧光。本发明考虑将新型检测方法用于各种用途,包括但不限于临床诊断目的。在一些实施方案中,通用检测探针可以是单链寡核苷酸,其中该淬灭剂和荧光团可以在寡核苷酸的3'或5'端或中间进行标记。在另一个实施方案中,通用检测探针包含多于一组的寡核苷酸,其中该特异性检测探针引发通用检测探针寡核苷酸组的总连续相互作用以生成指数扩增检测信号。
特异性探针序列的互补序列与通用检测探针之间的相互作用可以dna聚合酶非依赖性的,如在分子信标和阴阳探针的情况下。在这种情况下,特异性探针序列的互补序列与通用fq探针的杂交导致fq探针中荧光与淬灭部分之间的分离或结构变化,从而产生荧光信号。可选地,特异性探针序列的互补序列与通用fq探针之间的相互作用可以是dna聚合酶依赖性的。在这种情况下,特异性探针序列的新合成/置换的互补序列用作通用fq探针上的引物,并作为模板在fq探针上延伸,从而使淬灭部分从fq探针的荧光部分置换掉并产生荧光信号。在另一种情况下,特异性探针序列的新合成/置换的互补序列用作通用fq探针的模板,并在特异性探针序列上延伸以生成荧光信号变化。
对于有效的lamp反应,使用六种引物(两种内引物、两种外引物和两种环引物)。特异性探针序列可以附接在环引物序列的上游。lamp反应将导致特异性探针序列的互补序列的合成。当提供通用fq探针时,新合成的特异性探针序列的互补序列将杂交到通用fq探针的单链区域上,并通过链置换聚合酶沿着fq探针延伸,从而导致荧光和淬灭寡核苷酸的分离,并因此生成荧光。
在另一个实施方案中,特异性探针序列在lamp中的内引物(fip和bip)序列的上游附接。在另一个实施方案中,特异性探针序列在lamp中的缺口引物(茎引物)序列的上游附接。在另一个实施方案中,特异性探针序列在smap反应中的环引物序列的上游附接。在另一个实施方案中,特异性探针序列在smap反应中的回折引物(fp)的序列上游附接。在另一个实施方案中,特异性探针序列在smap反应中的缺口引物(茎引物)序列的上游附接。在另一个实施方案中,特异性探针序列在gear中的内引物(fip和bip)序列的上游附接。在另一个实施方案中,特异性探针序列在gear反应中的环引物(lf和lb)序列的上游附接。在另一个实施方案中,特异性探针序列在near反应中不含有切口酶识别位点的任何引物的上游附接。
在另一个实施方案中,可以添加与特异性探针序列互补的第二寡核苷酸,并与特异性探针序列形成双螺旋。在反应时,第二寡核苷酸将从特异性探针序列被置换掉并且可以与通用fq探针相互作用以生成荧光。
在另一个实施方案中,第二寡核苷酸含有g-四联体序列。在第二寡核苷酸从特异性探针序列被替换后,该寡核苷酸折叠成正确的g-四联体构象,其可以通过本领域技术人员已知的g-四联体检测方法检测。
在另一个实施方案中,第二寡核苷酸含有适体序列。在第二寡核苷酸从特异性探针序列被替换后,该寡核苷酸折叠成正确的适体构象,其可以通过本领域技术人员已知的适体检测方法检测。
在另一个实施方案中,单链特异性探针序列含有rna转录启动子序列。在扩增反应后,将合成该引物的互补链,这将生成功能性rna转录启动子。在ntp和可以由该启动子启动rna转录的rna聚合酶的存在下,将生成大量的rna转录物。可以通过本领域技术人员已知的方法检测这些rna转录物。
在另一个实施方案中,单链特异性探针序列含有切口内切核酸酶识别序列。在扩增反应时,将合成该引物的互补链,这将生成功能性切口内切核酸酶识别位点。在相应的切口内切核酸酶的存在下,双链dna将在预定位置带切口。链置换聚合酶将延伸带切口的dna链并置换单链dna,其可用作进一步扩增的模板。在一个实施方案中,通用fq探针是分子信标。在另一个实施方案中,通用fq探针是阴阳探针。在另一个实施方案中,通用探针是环状dna。在一些实施方案中,特异性探针序列的新合成的互补序列引发滚环扩增(rca),并且通过本领域技术人员已知的方法检测所得的rca产物。
在另一个实施方案中,通用探针是expar底物。在一些实施方案中,特异性探针序列的新合成的互补序列启动expar级联,并且通过本领域技术人员已知的方法检测所得的expar产物。
在另一个实施方案中,通用探针是fq侵入核酸。在一些实施方案中,fq侵入序列首先退火至fq探针的单链部分,然后置换fq探针的第二链,其中fq侵入序列与fq探针的双链部分重叠。通过从fq探针置换fq探针的第二条链将荧光团与淬灭剂分离,从而使荧光团发荧光。
本公开内容的附加方面及其各种实施方案是[1]一种使用链置换等温扩增反应检测样品中的模板核酸的方法,其包括
(i)通过将该样品与以下各项组合来生成该反应:(a)一种或多种扩增引物,其被配置成在合适的扩增条件下由该模板核酸生成扩增子核酸,和(b)链置换扩增聚合酶;
(ii)在合适的扩增条件下维持该反应;以及
(iii)通过在步骤(ii)过程中或之后监测(c)在合适的扩增条件下与该模板核酸、其补体、该扩增子核酸或其补体杂交的特异性检测探针与(d)通用检测探针之间的相互作用来检测在步骤(ii)中是否发生扩增或是否已经发生扩增。
[2][1]的方法,其中该通用检测探针是通用fq探针。
[3][1]或[2]的方法,其中该通用检测探针在合适的扩增条件下不退火至该模板核酸或其补体。
[4][1-3]中任一项的方法,其中该特异性检测探针和该通用检测探针之间的相互作用是通过扩增期间的杂交。
[5][1-3]中任一项的方法,其中该特异性检测探针和该通用检测探针之间的相互作用是通过该特异性检测探针的补体和该通用检测探针之间的杂交。
[6][1-3]中任一项的方法,其中该特异性检测探针和该通用检测探针之间的相互作用是通过扩增期间的杂交和聚合酶延伸。
[7][1-3]中任一项的方法,其中该特异性检测探针包含内部化学部分以阻止聚合酶延伸。
[8][1-7]中任一项的方法,其中该通用检测探针包含第一检测寡核苷酸链和第二检测寡核苷酸链。
[9][8]的方法,其中(a)第一检测寡核苷酸链包含淬灭剂部分且第二检测寡核苷酸链包含荧光团,或(b)第一检测寡核苷酸链包含荧光团且第二检测寡核苷酸链包含淬灭剂部分,其中该淬灭剂部分和该荧光团被配置为使得当第一检测寡核苷酸链和第二检测寡核苷酸链退火时,该淬灭剂部分淬灭该荧光团的荧光。
[10][9]的方法,其中包含该荧光团的检测寡核苷酸链的量与包含该淬灭剂部分的检测寡核苷酸链的量的比例小于1:1。
[11][9]或[10]的方法,其中检测步骤(ii)包括测量等温链置换扩增期间发射的荧光。
[12][8-11]中任一项的方法,其中第二检测寡核苷酸链包含与第一检测寡核苷酸链不互补的突出的不匹配区段。
[13][8-12]中任一项的方法,其中该特异性检测探针或其补体包括侵入序列,该侵入序列在扩增期间或之后与该突出的不匹配区段的一部分杂交,且与互补于第一检测寡核苷酸链的第二检测寡核苷酸链的一部分杂交。
[14][12]的方法,其进一步包括侵入序列踢除物探针,该侵入序列踢除物探针在它与第二检测寡核苷酸链杂交时在其3'端附近或在3’端包含错配。
[15][14]的方法,其进一步包括侵入序列踢除物替换探针以在侵入序列踢除物探针沿着第二检测寡核苷酸链延伸时替换侵入序列踢除物探针。
[16]一种使用链置换等温扩增反应检测样品中的模板核酸的方法,其包括
(i)通过将该样品与以下各项组合来生成该反应:(a)一种或多种扩增引物,其被配置成在合适的扩增条件下由该模板核酸生成扩增子核酸,和(b)链置换扩增聚合酶;
(ii)在合适的扩增条件下维持该反应;以及
(iii)通过在步骤(ii)过程中或之后监测适体探针来检测在步骤(ii)中是否发生扩增或是否已经发生扩增,其中该适体探针是在合适的扩增条件下与该模板核酸、其补体、该扩增子核酸或其补体杂交的特异性检测探针的一部分。
[17][16]的方法,适体探针是g-四联体探针。
[18][16]或[17]的方法,其中该g-四联体探针生成选自下组的可检测信号,该组由以下各项组成:色素形成、荧光、发光和化学发光。
[19][1-18]中任一项的方法,其中该链置换扩增聚合酶选自下组,该组由以下各项组成:bstdna聚合酶、bca(外切)dna聚合酶、dna聚合酶i的klenow片段、ventdna聚合酶、vent(外切)dna聚合酶(没有外切核酸酶活性的ventdna聚合酶)、deepventdna聚合酶、deepvent(外切)dna聚合酶(没有外切核酸酶活性的deepventdna聚合酶)、φ29噬菌体dna聚合酶、ms-2噬菌体dna聚合酶、z-taqdna聚合酶(takarashuzo)和koddna聚合酶(toyobo)。
[20][1-18]中任一项的方法,其中该链置换扩增聚合酶是bstdna聚合酶或bca(外切)dna聚合酶。
[21][1-20]中任一项的方法,其中该扩增引物之一是回折引物。
[22][1-21]中任一项的方法,其中该链置换等温扩增反应是lamp、smap、gear、near或cpa。
[23][1-21]中任一项的方法,其中该等温扩增反应是ω扩增,并且引物对是回折引物且该回折引物中至少一个是突出引物。
[24][23]的方法,其中该突出引物中的突出序列包含特异性检测探针序列。
[25][23]或[24]的方法,其中该突出序列包含内部修饰以阻止聚合酶延伸。
[26][1-25]中任一项的方法,其中该链置换等温扩增反应包含一个或多于一个踢除物加速引物或一个或多于一个茎加速引物或一个或多于一个环加速引物。
[27][26]的方法,其中该踢除物加速引物或环加速引物或茎加速引物在其5'端包含折叠序列,以在3'端通过聚合酶延伸后折叠到其3'端下游序列上。
[28][1-20]中任一项的方法,其中该链置换等温扩增反应是rca。
[29][1-20]中任一项的方法,其中该链置换扩增是切口扩增,且步骤(i)包括组合该反应中包含的切口酶。
[30][1-29]中任一项的方法,其中该特异性检测探针是参与等温链置换扩增的寡核苷酸。
[31]一种ω扩增引物组,其包含第一回折引物和第二回折引物,它们允许在合适的ω扩增条件下等温扩增靶核酸序列的一部分,其中第一回折引物在其5'末端包含第一突出序列或第二回折引物在其5'末端包含第二突出序列。
[32][31]的ω扩增引物组,其中:
(i)靶核酸序列具有第一链,其中第一链与互补链互补;
(ii)第一回折引物从5'到3'包含:
(1-b)序列(f1c),其中该序列(f1c)与靶核酸序列的互补链中的序列(f1t)杂交;以及
(1-c)在3'末端,序列(f2),其中该序列(f2)与靶核酸序列的第一链中的序列(f2ct)杂交,
其中该序列(f1t)是互补链中序列(f2t)的3';且该序列(f2t)与序列(f2ct)互补;
(iii)第二回折引物从5'到3'包含:
(2-b)第二序列,其包含:序列(r1c),其中该序列(r1c)与靶核酸序列的第一链中的序列(r1t)杂交,
(2-c)在3'末端,序列(r2),其中该序列(r2)与靶核酸序列的互补链中的序列(r2ct)杂交,
其中该序列(r1t)是第一链中序列(r2t)的3';且该序列(r2t)与该序列(r2ct)互补;并且
(iv)该引物组进一步包含:
(x)(1-a)在第一回折引物的5'末端的第一突出序列,其中第一突出序列为至少4个核苷酸且不能与第一链或互补链杂交,并且其中该序列(r1c)位于第二回折引物的5'末端;
(y)(2a)在第二回折引物的5'末端的第二突出序列,其中第二突出序列为至少4个核苷酸且不能与第一链或互补链杂交,并且其中该序列(f1c)位于第一回折引物的5'末端;或者
(z)(1-a)在第一回折引物的5'末端的第一突出序列,其中第一突出序列为至少4个核苷酸且不能与第一链或互补链杂交,和(2a)在第二引物的5'末端的第二突出序列,其中第二突出序列为至少4个核苷酸且不能与第一链或互补链杂交。
[33][32]的ω扩增引物组,其中序列(f1c)的一部分可以与序列(r1c)的一部分杂交。
[34][32]的ω扩增引物组,其中该序列(f1c)和该序列(r1c)重叠至少1、2、3、4、5、6、7、8、9、10、12、14、16、18、20、25或30个核苷酸。
[35][31-34]中任一项的ω扩增引物组,其中第一突出序列或第二突出序列为至少3、4、5、6、7、8、9、10、12、14、16、18、20、25、30、35、40、45、50、60、70、80、90、100、150或200个核苷酸。
[36][31-35]中任一项的ω扩增引物组,其中第一突出序列或第二突出序列小于500、450、400、350、300、250、200、150、100、90、80、70、60、50、45、40、35、30、25或20个核苷酸。
[37][31-36]中任一项的ω扩增引物组,其中第一突出序列或第二突出序列的长度为3至100个核苷酸、3至75个核苷酸、3至50个核苷酸或4至30个核苷酸。
[38][31-37]中任一项的ω扩增引物组,其中第一突出序列或第二突出序列包含g-四联体、适体序列、rna启动子序列、切口序列或fq检测顺序。
[39][31-38]中任一项的ω扩增引物组,其中第一突出序列或第二突出序列是富含g的。
[40][31-39]中任一项的ω扩增引物组,其中该ω扩增反应包含一个或多于一个踢除物加速引物或一个或多于一个茎加速引物或一个或多于一个环加速引物。
[41][31-40]中任一项的ω扩增引物组,其中该踢除物加速引物或环加速引物或茎加速引物在其5'端包含折叠序列,以在3'端通过聚合酶延伸后折叠到其3'端下游序列上。
[42][31-41]中任一项的ω扩增引物组,其中第一突出引物或第二突出引物在其5'末端具有发夹结构。
[43][31-42]中任一项的回折引物扩增引物组,其中回折引物包含非天然核苷酸。
[44][31-43]中任一项的回折引物扩增引物组,其中该折叠杂交序列包含非天然核苷酸。
[45]一种用于确定样品是否包含模板核酸的方法,该方法包括
(i)将样品与[31-44]中任一项的ω扩增引物组、链置换扩增聚合酶和检测探针组合;和
(ii)在合适的ω扩增条件下维持该组合;以及
(iii)通过监测该检测探针是否在步骤(ii)过程中参与扩增或是否在步骤(ii)之后已经参与扩增来确定该样品是否包含该模板核酸。
[46]一种用于评估样品中模板核酸的量的方法,该方法包括:
(i)将该样品与[31-44]中任一项的ω扩增引物组、链置换扩增聚合酶和检测探针组合;和
(ii)在合适的ω扩增条件下维持该组合;以及
(iii)通过在步骤(ii)过程中或之后监测该检测探针来定量该模板核酸的量。
[47][45]或[46]的方法,其中该监测在步骤(ii)过程中进行。
[48][45-47]中任一项的方法,其中该监测基于显色反应、浊度反应、化学发光反应或荧光反应。
[49][45-47]中任一项的方法,其中该监测是监测来自检测探针的荧光信号变化。
[50][45-49]中任一项的方法,其中该检测探针具有在其5'端附接的通用fq引物补体。
[51][44-49]中任一项的方法,其中该检测探针是特异性检测探针,并且该监测基于扩增期间或扩增后该特异性检测探针或其补体与通用fq探针之间的相互作用。
[52][51]的方法,其中该通用fq探针包含第一fq寡核苷酸链和第二fq寡核苷酸链。
[53][52]的方法,其中第一fq寡核苷酸链和第二fq寡核苷酸链在合适的ω扩增条件下不与模板链杂交。
[54][52]或[53]的方法,其中(a)第一fq寡核苷酸链包含淬灭剂部分且第二fq寡核苷酸链包含荧光团,或(b)第一fq寡核苷酸链包含荧光团且第二fq寡核苷酸链包含淬灭剂部分,其中该淬灭剂部分和该荧光团被配置为使得当第一fq寡核苷酸链和第二fq寡核苷酸链退火时,该淬灭剂部分淬灭该荧光团的荧光,并且该检测包括测量等温链置换扩增期间发射的荧光。
[55][54]的方法,其中包含该荧光团的fq寡核苷酸链的量与包含该淬灭剂部分的fq寡核苷酸链的量的比例小于1:1。
[56][52-55]中任一项的方法,其中第二fq寡核苷酸链包含与第一fq寡核苷酸链不互补的突出的不匹配区段。
[57][56]的方法,其中该特异性检测探针或其补体包括侵入序列,该侵入序列在扩增期间或之后与该突出的不匹配区段的一部分杂交,且与互补于第一检测寡核苷酸链的第二检测寡核苷酸链的一部分杂交。
[58][57]的方法,其进一步包括侵入序列踢除物探针,该侵入序列踢除物探针在它与第二检测寡核苷酸链杂交时在其3'端附近或在3’端包含错配。
[59][58]的方法,其进一步包括侵入序列踢除替换探针以在侵入序列踢除物探针沿着第二检测寡核苷酸链延伸时替换侵入序列踢除物探针。
[60][45-59]中任一项的方法,其中该检测探针或通用检测探针包括g-四联体探针或适体探针。
[61][45-60]中任一项的方法,其中第一突出序列或第二突出序列包含检测探针。
[62][45-61]中任一项的方法,其中该模板核酸是人乳头瘤病毒(hpv)。
[63][62]的方法,其中该hpv是hpv6、hpv11、hpv16、hpv18、hpv35或hpv73。
[64][62]的方法,其中该ω扩增引物组是18fip(seqidno:1)和ex18bip(seqidno:4)、ex18fip(seqidno:2)和18bip(seqidno:3),或ex18fip(seqidno:2)和ex18bip(seqidno:4),任选包括踢除物加速引物18kf(seqidno:9)和/或18kb(seqidno:10),任选包括环加速引物18lf(seqidno:5)和/或18lb(seqidno:6),并且任选包括包含fam-18lb(seqidno:7)和q-寡核苷酸(seqidno:8)的fq探针。
[65][62]的方法,其中该ω扩增引物组是73ovlp-exfip(seqidno:15)和73-bip(seqidno:18)、7350ovlp-exfip(seqidno:16)和73-bip(seqidno:18),或73-exfip(seqidno:17)和73-bip(seqidno:18),任选包括踢除物加速引物73-kf(seqidno:24)和/或73-kb(seqidno:25),任选包括环加速引物73ovlp-lf(seqidno:19)、7350ovlp-lf(seqidno:20)、73-lf(seqidno:21)和/或73-lb(seqidno:22),并且任选包括包含fam-73-lb(seqidno:23)和q-寡核苷酸(seqidno:8)的fq探针。
[66][62]的方法,其中该ω扩增引物组是hpv6g-fip(seqidno:27)和hpv6gbip-22nt(seqidno:29),任选包括踢除物加速引物hpv6g-kf(seqidno:33)和/或hpv6g-kb(seqidno:34),任选包括环加速引物73ovlp-lf(seqidno:19)、7350ovlp-lf(seqidno:20)、73-lf(seqidno:21)和/或73-lb(seqidno:22),并且任选包括包含fam-73-lb(seqidno:23)和q-寡核苷酸(seqidno:8)的fq探针。
[67][62]的方法,其中该ω扩增引物组是35-exfip(seqidno:45)和35-bip(seqidno:37),任选包括踢除物加速引物35-kf(seqidno:42)和/或35-kb(seqidno:43),任选包括环加速引物35-lf(seqidno:38)、35-fblf(seqidno:39)、35-lb(seqidno:40)和/或35-fblb(seqidno:41),并且任选包括包含35-lf-fam(seqidno:44))和q-寡核苷酸(seqidno:8)的fq探针。
[68]一种使用ω扩增反应的由样品中的模板核酸生成扩增子核酸的方法,该方法包括
(i)将该样品与[31-44]中任一项的ω扩增引物组和链置换扩增聚合酶组合;和
(ii)通过在合适的ω扩增条件下维持该组合来生成扩增子核酸。
[69]一种使用[32-44]中任一项的引物组由靶核酸分子制备扩增子核酸的方法,其中该扩增子核酸能够在第一端形成第一茎和环,能够在第二端形成第二茎和环或回折环,并且具有(i)位于第一端的末端的第一突出序列,和/或(ii)位于第二端的末端的第二突出序列,该方法包括:
(a)将具有靶核酸分子的样品与[32-44]中任一项的引物组组合;
(b)将第一引物的序列(f2)退火至靶核酸分子的第一链中的序列(f2ct);
(c)使用合适的聚合酶将第一引物从其3'端延伸,以形成包含在5'端的第一引物和序列(r2ct)的第一单链核酸分子;
(d)从靶核酸序列置换第一单链核酸分子;
(e)将第二引物的序列(r2)退火至第一单链核酸分子中的序列(r2ct);以及
(f)通过使用合适的聚合酶将第二引物从其3'端延伸以形成包含在5'端的第二引物和与第一引物互补的序列的第二单链核酸分子来制备靶核酸分子的复制部分;
其中置换步骤(d)通过以下方法进行:
(i)将附加的第一引物的序列(f2)退火至靶核酸分子的第一链中的序列(f2ct),并使用合适的聚合酶将附加的第一引物从其3'端延伸,以置换第一单链核酸分子;
(ii)步骤(d)和(e);或
(iii)(1)提供在其3'末端包含序列(f3)的第一踢除物引物,其中该序列(f3)与序列(f3ct)杂交,并且序列(f3ct)是在靶核酸序列的第一链中的序列(f2ct)的5';
(2)将第一踢除物引物中的序列(f3)退火至靶核酸分子的第一链中的序列(f3ct);以及
(3)使用合适的聚合酶将第一踢除物引物从其3'端延伸,以置换第一单链核酸分子。
[70][45-69]中任一项的方法,其中该反应的速度是如下相同反应的至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或甚至至少100%,其中第一突出引物在其5'末端不包含第一突出序列和/或第二突出引物在其5'末端不包含第二突出序列。
[71][45-70]中任一项的方法,其中第一突出序列或第二突出序列为至少1、2、3、4、5、6、7、8、9、10、12、14、16、18、20、25、30、35、40、45、50、60、70、80、90、100、150或200个核苷酸。
[72][45-71]中任一项的方法,其中第一突出序列或第二突出序列的长度为1至100个核苷酸、2至75个核苷酸、3至50个核苷酸或4至30个核苷酸。
[73][45-72]中任一项的方法,其中该链置换扩增聚合酶选自下组,该组由以下各项组成:bstdna聚合酶、bca(外切)dna聚合酶、dna聚合酶i的klenow片段、ventdna聚合酶、vent(外切)dna聚合酶(没有外切核酸酶活性的ventdna聚合酶)、deepventdna聚合酶、deepvent(外切)dna聚合酶(没有外切核酸酶活性的deepventdna聚合酶)、φ29噬菌体dna聚合酶、ms-2噬菌体dna聚合酶、z-taqdna聚合酶(takarashuzo)和koddna聚合酶(toyobo)。
[74][45-72]中任一项的方法,其中该链置换扩增聚合酶是bstdna聚合酶或bca(外切)dna聚合酶。
[75][45-74]中任一项的方法,其中该样品选自试样、培养物、患者样品、受试者样品、生物样品和环境样品。
[76][75]的方法,其中该患者样品或受试者样品来自血液、唾液、脑脊髓液、胸膜液、乳汁、淋巴液、痰液、精液、粪便、拭子、支气管肺泡灌洗液、组织样品或尿。
[77][45-76]中任一项的方法,其中该组合步骤进一步包括与选自由一种或多种加速引物、rna聚合酶启动子、切口序列及其组合组成的组的反应加速剂组合。
[78][77]的方法,其中该反应加速剂包含一种或多种加速引物,并且该加速引物选自由踢除物加速引物、环加速引物和茎加速引物组成的组。
[79][77]或[78]的方法,其中该反应加速剂包含rna聚合酶启动子,并且rna聚合酶启动子包含在第一突出引物、第二突出引物、踢除物加速引物、环加速引物或茎加速引物中。
[80][77]的方法,其中该rna聚合酶启动子是t7rna聚合酶启动子。
[81][77]的方法,其中该反应加速剂包含切口序列,并且切口序列包含在第一突出引物、第二突出引物,踢除物加速引物、环加速引物或茎加速引物中。
[82]一种包含[31-44]中任一项的引物组的试剂盒。
[83][82]的试剂盒,其进一步包含链置换扩增聚合酶。
[84][83]的试剂盒,其中该链置换扩增聚合酶选自下组,该组由以下各项组成:bstdna聚合酶、bca(外切)dna聚合酶、dna聚合酶i的klenow片段、ventdna聚合酶、vent(外切)dna聚合酶(没有外切核酸酶活性的ventdna聚合酶)、deepventdna聚合酶、deepvent(外切)dna聚合酶(没有外切核酸酶活性的deepventdna聚合酶)、φ29噬菌体dna聚合酶、ms-2噬菌体dna聚合酶、z-taqdna聚合酶(takarashuzo)和koddna聚合酶(toyobo)。
[85][83]的试剂盒,其中该链置换扩增聚合酶是bstdna聚合酶或bca(外切)dna聚合酶。
[86][82-85]中任一项的试剂盒,其进一步包含踢除物加速引物、环加速引物和/或茎加速引物。
[87][82-86]中任一项的试剂盒,其进一步包含检测探针。
[88][87]的试剂盒,其进一步包含在等温扩增期间与检测探针相互作用的通用检测探针。
[89][82-88]中任一项的试剂盒,其进一步包含热稳定的荧光素酶、荧光素和将无机焦磷酸盐转化为atp的酶。
[90]一种衍生自靶核酸序列的扩增子核酸,其从5'到3'包含:
(2)包含序列(r1c)的第二序列;
(3)序列(r2),其中该序列(r2)与靶核酸序列的互补链中的序列(r2ct)杂交;
(4)序列(r1t),其中该序列(r1t)与序列(r1c)杂交;
(5)序列(f1ct);
(6)序列(f2c),其中该序列(f2c)与靶核酸序列的互补链中的序列(f2t)杂交;以及
(7)序列(f1),其中该序列(f1)与(f1ct)杂交
其中该核酸进一步包含:
(x)(8)在3'末端的第一突出序列,其中第一突出序列为至少4个核苷酸且不能与模板核酸或其补体杂交,并且其中该序列(r1c)位于5'末端;
(y)(1)在5'末端的第二突出序列,其中第二突出序列为至少4个核苷酸且不能与模板核酸或其补体杂交,并且其中该序列(f1)位于3'末端;或
(z)(8)在3'末端的第一突出序列,其中第一突出序列为至少4个核苷酸且不能与模板核酸或其补体杂交,以及(1)在5'末端的第二突出序列,其中第二突出序列为至少4个核苷酸且不能与模板核酸或其补体杂交。
i.回折引物
本发明的一个方面是回折引物在本文所述的扩增反应中的用途。包括至少一对回折引物的扩增反应是回折扩增。
a.lamp引物
最简单形式的lamp引物包括两个回折引物,这两个回折引物被设计为通过折叠回模板(或扩增子内模板的一部分)生成环。用于lamp的正向回折引物包括退火至模板核酸序列的f1t序列的5'f1互补序列(f1c,图1)和退火至模板核酸序列的f2ct序列的3'f2序列(图1)。用于lamp的反向回折引物包括退火至模板核酸序列的r1t序列的5'r1互补序列(r1c,图1)和退火至模板核酸序列的r2ct序列的3'r2序列(图1)。正向和反向引物可以包括f1c和f2序列与r1c和r2序列之间的一个或多个核苷酸,或者它们可以在共用共同序列的位置重叠。模板核酸序列的f2t和f1t序列以及r2t和r1t序列可以具有间插核酸序列。优选地,间插序列不应太长以至于f1c序列和f1t序列或r1c序列和r1t序列的有效局部浓度不再导致扩增的核酸的自退火优先于两个单独分子的退火。因此,2t和1t序列之间的间插序列的优选长度通常为0至500个核苷酸、5至250个核苷酸或10至100个核苷酸之间。然而,在一些情况下,过短的间插序列可能不利于形成自退火环。此外,期望所形成的环具有如下结构,该结构能够使新的正向环引物(或环加速引物,其中使用该形式的加速)和能够平稳启动链置换互补链合成反应。因此,更优选地,设计引物使得2t和1t序列之间的距离在0至100个核苷酸或10至70个核苷酸之间。在3'端通过聚合酶延伸后,f1c序列或r1c序列可以与3'端下游序列基本上互补。对于突变检测,可以将f1c或r1c的5'端核苷酸设计为不与突变位点互补,从而导致非扩增或较低程度的扩增。相同的方法可以应用于甲基化检测。
b.smap引物
最简单形式的smap引物包括折叠回自身的发夹引物和回折引物,该回折引物被设计为通过折叠回模板(或扩增子内模板的部分)生成环。发夹引物不包括折叠到3'端发夹引物延伸序列下游的序列。为方便起见,发夹引物称为正向引物,而折回折引物称为反向引物,但这是任意名称。发夹引物可以是反向引物,而回折引物可以是正向引物。用于smap的发夹引物包括退火至正向引物的fb1互补序列(fb1c,图2)的5'fb1序列(图2)和退火至模板核酸序列的f2ct序列的3'f2序列(图2)。fb1c序列在fb1和f2序列之间。用于smap的反向引物包括退火至模板核酸序列的r1t序列的5'r1互补序列(r1c,图2)和退火至模板核酸序列的r2ct序列的3'r2序列(图2)。回折引物可包括上文第i(a)章节中所述的回折引物的所有特征。回折引物可以包括fb1c和fb1序列之间以及fb1c和f2序列之间的一个或多个核苷酸,或者它们可以在它们共用共同序列的位置重叠。优选地,fb1c和fb1序列之间的间插序列不应太长,以至于fb1c和fb1序列的有效局部浓度不再导致扩增的核酸的自退火优先于两个单独分子的退火。因此,fb1c和fb1序列之间的间插序列的优选长度通常为0至500个核苷酸、5至250个核苷酸或10至100个核苷酸之间。然而,在一些情况下,过短的间插序列可能不利于折叠和自退火。此外,在一些情况下,期望fb1c和fb1序列之间的间插序列具有如下结构,该结构能够使环加速引物退火并且能够平稳启动链置换互补链合成反应。因此,更优选地,当应用回折引物扩增时引物被设计为使得fb1c和fb1序列之间的距离的长度为至少10个核苷酸、至少15个核苷酸、至少20个核苷酸或至少30个、至少40个核苷酸、至少50个核苷酸或至少60个核苷酸,或在30至100个核苷酸之间。
c.gear引物
gear引物是smap引物或lamp引物的子集,其中该f1t和r1ct重叠或在相同区域中是一个(对于f1ct和r1t的相应情况也是如此)。f1t和r1ct之间的重叠可以为至少1、2、3、4、5、6、7、8、9、10、12、14、16、18、20、25或30个核苷酸或f1t和r1ct是同一个。另外,gear引物可具有上文第i(a)和i(b)章节中所述的lamp引物和/或smap引物的所有特征。
d.引物的退火部分的共同特征
回折引物和加速引物都包含在反应条件下退火至靶核酸、扩增子核酸或两者的一个或多个序列。因此,退火序列将具有足够的长度和核苷酸组成,以使得能够在扩增反应条件下以所需的特异性进行这种退火。如果退火序列提供至少一个游离的3'-oh基团,其用作链置换扩增聚合酶的链合成的起点,则该退火序列也是引发序列。引物将具有至少一个引发序列。由催化序列依赖性核酸合成的已知聚合酶识别的引物的最小长度为约5个核苷酸。此外,为了确保核苷酸序列特异性的高概率,优选使用包含十个核苷酸或更多核苷酸的退火序列。因此,退火序列的长度将优选为至少10个核苷酸、至少20个核苷酸、至少30个核苷酸、至少40个核苷酸、至少50个核苷酸、至少60个核苷酸或甚至至少70个核苷酸。在另一方面,更长的核苷酸序列的化学合成更昂贵,因此本文公开的上限是优选的。优选地,退火序列的长度为5至200个核苷酸,且更优选10至50个核苷酸。
因此,退火序列将通常与其所退火的序列基本上互补。术语“基本上互补”意指退火序列具有足够的互补性以在扩增反应条件下退火至模板核酸和/或扩增子核酸上的序列。这通常要求退火序列在扩增反应条件下与模板核酸和/或扩增子核酸上的序列具有至少70%、80%、90%、95%、99%或100%的互补性。
e.突出序列
对于ω扩增,该回折引物中至少一个将在其5'末端包含突出序列。突出序列可以是任何种类的寡核苷酸,包括天然或非天然核苷酸。包含突出序列的回折引物称为突出引物。如本文所用,ω扩增反应是回折引物扩增反应的子集。在一些实施方案中,突出序列发现于扩增子核酸的一端(或两端)。因此,突出序列将不提供游离的‘3oh,在ω扩增反应期间可以由该游离的‘3oh合成互补链。突出序列将优选完全不退火至模板核酸或至少不退火至模板核酸的扩增部分附近的模板核酸。
突出序列为至少1、2、3、4、5、6、7、8、9、10、12、14、16、18、20、25、30、35、40、45、50、60、70、80、90、100、150或200个核苷酸。突出序列可以为少于500、450、400、350、300、250、200、150、100、90、80、70、60、50、45、40、35、30、25或20个核苷酸。在某些方面,突出序列的长度可以为1至100个核苷酸、2至75个核苷酸、3至50个核苷酸或4至30个核苷酸。突出序列可以是任何序列,只要该序列将不提供游离的‘3oh,在ω扩增反应期间可以由该游离的‘3oh合成互补链。举例来说,正向回折引物中的突出序列将不退火至模板第二链的f1t区域的紧邻3'区域。在一些实施方案中,突出序列包含g-四联体、t7启动子序列、切口位点或fq序列。在一些实施方案中,突出序列将是富含g的,因为富含g的突出序列可以加快ω扩增反应。
ii.反应加速剂
除了上面讨论的回折引物之外,扩增反应还可以包括可加快扩增反应速率的一个或多个附加“加速引物”,如踢除物加速引物、环加速引物和茎加速引物。在某些实施方案中,扩增反应还可以包括可掺入一个或多个回折引物和一个或多个加速引物中的其他加速剂。加速引物和其他加速剂不是相互排斥的,因此可以以任何组合使用。
a.踢除物加速引物
踢除物加速引物是具有如下序列的引物,该序列退火至相应的回折引物所退火的位置的靶核酸5'的链(例如靶核酸的f3和r3)。例如,正向踢除物加速引物将包含退火至正向回折引物的5'的f3序列(图1和图2),这允许链置换扩增聚合酶置换掺有正向回折引物的新合成的链。反向踢除物加速引物将包含退火至反向回折引物的5'的r3序列(图1和图2),这允许链置换扩增聚合酶置换掺有反向回折引物的新合成的链。如果适用的话,踢除物加速引物可以是仅包含退火序列f3或r3的简单引物。在其他实施方案中,踢除物加速引物可在5'端包含附加的核苷酸,如用于检测的附加序列(例如,rna聚合酶启动子、fq引物互补序列、包含fq引物或fq侵入序列的第二链等),用于进一步加速的附加序列(例如,rna聚合酶启动子或切口序列)或甚至如下附加序列,其使得踢除物加速引物是附加的回折引物以折叠到其3'端延伸序列的下游。在其他实施方案中,使用多于一种的正向踢除物加速引物或反向踢除物加速引物来提高反应的速度和灵敏度。
b.环加速引物
环加速引物是具有如下序列的引物,该序列退火至在已经生成回折引物的链时或在已经生成包含环的回折引物的互补链时形成的环。例如,正向环加速引物将退火至f2(t)和f1t之间的模板核酸(图1)。从这种正向环加速引物的延伸和链置换将允许新的正向回折引物退火至模板核酸的f2ct序列。类似地,反向环加速引物将退火至r2(t)和r1t之间的模板核酸(图1)。来自这种正向环加速引物的延伸和链置换将允许新的正向回折引物退火至模板核酸的r2ct序列。环加速引物可以是仅包含退火序列的简单引物。在其他实施方案中,环加速引物可在5'端包含附加的核苷酸,如用于检测的附加序列(例如,rna聚合酶启动子、fq引物互补序列、包含fq引物或fq侵入序列的第二链等),用于进一步加速的附加序列(例如,rna聚合酶启动子或切口序列)或甚至如下附加序列,其使得环加速引物是附加的回折引物或发夹引物。
所公开的发明发现,环引物的3'端通过聚合酶延伸后,折叠到环引物下游序列的3'端上的环引物的5'端序列可以加快反应并提高反应灵敏度。折叠区域的长度可以为至少5个核苷酸、至少10个核苷酸、至少15个核苷酸、至少20个核苷酸、至少30个核苷酸、至少50个核苷酸、至少100个核苷酸、至少200个核苷酸、至少300个核苷酸或至少500个核苷酸。在另一个实施方案中,5'端环引物序列可具有化学部分以在特定或预期位置阻止聚合酶延伸。在优选的形式中,当环引物是正向环引物时,环引物的5'端序列是f1c序列,并且当环引物是反向环引物时,环引物的5'端序列是r1c序列。5'端环引物可以具有不同种类的序列。例如,部分环引物具有5'端折叠序列以加速反应,且部分环引物可具有5'端人工序列以携带用于检测的fq探针,并且部分环引物与模板杂交序列完全互补。在特定的扩增和检测反应中,所用环引物的5'端序列的类型取决于特定的应用和目的。作为用于突变检测的回折引物扩增的例子,5'端环引物可以具有fq探针,并且3'端环引物可以位于突变位点附近或与突变位点重叠。3'端环引物的错配不会延伸或延伸较少以生成可检测量的信号。为了增加特异性,可以在其3'端附近设计附加的错配。可选地,3'端环引物序列可包括核糖核苷酸或o-甲基核苷酸。相同的方法可用于甲基化检测。在某些情况下,可以使用环引物序列的5'端的混合物。特异性扩增的例子可包括与模板完全杂交的部分正向环加速引物和包含5'端人工序列的部分正向环加速引物。在环引物延伸后折叠到环引物下游序列的3'端的环引物的5'端是一种新型引物,其通常用于回折引物扩增反应(而非特异于ω扩增),因此是本公开内容的独立方面。
c.茎加速引物
美国专利公开2012/0157326公开了茎加速等温核酸扩增技术,其可用于通过使用与茎区域结合的称为“茎引物”的引物(在本文称为“茎加速引物”,并且将该申请通过引用并入本文,所述引用针对其关于茎引物的教导及其在加快等温扩增反应中的用途,但不针对其中的任何定义)。茎加速引物的退火区域优选不与回折引物的退火区域重叠。正向和反向回折引物退火区域(例如,f1ct和r1t或f1t和r1ct)之间的区域代表一种区域,该区域保证形成扩增子的一部分,但本身通常不提供lamp或smap中的任何引物结合位点。该区域在本文中称为扩增子核酸的“茎区域”。茎区域的长度可以为至少5个核苷酸、至少10个核苷酸、至少15个核苷酸、至少20个核苷酸、至少30个核苷酸、至少50个核苷酸、至少100个核苷酸、至少200个核苷酸、至少300个核苷酸或至少500个核苷酸。
茎加速引物可以位于模板核酸中的正向和反向回折引物退火位点之间的任何位置,条件是一个或多个茎加速引物的一个或多个退火位点与模板核酸中的正向或反向回折引物退火位点不显著重叠。当一个或两个回折引物是环引物时,模板核酸中的回折引物退火位点是f1t和/或r1ct序列,如果适用的话,使得在使用两个环引物时茎加速引物在r1(c)t和f1(c)t序列之间。
在一些方面,仅使用一种茎加速引物,其结合模板核酸(或扩增子核酸)的第一链或第二链。在其他方面,可以使用两种或更多种茎加速引物,其可以结合模板核酸(或扩增子核酸)的不同链或相同链。茎加速引物方法可以用一种、两种、三种、四种或更多种茎加速引物来实施,该茎加速引物可以以任何空间组合的形式使用,并且可以结合第一链或第二链,条件是茎加速引物的退火位点与正向或反向回折引物退火区域不显著重叠或完全不重叠。茎加速引物可进一步退火至靶核酸的茎区内的任何部分。因此,一个或多个茎加速引物可具有退火位点,该退火位点紧密接近正向或反向回折引物退火区域。“紧密接近”意指茎加速引物和回折引物退火区域的退火区域相隔小于10、50、100、200、300、400、500、600、700、800、900或1000个核苷酸。
茎加速引物的长度可以为至少5个核苷酸、至少10个核苷酸、至少20个核苷酸、至少30个核苷酸、至少40个核苷酸、至少50个核苷酸、至少60个核苷酸、至少70个核苷酸、至少80个核苷酸或至少90个核苷酸。
茎加速引物可以是简单的引物。然而,茎加速引物可包含用于检测的附加序列(例如,rna聚合酶启动子、fq引物互补序列、包含fq引物或fq侵入序列的第二链等),用于进一步加速的附加序列(例如,rna聚合酶启动子或切口序列)或甚至如下附加序列,其使得环加速引物是附加的折叠引物或环引物。当使用多于一个茎加速引物时,茎加速引物可以是相同类型或可以是不同种类引物的组合(例如,所有简单引物、所有检测引物、一个简单引物和一个加速引物等)。
d.rna聚合酶启动子
也可以通过与依赖于作为扩增过程的一部分的转录的其他等温扩增技术相结合来加快本文的扩增反应,例如基于核酸序列的扩增(nasba;美国专利号5,409,818,其并入本文的是其在nasba上的公开内容,但不是与本文中的术语及其用途相冲突的定义)和转录介导的扩增(tma;美国专利号5,399,491,其并入本文的是在tma上的公开内容,但不是与本文的术语及其使用相冲突的定义)。
rna聚合酶启动子可以包含在任何引物中,该引物包括:一个或多个突出引物、一个或多个回折引物、一个或多个环加速扩增引物、一个或多个踢除扩增引物、一个或多个茎扩增引物或其组合。在优选的实施方案中,rna聚合酶启动子包含在一个或多个突出引物上的突出序列中。当已经合成与引物互补的链时,生成功能性rna聚合酶启动子。然后rna聚合酶与双链启动子结合并生成可检测的rna。在优选的实施方案中,rna启动子是t7启动子,且rna聚合酶是热稳定的t7rna聚合酶。为了进行本文公开的rna聚合酶加快扩增反应,反应将包括链置换扩增聚合酶和催化链置换互补链合成反应的rna聚合酶。可选地,扩增反应可以被配置成进一步拷贝rna链以产生更多的扩增子以进行扩增。为了进一步加快扩增反应,可以使用具有逆转录酶活性的聚合酶来产生rna-dna杂种用于进一步扩增。在优选的实施方案中,链置换扩增聚合酶将具有逆转录酶活性。
e.切口扩增
本文的扩增反应可以另外通过与其他等温扩增技术结合来加速,所述其他等温扩增技术依赖于作为扩增过程的一部分的链切口,例如用于核酸的指数扩增的切口和延伸扩增反应(near;美国专利公开2009/0081670,其并入本文的是其在near上的公开内容,但不是与本文的术语及其使用相冲突的定义)。切口序列可以包含在任何引物中,该引物包括:一个或多个突出引物、一个或多个回折引物、一个或多个环加速引物、一个或多个踢除物加速引物、一个或多个茎加速引物或其组合。当已经生成引物链的互补链时,将会产生切口序列。然后,切口酶可以使双链核酸带切口以产生3'oh,链置换扩增聚合酶可以由该3'oh延伸。在一些实施方案中,切口酶将能够继续使通过链置换扩增聚合酶延伸的每个新链带切口,以继续加快扩增反应。
f.化学物质
添加到ω扩增反应中的某些化学物质可以显著加快反应。在一些情况下,通过将至少一种温和的镁螯合剂添加到核酸扩增的反应混合物中可以加快扩增反应。温和的镁螯合剂优选选自:柠檬酸钠、乙酸、adp、天冬氨酸、atp、正丁酸、柠檬酸、半胱氨酸、3,4-二羟基苯甲酸、o,o-二甲基红棓酚、edta、egta、葡萄糖酸、谷氨酸、戊二酸、甘油酸、甘氨酸、乙醇酸、甘氨酰甘氨酸、鸟苷、b-羟基丁酸、肌苷三磷酸、乳酸、苹果酸、nta、草酸、多磷酸盐、丙酸、嘌呤、水杨醛、水杨酸、琥珀酸、酒石酸、四偏磷酸盐、三偏磷酸盐、三磷酸盐、尿苷二磷酸。优选地,温和的镁螯合剂以0.5至2mm,更优选0.8至1.2mm的浓度使用。对于本发明的目的特别优选的温和的镁螯合剂是柠檬酸钠。
iii.扩增方法
本文所述的扩增反应通常是等温扩增方法,这意味着扩增反应不需要如常规pcr扩增反应所需的反应温度的变化。
技术人员将意识到,除了扩增所需的引物之外,扩增反应通常还需要其他试剂以生成扩增子核酸。本领域技术人员将能够容易地确定附加的试剂(其通常包括合适的缓冲液、dntp、链置换扩增聚合酶等)。
本领域技术人员将进一步理解,还必须提供用于生成扩增子核酸的合适条件。例如,这可以通过提供合适的孵育温度来实现。优选在等温条件下进行扩增。这意味着在扩增期间温度保持恒定。“恒定”意味着温度变化不超过±10℃,优选不超过±5℃。然而,扩增反应还包括涵盖在扩增过程期间大于10℃的单次温度变化、大于10℃的两次温度变化、大于10℃的三次温度变化、大于10℃的四次温度变化或大于10℃的五次温度变化的方法。
优选地,本文公开的扩增反应(包括在检测方法的优选实施方案中)在密封容器中进行。这具有很大的实用性,因为它减少甚至消除了样品被污染的可能性。此外,它减少甚至消除了实验室被污染的可能性。这尤其重要,因为即使模板核酸或扩增子核酸的一个拷贝逃逸到实验室中,这也可能潜在地污染待测试的其他样品并给出假阳性结果。因此,当在诊断应用中使用本发明的方法时,防止污染的能力是尤其重要的。
a.链置换扩增聚合酶
用于本文公开的扩增反应的聚合酶是链置换聚合酶。许多这样的聚合酶是本领域已知的。示例性dna聚合酶包括:bstdna聚合酶、bca(外切)dna聚合酶、dna聚合酶i的klenow片段、ventdna聚合酶、vent(外切)dna聚合酶(没有外切核酸酶活性的ventdna聚合酶)、deepventdna聚合酶、deepvent(外切)dna聚合酶(没有外切核酸酶活性的deepventdna聚合酶)、φ29噬菌体dna聚合酶、ms-2噬菌体dna聚合酶、z-taqdna聚合酶(takarashuzo)和koddna聚合酶(toyobo)。另外,这些酶的各种突变体可用于本文公开的扩增反应,只要它们具有序列依赖性互补链合成的活性和链置换活性即可。这样的突变体包括含有仅具有催化活性的结构的截短酶或突变酶等,该突变酶的催化活性、稳定性或热稳定性已被氨基酸突变修饰。
在这些酶中,bstdna聚合酶和bca(外切)dna聚合酶是特别优选的,因为它们具有高度的热稳定性和高催化活性。由于扩增反应通常需要一些加热,因此优选使用热稳定酶。可以使用热稳定酶在各种条件下实现反应。例如,vent(外切)dna聚合酶是具有链置换活性的高度热稳定酶。据报道,单链结合蛋白的添加加快了通过dna聚合酶的链置换互补链合成的反应(paulm.lizardi等人,naturegenetics19,225-232,july,1998)。当用于扩增反应时,预期通过添加单链结合蛋白来加快互补链合成。当使用vent(外切)dna聚合酶时,t4基因32作为单链结合蛋白是有效的。
在某些实施方案中,可以改变链置换扩增聚合酶浓度以影响扩增反应的速率,从而减少检测扩增子核酸的产生所需的时间。例如,在一个实施方案中,链置换扩增聚合酶浓度可以大于或等于约8u、大于或等于约16u、大于或等于约24u或大于或等于约32u。
b.反应条件
本文公开的扩增反应通常在缓冲液的存在下进行,以提供适合聚合酶反应的ph。此外,本文公开的扩增反应还可以包括:退火各种引物和维持聚合酶(和其他任选的酶)活性所需的盐,用于维持聚合酶(和其他任选的酶)的防腐剂,以及解链温度(tm)调节剂(如果需要的话)。可以包括以保持聚合酶活性和调节核酸的解链温度(tm)的盐的例子包括kcl、nacl、(nh4)2so4等。可用于维持聚合酶活性的防腐剂包括例如血清白蛋白如bsa和糖类如蔗糖、甘油等。
此外,典型的解链温度(tm)调节剂包括甜菜碱、脯氨酸、二甲基亚砜(下文缩写为dmso)、甲酰胺和三甲胺-n-氧化物(tmano)。当使用解链温度(tm)调节剂时,可以在有限的温度范围内调节本文所述的引物的退火。此外,甜菜碱(n,n,n-三甲基甘氨酸)和四烷基铵盐因为其具有同样的稳定作用通过消除富含gc和富含at的核酸之间的解链温度差异而有效地有助于提高链置换效率。向反应中加入浓度为约0.2至约3.0m,优选约0.5至约1.5m的甜菜碱可以强化本文公开的扩增反应。由于这些解链温度调节剂降低了解链温度,因此通过考虑反应条件如盐浓度和反应温度,凭经验选择提供所需严格性和反应性的条件。
通过利用tm调节剂可以容易地选择适合于酶反应的温度条件。tm根据引物和靶核苷酸序列的关系而变化。因此,优选调节tm调节剂的量,使得维持酶活性的条件与满足本发明标准的孵育条件一致。基于本发明的公开内容,本领域技术人员可以根据引物核苷酸序列容易地选择适当量的tm调节剂。例如,可以基于退火核苷酸序列的长度、gc含量、盐浓度和tm调节剂的浓度来确定tm。
iv.检测方法
本文公开的扩增反应中扩增子核酸的生成可以通过本领域技术人员已知的方法来检测。合适的方法包括但不限于使用荧光嵌入染料、荧光引物或探针、测量浊度、电化学探针、生物发光信号和化学发光探针。
可以使用实时方法(即,可以在模板核酸和/或扩增子核酸扩增时检测它们的方法)检测靶核酸的扩增。此类检测系统的例子包括但不限于荧光(例如,在扩增反应期间添加的荧光探针,如下文更全面描述的)、生物发光信号和电化学探针。其他合适的报告系统对于本领域普通技术人员而言是容易获得的。可选地,可以使用终点测量方法(即,在完成模板核酸和/或扩增子核酸的扩增后进行的测量方法)来检测扩增产物。
模板核酸和/或扩增子核酸的扩增也可以通过其他核酸扩增系统中采用的其他检测方法来检测。合适的例子包括但不限于fish、序列、基因阵列、侧流试纸条、电泳、质谱法和声学检测。
此外,本发明中使用的引物可以用已知的标记物质标记。这种标记物质包括具有结合能力的配体,如地高辛和生物素;酶;荧光物质;发光物质;和放射性同位素。此外,用于将引物中的核苷酸转化为荧光类似物的技术是已知的(wo95/05391;proc.natl.acad.sci.usa,91,6644-6648,1994)。
此外,扩增反应中使用的任何引物可以固定在固相上。可选地,引物的任意部分可以用具有结合能力的配体(如生物素)标记,然后可以经由结合配偶体(如固定的亲和素)间接固定。当固定的引物用作合成来源时,合成的核酸产物可以固定在固相上,因此可以容易地分离。可以通过核酸特异性指示剂或通过进一步杂交标记的探针来检测分离的产物。可选地,可以通过用任意限制酶消化核酸来回收感兴趣的核酸片段。
a.fq探针
本发明中的检测方法基于通用检测探针和特异性检测探针之间的相互作用。通用检测探针实际上是人工序列。如本文所用,术语“通用检测探针”是指将直接或间接与特异性探针序列相互作用的寡核苷酸。通用检测探针可以是单链或双链寡核苷酸。这些寡核苷酸可包括天然或非天然核苷酸。通用检测探针可具有二级结构,如茎环发夹结构。通用检测探针可包含一种或多于一种寡核苷酸。如果包含多于一种通用检测探针以便生成可检测的扩增信号,则特异性检测探针可以引发这些通用检测探针的总连续相互作用。特异性探针序列与通用检测探针之间的相互作用可以是聚合酶依赖性的或不依赖于聚合酶活性。当聚合酶涉及特异性探针序列与通用检测探针之间的相互作用时,特异性探针序列和通用检测探针均可用作引物或模板。典型的通用检测探针可包括四个基本组件:通用引物(fq侵入序列踢除物)、触发物(fq侵入序列,特异性检测探针的一部分或特异性检测探针的补体)、脊序列(第二链fq探针)和脊盖(fq探针的第一链)。触发物是指可以与脊相互作用并启动信号放大级联和检测反应的寡核苷酸。触发物可以是特异性检测探针的一部分或特异性检测探针的反向互补序列,或者它可以是在扩增期间生成或释放的任何序列。脊是含有fq侵入序列踢除物、fq侵入序列和脊盖(fq探针的第一链)的互补序列的寡核苷酸。当触发物未与脊杂交时,脊盖与脊杂交并防止fq侵入序列踢除物延伸。当触发物可用时,它与脊杂交,将脊盖与脊分离,并且使fq侵入序列踢除物与脊杂交并通过具有链置换活性的dna聚合酶进行延伸。反过来,触发物被置换并与另一个未反应的脊杂交。一些形式可以经由茎环结构将单个寡核苷酸中的两个基本组件组合。例如,脊本身在其3’端具有发夹环结构。但3'端用几个核苷酸翻转以阻止3'端延伸。在这种情况下,单链发夹寡核苷酸含有脊和脊盖二者。脊的3'端可以是染料标记的,且荧光强度变化可用于监测扩增。在另一个实施方案中,脊的3'端具有折叠序列,但由于脊盖而不能折叠到脊上。当fq侵入序列与脊杂交以踢掉脊盖时,3'端脊将折叠到脊上以延伸,从而替换fq侵入序列探针。在另一个实施方案中,脊盖在脊的5'端杂交。在扩增反应期间,脊的3'端将使用fq侵入序列作为模板进行延伸。延伸的脊将折叠到自身上以进一步延伸,从而替换5'端脊盖。一些形式的通用检测探针可能已经具有一个或多于一个灭活的触发物,该灭活的触发物作为脊的一部分或作为单独的寡核苷酸与其互补序列杂交以指数扩增荧光信号。在一个实施方案中,脊可包含多于一个脊盖。一些形式的通用检测探针可以在脊和脊盖上携带荧光团和淬灭剂或相反,而其他形式可以在fq侵入序列踢除物中携带荧光团和淬灭剂,或者提供单独通用fq探针以生成荧光信号。一些形式可能在系统中仅携带荧光团而没有淬灭剂,并使用嵌入染料作为荧光淬灭剂(专利公开号:us2012/0282617a1)。
侵入序列踢除物是人工序列,其允许将完整或部分适体序列掺入脊中。文献中有许多种适体序列,如凝血酶适体、atp适体等。部分适体的一个例子是g-四联体序列。例如,侵入序列踢除物可能包含部分g-四联体序列。当侵入序列踢除物采用脊作为模板延伸时,形成完整的g-四联体序列。延伸的侵入序列踢除物将形成稳定的g-四联体结构,以允许另一个侵入序列踢除物与脊杂交以生成指数扩增。侵入序列踢除物可以在其5'端包含人工序列。根据需要,人工序列可包含天然或非天然核苷酸。在另一个实施方案中,为了防止侵入序列踢除物在fq侵入序列触发扩增之前与脊和脊盖相互作用,侵入序列踢除物的3'端在与脊杂交时可包含错配。错配可以在其3'端或3'端附近。在另一个实施方案中,来自侵入序列踢除物的新合成的双链脊可以与另一个fq探针相互作用以生成指数扩增。在另一个实施方案中,脊可含有化学部分以阻止聚合酶延伸。
在另一个实施方案中,侵入序列踢除物具有5'端被荧光染料标记的发夹结构。反应系统将包括嵌入染料以在侵入序列与脊杂交之前淬灭侵入序列踢除物荧光。在它由于fq侵入引发反应而与脊杂交时,侵入序列踢除物的5'端将是单链的,并且5'端荧光染料将不会被嵌入染料淬灭。变化的荧光强度可用于监测扩增。
本文公开的扩增反应的优选检测方法包括fq探针。“fq探针”是包含荧光团和淬灭剂的核酸,它们在扩增反应和/或荧光团将发荧光的检测方法过程中充分分离。fq探针的示例性形式公开于美国专利公开2013/0171643中。fq探针通常是双链核酸,其中荧光团在一条链上而淬灭剂在另一条链上。fq探针将通常包含用于退火的单链区域。在扩增反应期间,链置换聚合酶将分离fq探针的两条链,从而允许荧光团发荧光。在优选的实施方案中,以下任何一种引物可包含fq探针:一个或两个回折引物、一个或多个茎加速引物或一个或多个环加速引物。在特别优选的实施方案中,一个或多个突出序列将包含fq探针。
在某些方面,fq探针将是通用探针。“通用fq探针”本身不会退火至模板核酸,而是退火至参与回折引物扩增反应的一个或多个引物中包含的任意序列,该一个或多个引物包括:一个或多个回折引物、一个或多个茎加速引物、一个或多个环加速引物、一个或多个踢除物加速引物或其组合。通用fq探针通常是用于回折引物扩增反应(而非特异于ω扩增)的新型探针,因此是本公开内容的独立方面。因为通用fq探针不退火至模板核酸,所以通用fq探针可以简单地通过在反应所包含的引物的一种中包括任意退火序列而在许多不同的无关扩增反应中重复使用。
通用fq探针通常以两种方式中的一种激活。首先,行为类似引物的“fq侵入序列”将退火至通用fq探针,优选退火至通用fq探针的单链部分。然后,链置换扩增聚合酶将使用fq侵入序列作为引物来延伸和置换通用fq探针的双链部分,使得荧光团与淬灭剂分离,从而使荧光团发荧光。fq侵入序列可以作为用于回折扩增的任何引物的第二链包括在内,该引物包括但不限于:一个或多个回折引物、一个或多个茎加速引物或一个或多个环加速引物或其组合。在扩增期间,当合成引物的互补链时,fq侵入序列将通过链置换扩增聚合酶置换。置换后,fq侵入序列可随后退火至通用fq探针,以用作引物来激活通用fq探针。可选地,fq侵入序列的互补序列可以包含在一个或多个引物中,使得当生成引物的互补链时,通过链置换扩增聚合酶生成fq侵入序列。在随后的置换后,新合成的fq侵入序列将能够退火至通用fq探针。在优选的实施方案中,fq侵入序列退火至一个或多个突出序列,或者突出序列是单链的但包含fq侵入序列的互补序列。图3提供了被退火至环加速引物的通用fq探针和fq侵入序列的示例性实现。在这种情况下,fq侵入序列是引物,且通用fq探针是其延伸模板。
第二,在立足点替换反应中行为类似探针的“fq侵入序列”将退火至通用fq探针的单链部分和通用fq探针的双链部分。fq侵入序列将首先退火至通用fq探针的单链部分,然后将置换通用fq探针的第二链,其中fq侵入序列与通用fq探针的双链部分重叠。从通用fq探针置换通用fq探针的第二链将使荧光团与淬灭剂分离,使得荧光团发荧光。在优选的实施方案中,“fq侵入序列踢除物”将退火至fq侵入序列所退火的同一链5'上的通用fq探针的双链部分。因此,当fq侵入序列退火并置换通用fq探针的第二链时,侵入序列踢除物将能够退火并提供游离的3'oh基团用于链置换扩增聚合酶延伸。通过链置换扩增聚合酶的延伸将置换fq侵入序列,从而使其退火至未被激活的另一个通用fq探针。因此,单个fq侵入序列将能够激活多个通用fq探针,从而进一步放大信号。图7提供了被退火至环加速引物的通用fq探针和fq侵入序列的示例性实现。图7还示出了使用侵入序列踢除物来置换fq侵入序列,使得它可以在信号放大循环中继续激活通用fq探针。
淬灭剂的例子可包括但不限于dabcyl、tamra和blackholequenchers(bhq)(biosearchtechnologies,诺瓦托,加利福尼亚州)。荧光团的例子可包括但不限于荧光素、cy3、cy5和本领域已知的任何数量的量子点。当fq探针的两条链退火时,荧光团和淬灭剂足够接近,使得荧光团不会有效地发荧光。
在某些实施方案中,含有荧光团的链与含有淬灭剂的链的比例可以选择为小于约1:1(例如,含有淬灭剂的链的浓度高于含有荧光团的链的浓度)。这种比例的例子可包括但不限于小于约1:1.1、小于约1:1.2、小于约1:1.3、小于约1:1.4、小于约1:1.5、小于约1:1.6、小于约1:1.7、小于约1:1.8、小于约1:1.9以及更小的比例。这种比例的例子可进一步包括但不限于小于约1:2、小于约1:3、小于约1:4、小于约1:5以及更小的比例。已经发现较高的比例降低了当掺入一种引物中时通用fq探针的存在抑制本文公开的扩增反应速率的程度,并且降低背景荧光混杂检测的程度。
在进一步的实施方案中,可以改变将掺入一种引物中的fq探针的两条链混合入扩增反应混合物中的方式,以提高扩增反应的速度,从而减少生成一定量的足以检测的扩增子核酸所需的时间。当加入到本文公开的扩增反应中时,含有荧光团的链和含有淬灭剂的链可以相对于彼此处于未退火状态。在某些实施方案中,含有荧光团的链和含有淬灭剂的链可以彼此同时或在不同时间加入本文公开的扩增反应中。
先前观察到,将含有荧光团的链和含有淬灭剂的链单独地加入lamp反应混合物中,与向lamp反应混合物中加入双链fq探针相反,lamp反应速率相对不受抑制,从而导致更快指示阳性反应(参见例如,美国专利公开2013/0171643的实施例5)。
也可以改变扩增反应中fq探针的总量以影响扩增反应的速度和可观察的荧光的发生。通过使用加入到扩增反应中的较少量的荧光和淬灭剂探针链,可以显著缩短检测时间。例如,加入扩增反应中的荧光探针链的量可以大于约0.08μm、大于或等于约0.4μm、大于或等于约1.6μm等,并且淬灭剂探针的各自浓度可以大于或等于约0.16μm、大于或等于约1.6μm等。
在进一步的实施方案中,荧光探针链与淬灭剂探针链的比例可小于约1:1。这种比例的例子可包括但不限于小于约1:1.5、小于约1:2、小于约1:2.5、小于约1:3、小于约1:3.5、小于约1:1.4、小于约1:1.4.5、小于约1:5、小于约1:5.5、小于约1:1.60、小于约1:1.65、小于约1:1.70、小于约1:1.75、小于约1:1.80、小于约1:8.5、小于约1:9、小于约1:9.5以及更小的比例。这种比例的例子可进一步包括但不限于约1:2、约1:3、约1:4、约1:5以及更小的比例。
在某些实施方案中,荧光探针链和淬灭剂探针链的量可以保持尽可能地低,同时当通过扩增反应对模板核酸进行阳性扩增时仍提供可检测水平的荧光。以这种方式,仍然可以进行检测,同时基本上消除由于通用fq探针的存在而导致的扩增反应速率的降低。在某些实施方案中,荧光探针链的量可以在约0.01至约0.4μm的范围内。在进一步的实施方案中,淬灭剂探针的量可以选择在约0.02至约0.8μm的范围内。在其他实施方案中,通用fq探针的总量可以在约0.03μm至约1.2μm的范围内。
b.分子信标
在某些方面,分子信标序列用于检测靶核酸和/或扩增子核酸的扩增。信标配置中的核酸广泛用作特异性dna感测矩阵。光活性发色团/淬灭剂与发夹末端的特异性连接导致发色团发光淬灭。随后通过分析的dna发夹的杂交而点亮发色团发光,并且信标开口用作dna的光子检测的一般基序(tyagi,s.;kramer,f.r.nat.biotechnol.1996,14,303-308.(b)tyagi,s.;marras,s.a.e.;kramer,f.r.nat.biotechnol.1998,18,1191-1196.)。通过分子或纳米颗粒淬灭剂淬灭染料(dubertret,b.;calame,m.;libchaber,a.nat.biotechnol.2001,19,365-370.)或者染料之间的荧光共振能量转移(fret)用于光学检测dna与信标的杂交过程。
c.g-四联体序列
在某些方面,g-四联体序列用于检测靶核酸和/或扩增子核酸的扩增。在某些金属离子(例如k+)的存在下,短的富含鸟嘌呤(g)的序列折叠成称为g-四分体或四联体的结构。四联体非常稳定,并且生物物理学研究已表明它们具有固有的光学性质(例如,吸收300nm处的光),这使它们与其他二级结构区别开来。先前已经开发了四联体形成测定法,其利用这种独特的四联体特征来研究裂解dna的酶[kankia,b.i.(2006)areal-timeassayformonitoringnucleicacidcleavagebyquadruplexformation,nucleicacidsresearch,34,p.141]或促进链交换反应[kankia,b.i.(2004)opticalabsorptionassayforstrand-exchangereactionsinunlabelednucleicacids,nucleicacidsresearch,32,p.154]。简而言之,当具有形成四联体的潜力的富含g的序列掺入dna底物中时,这些序列最初处于淬灭状态。在酶活性(例如链裂解或链交换)下,释放的序列折叠成四联体,并且当通过吸收和荧光光谱监测时变得可见。文献中有许多出版物描述了如何通过荧光检测g-四联体形成(topcurrchem(2013)330:111–178,chem.commun.,2015,51,16033,criticalreviewsinbiochemistryandmolecularbiology,2011;46(6):478–492)。例如,卟啉内消旋-5,10,15,20-四-(n-甲基-4-吡啶基)卟吩(tmpyp4)和n-甲基中卟啉ix(nmm)、硫磺素已被用作四联体检测探针。在低阳离子浓度的存在下卟啉与dna的相互作用表明,不同于tmpyp4,nmm可用作在所有阳离子存在下四联体结构的有效荧光探针。tmpyp4仅在存在钾时是有效的探针。可以通过抗体检测g-四联体(naturechemistry,vol5,march2013,182)。此外,生物化学研究表明,g-四联体是具有类似过氧化物酶的活性的催化dna。g-四联体可以与氯化血红素形成超分子复合物。据报道,该复合物通过h2o2(用于测定过氧化物酶活性的常用反应)催化2,2'-连氮双(3-乙基苯并噻唑啉)-6-磺酸abts的氧化。有人提出,鸟嘌呤-四联体层的超分子对接促进了氯化血红素嵌入复合物中,并促进了生物催化活性氯化血红素中心的形成。在某些方面,g-四联体序列用于检测靶核酸和/或扩增子核酸的扩增。g-四联体序列可以包含在回折引物扩增反应中的任何引物中,该引物包括:一个或两个回折引物、一个或多个茎加速引物、一个或多个环加速引物、一个或多个踢除物加速引物或其组合。g四联体序列通常是用于回折引物扩增反应(而非特异于ω扩增)的新型探针,因此是本公开内容的独立方面。
d.嵌入剂
已经描述了用于检测扩增产物的不同类型的可检测部分。一类可检测部分是嵌入剂,其非特异性地结合至双链核酸。嵌入剂在未结合时具有相对较低的荧光,且在结合至双链核酸时具有相对较高的荧光。因此,嵌入剂可用于监测核酸扩增反应期间双应变核酸的积累。这种非特异性染料的例子包括嵌入剂如sybrgreeni(molecularprobes)、碘化丙碇、溴化乙锭等。其他类型的可检测部分使用序列特异性核酸探针的衍生物。例如,寡核苷酸探针用一种或多种染料标记,使得在与模板核酸杂交时生成可检测的荧光变化。
e.焦磷酸盐
由于本文公开的扩增反应生成扩增子核酸,生成了大量无机焦磷酸盐。焦磷酸盐已用于本领域的检测方法中。以下讨论示例性检测方法。
1.浊度
本发明的稳健核酸扩增可以生成作为反应产物的大量不溶性焦磷酸盐。使用不溶性物质作为指示剂的检测可以通过测量浊度或通过检测沉淀来进行。浊度的测量或沉淀的检测可以通过添加凝结剂(例如,聚丙烯酸或羧甲基葡聚糖)来进行。获得的浊度可以用作检测核酸扩增的指示剂。当测量吸光度时,可以使用常用的测量装置。可以适当地确定用于测量吸光度的波长,并且测量通常在300至800nm下,优选在340至400nm的主波长下和在600至800nm的互补波长下进行。当测量散射光强度时,可以使用常用的测量装置。具体地,测量吸光度随时间的变化使得能够根据反应的持续时间监测核酸扩增的进展。(美国专利号7374879)。添加凝结剂如聚丙烯酸或羧甲基葡聚糖可提高沉淀产率,并可提高检测灵敏度。此外,这些不溶性物质可以着色或标记,从而有利于检测或提高检测灵敏度。例如,添加酸性橙使不溶性物质着色并且便于检测。
2.hnb染料
羟基萘酚蓝(hnb)是金属离子指示剂。如上所述,在ω扩增反应期间,因为镁与焦磷酸盐形成复合物并沉淀而使镁浓度降低。伴随核酸扩增的镁浓度的降低导致加入hnb的反应混合物的颜色变化,hnb的浓度为0.05-0.2mm,更优选0.1-0.15mm。特别地,混合物的颜色从紫色调变为淡蓝色调。对于本发明的目的特别优选的比色金属指示剂是羟基萘酚蓝。也可以使用其他比色金属指示剂,其优选选自:羟基萘酚蓝、铬黑t、8-羟基喹啉+丁酰胺、钛镍黄、二甲苯蓝、钙镁指示剂、二甲苯胺蓝ii、百里酚蓝、铬花青r、茜素s、邻甲酚酞、1,2,3-三羟基蒽醌、白藜芦醇、无色醌、醌茜素、对硝基苯-偶氮-对硝基苯-间苯二酚、丁酰胺、铬变素2b、氨+酚酞、碱性次碘酸盐、五甲炔花青二巴比妥酸和二苯卡巴肼。钙黄绿素(calcein或fluorexon)是一种螯合剂,其在结合的ca2+的存在下发出荧光且可用作比色金属指示剂。
3.发光
在一个实施方案中,实时生物发光测定(bart)报道系统用于检测扩增子核酸的合成。该系统已在wo2004/062338和wo2006/010948(其通过引用并入本文)中详细解释。bart是设计用于等温扩增反应的报告系统的例子,其由样品产生单一类型的信号:生物发光信号。bart使用依赖于萤火虫荧光素酶的无机焦磷酸盐检测。因此,在均相测定中,仅通过测量封闭管发出的光,就可以用bart实现分子诊断。bart已用于许多等温扩增反应,包括那些在50℃-63℃之间操作的那些反应。bart报告基因是跟踪反应中扩增速率的特别有效的手段,因为光输出代表瞬时扩增速率的量度。相反,荧光检测方法通常显示信号的积累,因此必须基于荧光信号的变化速率确定扩增速率。
v.公开方法的应用
本文公开的扩增反应可用于各种应用中。一种应用包括用于确定模板核酸内的特定靶核酸序列是否存在于生物的遗传密码中的方法。例如,它可用于确定模板核酸的核酸序列是否已被遗传修饰,用于检测与特定的非遗传修饰植物品种或经遗传修饰植物相关的dna,用于检测与纯种动物相关的dna或用于医学或兽医诊断应用,如基因检测或法医。使用本文公开的扩增反应的方法也适用于检测单核苷酸多态性(snp)。
本文公开的扩增反应也可用于诊断方法。特别地,该反应允许鉴定和定量患者样品和其他样品中的生物。生物可以是任何微生物,如病毒、细菌、支原体和真菌。微生物可以是致病性的,但它也可以是非致病性微生物。微生物也可以是经遗传修饰的生物(gmo)。此外,本文公开的扩增反应可用于鉴定经遗传修饰的农作物和动物,用于检测疾病状态,用于预测来自治疗的不良反应以及用于预测疾病状态易感性。
“患者样品”包括从受试者采集的任何样品,并且可包括血液、粪便、拭子、痰液、支气管肺泡灌洗液、组织样品、尿或脊髓液。其他合适的患者样品和提取它们的方法是本领域技术人员公知的。从中采集样品的患者或受试者可以是人或非人动物。当样品没有明确称为患者样品时,该术语还包括从其他来源采集的样品。例子包括来自表面的拭子、水样(例如废水、海水、湖水、饮用水)、食品样品、化妆品、药品、发酵产品、细胞和微生物培养物以及在其中可进行微生物检测的其他样品。
vi.试剂盒
在其他方面,本公开内容包括用于进行本文公开的扩增反应的试剂盒,该试剂盒可用于本文公开的特定应用或检测方法。试剂盒优选包含实施本文公开的扩增反应或检测方法所必需的所有组分,但不包含待扩增或测试的靶核酸(靶核酸可被包含作为阳性对照的情况除外)。
用于本文公开的扩增反应和方法的试剂盒优选包含聚合酶、核酸聚合酶的底物和适合于等温扩增靶核酸的回折引物以及适当的加速引物。更优选地,试剂盒进一步包含缓冲试剂(如镁离子源)或已知能改善试剂盒试剂的保质期的添加剂(如海藻糖)或已知有助于保存试剂的添加剂(如叠氮化钠)。可选地,用于根据本发明的方法的试剂盒可仅包含这些组分中的一些和/或附加的组分。然后可以在使用期间将样品和试剂盒中省略的任何其他组分添加到试剂盒中。
试剂盒可以包含适合于在试剂盒的扩增反应期间或之后进行的任何检测方法的其他组分。例如,试剂盒可以包含热稳定的荧光素酶、荧光素和将无机焦磷酸盐(ppi)转化为atp的酶(如atp硫化酶),并且将ppi转化为atp的酶的任何其他所需底物或辅因子(如5’磷硫酸腺苷)可以包含在试剂盒中。
优选地,试剂盒的至少一种组分是冻干的或者是适合于在试剂盒中储存的另一种形式。更优选地,试剂盒的所有组分都是冻干的或者是一种或多种适合于储存的其他形式。这种其他形式包括已添加稳定因子的组分和/或含有试剂盒组分的冷藏或冷冻主混合物。
实施例
以下是本公开文本的方法和组合物的实施例。应当理解,根据以上提供的一般描述可以实施各种其他实施方案。
实施例1:采用ω引物和lamp引物进行hpv18实时等温扩增的比较。
在第一引物(exfip)、第二引物(exbip)或两种引物上含有突出序列的ω引物用于实时等温扩增反应。扩增反应在25ul反应中进行,该反应含有20mmtris-hcl、10mm(nh4)2so4、10mmkcl、4mmmgso4、0.1%tritonx-100、0.4mm每种dntp、0.2m甜菜碱、回折引物0.8μm18fip(seqidno:1)或ex18fip(seqidno:2)和0.8μm18bip(seqidno:3)或ex18bip(seqidno:4)、环加速引物0.4μm18lf(seqidno:5)和0.3μm18lb(seqidno:6)、fq探针0.1μmfam-18lb(seqidno:7)和0.1μmq-寡核苷酸(seqidno:8)、踢除物加速引物0.2μm18kf(seqidno:9)和0.2μm18kb(seqidno:10)、8单位的bstdna聚合酶大片段(newenglandbiolabs)和含有hpv18序列(seqidno:11)的非变性重组质粒的20,000个拷贝。反应在bioradiq-5实时pcr仪器中60℃下进行150分钟,以30秒间隔测量fam荧光。将实时扩增谱与lamp引物的扩增谱进行比较(图9)。lamp引物和突出ω引物均能够扩增靶dna并提供相当的实时荧光信号强度。与使用该引物组的标准lamp反应相比,采用单侧ω引物的扩增显示出略慢的速率。与标准lamp反应相比,两侧的ω引物扩增显示出显著的延迟。
5’-acgtctggccgtaggtctttgcagctacagcacaccccctca(seqidno:1)
5’-tttttttttt-acgtctggccgtaggtctttgcagctacagcacaccccctca(seqidno:2)
5’-tgctacacgacctggacactgtgga-tgtaggtgtagctgcaccgaga(seqidno:3)
5’-tttttttttt-tgctacacgacctggacactgtgga-tgtaggtgtagctgcaccgaga(seqidno:4)
5’-cggacacggtgctggaatac(seqidno:5)
5’-cattgtggacctgtcaaccca(seqidno:6)
5’-fam-cacagccactccgcagggtccacgcacgatcgcacctg-cattgtggacctgtcaaccca(seqidno:7)
5’-caggtgcgatcgtgcgtggaccctgcggagtggctgtg-bhq(seqidno:8)
5’-cggtatccgctactcagcttgt(seqidno:9)
5’-tgttaccactacagagtttccgtctt(seqidno:10)
5’-aatatgggaacacaggtacgtgggaagtacattttgggaataatgtaattgattgtaatgactctatgtgcagtaccagtgacgacacggtatccgctactcagcttgttaaacagctacagcacaccccctcaccgtattccagcaccgtgtccgtgggcaccgcaaagacctacggccagacgtcggctgctacacgacctggacactgtggactcgcggagaagcagcattgtggacctgtcaacccacttctcggtgcagctacacctacaggcaacaacaaaagacggaaactctgtagtggtaacactacgcctataatacatttaaaaggtgacagaaacagtttaaaatgtttacggtacagattgcgaaaacatagcgaccactatagaga(seqidno:11)
实施例2:ω和lamp扩增产物大小的比较
扩增产物在含有0.5μg/ml溴化乙锭的tbe缓冲液中的1.5%琼脂糖凝胶上运行。在uv光下将扩增的dna产物可视化。ω和lamp引物均生成了具有相似大小模式的大扩增产物(图10)。
实施例3:通过限制酶消化分析比较ω和lamp产物
如实施例1中所述进行实验,不同之处在于每个反应具有以下回折引物对:泳道1和5,ecori-ex18fip(seqidno:12)和18bip(seqidno:3);泳道2和6,18fip(seqidno:1)和ecori-ex18bip(seqidno:13);泳道3、4、7、8ecori-18fip(seqidno:14)和18bip(seqidno:3)。在tbe缓冲液中的1.5%琼脂糖凝胶上分离扩增产物。凝胶用溴化乙锭染色,并在uv光下将扩增的dna产物可视化。
采用限制酶ecori处理使用ω和lamp引物产生的扩增产物,并随后在凝胶上运行以确定消化产物的大小模式(图11)。泳道1-4显示被限制酶切割的扩增产物。泳道5-8显示未被限制酶切割的扩增产物。这些结果表明,与在最终扩增产物中重复复制fip和bip序列的lamp扩增中不同,ω突出序列不会在扩增产物中重复复制。因此,ω扩增产物没有被限制酶ecori反复切割以产生短的和可区分的片段,而lamp扩增产物被限制酶切割成短的和可区分的片段。
5’-ttttgaattc-acgtctggccgtaggtctttgcagctacagcacaccccctca(seqidno:12)
5’-ttttttttttttttttgaattc-tgctacacgacctggacactgtgga-tgtaggtgtagctgcaccgaga(seqidno:13)
5’-acgtctggccgtaggtctttgc-gaattc-agctacagcacaccccctca(seqidno:14)
实施例4:采用两种折叠引物的ω扩增折叠到模板中的相同区域。
如实施例1中所述进行实验,不同之处在于以下引物:ω扩增引物0.8μm73ovlp-exfip(seqidno:15)(或7350ovlp-exfip(seqidno:16)或73-exfip(seqidno:17))、0.8μm73-bip(seqidno:18)、环加速引物0.4μm73ovlp-lf(seqidno:19)(相应地,或7350ovlp-lf(seqidno:20)或73-lf(seqidno:21))和0.3μm73-lb(seqidno:22)、fq探针0.1μmfam-73-lb(seqidno:23)、0.1μmq-寡核苷酸(seqidno:8)以及踢除物加速引物0.2μm73-kf(seqidno:24)和0.2μm73-kb(seqidno:25),其中含有hpv73序列的重组质粒的20,000个拷贝作为模板dna(seqidno:26)。反应在在bioradiq-5实时pcr仪器中60℃下进行100分钟,以30秒间隔测量荧光。标准ω扩增和重叠折叠ω扩增均能够扩增靶dna并提供相当的实时荧光信号曲线。
5’-tttttttttt-actctcgttcagcttgtctgtctagat-cttacatgttacgagtcattggaca(seqidno:15)
5’-tttttttttt-ttgtctgtctagatggctgtctgtttc-ccgaaattgaccttacatgttacgagt(seqidno:16)
5’-tttttttttt-gctgtctgtttcatcctcatcctctg-gaaaccaacaaccgaaattgacctt(seqidno:17)
5’-atctagacagacaagctgaacgagagt-tgttgctttcaatggcaaggc(seqidno:18)
5’-gtctgtttcatcctcatcctct(seqidno:19)
5’-ctcatcctctgagttgtcca(seqidno:20)
5’-agttgtccaatgactcgtaacatg(seqidno:21)
5’-agaatagttactgactgcacgaagt(seqidno:22)
5’-fam-cacagccactccgcagggtccacgcacgatcgcacctg-agaatagttactgactgcacgaagt(seqidno:23)
5’-ccttgcaggacattactttagacct(seqidno:24)
5’-acccataagcaactcttctatcactc(seqidno:25)
5’-aagatgcatggaaaaaaaacaaccttgcaggacattactttagacctgaaaccaacaaccgaaattgaccttacatgttacgagtcattggacaactcagaggatgaggatgaaacagacagccatctagacagacaagctgaacgagagtgttacagaatagttactgactgcacgaagtgtcagtgcacagtatgccttgccattgaaagcaacaaagctgatttaagagtgatagaagagttgcttatgggtacactaggtattgtgtgccccaactgttccaga
(seqidno:26)
实施例5:stem引物加速ω扩增
如实施例1中所述进行实验,不同之处在于以下引物:0.8μmhpv6g-fip(seqidno:27)、0.8μmhpv6g-bip(seqidno:28)或0.8μmhpv6gbip-22nt(seqidno:29)、正向环加速引物0.4μmhpv6g-lf(seqidno:30)、fq探针0.1μmhpv6g-lb-fam(seqidno:31)和0.1μmq-寡核苷酸(seqidno:8)、反向环加速引物0.3μmhpv6g-lb(seqidno:32)以及踢除物加速引物0.2μmhpv6g-kf(seqidno:33)和0.2μmhpv6g-kb(seqidno:34),其中在含有hpv6序列的重组质粒的20,000个拷贝作为模板dna(seqidno:35)的存在下有或没有0.4μmhpv6gp(seqidno:47)。反应在在bioradiq-5实时pcr仪器中60℃下进行90分钟,以30秒间隔测量荧光。实时扩增曲线显示茎引物显著加快了ω扩增。
5’-cgaacgttgctgtcacatccacag-tggacggacaagattcacaacctt(seqidno:27)
5’-gagaagtgcaacagcttctgttggg-ctgaatcgtccgccatcgtt(seqidno:28)
5’-tttttttttttttttttttttt-gagaagtgcaacagcttctgttggg-ctgaatcgtccgccatcgtt(seqidno:29)
5’-caacaggtcactatttggtaatgttgtt(seqidno:30)
5'-fam-cacagccactccgcagggtccacgcacgatcgcacctg-catctgcgcaccgaagaca(seqidno:31)
5'-catctgcgcaccgaagaca(seqidno:32)
5’-gcaattagtagacagctcagaagatga(seqidno:33)
5’-tgtacacccagacccctcat(seqidno:34)
5’-tggttgtgcagtgtacagaaacagacatca(seqidno:47)
5’-ccctgtagggttacattgctatgagcaattagtagacagctcagaagatgaggtggacgaagtggacggacaagattcacaacctttaaaacaacattaccaaatagtgacctgttgctgtggatgtgacagcaacgttcgactggttgtgcagtgtacagaaacagacatcagagaagtgcaacagcttctgttgggaacactaaacatagtgtgtcccatctgcgcaccgaagacataacaacgatggcggacgattcaggtacagaaaatgaggggtctgggtgtacaggatggtttatggtagaagcta(seqidno:35)
实施例6:回折环引物加快lamp和ω扩增。
如实施例1中所述进行实验,不同之处在于在存在含有hpv35序列(seqidno:46)的重组质粒的2,0000个拷贝作为模板dna的情况下用于lamp扩增反应的以下引物:35-fip(seqidno:36)、35-bip(seqidno:37)、35-lf(seqidno:38)或35-fblf(seqidno:39)、35-lb(seqidno:40)或35-fblb(seqidno:41)、35-kf(seqidno:42)、35-kb(seqidno:43)和0.1μm35-lf-fam(seqidno:44);以及用于ω扩增反应的引物:35-exfip(seqidno:45)、35-bip、35-lf或35-fblf、35-lb或35-fblb、35-kf、35-kb和0.1μm35-lf-fam。反应在在bioradcfx-96实时pcr仪器中60℃下进行40分钟,以60秒间隔测量荧光。与常规环引物相比,回折环引物加快了lamp和ω扩增中的等温扩增反应。
5’-aggctttggtatgggtctcggtggt-gcacagaactatccactgctga(seqidno:36)
5’-ggcaccacagaaacgcagaagaca-ctgagtcgcactcgcttgg(seqidno:37)
5’-ggcgtgtagctgtgtagcaat(seqidno:38)
5’-aggctttggtatgggtctcggtggt-ggcgtgtagctgtgtagcaat(seqidno:39)
5’-aatcacaaacgacttcgagggg(seqidno:40)
5’-ggcaccacagaaacgcagaagaca-aatcacaaacgacttcgagggg(seqidno:41)
5’-gtaattgtttgtcctgaatctgtatttagc(seqidno:42)
5’-gtcaacactgtccacggca(seqidno:43)
5’-fam-cacagccactccgcagggtccacgcacgatcgcacctgggcgtgtagctgtgtagcaat(seqidno:44)
5’-tttttttttt-aggctttggtatgggtctcggtggt-gcacagaactatccactgctga(seqidno:45)
5’-tatgggaagtgcatgtgggtggtcaggtaattgtttgtcctgaatctgtatttagcagcacagaactatccactgctgaaattgctacacagctacacgcctacaacaccaccgagacccataccaaagcctgctccgtgggcaccacagaaacccagaagacaaatcacaaacgacttcgagggggtaccgagctcccctacaaccccaccaagcgagtgcgactcagtgccgtggacagtgttgacagaggggtctactctacatctga(seqidno:46)
实施例7:通用检测探针可用作靶序列检测或等温扩增反应的信号放大和检测方法
利用通用检测探针,使用如图14所示的形式来检测实时等温反应中的侵入序列触发物。反应在25ul反应中进行,该反应含有20mmtris-hcl、10mm(nh4)2so4、10mmkcl、4mmmgso4、0.1%tritonx-100、0.4mm每种dntp、0.2m甜菜碱、0.1μm脊序列(seqidno:74)、0.1μm脊盖(seqidno:48)、0.8μm通用引物(seqidno:49)、8单位的bstdna聚合酶大片段(newenglandbiolabs)和各种浓度的侵入序列触发物(seqidno:50)作为靶标。在添加通用引物和聚合酶之前,将脊序列和脊盖混合在一起。反应在abistepone实时pcr仪器中60℃下进行60分钟,以60秒间隔测量fam荧光。该通用检测系统能够放大和检测由小于8nm的侵入序列触发物生成的信号(图23a)。
此外,这些通用检测探针用于在lamp反应中使用图9所示的设计替换特异性fq探针。如上所述进行实验,不同之处在于用于lamp扩增反应和信号检测的以下引物:33-fip(seqidno:51)、33-bip(seqidno:52)、33-lf(seqidno:53)、33-lb(seqidno:54)、33-kf(seqidno:55)、33-kb(seqidno:56)以及具有淬灭剂探针(seqidno:8)的0.1μm33-fq-lb(seqidno:57)或具有通用检测探针(seqidno:48-50和74)的0.1μm33-trigger’-lb(seqidno:58)。含有hpv33靶序列(seqidno:59)的质粒的10000个拷贝用作模板。将33-fq-lb和淬灭剂探针或33-trigger'-lb和触发物序列预先混合,然后加入到反应中。使用通用检测探针的信号检测显示出与使用特异性探针检测的速度相当的速度(图23b)。
5’-agcctgagtgcgtccaaccgtgcgacaggtgcgatcgtgcgtggaccctgcggagtggctgtg-bhq(seqidno:74)
5’-fam–cacagccactccgcagggtccacgc-tt(seqidno:48)
5’-cacagccactccgc(seqidno:49)
5’-agggtccacgc-acgatcgcacctgtcgcacggttggacgcactc(seqidno:50)
5’-cacaggtagggcacacaatattcactg-caacagtacagcaagtcacctacga(seqidno:51)
5’-aacatcatctacaatggccgatcctga-gactgcttctacctcaaaccaacc(seqidno:52)
5’-tgcccataagtagttgctgtatggt(seqidno:53)
5’-gtacaaatggggctgggatg(seqidno:54)
5’-cacttgtaacaccacagttcgtt(seqidno:55)
5’-tctgaaatattatctcctgttcttctctct(seqidno:56)
5’-fam-cacagccactccgcagggtccacgcacgatcgcacctg-gtacaaatggggctgggatg(seqidno:57)
5’-gagtgcgtccaaccgtgcgacaggtgcgatcgtgcgtggaccct-gtacaaatggggctgggatg(seqidno:58)
5’-cacttgtaacaccacagttcgtttatgtgtcaacagtacagcaagtgacctacgaaccatacagcaactacttatgggcacagtgaatattgtgtgccctacctgtgcacaacaataaacatcatctacaatggccgatcctgaaggtacaaatggggctgggatggggtgtactggttggtttgaggtagaagcagtcatagagagaagaacaggagataatatttcaga(seqidno:59)
实施例8:脊中具有附加触发物的通用检测探针可用作信号放大和检测方法
利用脊中具有附加触发物的通用检测探针,使用如图15所示的形式来检测实时等温反应中的侵入序列触发物。反应在25ul反应中进行,该反应含有20mmtris-hcl、10mm(nh4)2so4、10mmkcl、4mmmgso4、0.1%tritonx-100、0.4mm每种dntp、0.2m甜菜碱、0.1μm脊序列(seqidno:75-c3spacer-seqidno:76)、0.1μm脊盖(seqidno:77)、0.2μm侵入序列踢除物(seqidno:49)、8单位的bstdna聚合酶大片段(newenglandbiolabs)和各种浓度的侵入序列触发物(seqidno:50)作为靶标。在添加通用引物和聚合酶之前,将脊序列和脊盖混合在一起。反应在abistepone实时pcr仪器中60℃下进行60分钟,以60秒间隔测量fam荧光。
5’-cgaga-agggtcc-acgcacgatcgcacctgtcgcacggttggacgcactc-ga-c3spacer-ga-gagtgcgtccaaccgtgcgacaggtgcgatcgtgcgt-ggaccct-tctcg-tttttgagtgcgtccaaccgtgcgacaggtgcgatcgtgcgtggaccctgcggagtggctgtc-fam(seqidno:75-c3spacer-seqidno:76)
5’-bhq-gacagccactccgcagggtccacgcacg-ttt(seqidno:77)
实施例9:具有附加的脊盖和第二侵入序列踢除物的通用检测探针可用作信号放大和检测方法
利用具有附加脊盖和第二通用引物的通用检测探针,使用如图16所示的形式检测实时等温反应中的侵入序列触发物。反应在25ul反应中进行,该反应含有20mmtris-hcl、10mm(nh4)2so4、10mmkcl、4mmmgso4、0.1%tritonx-100、0.4mm每种dntp、0.2m甜菜碱、0.1μm脊序列(seqidno:47)、0.1μm脊盖1(seqidno:48)、0.1μm脊盖2(seqidno:53)、0.1μm通用引物1(seqidno:79)、0.1μm通用引物2(seqidno:80)、8单位的bstdna聚合酶大片段(newenglandbiolabs)和各种浓度的侵入序列触发物(seqidno:81)作为靶标。在添加侵入序列踢除物和聚合酶之前,将脊序列和脊盖混合在一起。反应在abistepone实时pcr仪器中60℃下进行60分钟,以60秒间隔测量fam荧光。
5’-acgatcgcacctgtcgcacg-tttt(seqidno:78)
5’-cagccactccgc(seqidno:79)
5’-gtccacgc-acga(seqidno:80)
5’-gcacctgtcgcacggttggacgcactcaggct(seqidno:81)
实施例10:通用检测探针可以与g-四联体基序介导的指数信号检测方法一起应用
利用具有g-四联体基序介导的指数信号检测机制的通用检测探针,使用如图17所示的形式来检测实时等温反应中的侵入序列触发物。反应在25ul反应中进行,该反应含有20mmtris-hcl、10mm(nh4)2so4、10mmkcl、4mmmgso4、0.1%tritonx-100、0.4mm每种dntp、0.2m甜菜碱、0.1μm脊序列(seqidno:82)、0.1μm脊盖(seqidno:83)、0.1μm侵入序列踢除物(seqidno:84)、8单位的bstdna聚合酶大片段(newenglandbiolabs)和各种浓度的侵入序列触发物(seqidno:50)作为靶标。在添加侵入序列踢除物和聚合酶之前,将脊序列和脊盖混合在一起。反应在abistepone实时pcr仪器中60℃下进行60分钟,以60秒间隔测量fam荧光。
5’-gagtgcgtccaaccgtgcgacaggtgcgat-cgtgcgtggaccct-cccacccaccctc-bhq(seqidno:82)
5’-fam-gagggtgggtggg-agggtccacgcacg-taa(seqidno:83)
5’-gg-gagggtgggtg(seqidno:84)
实施例11:具有fam标记的分子信标形式的侵入序列踢除物的通用检测探针可用作信号放大和检测方法
利用具有fam标记的分子信标(mb)形式的通用引物的通用检测探针,使用如图18所示的形式检测实时等温反应中的侵入序列触发物。反应在25ul反应中进行,该反应含有20mmtris-hcl、10mm(nh4)2so4、10mmkcl、4mmmgso4、0.1%tritonx-100、0.4mm每种dntp、0.2m甜菜碱、6.25μg/ml作为液体淬灭剂的亚甲基蓝、0.1μm脊序列(seqidno:60)、0.12μm脊盖(seqidno:61)、0.1μmmb形式的侵入序列踢除物(seqidno:62-c3spacer-seqidno:85)、8单位的bstdna聚合酶大片段(newenglandbiolabs)和各种浓度的侵入序列触发物(seqidno:50)作为靶标。在添加侵入序列踢除物和聚合酶之前,将脊序列和脊盖混合在一起。反应在abistepone实时pcr仪器中60℃下进行60分钟,以60秒间隔测量fam荧光。
5’-agcctgagtgcgtccaaccgtgcgacaggtgcgatcgtgcgtggaccctgcggagtggctgtg(seqidno:60)
5’-cacagccactccgcagggtccacgc-tt(seqidno:61)
5’-fam-gcgga-c3spacer-cacagccactccgc(seqidno:62-c3spacer-seqidno:85)
实施例12:在一个寡核苷酸中具有脊和盖序列的通用检测探针可用作信号放大和检测方法
利用一个寡核苷酸中具有脊和盖的通用检测探针,使用如图19所示的形式来检测实时等温反应中的侵入序列触发物。反应在25ul反应中进行,该反应含有20mmtris-hcl、10mm(nh4)2so4、10mmkcl、4mmmgso4、0.1%tritonx-100、0.4mm每种dntp、0.2m甜菜碱、6.25μg/ml作为液体淬灭剂的亚甲基蓝、0.1μm脊盖序列(seqidno:63)、0.2μm侵入序列踢除物(seqidno:64)、8单位的bstdna聚合酶大片段(newenglandbiolabs)和各种浓度的侵入序列触发物(seqidno:65)作为靶标。反应在abistepone实时pcr仪器中60℃下进行60分钟,以60秒间隔测量fam荧光。
5’-ccacgagtgccagtgcgtc-caacgcgtcgacaggtgcgatcgt-gatctctcgttat-gcggagtggctgtg-atccgc-ataacgagaga/t-fam/ctt(seqidno:63)
5’-cagccac-tccgc(seqidno:64)
5’-ataacgagagatc-acgatcgcacctgtcgacgcgttg(seqidno:65)
实施例13:自引发脊中具有附加触发物的通用检测探针可用作信号放大和检测方法
利用具有自引发脊的通用检测探针,使用如图20所示的形式来检测实时等温反应中的侵入序列触发物。反应在25ul反应中进行,该反应含有20mmtris-hcl、10mm(nh4)2so4、10mmkcl、4mmmgso4、0.1%tritonx-100、0.4mm每种dntp、0.2m甜菜碱、0.1μm脊序列(seqidno:66)、0.11μm淬灭剂探针(seqidno:67)、0.12μm脊盖(seqidno:68)、8单位的bstdna聚合酶大片段(newenglandbiolabs)和各种浓度的侵入序列触发物(seqidno:69)作为靶标。在加入聚合酶之前,将脊序列、脊盖和淬灭剂探针混合在一起。反应在abistepone实时pcr仪器中60℃下进行60分钟,以60秒间隔测量fam荧光。
5’-fam-gcgtggaccctgcggagtggctgtg-at-cactccctccaaccctcccacacctcccatcct-ccctccaccct-gagcta-cacatc-tagctc(seqidno:66)
5’-cacagccactccgcagggtccacgc-bhq(seqidno:67)
5’-gagctagatgtgtagctcagggtggagggaggatgggag-ttt(seqidno:68)
5’-agggtggagggaggatgggaggtgtgggagggttggaggga-ttt(seqidno:69)
实施例14:以脊为特征的通用检测探针可以用作信号放大和检测方法,所述脊能够在沿着侵入序列触发物延伸后自引发
利用具有能够在沿着侵入序列触发物延伸之后自引发的脊的通用检测探针,使用如图21所示的形式来检测实时等温反应中的侵入序列触发物。反应在25ul反应中进行,该反应含有20mmtris-hcl、10mm(nh4)2so4、10mmkcl、4mmmgso4、0.1%tritonx-100、0.4mm每种dntp、0.2m甜菜碱、0.1μm脊序列(seqidno:70)、0.12μm淬灭剂探针(seqidno:67)、8单位的bstdna聚合酶大片段(newenglandbiolabs)和各种浓度的侵入序列触发物(seqidno:71)作为靶标。在加入聚合酶之前,将脊序列和淬灭剂探针混合在一起。反应在abistepone实时pcr仪器中60℃下进行60分钟,以60秒间隔测量fam荧光。
5’-fam-gcgtggaccctgcggagtggctgtg-at-gcatgcacgatcgcacctgtcgcac-gagtcctcccaacc(seqidno:70)
5’-gcatgcacgatcgcacctgtcgcacggttgggaggactc-tat(seqidno:71)
实施例15:以发夹结构的脊为特征的通用检测探针可以用作信号放大和检测方法,所述脊能够在沿着侵入序列触发物延伸后自引发
利用以脊的备选设计(其在沿着侵入序列触发物延伸之后自引发)为特征的通用检测探针,使用如图22所示的形式来检测实时等温反应中的侵入序列触发物。反应在25ul反应中进行,该反应含有20mmtris-hcl、10mm(nh4)2so4、10mmkcl、4mmmgso4、0.1%tritonx-100、0.4mm每种dntp、0.2m甜菜碱、0.1μm脊序列(seqidno:72)、0.12μm淬灭剂探针(seqidno:67)、8单位的bstdna聚合酶大片段(newenglandbiolabs)和各种浓度的侵入序列触发物(seqidno:73)作为靶标。在加入聚合酶之前,将脊序列和淬灭剂探针混合在一起。反应在abistepone实时pcr仪器中60℃下进行60分钟,以60秒间隔测量fam荧光。
5’-fam-gcgtggaccctgcggagtggctgtg-at-gccgagagtcctcccaaccgtctgt-agcgagac-atat-gtcgcac-gtctcgca-tcccac(seqidno:72)5’-gtcgcacgtggga-acagacggttgggaggactctcggc-/3phos/(seqidno:73)
实施例16
实施例16显示了在基于如图14所示的形式的实时等温反应中使用通用检测探针的示例性实验结果。在含有0.1μm脊序列、0.1μm脊盖、0.8μm侵入序列踢除物的25ul反应中检测到0nm(绿色)、0.8nm(黑色)、8nm(红色)、80nm(浅蓝色)和800nm(深蓝色)侵入序列触发物。反应在abistepone实时pcr仪器中60℃下进行48分钟,以60秒间隔测量fam荧光。图23a和图23b显示了与使用通用fq探针检测的lamp反应相比,使用如图9所示的通用检测探针的lamp反应的比较结果。
本文公开和要求保护的所有组合物和/或方法可根据本公开文本进行制造和实施而无需过度实验。尽管已经以优选实施方案的方式描述了本发明的组合物和方法,但是对本领域技术人员而言将清楚的是,可以对本文描述的组合物和/或方法以及在步骤或者在方法的步骤的顺序中进行变化,而不脱离本发明的概念、精神和范围。更确切地,将清楚的是,化学和生理学相关的某些试剂可以代替在此描述的试剂,同时将实现相同或相似的结果。对于本领域技术人员而言清楚的所有此类类似的替换和修改被认为在本发明的如所附权利要求书所限定的精神、范围和概念之内。
序列表
<110>阿提拉生物系统股份有限公司
<120>ω扩增
<130>737962000140
<140>未分配
<141>与本申请同时
<150>us62/340,997
<151>2016-05-24
<160>86
<170>用于windows版本4.0的fastseq
<210>1
<211>42
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>1
acgtctggccgtaggtctttgcagctacagcacaccccctca42
<210>2
<211>52
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>2
ttttttttttacgtctggccgtaggtctttgcagctacagcacaccccctca52
<210>3
<211>47
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>3
tgctacacgacctggacactgtggatgtaggtgtagctgcaccgaga47
<210>4
<211>57
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>4
tttttttttttgctacacgacctggacactgtggatgtaggtgtagctgcaccgaga57
<210>5
<211>20
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>5
cggacacggtgctggaatac20
<210>6
<211>21
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>6
cattgtggacctgtcaaccca21
<210>7
<211>59
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>1
<223>连接到fam基团
<400>7
cacagccactccgcagggtccacgcacgatcgcacctgcattgtggacctgtcaaccca59
<210>8
<211>38
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>38
<223>连接到bhq基团
<400>8
caggtgcgatcgtgcgtggaccctgcggagtggctgtg38
<210>9
<211>22
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>9
cggtatccgctactcagcttgt22
<210>10
<211>26
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>10
tgttaccactacagagtttccgtctt26
<210>11
<211>400
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>11
aatatgggaacacaggtacgtgggaagtacattttgggaataatgtaattgattgtaatg60
actctatgtgcagtaccagtgacgacacggtatccgctactcagcttgttaaacagctac120
agcacaccccctcaccgtattccagcaccgtgtccgtgggcaccgcaaagacctacggcc180
agacgtcggctgctacacgacctggacactgtggactcgcggagaagcagcattgtggac240
ctgtcaacccacttctcggtgcagctacacctacaggcaacaacaaaagacggaaactct300
gtagtggtaacactacgcctataatacatttaaaaggtgacagaaacagtttaaaatgtt360
tacggtacagattgcgaaaacatagcgaccactatagaga400
<210>12
<211>52
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>12
ttttgaattcacgtctggccgtaggtctttgcagctacagcacaccccctca52
<210>13
<211>69
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>13
ttttttttttttttttgaattctgctacacgacctggacactgtggatgtaggtgtagct60
gcaccgaga69
<210>14
<211>48
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>14
acgtctggccgtaggtctttgcgaattcagctacagcacaccccctca48
<210>15
<211>62
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>15
ttttttttttactctcgttcagcttgtctgtctagatcttacatgttacgagtcattgga60
ca62
<210>16
<211>64
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>16
ttttttttttttgtctgtctagatggctgtctgtttcccgaaattgaccttacatgttac60
gagt64
<210>17
<211>61
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>17
ttttttttttgctgtctgtttcatcctcatcctctggaaaccaacaaccgaaattgacct60
t61
<210>18
<211>48
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>18
atctagacagacaagctgaacgagagttgttgctttcaatggcaaggc48
<210>19
<211>22
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>19
gtctgtttcatcctcatcctct22
<210>20
<211>20
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>20
ctcatcctctgagttgtcca20
<210>21
<211>24
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>21
agttgtccaatgactcgtaacatg24
<210>22
<211>25
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>22
agaatagttactgactgcacgaagt25
<210>23
<211>63
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>1
<223>连接到fam基团
<400>23
cacagccactccgcagggtccacgcacgatcgcacctgagaatagttactgactgcacga60
agt63
<210>24
<211>25
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>24
ccttgcaggacattactttagacct25
<210>25
<211>26
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>25
acccataagcaactcttctatcactc26
<210>26
<211>288
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>26
aagatgcatggaaaaaaaacaaccttgcaggacattactttagacctgaaaccaacaacc60
gaaattgaccttacatgttacgagtcattggacaactcagaggatgaggatgaaacagac120
agccatctagacagacaagctgaacgagagtgttacagaatagttactgactgcacgaag180
tgtcagtgcacagtatgccttgccattgaaagcaacaaagctgatttaagagtgatagaa240
gagttgcttatgggtacactaggtattgtgtgccccaactgttccaga288
<210>27
<211>48
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>27
cgaacgttgctgtcacatccacagtggacggacaagattcacaacctt48
<210>28
<211>45
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>28
gagaagtgcaacagcttctgttgggctgaatcgtccgccatcgtt45
<210>29
<211>67
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>29
ttttttttttttttttttttttgagaagtgcaacagcttctgttgggctgaatcgtccgc60
catcgtt67
<210>30
<211>28
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>30
caacaggtcactatttggtaatgttgtt28
<210>31
<211>57
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>1
<223>连接到fam基团
<400>31
cacagccactccgcagggtccacgcacgatcgcacctgcatctgcgcaccgaagaca57
<210>32
<211>19
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>32
catctgcgcaccgaagaca19
<210>33
<211>27
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>33
gcaattagtagacagctcagaagatga27
<210>34
<211>20
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>34
tgtacacccagacccctcat20
<210>35
<211>313
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>35
ccctgtagggttacattgctatgagcaattagtagacagctcagaagatgaggtggacga60
agtggacggacaagattcacaacctttaaaacaacattaccaaatagtgacctgttgctg120
tggatgtgacagcaacgttcgactggttgtgcagtgtacagaaacagacatcagagaagt180
gcaacagcttctgttgggaacactaaacatagtgtgtcccatctgcgcaccgaagacata240
acaacgatggcggacgattcaggtacagaaaatgaggggtctgggtgtacaggatggttt300
atggtagaagcta313
<210>36
<211>47
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>36
aggctttggtatgggtctcggtggtgcacagaactatccactgctga47
<210>37
<211>43
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>37
ggcaccacagaaacgcagaagacactgagtcgcactcgcttgg43
<210>38
<211>21
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>38
ggcgtgtagctgtgtagcaat21
<210>39
<211>46
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>39
aggctttggtatgggtctcggtggtggcgtgtagctgtgtagcaat46
<210>40
<211>22
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>40
aatcacaaacgacttcgagggg22
<210>41
<211>46
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>41
ggcaccacagaaacgcagaagacaaatcacaaacgacttcgagggg46
<210>42
<211>30
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>42
gtaattgtttgtcctgaatctgtatttagc30
<210>43
<211>19
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>43
gtcaacactgtccacggca19
<210>44
<211>59
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>1
<223>连接到fam基团
<400>44
cacagccactccgcagggtccacgcacgatcgcacctgggcgtgtagctgtgtagcaat59
<210>45
<211>57
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>45
ttttttttttaggctttggtatgggtctcggtggtgcacagaactatccactgctga57
<210>46
<211>271
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>46
tatgggaagtgcatgtgggtggtcaggtaattgtttgtcctgaatctgtatttagcagca60
cagaactatccactgctgaaattgctacacagctacacgcctacaacaccaccgagaccc120
ataccaaagcctgctccgtgggcaccacagaaacccagaagacaaatcacaaacgacttc180
gagggggtaccgagctcccctacaaccccaccaagcgagtgcgactcagtgccgtggaca240
gtgttgacagaggggtctactctacatctga271
<210>47
<211>30
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>47
tggttgtgcagtgtacagaaacagacatca30
<210>48
<211>27
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>1
<223>连接到fam基团
<400>48
cacagccactccgcagggtccacgctt27
<210>49
<211>14
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>49
cacagccactccgc14
<210>50
<211>44
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>50
agggtccacgcacgatcgcacctgtcgcacggttggacgcactc44
<210>51
<211>52
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>51
cacaggtagggcacacaatattcactgcaacagtacagcaagtcacctacga52
<210>52
<211>51
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>52
aacatcatctacaatggccgatcctgagactgcttctacctcaaaccaacc51
<210>53
<211>25
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>53
tgcccataagtagttgctgtatggt25
<210>54
<211>20
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>54
gtacaaatggggctgggatg20
<210>55
<211>23
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>55
cacttgtaacaccacagttcgtt23
<210>56
<211>30
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>56
tctgaaatattatctcctgttcttctctct30
<210>57
<211>58
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>1
<223>连接到fam基团
<400>57
cacagccactccgcagggtccacgcacgatcgcacctggtacaaatggggctgggatg58
<210>58
<211>64
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>58
gagtgcgtccaaccgtgcgacaggtgcgatcgtgcgtggaccctgtacaaatggggctgg60
gatg64
<210>59
<211>231
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>59
cacttgtaacaccacagttcgtttatgtgtcaacagtacagcaagtgacctacgaaccat60
acagcaactacttatgggcacagtgaatattgtgtgccctacctgtgcacaacaataaac120
atcatctacaatggccgatcctgaaggtacaaatggggctgggatggggtgtactggttg180
gtttgaggtagaagcagtcatagagagaagaacaggagataatatttcaga231
<210>60
<211>63
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>60
agcctgagtgcgtccaaccgtgcgacaggtgcgatcgtgcgtggaccctgcggagtggct60
gtg63
<210>61
<211>27
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>61
cacagccactccgcagggtccacgctt27
<210>62
<211>5
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>1
<223>连接到fam基团
<400>62
gcgga5
<210>63
<211>91
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>88
<223>连接到fam基团
<400>63
ccacgagtgccagtgcgtccaacgcgtcgacaggtgcgatcgtgatctctcgttatgcgg60
agtggctgtgatccgcataacgagagatctt91
<210>64
<211>12
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>64
cagccactccgc12
<210>65
<211>37
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>65
ataacgagagatcacgatcgcacctgtcgacgcgttg37
<210>66
<211>89
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>1
<223>连接到fam基团
<400>66
gcgtggaccctgcggagtggctgtgatcactccctccaaccctcccacacctcccatcct60
ccctccaccctgagctacacatctagctc89
<210>67
<211>25
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>25
<223>attachedtobhqgroup
<400>67
cacagccactccgcagggtccacgc25
<210>68
<211>42
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>68
gagctagatgtgtagctcagggtggagggaggatgggagttt42
<210>69
<211>44
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>69
agggtggagggaggatgggaggtgtgggagggttggagggattt44
<210>70
<211>66
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>1
<223>连接到fam基团
<400>70
gcgtggaccctgcggagtggctgtgatgcatgcacgatcgcacctgtcgcacgagtcctc60
ccaacc66
<210>71
<211>42
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>71
gcatgcacgatcgcacctgtcgcacggttgggaggactctat42
<210>72
<211>85
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>1
<223>连接到fam基团
<400>72
gcgtggaccctgcggagtggctgtgatgccgagagtcctcccaaccgtctgtagcgagac60
atatgtcgcacgtctcgcatcccac85
<210>73
<211>38
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>38
<223>连接到3phos基团
<400>73
gtcgcacgtgggaacagacggttgggaggactctcggc38
<210>74
<211>63
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>63
<223>连接到bhq基团
<400>74
agcctgagtgcgtccaaccgtgcgacaggtgcgatcgtgcgtggaccctgcggagtggct60
gtg63
<210>75
<211>51
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>75
cgagaagggtccacgcacgatcgcacctgtcgcacggttggacgcactcga51
<210>76
<211>114
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>114
<223>连接到fam基团
<400>76
gagagtgcgtccaaccgtgcgacaggtgcgatcgtgcgtggacccttctcgtttttgagt60
gcgtccaaccgtgcgacaggtgcgatcgtgcgtggaccctgcggagtggctgtc114
<210>77
<211>31
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>1
<223>连接到bhq基团
<400>77
gacagccactccgcagggtccacgcacgttt31
<210>78
<211>24
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>78
acgatcgcacctgtcgcacgtttt24
<210>79
<211>12
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>79
cagccactccgc12
<210>80
<211>12
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>80
gtccacgcacga12
<210>81
<211>32
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>81
gcacctgtcgcacggttggacgcactcaggct32
<210>82
<211>57
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>57
<223>连接到bhq基团
<400>82
gagtgcgtccaaccgtgcgacaggtgcgatcgtgcgtggaccctcccacccaccctc57
<210>83
<211>30
<212>dna
<213>人工序列
<220>
<223>合成构建体
<220>
<221>misc_feature
<222>1
<223>连接到fam基团
<400>83
gagggtgggtgggagggtccacgcacgtaa30
<210>84
<211>13
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>84
gggagggtgggtg13
<210>85
<211>14
<212>dna
<213>人工序列
<220>
<223>合成构建体
<400>85
cacagccactccgc14
<210>86
<211>400
<212>dna
<213>人乳头瘤病毒(humanpapillomavirus)
<400>86
aatatgggaacacaggtacgtgggaagtacattttgggaataatgtaattgattgtaatg60
actctatgtgcagtaccagtgacgacacggtatccgctactcagcttgttaaacagctac120
agcacaccccctcaccgtattccagcaccgtgtccgtgggcaccgcaaagacctacggcc180
agacgtcggctgctacacgacctggacactgtggactcgcggagaagcagcattgtggac240
ctgtcaacccacttctcggtgcagctacacctacaggcaacaacaaaagacggaaactct300
gtagtggtaacactacgcctataatacatttaaaaggtgacagaaacagtttaaaatgtt360
tacggtacagattgcgaaaacatagcgaccactatagaga400
- 还没有人留言评论。精彩留言会获得点赞!