一种含胆酸的高分子材料及其修饰的脂质体的制作方法
技术领域
本发明涉及一种含胆酸高分子材料及其修饰的脂质体,属于药物制剂学领域。
背景技术:
对于肝炎等慢性疾病,长期注射用药会给病人带来很多痛苦,口服给药方便,具有更好的顺应性等诸多优点,而口服给药后往往不能将药物有效地输送至肝脏病变部位,要想达到应有的疗效,加之肝脏本身对药物有耐受能力,药物剂量小时作用甚微;大剂量用药无疑会严重伤害其他脏器导致器官衰竭。口服肝靶向给药系统可以将药物有效地输送至肝脏的病变部位,同时减少其全身分布,提高药物的治疗指数和减少不良反应,对肝脏疾病的治疗具有积极的推动作用。因此,开发口服肝靶向性药物制剂在当前有重要意义。
载药脂质体是一种可实现靶向给药的重要方式。脂质体可保护药物分子,通过在脂质体的表面修饰含有特殊官能团的材料,可以借助细胞表面的受体-配体作用,将纳米颗粒靶向到特定的细胞。
胆酸分子在人体肝肠之间循环,促进脂类物质的消化和吸收。人体胆酸总量在3~5g,每日循环6~10次,这样每日总循环量为20~30g,因此肝细胞表面的胆酸转运蛋白表达量大,对胆酸分子作用强;另一方面在人体内脏中,仅有肝脏组织表达有胆酸转运蛋白,因此胆酸分子与胆酸转运蛋白有极强的组织特异性。这种相互作用力强、特异性好的胆酸-胆酸转运蛋白体系,可作为肝细胞靶向药物递送的手段。
国内外学者以胆酸为肝靶向基团开发了多种肝靶向纳米给药系统(袁直,查瑞涛,杜田,等.纳米肝靶向生物降解药物载体材料的制备方法[P].2006,CN1743008A;蒋国强,唐世福,于洋,等.一种含胆酸的高分子材料及其修饰的肝靶向给药纳米粒[P].2012,CN102351967A)。此纳米材料不如脂质体双分子层结构生物相容性强,体内降解情况不清楚。有学者合成了胆酸盐-PEG2000-胆酸盐,并修饰脂质体,配基物理吸附在脂质体上,不能与脂质体形成稳定的结构,经口服后可能结构被破坏(Zhi-Peng Chen,Jia-Bi Zhu,Hong-Xuan Chen,et al.Synthesis of a novel polymer bile salts-(polyethylene glycol)2000-bile salts and its application to the liver-selective targeting of liposomal DDB[J].Drug Development and Industrial Pharmacy,2010;36(6):657–665)。
中国发明专利CN 103784965A和中国发明专利CN 103735504A均采用胆酸修饰的高分子材料作为靶向肿瘤靶头制备纳米乳,利用该材料作为增强肿瘤靶向富集作用的配基,而并未提及其作为肝脏靶向配基的可能。另外,纳米乳含有大量助表面活性剂乙醇和丙二醇,刺激性大,储存稳定性差。
目前合成口服肝靶向材料,制备成具有口服主动肝靶向的脂质体给药系统技术尚未见相关文献报道。
技术实现要素:
本发明的目的在于克服现有技术存在的上述不足,基于胆酸-胆酸转运蛋白相互作用,提供一种含有胆酸分子的高分子材料及其制备方法,并用其修饰载药脂质体,得到一种胆酸衍生物修饰的药物脂质体及其制备方法,得到具有口服肝靶向性能的脂质体给药系统。
本发明的目的是通过如下技术方案实现的:
一种含有胆酸分子的高分子材料,其结构式如式I所示:
所述高分子材料的制备方法包括如下步骤:
步骤a,将胆酸溶解于N,N-二甲基甲酰胺(DMF)中,室温下反应;
步骤b,将二硬脂酰磷脂酰乙醇胺-氨基聚乙二醇(DSPE-PEG2000-NH2)溶于有机溶剂中,再加入至DMF液中,室温下反应;
步骤c,加水终止反应,纯化得到含胆酸分子的高分子材料。
进一步,所述胆酸与DSPE-PEG2000-NH2的质量比为1:1~10;更进一步,为1:3~5。
进一步,为推进步骤a反应进行,可加入催化剂,所述催化剂选自2-(7-偶氮苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯(HATU)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC.HCL)、1-羟基苯并三唑(HOBT)或4-二甲氨基吡啶(DMAP)中的任意一种或几种。更进一步,所述催化剂为EDC.HCL、HOBT和DMAP。
进一步,为推进步骤b反应进行,可加入催化剂,所述催化剂为三乙胺。
进一步,步骤b所述有机溶剂为二氯甲烷、三氯甲烷、丙酮、乙酸乙酯中的任意一种。
进一步,所述纯化方法可采用本领域常规方法,包括萃取、凝胶柱色谱、透析等。
本发明提供一种胆酸高分子材料修饰的脂质体,其原料主要包括载体、药物、修饰材料,其特征在于,所述脂质体载体主要包括磷脂和胆固醇,修饰材料为式I化合物,将药物包载于磷脂双分子层中。
进一步,所述磷脂的浓度为1~20mg/mL;更进一步,为5~10mg/mL;更进一步,为8~10mg/mL。
进一步,所述磷脂与胆固醇的质量比为3~10:1;更进一步为5~10:1;更进一步为8~10:1;更进一步为10:1。
进一步,所述药物与磷脂的质量比为1:5~100;更进一步,药物与磷脂的质量比为1:5~20;更进一步为1:8~15;更进一步为1:8~10。
进一步,所述式I化合物与磷脂的质量比为1:10~50;更进一步,式I化合物与磷脂的质量比为1:15~30;更进一步,式I化合物与磷脂的质量比为1:20。
所述药物选自水飞蓟宾、姜黄素、槲皮素、黄芩苷、葫芦素、鬼臼毒素、齐墩果酸、斑蝥素、羟基喜树碱等脂溶性药物。
上述脂质体采用乙醇注入法制备,具体包括如下步骤:
步骤a,制备水相;
步骤b,将药物、磷脂、胆固醇、式I化合物溶解于无水乙醇中,形成油相;
步骤c,将油相滴加至水相中,形成水油均匀的分散乳液;
步骤d,将步骤c得到的分散乳液去除乙醇后进行超声分散,即得到脂质体。
进一步,步骤a所述水相与步骤b所述油相体积比为1∶1~5;
进一步,步骤b所述磷脂的浓度为1~20mg/mL;更进一步,为5~10mg/mL;更进一步,为8~10mg/mL。
进一步,步骤b所述磷脂与胆固醇的质量比为3~10:1;更进一步为5~10:1;更进一步为8~10:1;更进一步为10:1。
进一步,所述药物与磷脂的质量比为1:5~100;更进一步,药物与磷脂的质量比为1:5~20;更进一步为1:8~15;更进一步为1:8~10。
进一步,所述式I化合物与磷脂的质量比为1:10~50;更进一步,式I化合物与磷脂的质量比为1:15~30;更进一步,式I化合物与磷脂的质量比为1:20。
进一步,所述的脂质体给药系统的粒径为50~400nm。
进一步,在形成脂质体后,加入冻干保护剂,所述冻干保护剂选自葡萄糖-甘露醇或蔗糖;更进一步优选为蔗糖。
本发明的优点和有益效果:
1、本发明制备了兼具主动靶向和被动靶向双重功效的胆酸修饰的复合给药系统。
2、本发明实现了将胆酸分子C24位羧基枝接到聚合物主链上而不影响胆酸转运蛋白对其中胆酸分子结构的识别。合成过程的原理和操作简单。本发明的材料具有两亲性,便于修饰在脂质体磷脂双分子层中。材料有很好的生物相容性,结合其能靶向到肝脏的特殊功能,是一种理想的肝靶向纳米载药系统的修饰材料。
3、本发明材料中的亲水性聚乙二醇的修饰可有效避免与细胞和蛋白的非特异性吸附。
4、此脂质体给药系统的制备方法简单实用,易于放大生产,体内实验显示胆酸修饰的脂质体对肝脏具有较强的靶向能力具有良好的应用前景。
附图说明
图1是胆酸高分子材料定性鉴别薄层色谱图。
图A显色剂为磷钼酸,1为胆酸,2、3、4为合成产物;
图B显色剂为碘蒸气,1为胆酸,2为DSPE-PEG2000-NH2,3为合成产物;
图C显色剂为茚三酮,1为胆酸,2为DSPE-PEG2000-NH2,3、4为合成产物。
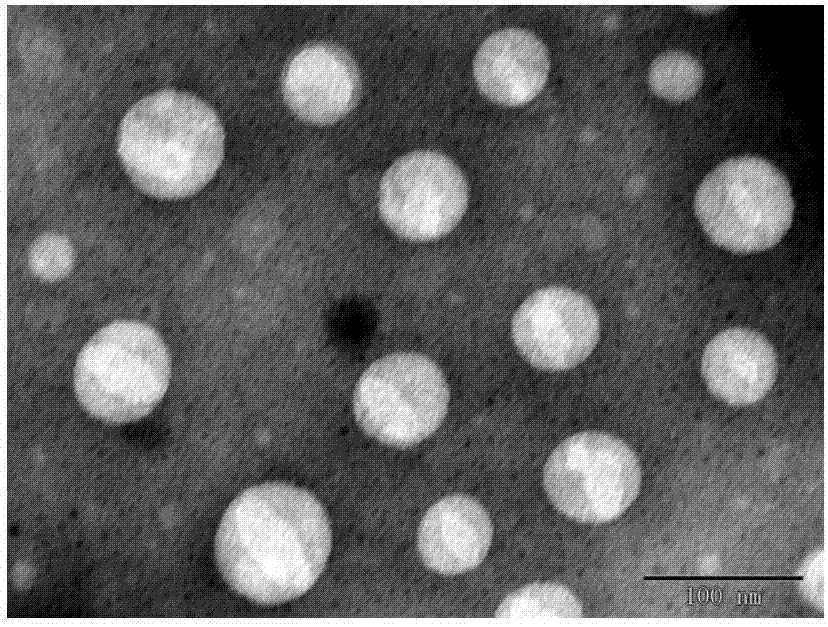
图2是脂质体透射电镜图。
图3是水飞蓟宾不同制剂在pH2条件下体外释放结果。
图4是水飞蓟宾不同制剂在pH7.4条件下体外释放结果。
具体实施方式
实施例1胆酸高分子材料的合成
称取25mg胆酸溶解于4mL N,N-二甲基甲酰胺(DMF)中,加入14mg 1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC.HCL)、10mg 1-羟基苯并三唑(HOBT)以及0.37mg 4-二甲氨基吡啶(DMAP),室温下反应1h。称取90mgDSPE-PEG2000-NH2溶于4mL二氯甲烷(DCM)中,将DCM液慢速加入至DMF液中,室温下反应48h。将反应体系中加水终止反应。
实施例2胆酸高分子材料的合成
称取8.7mg胆酸溶解于3mL N,N-二甲基甲酰胺(DMF)中,加入12.2436mg 2-(7-偶氮苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯(HATU),称取40mg DSPE-PEG2000-NH2和三乙胺6.5mg,溶于3mL二氯甲烷(DCM)中,将DCM液慢速加入至DMF液中,室温下反应30min。将反应体系中加水终止反应。
实施例3胆酸高分子材料的合成
称取25mg胆酸溶解于4mL N,N-二甲基甲酰胺(DMF)中,加入14mg 1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC.HCL)、8.4mg N-羟基琥珀酰亚胺(NHS),室温下反应4h。称取90mgDSPE-PEG2000-NH2溶于4mL二氯甲烷(DCM)中,将DCM液慢速加入至DMF液中,室温下反应48h。将反应体系中加水终止反应。
实施例4胆酸高分子材料的合成
称取45mg胆酸溶解于4mL N,N-二甲基甲酰胺(DMF)中,加入14mg 1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC.HCL)、10mg 1-羟基苯并三唑(HOBT)以及0.37mg 4-二甲氨基吡啶(DMAP),室温下反应1h。称取90mgDSPE-PEG2000-NH2溶于4mL三氯甲烷中,将DCM液慢速加入至DMF液中,室温下反应48h。将反应体系中加水终止反应。
实施例5胆酸高分子材料的纯化
分别取实施例1~3制备的产物,用DCM萃取;萃取液倒入5%NaHCO3溶液(100mL×3次)中去除多余的胆酸;然后DCM层用水(100mL×2次)、0.1mol/L盐酸(100mL×2次)、水(100mL×2次)、饱和食盐水(100mL×2次)依次洗涤,无水硫酸钠干燥,过滤、减压回收溶剂。甲醇溶解,上凝胶柱sephdex LH-20。冷冻干燥得到白色固体。
实施例1~3经纯化后最终产率分别为70%、60%、30%。
实施例6胆酸高分子材料的纯化
分别取实施例1~3制备的产物,用DCM萃取;萃取液倒入5%NaHCO3溶液(100mL×3次)中去除多余的胆酸。然后DCM层用水(100mL×2次)、0.1mol/L盐酸(100mL×2次)、水(100mL×2次)、饱和食盐水(100mL×2次)依次洗涤,无水硫酸钠干燥,过滤、减压回收溶剂。所得固体物用DMF溶剂溶解,截留分子量为1000透析袋透析48h。冷冻干燥得到白色固体。
实施例7水飞蓟宾脂质体的制备
将水飞蓟宾4mg、大豆磷脂40mg、胆固醇4mg、胆酸高分子材料2mg溶解于无水乙醇中,磷脂浓度为10mg/ml,形成油相,在50℃,磁力搅拌800r/min下将油相缓慢滴加至含吐温80的水相中,水相与油相体积比为1∶5;滴完后继续搅拌去除乙醇;待乙醇完全挥干后,用超声仪进行超声分散,即得到脂质体。粒径为147nm,载药量为8.33%。
实施例8水飞蓟宾脂质体的制备
将水飞蓟宾3mg、大豆磷脂40mg、胆固醇8mg、胆酸高分子材料2mg溶解于无水乙醇中,磷脂浓度为5mg/ml,形成油相,在50℃,磁力搅拌800r/min下将油相缓慢滴加至含吐温80的水相中,水相与油相体积比为1∶1;滴完后继续搅拌去除乙醇;待乙醇完全挥干后,用超声仪进行超声分散,即得到脂质体。粒径为170.4nm,载药量为5.88%。
实施例9水飞蓟宾脂质体的制备
将水飞蓟宾3.5mg、大豆磷脂40mg、胆固醇10mg、胆酸高分子材料2mg溶解于无水乙醇中,磷脂浓度为8mg/ml,形成油相,在50℃,磁力搅拌800r/min下将油相缓慢滴加至含吐温80的水相中,水相与油相体积比为1∶2;滴完后继续搅拌去除乙醇;待乙醇完全挥干后,用超声仪进行超声分散,即得到脂质体。粒径为163.0nm,载药量为6.54%。
实施例10姜黄素脂质体制备
将姜黄素3.5mg、大豆磷脂40mg、胆固醇6.7mg、胆酸高分子材料2mg溶解于无水乙醇中,磷脂浓度为20mg/ml,形成油相,在50℃,磁力搅拌800r/min下将油相缓慢滴加至含吐温80的水相中,水相与油相体积比为1∶2;滴完后继续搅拌去除乙醇;待乙醇完全挥干后,用超声仪进行超声分散,即得到脂质体。粒径为113.9nm,PDI=0.260,载药量为6.7%。
实施例11斑蝥素脂质体制备
将斑蝥素3.5mg、大豆磷脂40mg、胆固醇6.7mg、胆酸高分子材料2mg溶解于无水乙醇中,磷脂浓度为20mg/ml,形成油相,在50℃,磁力搅拌800r/min下将油相缓慢滴加至含吐温80的水相中,水相与油相体积比为1∶2;滴完后继续搅拌去除乙醇;待乙醇完全挥干后,用超声仪进行超声分散,即得到脂质体。粒径为61.68nm,PDI=0.239,载药量为6.7%。
实施例12槲皮素脂质体制备
将槲皮素4mg、大豆磷脂40mg、胆固醇8mg、胆酸高分子材料2mg溶解于无水乙醇中,磷脂浓度为20mg/ml,形成油相,在50℃,磁力搅拌800r/min下将油相缓慢滴加至含吐温80的水相中,水相与油相体积比为1∶2;滴完后继续搅拌去除乙醇;待乙醇完全挥干后,用超声仪进行超声分散,即得到脂质体。粒径为133.2nm,PDI=0.289,载药量为7.4%。实施例13齐墩果酸脂质体制备
将齐墩果酸2mg、大豆磷脂40mg、胆固醇10mg、胆酸高分子材料2mg溶解于无水乙醇中,磷脂浓度为20mg/ml,形成油相,在50℃,磁力搅拌800r/min下将油相缓慢滴加至含吐温80的水相中,水相与油相体积比为1∶2;滴完后继续搅拌去除乙醇;待乙醇完全挥干后,用超声仪进行超声分散,即得到脂质体。粒径为135.6nm,PDI=0.213,载药量为3.7%。
实施例14 10-羟基喜树碱脂质体制备
将10-羟基喜树碱0.5mg、大豆磷脂40mg、胆固醇10mg、胆酸高分子材料2mg溶解于无水乙醇中,磷脂浓度为20mg/ml,形成油相,在50℃,磁力搅拌800r/min下将油相缓慢滴加至含吐温80的水相中,水相与油相体积比为1∶2;滴完后继续搅拌去除乙醇;待乙醇完全挥干后,用超声仪进行超声分散,即得到脂质体。粒径为150.4nm,PDI=0.272,载药量为1%。
实施例15白藜芦醇脂质体制备
将白藜芦醇4mg、大豆磷脂40mg、胆固醇6.7mg、胆酸高分子材料2mg溶解于无水乙醇中,磷脂浓度为20mg/ml,形成油相,在50℃,磁力搅拌800r/min下将油相缓慢滴加至含吐温80的水相中,水相与油相体积比为1∶2;滴完后继续搅拌去除乙醇;待乙醇完全挥干后,用超声仪进行超声分散,即得到脂质体。粒径为114.6nm,PDI=0.253,载药量为7.59%。
实施例16
取实施例7制备的脂质体,按照蔗糖:磷脂=3:1的比例加入蔗糖,冷冻干燥。复溶后粒径为125.4nm,PDI=0.269。
实施例17
取实施例8制备的脂质体,按照葡萄糖-甘露醇(3:1):磷脂=5:1的比例加入葡萄糖-甘露醇,冷冻干燥。复溶后粒径为153.7nm,PDI=0.344。
实施例18
在实施例7制备脂质体过程中,在水相中加入冻干保护剂蔗糖,所述冻干保护剂蔗糖与磷脂的比例为3:1。冷冻干燥复溶后粒径为108.5nm,PDI=0.2。
实施例19胆酸高分子材料的鉴定
将实施例1制备的产物按实施例5纯化后所得白色固体按如下方法进行鉴定:
1薄层检测
将产物溶于二氯甲烷中,展开剂:二氯甲烷:甲醇:水:冰醋酸(3:1:0.5:0.05),显色剂:①5%磷钼酸(可使胆酸和产物显色);②碘蒸汽(可使胆酸、DSPE-PEG2000-NH2和产物均显色);③茚三酮(可使DSPE-PEG2000-NH2显色)。
结果:见图1。其中,图A为磷钼酸显色结果,磷钼酸可使胆酸和式I化合物显色,由图可见,合成产物中有式I化合物产生;
图B为碘蒸气显色结果,碘蒸气可使原料胆酸、DSPE-PEG2000-NH2和式I化合物均显色,由图可见,合成产物中不含有原料胆酸和DSPE-PEG2000-NH2;
图C为茚三酮显色结果,茚三酮可使原料DSPE-PEG2000-NH2的游离-NH2显色,由图可见,合成产物不显色,说明游离-NH2与胆酸C24位的-COOH发生了反应,形成了酰胺键,图C表明最终合成了式I所示的胆酸高分子材料,且胆酸分子是通过C24位羧基枝接到聚合物主链上的。
2 1H-NMR表征
称取一定量合成产物,以氘代三氯甲烷为溶剂,进行1H-NMR(600MHz)分析。
从1H-NMR图中看出,δ(ppm)4.457-4.437(t,2H)为DSPE-PEG2000-NH2上的亚甲基,δ(ppm)0.715(s)为胆酸上CH3,说明均有胆酸和DSPE-PEG2000-NH2特征峰,胆酸峰面积为亚甲基1.10倍,说明合成产物纯度大概为:2×1.10÷3×100%=73%。
3红外光谱测定
IR(v,cm-1):3434.98vs(v,-OH);3479.34vs(v,-OH);3507.31vs(v,胺基-NH-C=O);2918.10vs,2872.77vs,2850.59vs(v,Alkyl);1738.71s(v,O=C-O);1651.92s,1344.29s(v,羰基O=C-NH);1459.05,1467.73s(δ,Alkyl);111.89s(v,C-O);952.77,842.83(r,Alkyl)
无-COOH特征吸收峰(s,2500-3500cm-1),有酰胺键特征峰,说明-COOH与-NH2形成了酰胺键。
4MALDI TOF质谱表征
固体氮激光发射波长为355nm,整个实验所用基质为a-氰基-4-羟基肉桂酸在四氢呋喃中的饱和溶液,DSPE-PEG2000-NH2和产物样品溶解在氯仿中配成10mg/mL的浓度备用,反射器模式为正离子模式,加速电压为20KV。
原材料及产物MALDI-TOF质谱分析,适用于多分散性聚合物的组成进行分析,由于原材料MALDI的平均分子量为2986,合成物MALDI的平均分子量为3348,所以原材料的合成是成功的。
综合以上鉴定结果,表明合成反应最终生成了式I化合物,且胆酸分子是通过C24位的-COOH与DSPE-PEG2000-NH2分子中的-NH2形成酰胺键枝接到聚合物主链上的。
实施例20胆酸高分子材料的安全性评价
取实施例1合成的产物按实施例5进行纯化得到的胆酸高分子材料(DSPE-PEG-胆酸)进行如下实验。
取对数生长期细胞,0.25%胰蛋白酶消化后轻轻吹打成单细胞悬液,调整细胞浓度为5×104个/mL,接种于96孔板中,每孔200μL,共接种2块培养板,置于37℃,5%CO2,饱和湿度培养箱中培养,待细胞贴壁后,弃去原培养液,加入不同物质,分组情况如下:空白对照孔,不接种细胞,只加含DMSO的培养液、MTT溶液;溶剂对照孔:接种细胞,加含DMSO的培养液、MTT溶液;试验组,接种细胞,加入含DSPE-PEG-胆酸浓度为5、10、25、40、55、70、85、100μg/mL培养液200μL,每组设6个复孔,培养24h后,弃去培养基,加入200uL培养基,20μLMTT(5mg/mL)培养4h,吸出上清液,每孔加150μLDMSO,使细胞内产生的紫色结晶充分溶解,用酶标仪在波长570nm处测OD值,计算细胞存活率。
实验结果表明,材料在浓度低于85μg/mL时,对结肠癌细胞Caco-2和人肝癌细胞HepG-2 24小时均无毒性作用。
表1合成材料安全性评价结果(n=6)
实施例21脂质体粒径测定及透射电镜观察形态
本实施例所用脂质体为实施例7制备的脂质体
1粒径测定
取脂质体液体,用马尔文Nano-ZS粒度仪测定25℃条件下的粒径分布,平行3次,每次12个循环。平均粒径为147nm,PDI=0.27。
2透射电镜
制备1mg/mL水飞蓟宾浓度的脂质体液体,稀释1000倍,吸取6μL滴到300目的铜网上,空气中自然晾干,后用2%磷钨酸染色10min,透射电镜下观察粒子形态。见图2。
从电镜可以看出,该制剂具有双分子层结构,说明形成的制剂为脂质体。实施例22制剂人工胃液、人工肠液、大鼠血浆中稳定性考察
本实施例所用“修饰脂质体”为实施例7制备的脂质体;“普通脂质体”处方中缺少靶向材料(胆酸高分子材料),其余与实施例7脂质体制备方法相同。
1水飞蓟宾在pH2及7.4条件下的稳定性
配制3%SDS溶液,分别调节pH为2和7.4,取适量水飞蓟宾原料药于上述溶液中,用0.45μm水系滤膜过滤,滤液放置37℃水浴中,分别于0、1、2、3、4、5、6、12、24h条件下测定含量,计算RSD值,pH2条件下24h稳定性RSD为1.45%,pH7.4条件下24小时稳定性RSD为3.35%。
结果表明,水飞蓟宾在pH2及7.4条件下24小时稳定性良好。
2脂质体在人工胃液、人工肠液、大鼠血浆中稳定性考察
人工胃液:取稀盐酸16.4mL,加水约800mL与胃蛋白酶10g,摇匀后,加水称释成1000ml即得。其中,稀盐酸是1mol/L盐酸。
人工肠液:取磷酸二氢钾6.8g加水500mL。用0.4%的氢氧化钠溶液调节pH至6.8;另取胰酶10g加水适量使溶解,将两液混合后,加水定容至1000mL即可。
将脂质体混悬液加入到等体积人工胃液中37℃条件下培养2h,然后再加入到人工肠液中37℃条件下培养6h。分别在人工胃液中0h、0.5h、1h、1.5h、2h和人工肠液中0h、1h、2h、4h、6h以及大鼠血浆中2h、4h、8h、12h取样测定粒径,并测定包封率。
结果见表2-4。结果表明,两种脂质体在人工胃液、人工肠液和大鼠血浆条件下,其粒径和包封率均无显著性变化。
表2人工胃液中稳定性结果(n=2)
表3人工肠液中稳定性结果(n=2)
表4大鼠血浆中稳定性结果(n=2)
注:表2-4中“-”为未进行测定
3脂质体体外释放考察
3.1水飞蓟宾在3%SDS溶液中平衡溶解度
取过量水飞蓟宾于10mL3%SDS水溶液中,超声30min,取样,进行含量测定,进样10μL,于37℃水溶条件下往复频率100rpm,24h后取样,0.45μm微孔滤膜过滤,进样10μL。
实验结果:超声30min后水飞蓟宾浓度为84.00ug/mL,平衡溶解24h后浓度为107.48μg/mL。
故将含1mg水飞蓟宾脂质体在100mL3%SDS释放液中进行体外释放考察,符合漏槽条件。
3.2体外释放考察
分别吸取1ml水飞蓟宾原料药和修饰脂质体置于处理过的透析袋中,封口,将其置于100ml含3%十二烷基硫酸钠的PBS溶液中,分别调节pH为2和7.4,于37℃100rpm磁力搅拌下透析,每次取1mL,补足1mL。取样点0.5,1,2,4,6,8,12,24,测定累积释放百分率。
结果见表5-6,图3-4。结果表明:水飞蓟宾原料药体外释放较快,4h基本释放完全,而修饰脂质体在pH=2和7.4条件下缓慢释放,说明该制剂在胃肠道中稳定性较好,更有利于药物以完整制剂形式靶向于肝脏。
表5水飞蓟宾不同制剂在pH2条件下体外释放结果(n=3)
表6水飞蓟宾不同制剂在pH7.4条件下体外释放结果(n=3)
实施例23胆酸高分子材料修饰的水飞蓟宾载药脂质体的体内分布实验的研究
1小鼠血浆样品中水飞蓟宾分析方法的建立
1.1色谱条件
色谱柱:C18色谱柱(Kromasil,250×4.6mm,5μm);流动相:甲醇-1%醋酸水(48:52);检测波长:287nm;流速:1.0mL·min-1;柱温:30℃。
1.2小鼠血浆样品的提取与分离
吸取小鼠血浆100μL,加入100μL1mol/L磷酸氢二钠1mL,涡旋1min,加入1mL乙醚萃取,漩涡混合器振荡3min,10000r·min-1高速离心10min,吸取上清液,共萃取两次,合并上清液,N2吹干,100uL流动相复溶,40μL进样。
1.3色谱行为
取空白小鼠血浆、加入水飞蓟宾对照品的小鼠血浆和口服水飞蓟宾后的小鼠血浆,按“1.2”项下处理,进样分析,结果表明,小鼠血浆中杂质不干扰水飞蓟宾样品的测定。
1.4小鼠血浆样品标准曲线的制备
精密称取4.26mg水飞蓟宾对照品于25mL量瓶中,甲醇溶解并稀释至刻度,得浓度为170.4μg/mL储备液。取上述储备液,用甲醇分别稀释成浓度为0.6656、1.33125、2.6625、5.325、10.65、21.3、42.6、85.2μg/mL溶液,各取10μL加入空白1.5mL离心管中,加入小鼠空白血浆100μL,涡旋混合30s,按“1.2”项下处理,进样分析。按以水飞蓟宾浓度C(μg/mL)为横坐标,以水飞蓟宾峰面积A为纵坐标,进行线性回归,回归方程为Y=120362–2960.8,r=0.9991。表明小鼠血浆中水飞蓟宾浓度在0.066~8.52μg/mL线性关系良好,峰面积与血浆药物浓度呈良好的线性关系。
1.5回收率
方法回收率:取水飞蓟宾对照品溶液10μL置1.5mL离心管中,加入空白小鼠血浆100μL,使血浆中水飞蓟宾浓度分别为0.26625、2.13、8.52ug/mL,加入1mL乙醚萃取。按“1.2”项下处理,进样分析。代入标准曲线计算测得的血浆含药量,与理论值进行比较,计算方法回收率,结果见表7。方法回收率符合药动学实验要求。
表7血浆样品方法回收率测定结果(n=3)
萃取回收率:取水飞蓟宾对照品溶液10μL置1.5mL离心管中,加入空白小鼠血浆100μL,使血浆中水飞蓟宾浓度分别为0.26625、2.13、8.52ug/mL。按“1.2”项下处理,进样分析。另以蒸馏水替代空白血浆进行前述样品的制备,进样分析。将所得各浓度的血浆样品峰面积与蒸馏水样品峰面积进行比较,计算萃取回收率,结果见表8。萃取回收率符合药动学实验要求。
表8血浆样品萃取回收率测定结果(n=3)
1.6精密度
取水飞蓟宾对照品溶液10μL置1.5mL离心管中,空气吹干,加入空白小鼠血浆100μL,使血浆中水飞蓟宾浓度分别为0.26625、2.13、8.52ug/mL。每个浓度配制5份样品,按“1.2”项下处理。将相同浓度水平的制得样品混合。每个浓度于早、中、晚及第二天、第三天分别进样,所得峰面积代入标准曲线计算药物浓度并进行比较,计算日内精密度和日间精密度,结果见表9-10。精密度符合药动学实验要求。
表9日内精密度(n=3)
表10日间精密度(n=3)
1.7基质效应
取空白血浆,按血浆样品处理方法处理后,加入与质控样本等量的各混合对照品溶液(n=3),吹干复溶;另取上述低、中、高浓度的混合对照品溶液,吹干复溶。将两种样品进样,计算峰面积比值。结果如表11所示,表明低、中、高浓度样品的基质效应均符合药动学实验要求。
表11血浆样品基质效应考察结果(n=3)
1.8稳定性
1.8.1含药血浆稳定性:取水飞蓟宾对照品溶液10μL置1.5mL离心管中,空气吹干,加入空白小鼠血浆100μL,使血浆中水飞蓟宾浓度分别为0.26625、2.13、8.52ug/mL,制备含药血浆各5份,混合,室温放置。于0,12,24h分别吸取100μL含药血浆,按“1.2”项下处理,进样分析。所得峰面积代入标准曲线计算浓度,比较不同时间的浓度变化,评价含药血浆的稳定性。结果见表12。含药血浆稳定性符合药动学实验要求。
表12含水飞蓟宾血浆样品稳定性(n=3)
1.8.2冻融稳定性:取水飞蓟宾对照品溶液10μL置1.5mL离心管中,空气吹干,加入空白小鼠血浆100μL,使血浆中水飞蓟宾浓度分别为0.26625、2.13、8.52ug/mL,制备含药血浆各3份,于-20℃冰箱中反复冻融3次后处理,考察反复冻融稳定性。结果见表13。稳定性符合药动学实验要求。
表13血浆样品冻融稳定性考察结果(n=3)
1.9最低检测限
在本实验色谱条件下,最低定量限为66ng/mL(S/N≥3),达到水飞蓟宾体内分析要求。
2小鼠肝脏样品分析方法的建立
2.1色谱条件
色谱条件同“1.1”。
2.2小鼠肝脏样品的提取与分离
小鼠脱颈椎处死后,迅速分离出小鼠肝脏,小心吸干肝脏上的残留血液,称重。按1.5mL/g的比例加入生理盐水,匀浆。取匀浆液1mL,加入1mL1mol/L磷酸氢二钠溶液,涡旋混匀1min,加入2mL乙醚萃取,漩涡混合器振荡3min,12000r·min-1高速离心10min,吸取上清液,萃取两次,合并萃取液,N2吹干,加入0.5mL乙腈沉淀蛋白,涡旋1min,12000r·min-1高速离心10min,吸取上清液,N2吹干,100μL流动相溶液振荡3min,12000r·min-1高速离心10min,取上清液40μL进样。
2.3色谱行为
取空白小鼠肝脏组织匀浆液、加入水飞蓟宾对照品的小鼠肝脏组织匀浆液和口服给药后的小鼠肝脏组织匀浆液,按“2.4.2”项下处理,进样分析,比较三者的色谱图,结果表明小鼠肝脏中杂质不干扰水飞蓟宾样品的测定。
2.4小鼠肝脏样品标准曲线的制备
取空白小鼠肝脏,按1.5mL/g的量加入生理盐水匀浆,即得空白肝脏组织匀浆液。在4mL离心管中分别加入浓度为0.665625、1.33125、2.6625、5.325、10.65、21.3、42.6、85.2μg/mL水飞蓟宾对照品10μL,各加入1mL空白肝脏组织匀浆液,涡旋混合30s,13.3125、26.625、53.25、106.5、213、426、852、1704ng/g,按“2.2”项下处理,进样分析。按肝脏中水飞蓟宾含量C(ng/g)为横坐标,以水飞蓟宾峰面积A为纵坐标,进行线性回归。得到回归方程为A=595.44C-4234.4,r=0.9989。表明小鼠肝脏中水飞蓟宾浓度在13.31~1704ng/g内,峰面积与肝脏中药物浓度呈良好的线性关系。
2.5回收率
方法回收率:取水飞蓟宾对照品溶液置4mL离心管中吹干,加入空白小鼠肝脏组织匀浆液1mL,得到肝脏中药物浓度为53.25、426、1704ng/g肝脏组织匀浆液。按“2.2”项下处理,进样分析。代入标准曲线计算测得的肝脏药含量,与理论值进行比较,计算方法回收率,结果见表14。方法回收率符合肝脏药动力学实验要求。
表14方法回收率结果(n=3)
萃取回收率:取水飞蓟宾对照品溶液10μL置1.5mL离心管中,加入空白小鼠肝脏组织匀浆液1mL,得到肝脏中药物浓度为53.25、426、1704ng/g。按“1.2”项下处理,进样分析。另以蒸馏水替代空白肝脏进行前述样品的制备,进样分析。将所得各浓度的肝脏样品峰面积与蒸馏水样品峰面积进行比较,计算萃取回收率,结果见表15。萃取回收率符合药动学实验要求。
表15萃取回收率结果(n=3)
2.6精密度
取水飞蓟宾对照品溶液10μL置1.5mL离心管中,加入空白小鼠肝脏组织匀浆液1mL,得到肝脏中药物浓度为53.25、426、1704ng/g。每个浓度配制5份样品,按“2.2”项下处理。将相同浓度水平的制得样品混合。每个浓度于早、中、晚分别进样,所得峰面积代入标准曲线计算药物浓度并进行比较,计算日内精密度及日间精密度,结果见表16-17。精密度符合药动学实验要求。
表16日内精密度(n=3)
表17日间精密度(n=3)
2.7基质效应
取空白肝脏组织匀浆液,按肝脏样品处理方法处理后,加入与质控样本等量的各对照品溶液(n=3),吹干复溶;另取上述低、中、高浓度的对照品溶液,吹干复溶。将两种样品进样,计算峰面积比值。结果见表18。如表所示,表明低、中、高浓度样品的基质效应均符合要求。
表18基质效应实验结果(n=3)
2.8稳定性
2.8.1含药肝脏组织匀浆液稳定性
取水飞蓟宾对照品溶液10μL置1.5mL离心管中,加入空白小鼠肝脏组织匀浆液1mL,使肝脏组织匀浆液中水飞蓟宾浓度分别为53.25、426、1704ng/g,制备含药肝脏组织匀浆液各5份,混合,室温放置。于0,12,24h分别吸取1mL含药肝脏组织匀浆液,按“2.2”项下处理,进样分析。所得峰面积代入标准曲线计算浓度,比较不同时间的浓度变化,评价含药肝脏组织匀浆液的稳定性。结果见表19。含药肝脏组织匀浆液稳定性符合药动学实验要求。
表19含有水飞蓟宾肝脏组织匀浆液室温放置稳定性考察(n=3)
2.8.2冻融稳定性
取水飞蓟宾对照品溶液10μL置1.5mL离心管中,加入空白小鼠肝脏组织匀浆液,使肝脏组织匀浆液中水飞蓟宾浓度分别为53.25、426、1704ng/g,制备含药肝脏组织匀浆液各3份,于-20℃冰箱中反复冻融3次后处理,考察反复冻融稳定性。结果见表20。
表20含有水飞蓟宾肝脏组织匀浆液冻融稳定性考察(n=3)
2.9最低检测限
在本实验色谱条件下,最低定量限为13.31ng/g(S/N≥3),达到水飞蓟宾体内分析要求。
3给药
以雄性的体重范围在18-22g的ICR小鼠为动物模型,将小鼠分为3组,每组18只。通过灌胃给予分别相当100mg/kg剂量水飞蓟宾的制剂(分别为水飞蓟宾原料药组,水飞蓟宾普通脂质体组,水飞蓟宾修饰脂质体组),在设定好的时间段,每组取出3只小鼠,眼眶取血后,脱颈处死,取出肝脏,提取血浆及肝脏中的水飞蓟宾,并通过HPLC-UV进行测量,计算血浆和肝脏中水飞蓟宾的含量,并计算靶向指数、选择性指数、靶向效率和相对靶向效率。计算公式如下所示:
DTI(靶向指数)=给予靶向制剂后T时刻I器官的药物量/给予非靶向制剂后T时刻I器官的药物量
DSI(选择性指数)=T时刻靶器官的药物量/T时刻血液或非靶器官的药物量
DTE(靶向效率)=靶器官的药时曲线下面/血液或非靶器官的药时曲线
RTE(相对靶向效率)=给予靶向制剂后,靶器官的药时曲线下面积/给予非靶向制剂后,靶器官的药时曲线下面积
注:水飞蓟宾修饰脂质体采用实施例7制备的脂质体;水飞蓟宾普通脂质体
的处方中缺少胆酸高分子材料,其余与实施例7脂质体制备方法相同。
实验结果见表21。
表21水飞蓟宾及其制剂口服肝靶向参数
实验结果表明:与水飞蓟宾溶液剂和普通脂质体相比,修饰脂质体给药系统的靶向效果明显提高,说明该给药系统不仅具有被动靶向作用,同时具有主动靶向于肝脏作用。
实施例24胆酸高分子材料修饰的水飞蓟宾载药脂质体人肝癌细胞系HepG-2摄取实验
1肝肿瘤细胞对脂质体的摄入
1.1方法学
1.1.1裂解液的配制
取PMSF-SDN(1:100)配成细胞裂解液,备用。
1.1.2对照品溶液的配制
精密称水飞蓟宾85.2μg/mL对照品溶液。临用前用裂解后空白细胞悬液稀释成浓度为0.0852、0.852、3.408μg/mL的对照品溶液。
1.1.3样品测定
取细胞裂解样品,10000r/min离心10min,取上清液40μL进样分析。
1.1.4提取回收率
按“1.1.3”项下的方法,用空白细胞裂解悬液配制含水飞蓟宾为0.0852、0.852、3.408μg/mL的质控样品各3份;同时,用裂解液配制同浓度的样品,分别进样40μL,依法测定并记录峰面积。比较3份细胞裂解样品和裂解液样品中水飞蓟宾的平均峰面积,计算提取回收率。
表22提取回收率
1.1.5精密度
按“1.1.3”项下的方法,用空白细胞裂解悬液配制含水飞蓟宾为0.0852、0.852、3.408μg/mL的质控样品各1份,依法处理并测定,每天早、中、晚各一次,每天一次,连续测定3d。计算RSD,以测得日内、日间精密度。
表23日内精密度
表24日间精密度
1.1.6稳定性
用空白细胞裂解悬液配制水飞蓟宾为0.0852、0.852、3.408μg/mL的质控样品各1份,室温放置0、1、2、4、6、8、12h,计算RSD值。
表25稳定性考察
1.1.7细胞摄取动力学
将HepG2细胞培养于六孔板中,每孔106个细胞,于37℃,5%CO2培养箱中培养24h。更换不含血清的RPMI1640培养基继续培养30min以上,再加入水飞蓟宾溶液,普通脂质体,修饰脂质体,使其终浓度为50μg/mL,继续于培养箱中培养,分别于2h后,移去培养基,4℃冷PBS溶液冲洗两次,终止试验。加入200μL细胞裂解液,放置30min,吸取样品于1.5mL塑料离心管中,10000r/min离心10min,取上清液100μL用HPLC法测定药物含量,剩余100μL用BCA试剂盒测定蛋白含量。每孔样品细胞内药物的浓度除以每孔总蛋白量标准化数据,以μg/μg protein表示。
表26摄取实验结果(n=3)
实验结果表明:与水飞蓟宾溶液剂和普通脂质体相比,修饰脂质体给药系统的体外肝细胞摄取分别提高了7.4和3.2倍,说明该给药系统不仅具有被动靶向作用,同时具有主动靶向于肝癌细胞的作用。
- 还没有人留言评论。精彩留言会获得点赞!