次氯酸根响应性偶酰肼连接键及其应用的制作方法
本发明属于生物医药和疾病诊疗技术领域,具体涉及一种次氯酸根响应性偶酰肼连接键及其应用。
背景技术
活性氧(reactiveoxygenspecies,ros)是细胞在氧气代谢过程中产生的一系列化学活性物质,其共同点是带有孤对电子,寿命短,反应活性高。常见ros包括过氧化氢(h2o2)、氢氧自由基(·oh)、超氧阴离子(o2˙ˉ)、过氧亚硝基阴离子(onooˉ)、单线态氧(1o2)、次氯酸(hocl/oclˉ)和臭氧(o3)等等。ros参与大部分机体生理活动。在组织层面,主要在三个方面扮演着重要角色:先天免疫1、作为第二信使参与细胞信号转导2以及维持细胞和组织微环境氧化还原稳态3。ros还参与多种病理过程,包括机体疲劳4、过度肥胖5、炎症6、免疫过程7、细胞衰老8等;也在许多疾病的发生发展过程中扮演“帮凶”,包括心血管疾病9-11、糖尿病12,13、肾病14,15以及各种癌症16-20。比如,致癌基因kras刺激ros生成,后者进一步促进胰腺导管腺癌前期病变16;i型、ii型糖尿病患者的心脏组织中ros水平升高,造成氧化性损伤,是糖尿病性心肌病的发病源9。
hocl/oclˉ是ros其中一种,在体内主要由髓过氧化物酶与氯离子(clˉ)、h2o2等产生,即mpo-clˉ-h2o2系统。这一系统在多种生理病理活动中扮演着重要角色,例如在免疫过程中帮助机体对抗外来物质(细菌、病毒等)对侵袭,在发炎过程中又会引起组织氧化损伤,在动脉粥样硬化疾病过程中促进动脉粥样硬化斑块的形成。所以,设计各种结构的响应hocl/oclˉ的是一大热点。
目前已发表的文献中,用于识别hocl/oclˉ的结构种类较多。zhou等利用碳碳双键设计了靶向检测线粒体内源性hocl的esipt荧光探针21。peng等同样根据碳碳双键设计了同时监测oclˉ和细胞基质粘度的bodipy类荧光探针22。然而,碳碳双键又被报道可以响应过氧亚硝基(onooˉ)。yu等设计的onooˉ比率型荧光探针23,其识别机理是活化的碳碳双键(与两个芳香环共轭)被onooˉ切断,说明碳碳双键作为hocl识别结构不具备专属性。在荧光分子中引入螺环结构使荧光淬灭也是设计hocl荧光探针常用策略之一,可以自由旋转的螺环结构破坏了荧光分子内原有的共轭体系,导致荧光淬灭。具体来说,又可以分为硫醇螺环24,25,硫代内酯螺环26,苯酰肼螺环27等。这说明并不是某一种特定的螺环结构可以识别hocl,而可能是螺环结构可以和hocl发生反应,同样缺乏专属性。另外,chen等28报道的以苯并噻唑为母核结构的荧光探针、zhao等29报道的fret型oclˉ荧光探针,其荧光强度与oclˉ的浓度之间线性关系并不理想,不能满足分析方法的要求,r2值仅为0.99。
近十年来,纳米技术迅猛发展,研究人员利用纳米技术设计了各式各样的纳米载体,用于疾病的诊断和治疗。可控释放的纳米载体属于“精准医疗”的范畴,可减少药物对于正常组织的损伤,降低脱靶效应。目前,响应次氯酸根离子的纳米药物载体还未见报道。考虑到众多疾病的发生发展过程中都会引起中性粒细胞的浸润,从而合成和释放大量次氯酸根离子到病灶组织中。因此,设计次氯酸根离子响应的纳米药物载体对于相关疾病的治疗具有十分重要的意义。本发明所涉及的偶酰肼连接键会在次氯酸根离子作用下断裂,当纳米药物载体的母体结构中有偶酰肼连接键时,该载体在次氯酸根离子较多的组织中解体,造成药物释放,发挥药效。“诊疗一体化”纳米平台可同时完成疾病的诊断和治疗,是节约医疗资源和患者时间的重要手段。偶酰肼连接键在“诊疗一体化”纳米系统的构建中也可发挥作用。例如,将荧光分子和药物通过偶酰肼连在聚合物(如透明质酸)上,荧光分子和药物的疏水作用将使整合聚合物容易形成胶束等纳米结构。同时,荧光分子在局部浓度过高,由于“聚集诱导荧光淬灭”效应,荧光分子的荧光信号消失。当“诊疗一体化”纳米粒到达病灶组织后,组织中过量的次氯酸根离子将偶酰肼连接键切断,荧光分子释放并游离在组织中,荧光信号恢复;药物分子以原型的形式释放后,可作用其靶点,发挥药效。像这样的“诊疗一体化”系统相对于传统的药物载体或组织成像具有明显的优势。
某些分子对于疾病具有很好的疗效,但是其本身分子结构却可能具有一定的缺陷性,而不容易被制成药物。例如,部分小分子因为活性基团的存在,容易被机体代谢而快速清除;或具有强烈的刺鼻气味,患者依从性低。此类药物适合于制成前药,如果结构中存在羧基,可以利用偶酰肼连接键对药物进行结构修饰。优化的小分子的活性基团被掩盖,其代谢稳定性提高;分子结构发生改变,其物理化学性质也会有一定的改善,比如,气味、水溶性等。当偶酰肼修饰的前药通过血液循环到达病灶组织后,可在次氯酸根离子的作用下释放中原型药物,发挥治疗效果。
参考文献:
(1)nathan,c.;cunningham-bussel,a.nat.rev.immunol.2013,13,349-361.
(2)li,z.;xu,x.;leng,x.;he,m.;wang,j.;cheng,s.;wu,h.archvirol2016.
(3)li,y.r.;trush,m.reactiveoxygenspecies2016,1.
(4)reid,m.b.medscisportsexerc2016,48,2239-2246.
(5)mcmurray,f.;patten,d.a.;harper,m.e.obesity(silverspring)2016,24,2301-2310.
(6)rimessi,a.;previati,m.;nigro,f.;wieckowski,m.r.;pinton,p.intjbiochemcellbiol2016,81,281-293.
(7)winterbourn,c.c.;kettle,a.j.;hampton,m.b.annurevbiochem2016,85,765-792.
(8)berridge,m.j.philostransrsoclondbbiolsci2016,371.
(9)ni,r.;cao,t.;xiong,s.;ma,j.;fan,g.c.;lacefield,j.c.;lu,y.;letissier,s.;peng,t.freeradicbiolmed2016,90,12-23.
(10)griendling,k.k.;touyz,r.m.;zweier,j.l.;dikalov,s.;chilian,w.;chen,y.r.;harrison,d.g.;bhatnagar,a.;americanheartassociationcouncilonbasiccardiovascular,s.circres2016,119,e39-75.
(11)ismael,f.o.;proudfoot,j.m.;brown,b.e.;vanreyk,d.m.;croft,k.d.;davies,m.j.;hawkins,c.l.arch.biochem.biophys.2015,573,40-51.
(12)ridzuan,n.;john,c.m.;sandrasaigaran,p.;maqbool,m.;liew,l.c.;lim,j.;ramasamy,r.worldjournalofdiabetes2016,7,271.
(13)restaino,r.m.;deo,s.h.;parrish,a.r.;fadel,p.j.;padilla,j.expphysiol2016.
(14)xiao,l.;liu,c.;chen,x.;yang,z.foodchemtoxicol2016,90,76-83.
(15)heimlich,j.b.;speed,j.s.;o'connor,p.m.;pollock,j.s.;townes,t.m.;meiler,s.e.;kutlar,a.;pollock,d.m.brjpharmacol2016,173,386-395.
(16)durand,n.;storz,p.expertrevanticancerther2017,17,19-31.
(17)luo,s.;li,q.journalofappliedpharmacy2016,08.
(18)lim,s.;liu,h.;barnes,l.;tan,m.cancerresearch2016,76,48-48.
(19)sainz,a.g.;song,j.h.;kraft,a.s.;warfel,n.a.cancerresearch2016,76,lb-024-lb-024.
(20)pant,k.;gupta,p.;damania,p.;yadav,a.k.;gupta,a.;ashraf,a.;venugopal,s.k.bmccomplementalternmed2016,16,148.
(21)zhou,l.;lu,d.q.;wang,q.;hu,s.;wang,h.;sun,h.;zhang,x.spectrochimactaamolbiomolspectrosc2016,166,129-134.
(22)wang,x.;song,f.;peng,x.dyesandpigments2016,125,89-94.
(23)liao,y.-x.;yang,z.-x.;li,k.;yu,x.-q.chemistryletters2016,45,691-693.
(24)sugurukenmoku,y.u.,hirotatsukojima,andtetsuonagano.j.am.chem.soc.2007,129,7313–7318.
(25)koide,y.;urano,y.;hanaoka,k.;terai,t.;nagano,t.j.am.chem.soc.2011,133,5680-5682.
(26)chen,x.;lee,k.a.;ren,x.;ryu,j.c.;kim,g.;ryu,j.h.;lee,w.j.;yoon,j.natprotoc2016,11,1219-1228.
(27)zhang,r.;zhao,j.;han,g.;liu,z.;liu,c.;zhang,c.;liu,b.;jiang,c.;liu,r.;zhao,t.;han,m.y.;zhang,z.jamchemsoc2016,138,3769-3778.
(28)chang,c.;wang,f.;qiang,j.;zhang,z.;chen,y.;zhang,w.;wang,y.;chen,x.sensorsandactuatorsb:chemical2017,243,22-28.
(29)zhang,y.-r.;zhao,z.-m.;miao,j.-y.;zhao,b.-x.sensorsandactuatorsb:chemical2016,229,408-413.
技术实现要素:
解决的技术问题:本发明的目的是解决现有次氯酸根响应性连接键专属性差、灵敏度低的问题,提供一种次氯酸根响应性偶酰肼连接键及其应用,该连接键对次氯酸根具有很强的专属性。
技术方案:
次氯酸根响应性偶酰肼连接键,结构式为
为形成偶酰肼连接键,r1和r2的母体结构中有活性羰基存在,具体可以是酯、羧酸、酰氯、醛或环酮等,两者与水合肼反应后能形成本发明的偶酰肼连接键。
本发明的偶酰肼连接键可与次氯酸根离子发生特异性反应,被次氯酸根离子氧化切断,形成羧基,从而在ros中区分次氯酸根离子。
由于偶酰肼连接键对次氯酸根离子具有很强的专属性,因此可广泛用于次氯酸根响应的各领域,比如次氯酸根荧光探针、次氯酸根响应性药物载体(包括细胞载体、外泌体载体、病毒载体、细菌载体、胶束、脂质体、纳米胶、水凝胶、纳米药物晶体、金纳米粒、银纳米粒、金属纳米簇、金属有机框架、磁性纳米氧化铁、介孔硅、纳米石墨烯等)、次氯酸根响应性纳米探针(量子点、上转化荧光纳米粒等)、治疗ros相关疾病的前药、具有诊断和治疗双重作用的载体(诊疗一体化载体)。
在设计次氯酸根离子荧光探针时,r1和r2的选择要保证将反应中化学结构的变化转换为荧光信号的强弱。因此,r1可选取发出荧光的基团,而r2可选取猝灭荧光的基团或者与r1荧光分子之间发生fret效应的荧光分子。在设计次氯酸根离子响应性纳米递药系统时,r1可选取亲脂性分子,如卵磷脂、胆固醇等;r2可选取亲水性较强的分子,如聚乙二醇(peg)、聚乙烯吡咯烷酮(pvp)等。当设计次氯酸根离子响应性纳米胶时,r1和r2可选取一端带有可交联化学键的分子或聚合物。当设计次氯酸根离子响应性前药时,r1可选取带有羧基的药物,r2可选取苯环、脂肪链等结构,以保证前药分子不会对细胞或组织产生毒性。当设计次氯酸根离子响应性“诊疗一体化”纳米粒时,r1可选取带有羧基的聚合物作为母体,r2可选取带有羧基的荧光分子和药物。
以偶酰肼连接键作为识别基团的探针对次氯酸根具有很强的专属性,荧光响应与次氯酸根浓度具有优越的线性关系。文献中报道的硫醚、硒醚和碳碳双键等基团作为次氯酸根识别基团的探针对次氯酸根没有很好的专属性,而对过氧化氢、过氧亚硝基等其他ros也有响应。
偶酰肼连接键可以被次氯酸根氧化切断,形成羰基二氮烯,在质子性溶剂中最终水解生成羧基。因此,在设计次氯酸根荧光探针时,可以将荧光分子通过偶酰肼连接键与具有荧光猝灭功能的基团连接,或者用偶酰肼连接键将两个可以发生荧光共振能量转移(fret)的荧光分子连接,来设计次氯酸根“关-开”型荧光探针和fret型荧光探针。
次氯酸根离子荧光探针,结构式为:
具体地,a选自香豆素类、罗丹明类、荧光素类、氟硼二吡咯类(bodipy)、菁染料类(cy)、萘二甲酰亚胺类经典荧光分子、荧光蛋白、氨基萤光素、荧光量子点或上转换荧光纳米粒(ucnps)。b选自吸收波长与a部分的荧光发射波长有重叠的香豆素类、罗丹明类、荧光素类、氟硼二吡咯类(bodipy)、菁染料类(cy)、萘二甲酰亚胺类经典荧光分子、荧光蛋白、生物荧光分子和荧光纳米粒,或者是具有荧光猝灭功能的强吸电子基团,也可以是石墨烯、金纳米粒、硅纳米粒等无机材料。
在次氯酸根水平较高的肿瘤组织或者相关疾病组织中,偶酰肼连接键被切断,导致纳米粒结构不稳定,从而释放药物。次氯酸响应性的纳米载体(如脂质体、胶束、纳米胶)可将偶酰肼连接键置于两亲性分子或聚合物的亲水部分与疏水部分之间,也可将疏水性的药物与亲水性的聚合物通过偶酰肼连接键连接。
次氯酸根离子响应性胶束或脂质体,结构式为:
具体地,c选自磷脂酰胆碱(卵磷脂)、磷脂酰乙醇胺(脑磷脂)、磷脂酰丝氨酸、磷脂酰甘油、二磷脂酰甘油(心磷脂)、磷脂酰肌醇、神经鞘磷脂、胆固醇、聚丙烯,聚苯乙烯,聚氨基酸,聚乳酸、肉蔻酸、聚氨酯、硬脂酸或软脂酸。b选自聚乙二醇(peg)、聚乙烯吡咯烷酮(pvp)、聚氧乙烯(peo)、聚乙烯亚胺(pei)、半乳糖、壳聚糖、聚己内酯、透明质酸或葡聚糖。
次氯酸根离子响应性纳米胶,结构式为:
具体地,e和f可以选自甲基丙烯酸修饰的peg、甲基丙烯酸修饰的透明质酸、聚(n-异丙基丙烯酰胺)(pnipam)、聚丙烯酸(paa)、聚氨基酸、葡聚糖、壳多糖、聚乙烯醇、羟丙基纤维素、聚(n-乙烯基己内酰胺)(pvcl)、甲基丙烯酸修饰的肝素或普鲁兰多糖(pullulan)。
在次氯酸根相关疾病的治疗中,偶酰肼连接键可以修饰药物以形成前药,在靶部位被次氯酸根激活,进一步发挥作用。
次氯酸根离子响应性前药,结构式为:
具体地,x可以选自托泊替康、米托蒽醌、依托泊苷、替尼泊苷、甲氨蝶呤、紫杉醇、阿霉素、喜树碱、羟基喜树碱、伊立替康、非布索坦、阿司匹林、吲哚美辛、萘普生、双氯芬酸、布洛芬、头孢菌素、氟伐他汀、阿托伐他汀、瑞舒伐他汀、普伐他汀、匹伐他汀、罗伐他汀、西立伐他汀、喹诺酮类药物、苯丁酸氮芥、甲氨蝶呤或苯达莫司汀。y选自x中提到的药物、烷基链或取代芳香化合物。
有益效果:本发明中偶酰肼连接键可与cloˉ特异性发生反应,被cloˉ氧化切断,形成羧基,从而在ros中区分cloˉ,专属性较强。偶酰肼连接键可以用于次氯酸根离子荧光探针、次氯酸根离子响应性纳米递药系统和治疗次氯酸根离子相关疾病前药的设计。
附图说明
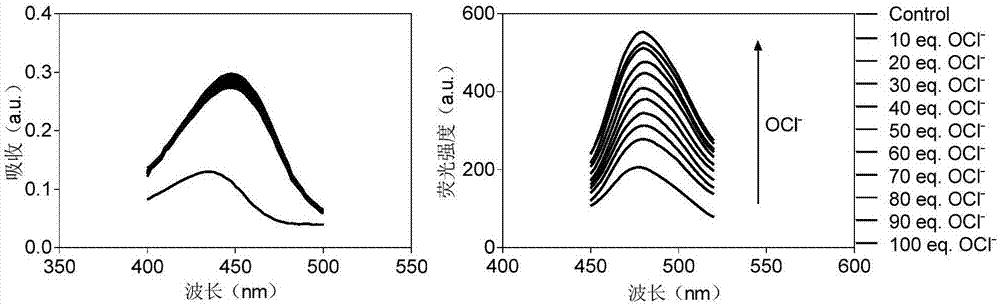
图1为实施例1中cou-dhz-ph-no2和oclˉ溶液混合后的吸收光谱和荧光光谱;
图2为实施例1中cou-dhz-ph-no2用于检测oclˉ的标准曲线;
图3为实施例1中在cou-dhz-ph-no2溶液中分别加入oclˉ、h2o2、·oh、1o2、no后的相对荧光值;
图4为实施例1中cou-dhz-ph-no2用于raw264.7细胞中内源性oclˉ的检测实验中的相对荧光值;
图5为实施例1中cou-dhz-ph-no2用于raw264.7细胞中内源性oclˉ的检测实验的共聚焦观察结果;
图6为实施例1中cou-dhz-ph-no2用于检测肝损伤组织中oclˉ的共聚焦观察结果;
图7为实施例1中cou-dhz-ph-no2的“关-开”原理示意图;
图8为实施例2中oclˉ响应性脂质体与普通脂质体的阿霉素释放曲线;
图9为实施例2中载阿霉素的oclˉ响应性脂质体与普通脂质体对mda-mb-231细胞的mtt实验;
图10为实施例3中oclˉ响应性纳米胶对a549细胞和huvec细胞的细胞毒性;
图11为实施例4中苯达莫司汀(ben)、ben-dhz-ch3和苯达莫司汀对照前药(ben-amide-ch3)对于a549细胞的mtt实验;
图12为实施例4中ben、ben-dhz-ch3和ben-amide-ch3对于huvec细胞的mtt实验;
图13为实施例5中oclˉ响应性“诊疗一体化”纳米粒对a549细胞和huvec细胞的细胞毒性;
图14为实施例5中oclˉ响应性“诊疗一体化”纳米粒在a549细胞和huvec细胞中的荧光强度。
具体实施方式
下面结合具体实施例对本发明的技术方案做进一步的说明。
实施例1
oclˉ荧光探针cou-dhz-ph-no2的设计与应用
合成路线:首先通过knoevenagel缩合反应由4-二乙氨基水杨醛和丙二酸二乙酯合成了化合物7-(二乙胺基)香豆素-3-甲酸乙酯,后者与水合肼反应生成化合物7-(二乙胺基)香豆素-3-甲酰肼。cou-dhz-ph-no2由对硝基苯甲酰氯与7-(二乙胺基)香豆素-3-甲酰肼反应而得。具体路线如下:
7-(二乙胺基)香豆素-3-甲酸乙酯的合成:将4-二乙氨基水杨醛(3.86g,20mmol)溶于60ml乙醇中,加入6ml丙二酸二乙酯(40mmol)和2ml哌啶。氮气保护,加热至80℃回流反应24h。反应结束,溶液呈黑色。旋蒸除去溶剂,将剩余粘稠液体倾入20ml石油醚,有沉淀析出。抽滤,10ml石油醚洗涤三次。取滤饼与5g硅胶制砂,通过层析柱纯化,流动相为石油醚:二氯甲烷(1:1,v:v),最终得4.23g黄色粉末状固体,产率为73%。
7-(二乙胺基)香豆素-3-甲酰肼的合成:将7-(二乙胺基)香豆素-3-甲酸乙酯(10mmol,2.89g)溶于30ml乙醇,加入1.71ml(30mmol)水合肼(85%)。氮气保护下,室温避光搅拌反应1h。抽滤得橘黄色固体,用冰乙醇(30ml)洗涤三次,真空干燥得1.68g粉末状黄色固体,产率为61%。
cou-dhz-ph-no2的合成:精确称量110mg7-(二乙胺基)香豆素-3-甲酰肼(0.4mmol),加5ml无水二氯甲烷溶解。分别精确称量112mg对硝基苯甲酰氯,加5ml无水二氯甲烷溶解。快速搅拌下将酰氯溶液缓慢滴入香豆素甲酰肼溶液,可以观察到有沉淀产生。氮气保护下,室温搅拌避光反应1h。旋蒸除去溶剂,制砂,层析柱纯化,流动相为纯二氯甲烷。真空干燥,得139mg黄色粉末状固体,产率82%。
1hnmr(dmso-d6,300mhz),δ(ppm):11.23(s,1h),10.48(s,1h),8.69(s,1h),8.32(d,j=8.5hz,2h),8.10(d,j=8.6hz,2h),7.70(d,j=9.0hz,1h),6.80(dd,j=9.0,1.6hz,1h),6.62(d,j=1.1hz,1h),3.47(q,j=6.8hz,4h),1.11(t,j=6.9hz,6h).
13cnmr(dmso-d6,75mhz),δ(ppm):163.60,161.57,157.94,153.35,149.82,148.92,138.40,132.32,129.57,124.08,110.83,108.28,108.13,96.40,44.87,12.75.
tof-mses-calc.m/z=424.2,foundm/z=423.2[m-h]ˉ.
精确称量4.24mgcou-dhz-ph-no2于管1.5mlep管中,加1mldmso溶解,涡旋混匀,得10mmdmso储备液。-20℃长期保存。配制10μm10%dmso水溶液,向其中分别加入终浓度为0μm、100μm、200μm、300μm、400μm、500μm、600μm、700μm、800μm、900μm、1mm的oclˉ溶液。涡旋混匀,室温避光反应10min。采用酶标仪(tecanm1000proinfinite)测定吸收光谱和荧光光谱,如图1所示。oclˉ使cou-dhz-ph-no2在430nm处吸收值显著增强。以最大吸收波长430nm作为荧光激发波长,测定荧光发射图谱。oclˉ使cou-dhz-ph-no2的荧光增强,且478nm处荧光值随着加入oclˉ的比例的提高而逐渐增强。取478nm处荧光值与oclˉ浓度做拟合曲线,如图2所示,结果表明两者呈线性关系,r2值为0.9993,满足分析方法的基本要求。
根据公式cl=3σ/k,式中cl为检出限,σ为空白溶剂的标准偏差,k为线性回归方程的斜率。430nm激发后,六组空白溶剂在478nm的荧光值标准差σ为0.286。根据公式计算出cou-dhz-ph-no2对oclˉ的检测限为5.00μm。
向10μmcou-dhz-ph-no2溶液中分别加入终浓度为100当量的oclˉ、h2o2、·oh、1o2、no。涡旋混匀,室温避光反应10min之后,430nm为激发波长,测定478nm处荧光值。如图3所示,在所检测的不同ros中,仅oclˉ可使cou-dhz-ph-no2在478nm处的荧光增强两倍以上,差值极其显著(p<0.001)。其他ros对于荧光值的影响没有统计学意义。结果说明cou-dhz-ph-no2用于检测oclˉ具有良好的专属性。
cou-dhz-ph-no2可应用于细胞内源性oclˉ的检测,lps、pma可刺激细胞产生ros。raw264.7细胞按照americantypetissueculturecollection规定进行培养。细胞培养在25cm2的培养瓶中,细胞培养基为dmem,加入10%的牛胎儿血清以及1%的青霉素/链霉素双抗。培养瓶放入温度设置为37℃,co2浓度为5%的细胞培养箱中进行培养。当培养瓶中raw264.7细胞密度达到90%时进行实验。
三组实验组分别为lps(1μg/ml)刺激细胞12h,pma(5μg/ml)刺激1h,以及lps/pma共同刺激,对照组不作处理。用1ml20μmcou-dhz-ph-no2溶液培养细胞2h。培养结束后,弃掉培养基,pbs洗涤两次。加胰酶消化,在显微镜下观察细胞消化情况,当细胞呈圆形并悬浮之后,加完全培养基终止消化。将液体转移至1.5mlep管中,离心力1000g离心三分钟。弃去上清液,pbs洗涤两次。用1%tritonx-100细胞裂解液裂解细胞,涡旋混匀,放置10min。待10min反应结束,12000rpm再次离心10min,除去细胞碎片以及未裂解的细胞器。取200μl上清液到96孔黑板中,酶标仪测定430nm激发后478nm处荧光值,另取20μl液体用bca方法定量蛋白。共聚焦观察实验中实验组用lps/pma共处理,随后两组用50μmcou-dhz-ph-no2溶液培养2h,pbs洗涤两次后,用zeisslsm700成像,激发波长405nm。
如图4所示,与未加lps/pma的对照组相比,lps孵育细胞12h、pma孵育细胞1h和lps/pma共同刺激组,细胞内荧光强度增强;pma组与对照组的差值具有统计学意义(p<0.05),lps/pma组与对照组的差值非常显著(p<0.01)。激光共聚焦观察细胞如图5所示,第一行未刺激的巨噬细胞中,绿色荧光通道下观察不到荧光。经过lps/pma处理的巨噬细胞,绿色荧光通道下可以观察到强烈的荧光。结果表明,cou-dhz-ph-no2荧光探针可以用于检测巨噬细胞中内源性次氯酸。
酒精导致的肝损伤通过ros形成,cou-dhz-ph-no2可应用于急性肝损伤模型中肝组织oclˉ的检测。酒精诱导的急性肝损伤模型用昆明小鼠建立,6只小鼠随机分为2组。禁食12h后,实验组小鼠灌胃60%乙醇,剂量为10ml/kg,对照组小鼠用相同剂量蒸馏水处理。4h后,两组小鼠经原位肝组织灌流20ml50μμcou-dhz-ph-no2溶液。灌流结束,脱颈处死小鼠,分离肝部,做冷冻切片。切片在zeisslsm700下观察。如图6所示,405nm激发后,绿色荧光通道下正常组织观察不到荧光,而酒精诱导的急性肝损伤小鼠的肝组织中却观察到信号强烈的绿色荧光。结果说明,cou-dhz-ph-no2可在动物组织的oclˉ成像中发挥作用。
精确称量42.4mgcou-dhz-ph-no2,加入200ml甲醇搅拌溶解。完全溶解后,加入10当量的次氯酸钠溶液,反应4h。旋蒸除去溶剂,制砂,层析柱纯化得主要产物,经质谱表征。质谱图中观察到262.1014,归属为7-(二乙胺基)香豆素-3-甲酸的加氢峰。表明次氯酸根离子将cou-dhz-ph-no2中偶酰肼连接键切断,生成7-(二乙胺基)香豆素-3-甲酸,并通过简单有效的策略成功设计了“关-开”型荧光探针,如图7所示。
实施例2
oclˉ响应性新型磷脂sa-dhz-his(c38h55n7o4)的设计与应用
合成路线:首先对硝基苯甲酰氯与水合肼反应生成对硝基-n’-对硝基苯甲酰基-苯甲酰肼,后者与水合肼反应生成化合物对氨基-n’-对氨基苯甲酰基-苯甲酰肼。继续与硬脂酰氯反应得sa-dhz,在sa-dhz另一侧通过edc/nhs反应连接水溶性氨基酸l-组氨酸得两亲性分子sa-dhz-his。具体路线如下:
对硝基-n’-对硝基苯甲酰基-苯甲酰肼的合成:取0.38ml85%水合肼(10mmol)溶于30ml95%乙醇中,缓慢加入1.9g对硝基苯甲酰氯(10mmol)。搅拌下逐滴加入10ml碳酸钠溶液(含碳酸钠1.06g,10mmol),随后再次加入另一份1.9g的对硝基苯甲酰氯。继续搅拌反应12h,可观察到灰白色沉淀产生。抽滤,滤渣用95%乙醇洗涤三次,真空干燥得3.24g灰白色固体,产率49.2%。
对氨基-n’-对氨基苯甲酰基-苯甲酰肼的合成:取1g对硝基-n’-对硝基苯甲酰基-苯甲酰肼溶于100ml四氢呋喃,向其中加入10mgpd/c。配置氢气球,抽放三次使氢气充满反应瓶。搅拌反应过夜。旋蒸除去溶剂,产物经层析柱纯化。真空干燥得0.62g白色固体,产率62.3%。
sa-dhz的合成:取1.35g对氨基-n’-对氨基苯甲酰基-苯甲酰肼(5mmol)溶于100ml无水四氢呋喃中,加入200μl三乙胺。快速搅拌下缓慢滴加硬脂酰氯溶液(1.69ml,5mmol),继续反应4h。旋蒸除去溶剂,产物经层析柱纯化。真空干燥得1.97g白色固体,产率73.5%。
sa-dhz-his的合成:取775mgl-组氨酸(5mmol)溶于5ml去离子水中,加入95.8mg1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(0.5mmol)和65.1mgn-羟基琥珀酰亚胺磺酸钠盐(0.3mmol),搅拌30min。将1.61gsa-dhz(3mmol)溶于20ml四氢呋喃,搅拌下将四氢呋喃溶液缓慢滴入上述溶液中,反应12h。旋蒸除去溶剂,产物经层析柱纯化。真空干燥得0.97g白色固体,产率48.3%。
1hnmr(dmso-d6,300mhz),δ(ppm):12.86(s,1h),10.64(s,2h),10.11(s,1h),9.64(s,1h),8.87(s,2h),8.71(d,j=7.3hz,1h),7.84-7.82(m,4h),7.80-7.77(m,4h),7.64(d,j=4.3hz,1h),4.09(t,j=3.9hz,2h),3.28-3.26(m,1h),3.03-2.99(m,1h),2.37(t,j=1.9hz,2h),1.59–1.56(m,1h),1.31–1.25(m,28h),0.86(t,j=3.4hz,3h).
13cnmr(dmso-d6,75mhz),δ(ppm):179.60,173.31,161.87,142.45,138.53,131.28,129.40,127.45,120.77,119.57,110.83,53.68,38.78,32.57,31.24,29.48,27.69,26.9824.96,22.83,14.08.
tof-mses-calc.m/z=673.4,foundm/z=674.5[m+h]+.
脂质体(lipo)的制备:采取薄膜分散-水合法制备脂质体。称取120mg磷脂(phospholipid,pc)和15mg胆固醇(cholesterol,chol),三者用混合溶剂三氯甲烷:甲醇(2:1,v:v)溶解,溶解后转移至500ml茄形瓶中,旋蒸除去溶剂,15min后将茄形瓶放入干燥器中,继续真空抽除残余溶剂。加入纯净水5ml在37℃恒温水浴下水合脂质薄膜,水化后转移至西林瓶当中。冰浴下探头超声,制得脂质体。以0.22μm水系滤膜过滤脂质体,除去超声时混入的铁屑等杂质颗粒。制备oclˉ响应性脂质体(oclˉ-dox-lipo)所用原料为100mg磷脂(phospholipid,pc)、20mgsa-dhz-his和15mg胆固醇(cholesterol,chol),其余步骤相同。
载抗肿瘤药物阿霉素(dox)脂质体的制备:采用硫酸铵梯度法制备阿霉素脂质体。将制备脂质体实验方法中水合部分所用的5ml纯净水替换为300mm硫酸铵溶液,其余步骤相同。将制得的脂质体混悬液转移至透析袋中,透析介质为纯净水,透析过夜。向透析后脂质体混悬液中加入dox溶液,45℃水浴下使用磁力搅拌器200rpm,搅拌1h。将混合液转移至15ml,10kda的
dox的体外释放考察:精密移取dox贮备液,超纯水稀释成浓度为10ng/ml、20ng/ml、40ng/ml、60ng/ml、80ng/ml、100ng/ml的系列标准溶液。取200μl用酶标仪测定不同浓度溶液的荧光值,激发波长为480nm,发射波长为595nm。以对照品浓度c(μg/ml)、荧光强度(f)为横、纵坐标,得一元线性拟合曲线,作为标曲。取置于透析袋内,两端扎紧,分别加入到50ml释放介质中,释放介质为1%tween80的ph7.4的pbs(含100μm次氯酸根离子),在37℃,50rpm搅拌下考察其释放情况。分别于1h、2h、4h、6h、8h、10h、12h、24h、36h、48h、60h、72h。取1ml释放介质,同时补充1ml新鲜的释放介质。酶标仪进样,记录595nm处荧光值,计算各时间点不同脂质体的dox的释放量,绘制释放曲线。
如图8所示,相比于dox-lipo,在100μm次氯酸根离子的环境中,oclˉ-dox-lipo的药物释放速度显著加快,72h释放量可达50%左右,而dox-lipo仅可释放20%的dox。说明新合成的oclˉ响应性脂质分子成功地插入到脂质体磷脂双分子层当中,与oclˉ反应后造成脂质体结构的破坏,使dox释放。
考察oclˉ响应性阿霉素脂质体的细胞毒性:取对数生长期的mda-mb-231细胞,以1×104个细胞/孔接种于96孔板中,完全培养基37℃培养24h。移除培养基,分别用含载0.01μg、0.05μg、0.10μg、0.25μg、0.50μg、1.00μg、5.00μg、10.00μg的dox-lipo和oclˉ-dox-lipo以及不载药脂质体的无fbs培养基溶液培养,置于37℃孵育24h后,加入20μlmtt(5mg/ml),孵育4h。移除培养基,加入150μldmso,酶标仪测定570nm处荧光强度。
如图9所示,相比于普通dox脂质体(dox-lipo),制备的oclˉ响应性阿霉素脂质体(oclˉ-dox-lipo)对mda-mb-231细胞的杀伤能力显著增强。肿瘤细胞中高水平的次氯酸根离子可以破坏被摄取的脂质体,导致dox释放,使其ic50值降低至110.9ng/ml。表明oclˉ响应性脂质体具有响应肿瘤微环境的能力,从而降低化疗药的使用剂量以及对正常组织的毒性。
精确称量67.3mgsa-dhz-his,加入100ml四氢呋喃搅拌溶解。完全溶解后,加入10当量的次氯酸钠溶液,反应4h。旋蒸除去溶剂,制砂,层析柱纯化可得两个主要产物,经质谱表征。各自的质谱结果中可观察到404.4和273.1的质谱峰,归属为对硬脂酰氨基苯甲酸的加氢峰和4-(s)-2-氨基-3-(4-咪唑基)丙酰氨基苯甲酸。结果表明次氯酸根离子将sa-dhz-his中偶酰肼连接键切断,导致脂质体结构的破坏,并最终造成所载药物的释放。
实施例3
oclˉ响应性交联剂n-丙烯酰基丙烯酰肼(c6h8n2o2)的设计与应用
合成路线:丙烯酰氯和水合肼在95%乙醇中反应生成n-丙烯酰基丙烯酰肼,该产物可以用于凝胶的形成。具体合成路线如下:
n-丙烯酰基丙烯酰肼的合成:取0.38ml85%水合肼(10mmol)溶于30ml95%乙醇中,缓慢加入905.1mg丙烯酰氯(10mmol)。搅拌下逐滴加入10ml碳酸钠溶液(含碳酸钠1.06g,10mmol),随后再次加入另一份905.1mg的丙烯酰氯。继续搅拌反应12h。产物经层析柱纯化,真空干燥后得1.15g白色固体,产率82.1%。
1hnmr(dmso-d6,300mhz),δ(ppm):11.23(s,2h),6.36(m,2h),5.92(m,,2h),5.20(m,2h).
13cnmr(dmso-d6,75mhz),δ(ppm):163.28,132.02,125.65.
tof-mses+calc.m/z=140.1,foundm/z=141.1[m-h]+.
次氯酸响应性纳米凝胶的制备:将4ml丙烯酰胺(1.4mol/l)、2g葡聚糖、100μl过硫酸铵和2.2g胆固醇丙烯酸酯以及10ml去离子水在三颈瓶中混匀,55℃下搅拌反应1h,随后加入2mln-丙烯酰基丙烯酰肼(0.1mol/l)。4h后,由于胆固醇提供的疏水作用力,纳米水凝胶形成。该纳米胶可用于装载疏水性药物,如dox。在制备过程中将dox(30mg)与胆固醇丙烯酸酯一同加入,最终将制得次氯酸响应性阿霉素纳米水凝胶(oclˉ-dox-ng)。
考察oclˉ-dox-ng对a549细胞和huvec细胞的细胞毒性:取对数生长期的a549细胞和huvec细胞,以1×104个细胞/孔接种于96孔板中,完全培养基37℃培养24h。移除培养基,分别用含dox0.01μg、0.05μg、0.10μg、0.25μg、0.50μg、1.00μg、5.00μg、10.00μg的oclˉ-dox-ng溶液培养,置于37℃孵育24h后,加入20μlmtt(5mg/ml),继续孵育4h。移除培养基,加入150μldmso,酶标仪测定570nm处荧光强度。
如图10所示,oclˉ-dox-ng对a549细胞的毒性比对正常的huvec细胞毒性强,本发明所设计的次氯酸响应性纳米凝胶可以提到药物对肿瘤细胞的杀伤能力。
实施例4
抗肿瘤药物苯达莫司汀前药的设计与应用ben-dhz-ch3(c18h25cl2n5o2)
合成路线:首先乙酸乙酯与水合肼在乙醇中发生取代反应生成乙酰肼,后者与苯达莫司汀反应在水中生成化合物ben-dhz-ch3。具体路线如下:
乙酰肼的合成:准确量取0.98ml乙酸乙酯(99%,10mmol),加入10ml乙醇混匀。搅拌条件下,加入0.73ml水合肼(85%,20mmol)。60℃回流反应4h,产物经层析柱纯化,得0.73mg白色固体,产率98.5%。
ben-dhz-ch3的合成:精确称取盐酸苯达莫司汀1.97g(5mmol),溶于5ml去离子水中,加入95.8mg1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(0.5mmol)和65.1mgn-羟基琥珀酰亚胺磺酸钠盐(0.3mmol),搅拌30min,目的是活化羧基。精确称取乙酰肼0.60mg(8mmol),搅拌条件下缓慢加入上述溶液中,室温反应12h。旋蒸除去溶剂,产物经层析柱纯化。真空干燥得1.37g白色固体,产率66.1%。
1hnmr(dmso-d6,300mhz),δ(ppm):10.74(s,2h),7.36(d,j=2.3hz,1h),6.98(d,j=4.8hz,1h),6.56(dd,j=3.1hz,2.9hz,1h),3.73(s,3h),3.64-3.60(m,8h),2.89(t,j=1.6hz,2h),2.07(t,j=6.1hz,2h),1.97(s,3h),1.72–1.69(m,2h).
13cnmr(dmso-d6,75mhz),δ(ppm):176.38,168.29,152.95,148.83,133.87,126.98,117.47,114.67,97.28,56.44,42.92,38.46,31.95,26.69,25.93,20.48.
tof-mses-calc.m/z=413.1,foundm/z=412.1[m-h]-.
考察ben-dhz-ch3对a549细胞和huvec细胞的细胞毒性:取对数生长期的a549细胞和huvec细胞,以1×104个细胞/孔接种于96孔板中,完全培养基37℃培养24h。移除培养基,分别用含苯达莫司汀0.1μg/ml、0.2μg/ml、0.5μg/ml、1μg/ml、2μg/ml、5μg/ml、10μg/ml的苯达莫司汀、ben-dhz-ch3和ben-amide-ch3(对照组前药)溶液培养,置于37℃孵育24h后,加入20μlmtt(5mg/ml),继续孵育4h。移除培养基,加入150μldmso,酶标仪测定570nm处荧光强度。
如图11和图12所示,相比于ben-amide-ch3,制备的苯达莫司汀前药(ben-dhz-ch3)对a549细胞的杀伤能力与原型药物相当,而显著降低了对正常的huvec细胞毒性。表明肿瘤细胞中有足够的oclˉ,可将含偶酰肼键的前药代谢为原型药物。
精确称量41.3mgben-dhz-ch3,加入10ml去离子水搅拌溶解。完全溶解后,加入10当量的次氯酸钠溶液,反应4h。旋蒸除去溶剂,制砂,层析柱纯化可得两个主要产物,经质谱表征。各自的质谱结果中可观察到356.1和61.1的质谱峰,归属为苯达莫司汀的减氢峰和乙酸的加氢峰。结果表明次氯酸根离子将苯达莫司汀前药中的偶酰肼连接键切断,并释放出原型药物。
实施例5
oclˉ响应性“诊疗一体化”平台的构建
抗肿瘤药物苯达莫司汀和荧光分子cy5.5-cooh可通过偶酰肼连接键结合在聚合物(如透明质酸)上,合成的材料(ha-ben-cy)在水中可形成纳米粒。其中,cy5.5的荧光因为“聚集诱导荧光淬灭”效应而猝灭。苯达莫司汀和荧光分子cy5.5-cooh先与水合肼反应,得到的产物进一步与透明质酸结构中的羧基反应。具体合成路线如下:
苯达莫司汀酰肼的合成:将1.79g苯达莫司汀(5mmol)溶于20mldmso中,加入958.5mg1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(5mmol)搅拌0.5h。随后加入2.30gn-羟基丁二酰亚胺(20mmol)和182.5μl水合肼(85%,5mmol),继续反应12h。层析柱纯化得1.53g白色固体,产率82.4%。
1hnmr(dmso-d6,300mhz),δ(ppm):8.86(s,1h),7.39(d,j=2.2hz,1h),7.01(s,1h),6.52(m,1h),4.13(s,2h),3.72(s,3h),3.63-3.60(m,8h),2.85(t,j=1.9hz,2h),2.03(t,j=5.7hz,2h),1.73-1.70(m,2h).
13cnmr(dmso-d6,75mhz),δ(ppm):174.18,169.12,154.57,149.75,131.85,128.38,116.72,113.67,98.86,58.42,45.97,37.63,32.17,21.64,28.93,19.75.
tof-mses+calc.m/z=371.1,foundm/z=372.1[m-h]+.
cy5.5-酰肼的合成:将3.10gcy5.5(5mmol)溶于20mldmso中,加入958.5mg1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(5mmol)搅拌0.5h。随后加入2.30gn-羟基丁二酰亚胺(20mmol)和182.5μl水合肼(85%,5mmol),继续反应12h。层析柱纯化得2.18g白色固体,产率73.0%。
1hnmr(dmso-d6,300mhz),δ(ppm):8.69.(s,1h),8.05-7.93(m,4h),8.01-8.80(m,2h),7.73-7.62(m,3h),7.40-7.33(m,2h),7.04(m,1h),6.56-6.50(m,3h),5.72(s,1h),5.32(d,j=2.0hz,1h),4.14(s,2h),4.00(m,2h),3.45(s,3h),2.17(t,j=2.2hz,2h),1.90(s,6h),1.56-1.50(m,8h),1.31-1.28(m,4h).
13cnmr(dmso-d6,75mhz),δ(ppm):178.35,173.29,147.54,140.25,135.28,133.16,132.59,132.42,130.49,128.65,127.56,124.64,122.16,119.66,117.48,116.59,114.89,113.49,110.18,105.48,56.48,52.97,39.46,32.18,22.18,21.15.
tof-mses-calc.m/z=597.3,foundm/z=597.4[m-h]-.
oclˉ响应性“诊疗一体化”纳米粒的制备:为增强透明质酸(ha)在dmso中的溶解性,透明质酸先经四丁基氢氧化铵修饰得到(ha-tba)。在50ml3.10gha-tba(5mmol游离羧基)的dmso溶液中,加入958.5mg1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(5mmol)搅拌0.5h。随后加入2.30gn-羟基丁二酰亚胺(20mmol)、1.86g苯达莫司汀酰肼(5mmol)和2.99gcy5.5-酰肼(5mmol),继续搅拌反应12h。反应结束后,在去离子水中透析72h,除去过量的小分子药物和荧光分子以及dmso。ha-ben-cy经冻干得到,复溶于去离子水中可形称“诊疗一体化”纳米粒。
考察ha-ben-cy纳米粒对a549细胞和huvec细胞的细胞毒性:取对数生长期的a549细胞和huvec细胞,以1×104个细胞/孔接种于96孔板中,完全培养基37℃培养24h。移除培养基,分别用含苯达莫司汀0.1μg/ml、0.2μg/ml、0.5μg/ml、1μg/ml、2μg/ml、5μg/ml、10μg/ml的纳米粒溶液培养,置于37℃孵育24h后,加入20μlmtt(5mg/ml),继续孵育4h。移除培养基,加入150μldmso,酶标仪测定570nm处荧光强度。
如图13所示,同样地,ha-ben-cy纳米粒对肿瘤细胞的毒性更强。
考察ha-ben-cy纳米粒在a549细胞和huvec细胞中的荧光强度:取对数生长期的a549细胞和huvec细胞,以1×104个细胞/孔接种于96孔板中,完全培养基37℃培养24h。移除培养基,分别用含苯达莫司汀5μg/ml的纳米粒溶液培养,置于37℃孵育24h后。随后,裂解细胞,进行蛋白定量并测定各孔在710nm处荧光强度。
如图14所示,仅在肿瘤细胞中才能检测到荧光信号的增强,说明了本发明所涉及的诊疗一体化具有很强的实用性。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种检测醛酮类化合物的方法与制造工艺
- 中氮茚罗丹明酰肼类铜离子比率荧光探针及其应用的制造方法与工艺
- 用作选择性抗菌剂的含2‑吡啶酮部分的芳基酰肼的制造方法与工艺
- 硫代杯[4]芳烃酰腙类希夫碱衍生物及其合成方法和应用与制造工艺
- 一种识别肼的小分子荧光探针及其应用的制造方法与工艺
- 一种2-甲基-1,3,4-噁二唑-5(4H)-酮生产工艺的制造方法与工艺
- 吩嗪‑1‑羧酸双酰肼类化合物及含其化合物的杀菌组合物的制造方法与工艺
- 吲哚啉‑2‑酮的肼基二硫代甲酸甲酯衍生物的铂配合物及其制备方法和用途与制造工艺
- 3‑(2‑氨基‑2‑硫代乙基)苯甲酸甲酯的合成方法与制造工艺
- 3‑(2‑氨基‑2‑硫代乙基)苯甲酸甲酯的制备方法与制造工艺