一种喹唑啉酮席夫碱类化合物的合成方法与流程
本发明属于有机合成领域,具体涉及一种喹唑啉酮席夫碱类化合物的合成方法。
背景技术:
喹唑啉酮类化合物是一种重要的含氮的杂环类化合物,大约有150种从天然产物中分离的生物碱具有喹唑啉酮环骨架。这类化合物在抗炎、抗菌、降压、利尿、镇痛等方面均表现出良好的活性。喹唑啉酮席夫碱类化合物作为喹唑啉酮的一类重要衍生物,其合成方法也广受关注。现有的关于喹唑啉酮席夫碱类化合物的合成方法,多采用邻氨基苯甲酰肼和醛类化合物为反应底物进行合成,这些合成方法有其优点,但是也存在一定的不足。如反应组分较多、须在酸性或碱性条件下进行反应、需要加入配体、溶剂毒性大、反应步骤多等。因此,开发一种简洁高效的合成方法,是需要迫切解决的技术难题。
技术实现要素:
本发明的目的在于提供一种喹唑啉酮席夫碱类化合物的合成方法,以克服上述现有技术存在的缺陷,本发明避免了当前合成反应中酸碱条件以及配体的使用,简化了反应步骤,提高了反应产率。
为达到上述目的,本发明采用如下技术方案:
一种喹唑啉酮席夫碱类化合物的合成方法,包括以下步骤:
步骤一:按照1:(2~2.2):1的摩尔比称取靛红酸酐、含羰基化合物以及水合肼为原料;
步骤二:将步骤一称取的原料在溶剂中混合后,以纳米金属氧化物为催化剂进行加热回流反应;
步骤三:将步骤二的反应产物分离提纯后即得到喹唑啉酮席夫碱类化合 物。
进一步地,所述的靛红酸酐的结构式为:
进一步地,所述的含羰基化合物的结构式为:
进一步地,所述的喹唑啉酮席夫碱类化合物的结构式为:
其中,R为H或Cl,R1和R2选自独立的H、C1-C6烷基、苄基、带有不同取代基的芳香基团,不同取代基的芳香基团包括未取代芳基、未取代杂芳基、带有取代基的芳基或带有取代基的杂芳基,取代基独立地选自C1-C6烷基、C1-C6烷氧基。
进一步地,所述溶剂为乙醇、DMSO、DMF、Dioxane、NMP、水,或者乙醇与水按照1:(2.5~4)的体积比混合得到的混合溶剂。
进一步地,纳米金属氧化物为纳米氧化铜、纳米氧化铈、纳米四氧化三铁或纳米氧化钛。
进一步地,所述的纳米金属氧化物与靛红酸酐的摩尔比为(0.1~0.2):1。
进一步地,加热回流反应的温度为76~120℃,时间为5~6h。
与现有技术相比,本发明具有以下有益的技术效果:
本发明采用靛红酸酐、含羰基化合物、水合肼三组分一步法完成喹唑啉酮席夫碱的合成,使用无毒非均向催化剂金属纳米氧化物作为催化剂,简洁 高效,不需要再加入其它氧化剂和配体,制备方法简单易行,避免了当前合成反应中酸碱条件和配体的使用,简化了反应步骤,提高了反应产率。
附图说明
图1为实施例1所制备的产物的1H NMR谱图;
图2为实施例1所制备的产物的13C NMR谱图;
图3为实施例2所制备的产物的1H NMR谱图;
图4为实施例2所制备的产物的13C NMR谱图;
图5为实施例3所制备的产物的1H NMR谱图;
图6为实施例3所制备的产物的13C NMR谱图;
图7为实施例4所制备的产物的1H NMR谱图;
图8为实施例4所制备的产物的13C NMR谱图;
图9为实施例5所制备的产物的1H NMR谱图;
图10为实施例5所制备的产物的13C NMR谱图;
图11为实施例6所制备的产物的1H NMR谱图;
图12为实施例6所制备的产物的13C NMR谱图;
图13为实施例7所制备的产物的1H NMR谱图;
图14为实施例7所制备的产物的13C NMR谱图;
图15为实施例8所制备的产物的1H NMR谱图;
图16为实施例8所制备的产物的13C NMR谱图;
图17为实施例9所制备的产物的1H NMR谱图;
图18为实施例9所制备的产物的13C NMR谱图;
图19为实施例10所制备的产物的1H NMR谱图;
图20为实施例10所制备的产物的13C NMR谱图;
图21为实施例11所制备的产物的1H NMR谱图;
图22为实施例11所制备的产物的13C NMR谱图。
图23为实施例12所制备的产物的1H NMR谱图;
图24为实施例12所制备的产物的13C NMR谱图;
图25为实施例13所制备的产物的1H NMR谱图;
图26为实施例13所制备的产物的13C NMR谱图;
图27为实施例14所制备的产物的1H NMR谱图;
图28为实施例14所制备的产物的13C NMR谱图;
图29为实施例15所制备的产物的1H NMR谱图;
图30为实施例15所制备的产物的13C NMR谱图。
具体实施方式
下面对本发明的实施方式做进一步详细描述:
一种喹唑啉酮席夫碱类化合物的制备方法,合成路线如下:
R为H或Cl,R1和R2选自独立的H、C1-C6烷基、苄基、带有不同取代基的芳香基团,不同取代基的芳香基团包括未取代芳基、未取代杂芳基、带有取代基的芳基或带有取代基的杂芳基,取代基独立地选自C1-C6烷基、C1-C6烷氧基。
包括以下步骤:
步骤一:按照1:(2~2.2):1的摩尔比称取靛红酸酐(如式Ⅰ所示)、含羰基化合物(芳香醛、杂环芳醛或含有羰基的环状化合物,如式Ⅲ所示)以及水合肼(如式Ⅱ所示)为原料;
步骤二:将步骤一称取的原料在溶剂(乙醇、DMSO、DMF、Dioxane、NMP、水,或者乙醇与水按照1:(2.5~4)的体积比混合得到的混合溶剂) 中混合后,以纳米金属氧化物(纳米氧化铜、纳米氧化铈、纳米四氧化三铁或纳米氧化钛)为催化剂,在76~120℃温度下加热回流5~6h,其中纳米金属氧化物与靛红酸酐的摩尔比为(0.1~0.2):1;
步骤三:将步骤二的反应产物分离提纯后即得到喹唑啉酮席夫碱类化合物(如式Ⅳ所示)。
下面结合实施例对本发明做进一步详细描述:
实施例1
2-苯基-3-(苄亚甲基氨基)-4(1H)-喹唑啉酮的制备
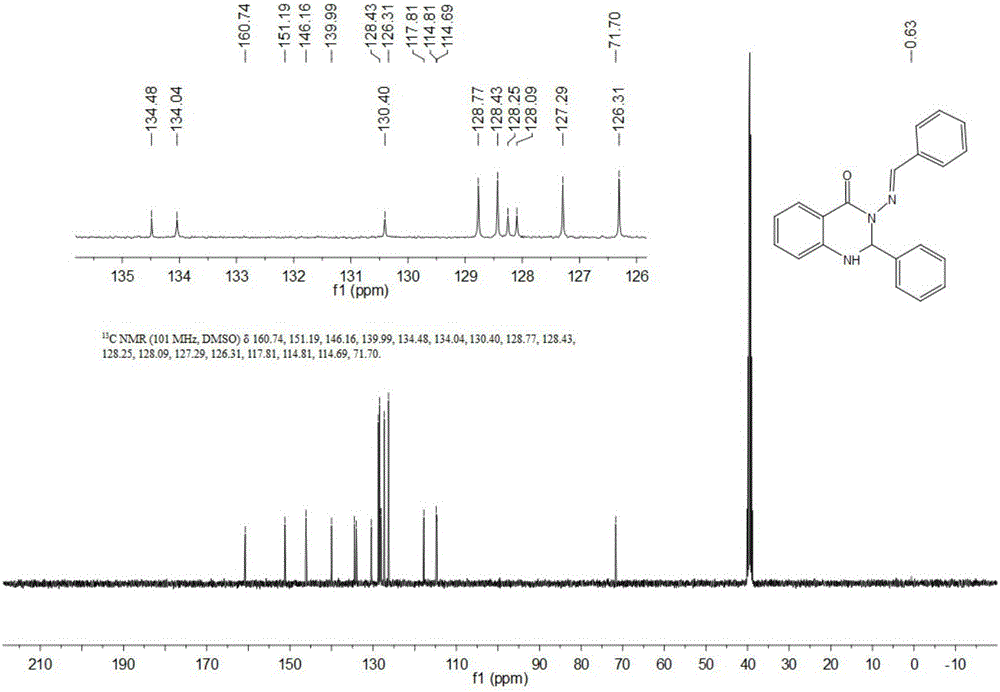
将1mmol的靛红酸酐溶于体积比为1:3的乙醇与水混合液溶剂中,加入2.2mmol苯甲醛和1mmol的水合肼,以0.15mmol纳米氧化铜为催化剂,于76℃下加热回流5小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到271mg淡黄色固体,产率为83%,所得产品结构式如下:
如图1和图2所示,产品核磁表征:13C NMR(101MHz,DMSO)δ160.74(s,1H),151.19(s,2H),146.16(s,1H),139.99(s,1H),134.48(s,1H),134.04(s,2H),130.40(s,2H),128.77(s,4H),128.53–127.95(m,9H),127.29(s,5H),126.31(s,5H),117.81(s,2H),114.75(d,J=11.4Hz,4H),71.70(s,2H).13C NMR(101MHz,DMSO)δ160.74,151.19,146.16,139.99,134.48,134.04,130.40,128.77,128.43,128.25,128.09,127.29,126.31,117.81,114.81,114.69,71.70.
实施例2
2-苯基-3-(4′-醛基-苄亚甲基氨基)-4(1H)-喹唑啉酮的制备
将1mmol的靛红酸酐溶于体积比为1:2.5的乙醇与水混合液溶剂中,加入2mmol对苯二甲醛和1mmol的水合肼,以0.1mmol纳米氧化铈为催化剂,于80℃下加热回流6小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到268mg淡黄色固体,产率为70%,所得产品结构式如下:
如图3和图4所示,产品核磁表征:1H NMR(400MHz,DMSO)δ10.04(s,1H),9.94(s,1H),9.00(s,1H),8.11(t,J=3.8Hz,1H),8.01–7.84(m,6H),7.74(dd,J=7.8,1.0Hz,1H),7.59(d,J=8.2Hz,2H),7.37–7.29(m,1H),6.86–6.68(m,3H).13C NMR(101MHz,DMSO)δ192.73,192.54,160.68,148.95,146.13,145.95,139.94,137.00,136.06,134.44,129.91,129.75,128.25,127.79,127.00,118.24,115.02,114.51,71.30.
实施例3
2-苯基-3-(2′-溴-苄亚甲基氨基)-4(1H)-喹唑啉酮的制备
将1mmol的靛红酸酐溶于体积比为1:4的乙醇与水混合液溶剂中,加入2.1mmol邻溴苯甲醛和1mmol的水合肼,以0.2mmol纳米四氧化三铁为催化剂,于90℃下加热回流5小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到366mg白色固体,产率为76%,所得产品结构式如下:
如图5和图6所示,产品核磁表征:1H NMR(400MHz,DMSO)δ9.02(s,1H),7.83(d,J=7.5Hz,1H),7.69(m,4H),7.34(m,6H),6.80(m,3H).13C NMR(101MHz,DMSO)δ160.97,149.72,145.63,137.75,134.46,133.28,133.14,132.92,132.20,130.81,128.28,128.20,128.07,127.67,127.05,124.02,122.31,118.17,115.01,113.74,72.97.
实施例4
2-苯基-3-(4′-甲基-苄亚甲基氨基)-4(1H)-喹唑啉酮的制备
将1mmol的靛红酸酐溶于乙醇溶剂中,加入2.2mmol对甲基苯甲醛和1mmol的水合肼,以0.15mmol纳米氧化钛为催化剂,于100℃下加热回流6小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到259mg白色固体,产率为73%,所得产品结构式如下:
如图7和图8所示,产品核磁表征:1H NMR(400MHz,DMSO)δ8.75(s,1H),7.84(d,J=2.9Hz,1H),7.67(m,3H),7.27(m,5H),7.16(s,2H),6.75(m,2H),6.45(d,J=2.7Hz,1H),2.34(s,3H),2.23(s,3H).13C NMR(101MHz,DMSO)δ160.64,151.25,146.12,140.26,137.51,137.03,133.89,131.75,129.36,128.93,128.01,127.29,126.21,117.69,114.75,71.39,21.03,20.59.
实施例5
2-苯基-3-(4′-甲氧基-苄亚甲基氨基)-4(1H)-喹唑啉酮的制备
将1mmol的靛红酸酐溶于DMSO(二甲基亚砜)溶剂中,加入2mmol对甲氧基苯甲醛和1mmol的水合肼,以0.1mmol纳米氧化铜为催化剂,于110℃下加热回流5小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到317mg白色固体,产率为82%,所得产品结构式如下:
如图9和图10所示,产品核磁表征:1H NMR(400MHz,DMSO)δ8.74(s,1H),7.86(d,J=2.1Hz,1H),7.68(dd,J=22.3,8.2Hz,3H),7.29(dd,J=11.5,8.3Hz,3H),7.00(d,J=8.6Hz,2H),6.89(d,J=8.6Hz,2H),6.79(d,J=8.1Hz,1H),6.72(t,J=7.5Hz,1H),6.39(d,J=2.1Hz,1H),3.80(s,3H),3.69(s,3H). 13C NMR(101MHz,DMSO)δ161.10,160.64,159.06,151.98,146.19,133.79,132.04,128.97,127.96,127.64,126.93,117.58,114.74,114.70,114.24,113.68,71.47,55.28,55.00.
实施例6
2-苯基-3-(4′-氯-苄亚甲基氨基)-4(1H)-喹唑啉酮的制备
将1mmol的靛红酸酐溶于DMF(N,N-二甲基甲酰胺)溶剂中,加入2.2mmol对氯苯甲醛和1mmol的水合肼,以0.15mmol纳米氧化铈为催化剂,于120℃下加热回流6小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到329mg黄色固体,产率为77%,所得产品结构式如下:
如图11和图12所示,产品核磁表征:1H NMR(400MHz,DMSO)δ8.88(s,0H),8.74(s,1H),7.94(dd,J=19.1,5.6Hz,3H),7.72(m,2H),7.60(d,J=8.4Hz,2H),7.52(d,J=8.4Hz,1H),7.36(m,3H),6.78(m,1H),6.53(d,J=2.7Hz,1H).13C NMR(101MHz,DMSO)δ160.62,150.06,145.97,138.90,136.00,134.94,134.23,133.36,132.93,132.58,130.01,129.08,128.92,128.49,128.21,118.05,114.90,114.55,71.18.
实施例7
2-吡啶-3-(3′-吡啶氨基)-4(1H)-喹唑啉酮的制备
将1mmol的靛红酸酐溶于Dioxane(1,4-二氧六环)溶剂中,加入2.2mmol 3-吡啶甲醛和1mmol的水合肼,以0.2mmol纳米四氧化三铁为催化剂,于76℃下加热回流5小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到257mg淡黄色固体,产率为78%,所得产品结构式如下:
如图13和图14所示,产品核磁表征:1H NMR(400MHz,DMSO)δ9.06(s,1H),8.84(s,1H),8.63(m,2H),8.51(d,J=3.9Hz,1H),8.09(d,J=8.0Hz,1H),8.00(d,J=2.7Hz,1H),7.76(m,2H),7.47(dd,J=7.9,4.8Hz,1H),7.37(m,2H),6.82(m,2H),6.63(d,J=2.7Hz,1H),3.17(s,0H).13C NMR(101MHz,DMSO)δ160.87,151.15,149.55,149.47,148.97,147.96,146.11,135.27,134.42, 134.13,133.63,130.26,128.23,124.00,123.61,118.30,115.00,114.50,70.62.
实施例8
2-螺[环己烷]-3-环己氨基-4(1H)-喹唑啉酮的制备
将1mmol的靛红酸酐溶于NMP(N-甲基吡咯烷酮)溶剂中,加入2mmol环己酮和1mmol的水合肼,以0.1mmol纳米氧化钛为催化剂,于80℃下加热回流6小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到239mg白色固体,产率为77%,所得产品结构式如下:
如图15和图16所示,产品核磁表征:1H NMR(400MHz,CDCl3)δ9.08(dd,J=8.2,0.9Hz,1H),8.48(dd,J=8.1,1.1Hz,1H),7.85(ddd,J=8.5,7.1,1.5Hz,1H),7.73(m,1H),7.68(dd,J=7.7,1.1Hz,1H),7.53(m,3H).13C NMR(101MHz,DMSO)δ176.77,158.63,145.21,133.07,127.35,117.04,114.89,114.52,75.02,35.37,34.95,30.25,29.73,27.19,25.78,25.08,24.38,21.46,20.77.
实施例9
2-呋喃-3-(2′-呋喃氨基)-4(1H)-喹唑啉酮的制备
将1mmol的靛红酸酐溶于水中,加入2.1mmol呋喃甲醛和1mmol的水合肼,以0.15mmol纳米氧化铜为催化剂,于90℃下加热回流6小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到218mg褐色固体,产率为71%,所得产品结构式如下:
如图17和图18所示,产品核磁表征:1H NMR(400MHz,DMSO)δ8.77(s,1H),7.75(m,3H),7.52(m,1H),7.32(m,1H),6.96(d,J=3.4Hz,1H),6.79(m,2H),6.63(dd,J=3.4,1.8Hz,1H),6.43(s,1H),6.34(dd,J=3.3,1.8Hz,1H),6.22(d,J=3.3Hz,1H).13C NMR(101MHz,DMSO)δ160.67,151.77,148.94,145.67,145.54,143.11,140.93,134.23,127.98,118.35,115.55,114.81,114.58,112.38,110.48,108.27,66.27.
实施例10
2-苯基-3-(4′-异丙基-苄亚甲基氨基)-4(1H)-喹唑啉酮的制备
将1mmol的靛红酸酐溶于体积比为1:2.5的乙醇与水混合液溶剂中,加入2.2mmol枯名醛和1mmol的水合肼,以0.15mmol纳米四氧化三铁为催化剂,于100℃下加热回流6小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到189mg淡黄色固体,产率为46%,所得产品结构式如下:
如图19和图20所示,产品核磁表征:1H NMR(400MHz,DMSO)δ8.84(s,1H),7.84(d,J=2.8Hz,1H),7.72(d,J=7.9Hz,1H),7.63(d,J=8.1Hz,2H), 7.30(m,6H),7.20(d,J=8.2Hz,2H),6.77(dt,J=14.9,8.8Hz,2H),6.45(d,J=2.7Hz,1H),2.86(m,2H),1.21(d,J=6.9Hz,7H),1.13(d,J=6.9Hz,6H).13C NMR(101MHz,DMSO)δ160.69,151.14,151.05,148.35,146.14,137.50,133.93,132.23,128.06,127.41,126.71,126.33,126.25,117.69,114.75,71.50,33.37,33.02,23.68,23.63,23.60.
实施例11
2-苯基-3-苄亚甲基氨基-6-氯-4(1H)-喹唑啉酮的制备
将1mmol的5-Cl靛红酸酐溶于体积比为1:3的乙醇与水混合液溶剂中,加入2.2mmol苯甲醛和1mmol的水合肼,以0.1mmol纳米氧化铜为催化剂,于110℃下加热回流6小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到260mg淡黄色固体,产率为72%,所得产品结构式如下:
如图21和图22所示,产品核磁表征:1H NMR(400MHz,DMSO)δ8.86(s,1H),8.13(t,J=6.2Hz,1H),7.69(m,3H),7.37(m,9H),6.85(d,J=8.7Hz,1H),6.57(d,J=3.0Hz,1H).13C NMR(101MHz,DMSO)δ159.53,152.09,144.96,139.59,134.23,133.83,130.61,128.80,128.53,128.42,127.39,126.92,126.26,121.43,116.87,115.75,71.57.
实施例12
2-苯基-3-(4′-甲基-苄亚甲基氨基)-6-氯-4(1H)-喹唑啉酮的制备
将1mmol的5-Cl靛红酸酐溶于DMSO溶剂中,加入2.2mmol对甲基苯甲醛和1mmol的水合肼,以0.2mmol纳米氧化钛为催化剂,于120℃下 加热回流5小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到253mg白色固体,产率为65%,所得产品结构式如下:
如图23和图24所示,产品核磁表征:1H NMR(400MHz,DMSO)δ8.74(s,1H),8.05(t,J=4.6Hz,1H),7.61(dd,J=12.9,5.3Hz,3H),7.33(dd,J=8.7,2.6Hz,1H),7.25(d,J=16.0Hz,4H),7.14(d,J=8.0Hz,2H),6.82(m,1H),6.50(d,J=2.9Hz,1H),2.34(s,3H),2.23(s,3H).13C NMR(101MHz,DMSO)δ159.45,152.22,144.92,140.54,137.74,133.69,131.50,129.39,129.03,127.41,126.85,126.15,121.35,116.83,71.32,21.03,20.59.
实施例13
2-吡啶-3-(3′-吡啶氨基)-6-氯-4(1H)-喹唑啉酮的制备
将1mmol的5-Cl靛红酸酐溶于体积比为1:4的乙醇与水混合液溶剂中,加入2.2mmol 3-吡啶苯甲醛和1mmol的水合肼,以0.15mmol纳米氧化铜为催化剂,于76℃下加热回流5小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到243mg褐色固体,产率为67%,所得产品结构式如下:
如图25和图26所示,产品核磁表征:1H NMR(400MHz,DMSO)δ9.05(s,1H),8.84(s,1H),8.58(dd,J=42.5,5.3Hz,3H),8.15(dd,J=48.1,5.0Hz,2H),7.72(dd,J=33.4,5.0Hz,2H),7.43(m,4H),6.89(d,J=8.7Hz,1H),6.68(d,J=2.1Hz,1H).13C NMR(101MHz,DMSO)δ159.68,151.31,150.34,149.71,149.05,147.94,144.92,134.93,134.19,134.11,133.72,130.05,127.07,124.00,123.68,121.94,117.08,115.56,70.53.
实施例14
2-呋喃-3-(2′-呋喃氨基)-6-氯-4(1H)-喹唑啉酮的制备
将1mmol的5-Cl靛红酸酐溶于NMP溶剂中,加入2mmol呋喃甲醛和1mmol的水合肼,以0.15mmol纳米氧化铈为催化剂,于76℃下加热回流5小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到246mg褐色固体,产率为72%,所得产品结构式如下:
如图27和图28所示,产品核磁表征:1H NMR(400MHz,DMSO)δ8.90(s,1H),8.04(d,J=3.2Hz,1H),7.88(d,J=1.2Hz,1H),7.63(m,2H),7.37(dd,J=8.7,2.5Hz,1H),6.99(d,J=3.3Hz,1H),6.87(d,J=8.7Hz,1H),6.66(dd,J=3.4,1.8Hz,1H),6.51(d,J=3.2Hz,1H),6.37(dd,J=3.2,1.8Hz,1H),6.28(d,J=3.2Hz,1H).13C NMR(101MHz,DMSO)δ159.37,151.74,149.02,145.76,144.74,143.34,141.79,133.74,126.80,121.70,116.84,115.87,115.63,112.32,110.41,108.37,66.47.
实施例15
2-苯基-3-(4′-溴-苄亚甲基氨基)-6-氯-4(1H)-喹唑啉酮的制备
将1mmol的5-Cl靛红酸酐溶于乙醇溶剂中,加入2.2mmol对溴苯甲醛和1mmol的水合肼,以0.15mmol纳米氧化铜为催化剂,于76℃下加热回流5小时,用TLC监测反应的进行,反应完全后浓缩,经柱层析分离,得到361mg淡黄色固体,产率为70%,所得产品结构式如下:
如图29和图30所示,产品核磁表征:1H NMR(400MHz,DMSO)δ8.85(s,1H),8.17(d,J=2.8Hz,1H),7.84(d,J=8.4Hz,1H),7.74(d,J=8.4Hz,1H),7.66(s,3H),7.57(d,J=8.4Hz,2H),7.34(m,3H),6.85(d,J=8.7Hz,1H),6.57(d,J=2.8Hz,1H).13C NMR(101MHz,DMSO)δ159.43,150.84,144.76,138.88,133.45,132.00,131.87,131.51,130.19,129.23,128.46,126.97,124.02,121.69,116.99,115.61,71.01. 。
- 还没有人留言评论。精彩留言会获得点赞!