一种高生物活性细胞膜仿生微囊泡及其制备方法与应用与流程
本发明涉及一种细胞膜仿生微囊泡的制备方法与应用,尤其涉及一种具有高生物活性的细胞膜仿生微囊泡及其制备方法与应用。
背景技术:
仿生微囊泡主要是由磷脂和蛋白组成的、类似细胞膜的封闭双分子层结构。仿生微囊泡具有类似细胞膜的结构、类似细胞大小的尺寸,以及可提供相对稳定的内环境的特点,因此被广泛用于细胞仿生研究。目前,仿生微囊泡被用于模拟生命活动过程,模拟细胞的结构和功能以及构筑智能仿生系统,引起化学和生物交叉领域的广泛关注。研究显示,具有类似细胞膜结构的仿生微囊泡是用于细胞仿生研究的理想模型,目前,细胞膜仿生微囊泡主要作为细胞膜模型用来研究细胞膜的相结构和相分离、细胞膜脂筏区的性质、以及生物分子相互作用等。
化学合成法(水合法、乙醇注射法、双重乳剂法等)是制备微囊泡的常用方法。虽然化学合成的微囊泡结构简单,成分可调控,但是这种微囊泡缺乏生物活性组分,难以模拟天然细胞膜复杂的结构和性质。相对而言,从细胞中提取的细胞膜仿生微囊泡由于具有类似细胞膜的结构和组分,有利于细胞仿生研究。
目前,从细胞中提取细胞膜仿生微囊泡的方法主要使用化学试剂诱导法或者高盐试剂诱导法,例如:erdincsezgin等人采用含有多聚甲醛、二硫苏糖醇的缓冲液与细胞孵育,从而获取细胞膜微囊泡,但二硫苏糖醇是一种还原剂,可以破坏蛋白质中半胱氨酸间的二硫键,多聚甲醛能使蛋白交联,因此影响细胞膜微囊泡的生物活性;cohen等人采用低渗溶液处理细胞,通过将细胞与缓冲液孵育使细胞产生细胞膜微囊泡,但这种方法仅对基底具有高粘附能力的细胞(如,表皮样癌细胞系a431)有效;nualadelpiccolo等人利用含有氯盐的缓冲溶液(200mmnacl,5mmkcl,0.5mmmgcl2,0.75mmcacl2溶解在ph=8.5的n,n-二羟乙基甘氨酸中)从中国仓鼠卵巢细胞(cho)中提取细胞膜微囊泡,然而进行后续研究时,这种制备方法存在需要分离细胞膜微囊泡的问题。总之,现有的制备细胞膜微囊泡的方法存在以下问题:(1)化学试剂或者高盐缓冲液不利于保持细胞膜上生物分子的活性,不利于长时间保存;(2)由于使用生物不相容缓冲液,需要繁琐的分离提纯操作,费时费力、产率低,不利于后续研究。
对比文件1:cn106289927a公开一种从肿瘤细胞上清中分离微囊泡及其外泌体的方法,所述方法为:将肿瘤细胞贴壁培养后,取培养液离心,取上清液与偶联复合物混合,在4℃、100~300rpm水平振荡条件下孵育3~16h,去除液体,获得孵育后的偶联复合物并用pbs缓冲液清洗,获得吸附微囊泡的偶联微球;本发明采用的方法提取的总微囊泡,保留了全部微囊泡的结构和成分,产量高。并且可以进行二次分选,对特定的微囊泡进行分析,提高了提取效率和研究价值。总共的提取时间最少只要4小时,就可以完成微囊泡的提纯,最少5小时可以完成外泌体的提纯。该对比文件公开的方法通过偶联复合物提取微囊泡,虽然可以保留微囊泡的结构和成分,具有较好的生物活性,但是其生物相容性不佳,且上述方法主要适用于肿瘤细胞,普适性也有待提高。
针对相关研究现状,本发明拟提出一种产率高、普适性好、可使生物分子保持较好生物活性的细胞膜仿生微囊泡的制备技术。
技术实现要素:
本发明要解决的技术问题是提供一种高生物活性细胞膜仿生微囊泡的制备方法,该方法普适性好,制备出来的细胞膜仿生微囊泡产率高且保持较好的生物活性和生物相容性,其具有类似细胞膜的结构和性质,是研究精准药物递送、细胞仿生以及细胞膜结构和性质的理想模型。
为了解决上述技术问题,本发明采用以下技术方案:
首先,提供一种高生物活性细胞膜仿生微囊泡的制备方法,具体是一种将贴壁细胞与纳米材料孵育后,置于生物相容性缓冲液中并于白光光源光照下,制备高生物活性细胞膜仿生微囊泡的方法。
进一步地,上述方法具体包括如下步骤:
s1、加样:将培养贴壁细胞的培养皿中的培养基吸净,然后采用dpbs缓冲液或pbs缓冲液清洗贴壁细胞,接着加入细胞培养基,细胞培养基的加入量以每100万贴壁细胞2~4ml计,然后再向培养皿中按每毫升细胞培养基加入8~15μl的纳米材料,摇匀;
s2、孵育:将混匀好的培养皿放入37℃(温度的选择参照细胞培养标准条件即可)培养箱中孵育2~4h;
s3、换液:待步骤s2的纳米材料与贴壁细胞孵育完成后,吸净培养皿中的培养基,然后采用dpbs缓冲液或pbs缓冲液清洗贴壁细胞,再加入生物相容性缓冲液,生物相容性缓冲液的加入量以每100万贴壁细胞2~4ml计;
s4、光照:将步骤s3更换完培养基的贴壁细胞置于白光光源下光照30~90min;白光光源的波长为400~700nm;
s5、静置:将光照完成后的贴壁细胞放于避光的环境下静置5~14h,接着收集培养皿中的溶液即可获得细胞膜仿生微囊泡。
进一步地,
所述贴壁细胞包括肿瘤细胞和非肿瘤细胞。
进一步地,
肿瘤细胞为hepg2细胞(即肝癌细胞,属于肿瘤细胞)、hela细胞(宫颈癌细胞,属于肿瘤细胞)等肿瘤细胞。
进一步地,
非肿瘤细胞为lo2细胞(即人正常肝细胞,属于非肿瘤细胞)等正常细胞。
进一步地,
所述纳米材料为富勒烯酸衍生物纳米材料。
优选地,所述富勒烯酸衍生物纳米材料为二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒、三加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒等。
进一步地,
步骤s1中的细胞培养基包括但不限于dmem液体培养基、1640培养基中的任意一种。
进一步地,
所述生物相容性缓冲液包括但不限于dmem培养基、1640培养基、dpbs缓冲液、pbs缓冲液、hepes缓冲液中的任意一种。
dmem(dulbecco'smodifiedeaglemedium的缩写)是一种含各种氨基酸和葡萄糖的细胞培养基;rpmi-1640培养基,是rpmi(roswellparkmemorialinstitute,)洛斯维·帕克纪念研究所研发的代号为1640的细胞培养基;dpbs:杜氏磷酸盐缓冲液(dulbecco'sphosphatebufferedsaline);pbs:磷酸盐缓冲溶液(phosphatebuffersaline);hepes:4-羟乙基哌嗪乙磺酸,一种氢离子缓冲剂。
本发明还提供上述制备方法制备的高生物活性的细胞膜仿生微囊泡。
本发明还提供上述制备方法制备的高生物活性的细胞膜仿生微囊泡在构建细胞仿生模型中的应用。
所述细胞仿生模型能用于细胞膜的相结构、相分离,细胞膜脂筏区的性质及生物分子反应以及细胞智能仿生系统构建等方面的仿生研究。
该制备方法的工作原理:
在贴壁细胞孵育过程中,贴壁细胞会将富勒烯酸衍生物纳米材料吞进细胞,白光(400~700nm)光照下,可以使富勒烯酸衍生物纳米材料在细胞内通过能量、电子转移产生活性氧(ros),产生的ros会破坏细胞内溶酶体、线粒体、高尔基体等细胞器的结构,从而使细胞内渗透压发生变化,细胞发生肿胀,产生囊泡。
本发明的有益效果:
1、本发明提供的是一种在生物相容性缓冲液中采用纳米材料(优选富勒烯酸衍生物纳米材料)辅助制备高生物活性细胞膜仿生微囊泡的方法,提取的细胞膜仿生微囊泡膜具有类似细胞膜的结构和性质,是研究精准药物递送、细胞仿生以及细胞膜结构和性质的理想模型。
2、由于本发明的细胞膜仿生微囊泡是在生物相容性缓冲液中制备,具有良好的生物相容性,且极大地保留了细胞膜的生物活性,而且无需分离操作即可用于后续研究,操作简单、成本低、有利于其广泛应用。
3、本发明提取的细胞膜仿生微囊泡产率高,是化学试剂诱导法(多聚甲醛和二硫苏糖醇)的3~6倍;本发明提供的制备方法普适性好,适用于所有贴壁细胞,包括肿瘤细胞和非肿瘤细胞。
4、相比现有采用化学试剂诱导法(多聚甲醛和二硫苏糖醇)和高盐缓冲液法从细胞中提取细胞膜仿生微囊泡的方法,本发明所提出的制备细胞膜仿生微囊泡的新方法不仅可以获得具有高生物活性的细胞膜仿生微囊泡,更重要的是还能解决现有技术繁琐的分离操作,解决传统细胞膜仿生微囊泡由于制备方法的缺陷导致其生物应用受限的问题,具有广泛的应用前景。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
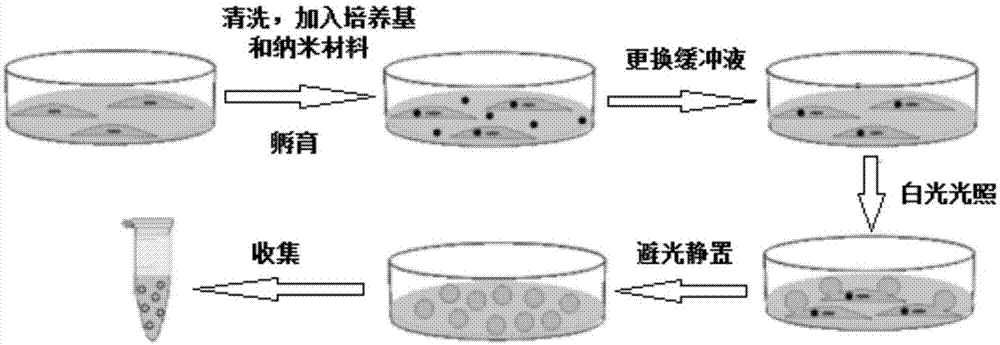
图1为本发明的制备工艺流程图;
图2a为染料孵育的实施例1细胞膜仿生微囊泡y1的形态分布激光共聚焦图(标尺20μm);
图2b为本发明实施例1制得的细胞膜仿生微囊泡y1尺寸分布图(标尺20μm);
图3a为cem细胞与胚乳凝集素孵育前的明场与荧光叠加图(标尺10μm);
图3b为cem细胞与胚乳凝集素孵育后的明场与荧光叠加图(标尺10μm);
图3c为实施例1细胞膜仿生微囊泡y1与胚乳凝集素孵育前的明场与荧光叠加图(标尺10μm);
图3d为实施例1细胞膜仿生微囊泡y1与胚乳凝集素孵育后的明场与荧光叠加图(标尺10μm);
图3e为pe标记cd71抗体与实施例1细胞膜仿生微囊泡y1孵育结果活性表征图(标尺30μm);
图3f为pe标记igg2a抗体与实施例1细胞膜仿生微囊泡y1孵育结果图(标尺30μm);
图4为不同制备方法制备的细胞膜微囊泡的产率对比图,其中空白柱状图为采用化学试剂诱导法(多聚甲醛、二硫苏糖醇)制备的细胞膜微囊泡的产率;斜线柱状图为采用本发明制备的细胞膜微囊泡的产率;
图5a为对比例4中hela细胞与富勒烯酸衍生物孵育后未经白光光照的明场图(标尺:10μm);
图5b为对比例4中hela细胞与富勒烯酸衍生物孵育后未经白光光照后与细胞膜染料、细胞核染料染色后荧光与明场叠加图(标尺:10μm);
图5c为实施例1中hela细胞与富勒烯衍生物孵育后经白光光照后的明场图(标尺:10μm);
图5d为实施例1中hela细胞与富勒烯衍生物孵育后经白光光照后与细胞膜染料、细胞核染料染色后荧光与明场叠加图(标尺:10μm);
图6a为hela细胞与富勒烯衍生物孵育后,经线粒体染料、细胞核染料染色后荧光与明场叠加图;
图6b为hela细胞与富勒烯衍生物孵育后,经细胞膜染料、细胞核染料染色后荧光与明场叠加图;
图6c为hela细胞与富勒烯衍生物孵育后,经线粒体染料、细胞核染料、细胞膜染料染色后荧光与明场叠加图;
图6d为hela细胞与原卟啉ix孵育后,经线粒体染料、细胞核染料染色后荧光与明场叠加图;
图6e为hela细胞与原卟啉ix孵育后,经细胞膜染料、细胞核染料染色后荧光与明场叠加图;
图6f为hela细胞与原卟啉ix孵育后,经线粒体染料、细胞核染料、细胞膜染料染色后荧光与明场叠加图。
具体实施方式
下面结合实施例及附图对发明进一步说明,但不用来限制本发明的范围。
实施例1
如图1所示,本实施例提供一种hela细胞的细胞膜仿生微囊泡的方法,具体包括如下步骤:
s1、加样:用胶头滴管将培养hela细胞(数量约200万)的大皿中的培养基吸净,dpbs缓冲液清洗,加入4ml1640培养基,再向大皿中加入40μl二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒,摇匀;
s2、孵育:将混匀好的大皿放入37℃培养箱中孵育2h;
s3、换液:待步骤s2中二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒与hela细胞孵育完成后,用胶头滴管吸净大皿中的培养基,再次用dpbs缓冲液清洗细胞,然后加入4ml1640培养基;
s4、光照:将步骤s3中更换完培养基的hela细胞置于白光光源(400~700nm)下光照60min;
s5、静置:将光照完成后的细胞放于避光的环境下静置12h,用移液枪收集培养皿中的溶液,即可获得细胞膜仿生微囊泡,记为样品p1。
实施例2
如图1所示,本实施例提供一种制备hela细胞的细胞膜仿生微囊泡的方法,包括如下步骤:
s1、加样:用胶头滴管将培养hela细胞(数量约200万)的大皿中的培养基吸净,dpbs缓冲液清洗,加入6ml1640培养基,再向大皿中加入60μl二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒,摇匀;
s2、孵育:将混匀好的大皿放入37℃培养箱中孵育2h;
s3、换液:待二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒与hela细胞孵育完成后,用胶头滴管吸净大皿中的培养基,dpbs缓冲液清洗细胞,加入6mldmem液体培养基;
s4、光照:将步骤s3中更换完培养基的细胞置于白光光源(400~700nm)下光照60min;
s5、静置:将光照完成后的细胞放于避光的环境下静置10h,用移液枪收集培养皿中的溶液,即可获得细胞膜仿生微囊泡,记为样品p2。
实施例3
本实施例提供一种在dpbs缓冲液中制备hela细胞的细胞膜仿生微囊泡的方法,包括如下步骤:
s1、加样:用胶头滴管将培养hela细胞(数量约200万)的大皿中的培养基吸净,dpbs缓冲液清洗,加入8mldmem液体培养基,再向大皿中加入64μl三加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒,混匀;
s2、孵育:将混匀好的大皿放入37℃培养箱中孵育4h;
s3、换液:待三加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒与hela细胞孵育完成后,用胶头滴管吸净大皿中的培养基,dpbs缓冲液清洗细胞,加入8mldpbs缓冲液;
s4、光照:将更换完培养基的细胞置于白光光源(400~700nm)下光照90min;
s5、静置:将光照完成后的细胞放于避光的环境下静置14h,用移液枪收集培养皿中的溶液,即可获得细胞膜仿生微囊泡,记为样品p3。
实施例4
本实施例提供一种制备hela细胞的细胞膜仿生微囊泡的方法,包括如下步骤:
s1、加样:用胶头滴管将培养hela细胞(数量约200万)的大皿中的培养基吸净,pbs缓冲液清洗,加入4ml1640培养基,再向大皿中加入60μl三加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒,摇匀;
s2、孵育:将混匀好的大皿放入37℃培养箱中孵育3h;
s3、换液:待三加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒与hela细胞孵育完成后,用胶头滴管吸净大皿中的培养基,pbs缓冲液清洗细胞,加入4mlpbs缓冲液;
s4、光照:将更换完培养基的细胞置于白光光源(400~700nm)下光照30min;
s5、静置:将光照完成后的细胞放于避光的环境下静置12h,用移液枪收集培养皿中的溶液,即可获得细胞膜仿生微囊泡,记为样品p4。
实施例5
本实施例提供一种制备hela细胞的细胞膜仿生微囊泡的方法,包括如下步骤:
s1、加样:用胶头滴管将培养hela细胞(数量约200万)的大皿中的培养基吸净,pbs缓冲液清洗,加入4ml1640培养基,再向大皿中加入40μl二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒,摇匀;
s2、孵育:将混匀好的大皿放入37℃培养箱中孵育3h;
s3、换液:待二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒与hela细胞孵育完成后,用胶头滴管吸净大皿中的培养基,pbs缓冲液清洗细胞,加入4mlhepes;
s4、光照:将更换完培养基的细胞置于白光光源(400~700nm)下光照60min;
s5、静置:将光照完成后的细胞放于避光的环境下静置5h,用移液枪收集培养皿中的溶液,即可获得细胞膜仿生微囊泡,记为样品p5。
实施例6
本实施例提供一种在生物相容缓冲液1640培养基中制备lo2细胞的细胞膜仿生微囊泡的方法,本实施例与实施例1的区别在于是采用实施例提供的制备方法制备lo2细胞的细胞膜仿生微囊泡,记为样品p6。
实施例7
本实施例提供一种在生物相容缓冲液1640培养基中制备hepg2细胞的细胞膜仿生微囊泡的方法,本实施例与实施例1的区别在于是采用实施例提供的制备方法制备hepg2细胞的细胞膜仿生微囊泡,记为样品p7。
对比例1
本对比例与实施例1的区别在于:参照erdincsezgin等人采用含有多聚甲醛、二硫苏糖醇的缓冲液与细胞孵育的方法(化学试剂诱导法),对hela细胞进行孵育,从而获取hela细胞的细胞膜仿生微囊泡,记为样品d1。
对比例2
本对比例与实施6的区别在于:参照erdincsezgin等人采用含有多聚甲醛、二硫苏糖醇的缓冲液与细胞孵育的方法(化学试剂诱导法),对lo2细胞进行孵育,从而获取lo2细胞的细胞膜仿生微囊泡,记为样品d2。
对比例3
本对比例与实施例7的区别在于:参照erdincsezgin等人采用含有多聚甲醛、二硫苏糖醇的缓冲液与细胞孵育的方法(化学试剂诱导法),对hepg2细胞进行孵育,从而获取hepg2细胞的细胞膜仿生微囊泡,记为样品d3。
对比例4
本对比例与实施例1的区别在于:
省去步骤s4的光照,直接经s1、加样;s2孵育和s3换液后,放于避光的环境下静置12h,收集培养基中的溶液记为样品d4。
对比例5
本对比例与实施例1的区别在于:
将步骤s1中加入的40μl二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒替换为原卟啉ix(protoporphyrinix),其他步骤与实施例1相同,最后收集培养基中的溶液记为样品d5。
对上述实施例和对比例进行如下实验验证:
1、细胞膜仿生微囊泡的形态及尺寸分布
实施例1~7均产生了细胞膜仿生微囊泡,对本发明实施例1~7制得的样品p1~p7进行激光共聚焦扫描,得知本发明实施例制得的细胞膜仿生微囊泡样品的具有类似细胞大小的尺寸,图2a、2b分别为本发明实施例制得的细胞膜仿生微囊泡样品p1的形态分布激光共聚焦图和尺寸分布图,从图中可以看出:样品p1的形态具有类似细胞大小的尺寸,囊泡尺寸主要分布在15μm左右。
2、细胞膜仿生微囊泡的生物活性表征
(1)将本发明实施例1的hela细胞的仿生微囊泡样品p1与胚乳凝集素进行孵育,比对孵育前后的囊泡生物活性,同时还将cem细胞与胚乳凝集素进行孵育,比对孵育前后的囊泡生物活性,由于胚乳凝集素可以特异性识别膜上的糖类物质,因此通过比对能间接得知我们制备的囊泡膜上的糖是否保持了原有的结构。
由图3a(cem细胞与胚乳凝集素孵育前)、3b(cem细胞与胚乳凝集素孵育后)的明场与荧光叠加图及图3c(囊泡与胚乳凝集素孵育前)、3d(囊泡与胚乳凝集素孵育后)的明场与荧光叠加图可知:细胞膜微囊泡表面糖分子复合物被保留在囊泡表面。
pe标记cd71抗体、igg2a抗体,分别与仿生微囊泡样品p1进行孵育,如附图3e所示,其结果显示:细胞膜微囊泡p1表面的转铁蛋白受体(cd71)生物活性被保持,可以被cd71抗体特异性识别;如附图3f所示,其结果显示:细胞膜仿生微囊泡p1表面的cd71不能被igg2a抗体特异性识别,证明细胞膜仿生微囊泡表面抗原仍然保持其原有的结构,仍能够被对应抗体特异性识别。
依照上述方法对样品y2~y7进行生物活性测试,也同样发现样品y2~y7的囊泡表面的转铁蛋白受体(cd71)生物活性保持,可以被对应的抗体特异性识别。
因此,本发明方法制得的hela细胞的仿生微囊泡具有很好的生物活性,而对比例1~3采用的是化学试剂诱导法(多聚甲醛+二硫苏糖醇),由于二硫苏糖醇是一种还原剂,会破坏蛋白质中半胱氨酸间的二硫键,而多聚甲醛能使蛋白交联,因此会影响细胞膜微囊泡的生物活性。
3、不同制备方法的产率比对
实施例1~7,对比例1~5的产率如下表1:
表1各实施例、对比例的囊泡产率比对表
从上表1和附图4,可以得知:本发明的制备方法针对不同的贴壁细胞(hela细胞、lo2细胞、hepg2细胞)均有较高的产率(实施例1hela细胞79.88%、实施例6lo2细胞67.12%、实施例7hepg2细胞78.79%),相比对应的对比例的产率有显著的增长(对比例1hela细胞21.40%、对比例2lo2细胞25.32%、对比例3hepg2细胞10.79%)。
4、白光光照的影响
将实施例1制得的样品y1(二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒,1640培养基,白光光照60min)与对比例4制得的样品d4(二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒,1640培养基,未经光照)分别进行激光共聚焦扫描,结果如附图5a、5b、5c、5d所示,图5a为对比例4中hela细胞与二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒孵育后未经白光光照的明场图;图5b为对比例4中hela细胞与二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒孵育后未经白光光照后与细胞膜染料、细胞核染料染色后荧光与明场叠加图;图5c为实施例1中hela细胞与二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒孵育后经白光光照后的明场图(标尺:10μm);图5d为实施例1中hela细胞与二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒孵育后经白光光照后与细胞膜染料、细胞核染料染色后荧光与明场叠加图。从图中可以看出:光照是囊泡产生的关键,未经光照的细胞(样品d4中)未产生囊泡,经光照照射的细胞(样品y1中)产生囊泡。
5、纳米材料的影响
将实施例1制得的囊泡样品y1(二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒+1640培养基孵育,白光光照60min)与对比例5制得的样品d5(原卟啉ix+1640培养基孵育,白光光照60min)激光共聚聚扫描,结果如附图6a、6b、6c、6d、6e、6f所示,图6a、6d分别表示样品y1、d5与线粒体染料、细胞核染料叠加图;图6b、6e分别表示样品y1、d5与细胞膜染料、细胞核染料叠加图;图6c、6f分别表示样品y1、d5与线粒体染料、细胞核染料、细胞膜染料的叠加图。结果表明二加成的c70富勒烯丙二酸二乙酯的水解产物纳米颗粒(富勒烯酸衍生物)是囊泡产生的关键,图6a-6c表示加入富勒烯酸衍生物的细胞(样品y1中)产生囊泡,图6d-6f表示加入原卟啉ix的细胞(样品d5中)未产生囊泡。
综上,可知:本发明提供的在生物相容性缓冲液中采用纳米材料辅助制备的细胞膜仿生微囊泡,具有类似细胞膜的结构和性质和良好的生物相容性,且极大地保留了细胞膜的生物活性;与化学试剂诱导法(多聚甲醛和二硫苏糖醇)制备细胞膜仿生微囊泡的方法相比,本发明的产率显著提高,是化学试剂诱导法的3~6倍;且本发明提供的制备方法普适性好,能适用于所有贴壁细胞,包括肿瘤细胞和非肿瘤细胞。
本发明制得的细胞膜仿生微囊泡无需分离操作即可用于后续研究,操作简单、成本低、有利于其广泛应用,是研究精准药物递送、细胞仿生以及细胞膜结构和性质的理想模型。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等同物界定。
- 还没有人留言评论。精彩留言会获得点赞!