使用聚合微管蛋白纯化核酸的方法和工具与流程
本发明涉及用于纯化核酸的方法和工具;并且更具体地,涉及适用于高通量测序和诊断的纯化方法。
背景技术:
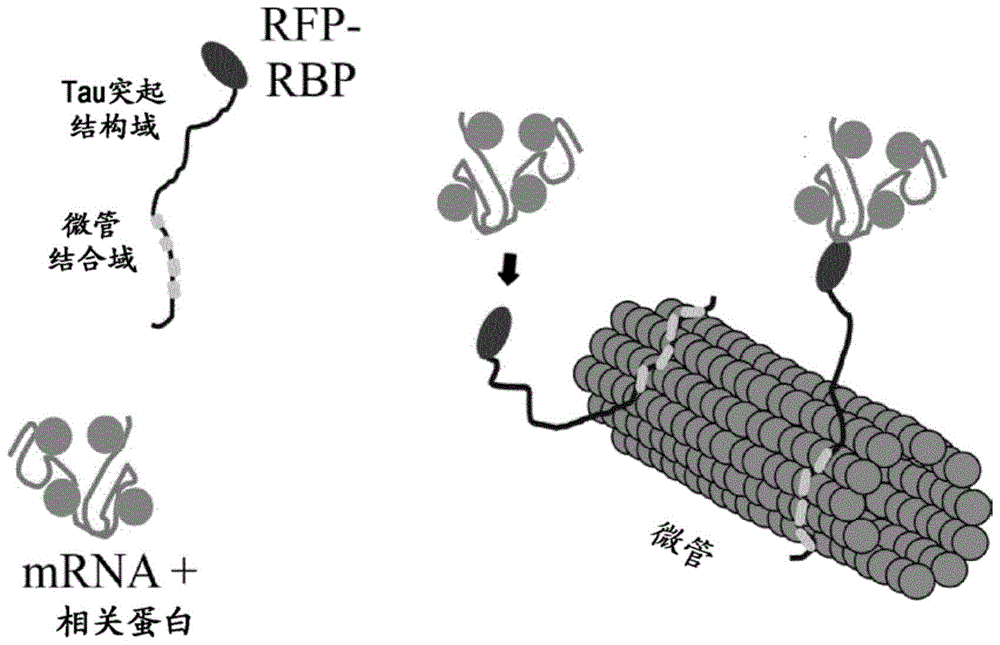
:分子诊断学变得日益重要。不仅已经找到了进入疾病临床诊断的途径(尤其是感染性试剂的检测、基因组突变的检测、循环肿瘤细胞的发现以及对疾病易感性的风险因素的识别),而且在兽医、环境分析和食品测试中,也正在使用分子诊断方法。在病理学/细胞学研究所或法医问题方面的测试代表进一步的应用领域。在医疗保健方面(例如,在没有感染性试剂的情况下对血液供应进行测试),也正在使用基因诊断法,且立法者计划在将来通过法律规范此类测试。用于临床分子诊断的方法(例如杂交或扩增技术,诸如聚合酶链反应(pcr)、转录介导的扩增(tma)、连接酶链反应(lcr)、支链dna(bdna)或基于核酸序列的扩增(nasba)技术)也是基础科学研究常规程序的一部分。特别地,通过测定组织中的基因表达,核酸分析为癌症的研究和诊断开辟了有希望的新可能性。因此,例如,微阵列系统打开了在单个反应中测定数百个甚至数千个基因表达的可能性。例如,从样品材料开始,将纯化的核酸(即rna或cdna)施加到包含相应捕获寡核苷酸的芯片上,因此可以通过杂交检测样品中的核酸。另外,用于检测样品中的核酸的其他方法,例如扩增方法(诸如聚合酶链反应(pcr)),也被广泛使用。核酸分析中的一个基本问题是样品制备。待研究的样品通常包含具有干扰的部分不溶性成分(称为碎片)的细胞或组织,这些成分可能会干扰目标核酸随后的分离和分析。这种不溶性成分特别是在从粪便/大便、血液、疣、钙化结构(骨骼)或严重坏死的组织样本中分离核酸的情况下出现。在最广泛的意义中,碎片还可包括在分离核酸期间应去除的其他可溶性成分。用于纯化核酸的方法(尤其是在测序之前)已经在本领域有报道。例如,磁性固相载体(诸如功能化的珠或颗粒),已经在用于可逆结合核酸的方法中使用了数年(参见参考文献us5705628a),以用于纯化所述核酸的特定目的。另外,在对以低于核糖体rna的含量存在的信使rna和其他非编码rna进行测序之前,磁性固相载体(诸如功能化的珠或颗粒)已用于从总rna样品中去除核糖体rna。同样,rna免疫沉淀测序(rip-seq)方法包括映射蛋白质与rna-蛋白质复合物中的rna结合的位点。在这种方法中,rna-蛋白质复合物用靶向目标蛋白质的抗体免疫沉淀。然后,提取通过免疫沉淀回收的rna分子、逆转录为cdna、鉴定并定量。或者,在部分rnase消化后,则通过其与蛋白质结合而被保护的rna序列可被映射回基因组,而cdna的深度测序可进一步提供结合rna的单碱基分辨率(参见参考文献us2002/0004211a1,其涉及用于区分内源性细胞mrna-蛋白质(mrnp)复合物的方法)。仍然需要用于纯化核酸(尤其来自生物样品的核酸)的有效方法和工具,其仍可负担、可再现且与高通量测序和诊断兼容。发明简述根据第一目的,本发明涉及一种用于纯化样品中的核酸分子的方法,至少包括以下步骤:a)在有效条件下使所述样品与至少一种微管蛋白和一种或多种包含核酸结合部分和聚合微管蛋白结合部分的核酸捕获蛋白接触,以与结合所述待纯化核酸的所述核酸捕获蛋白复合形成聚合微管蛋白;和b)回收所述结合核酸分子的核酸捕获蛋白,从而纯化所述核酸分子。根据另一目的,本发明涉及一种表征(优选测序)样品中的核酸分子的方法,至少包括以下步骤:a)在有效条件下使所述样品与至少一种微管蛋白和一种或多种包含核酸结合部分和聚合微管蛋白结合部分的核酸捕获蛋白接触,以与结合所述待纯化核酸的所述核酸捕获蛋白复合形成聚合微管蛋白;b)回收所述结合核酸分子的核酸捕获蛋白,从而纯化所述核酸分子;和c)表征(优选测序)所述纯化的核酸分子。根据另一目的,本发明涉及一种用于比较两个样品之间的靶核酸分子的量的方法,至少包括以下步骤:a)通过使用选择的核酸捕获蛋白对第一样品施加上述定义的方法,以获得纯化的靶核酸分子的第一集合,b)通过使用与步骤a)中使用的相同的选择的核酸捕获分子对第二样品施加上述定义的方法,以获得纯化的靶核酸分子的第二集合,和c)测定分别包含在纯化的靶核酸分子的第一集合和纯化的靶核酸分子的第二集合中的靶核酸分子的量。根据另一目的,本发明涉及一种制备用于纯化样品中所含的核酸分子的亲和载体的方法,包括将一种或多种核酸捕获蛋白固定于聚合微管蛋白上的体外步骤;其中所述核酸捕获蛋白包含核酸结合部分和聚合微管蛋白结合部分。根据另一目的,本发明涉及一种用于纯化核酸分子和/或用于制备用于纯化核酸分子的亲和载体的试剂盒,其包含:a)至少一种核酸捕获蛋白,和/或包含用于表达核酸捕获蛋白的表达盒的载体,和/或表达核酸捕获蛋白的细胞;和b)冻干或纯化的微管蛋白;其特征在于所述核酸捕获蛋白包含核酸结合部分和聚合微管蛋白结合部分。根据另一目的,本发明涉及用于纯化核酸分子的亲和载体,所述核酸分子包含固定于重组或合成的聚合微管蛋白上的核酸捕获蛋白,其中所述核酸捕获蛋白包含核酸结合部分和聚合微管蛋白结合部分。附图说明图1:微管工作台和rbp功能示范。a.将rbp带到微管上的方法的示意图。b.rt-pcr测定的示意图(方案1)。通过添加羊脑微管并离心,从表达tau-rfp-rbp的hek293t细胞的提取物中纯化mrnp。c.rt-pcr测定的示意图(方案2)。在适于微管蛋白聚合的条件下,通过添加未聚合的微管蛋白并离心,从表达tau-rfp-rbp的hek293t细胞的提取物中纯化mrnp。图2:tau-rbp与微管结合的分析。a.rt-pcr分析从表达指定构建体的hek293t细胞的微管沉淀中分离的gapdh和肌动蛋白mrna的存在。为了比较,将微管沉淀的ct值减去离心前在全细胞裂解液中获得的ct值。ct表示循环阈值。报告的值是平均值±sd(n=3)。y轴表示为δct[微管沉淀-细胞裂解液]。b&c.从表达指定的tau-gfp-rbp(上图)的hek293t细胞或通过表达gfp-rbp的细胞的抗gfp免疫沉淀(ip)(下图)对微管沉淀中分离的mrna进行rt-pcr分析。y轴表示为log2富集。图3:纯化的tau-rfp-yb-1可以用作蛋白诱饵来纯化mrna。琼脂糖凝胶对应于tau-rfp-yb-1与微管在右侧条带上共沉淀后每个部分的含量。不含tau-rfp-yb1或微管的对照分别显示于左侧和中间条带上。在上部,“s”代表上清液级分,“p”代表沉淀级分。发明详述本发明的目的是满足上述需求。如本文所用,表述“包含”也包括“由...组成”。如本文所用,表述“至少一个”还包括“一个”或“一个以上”或“多个”。如本文所用,“样品”可以指易于含有核酸的任何样品,尤其是任何生物样品。特别地,这可以涵盖包含细胞、细胞裂解液和/或生物流体或由细胞、细胞裂解液和/或生物流体组成的任何样品。因此,以非排他性的方式,样品可以由细胞或细胞裂解液,诸如由原核或真核细胞、或其裂解液组成。因此,这种样品可以是但不限于体液(例如血液、血浆、血清或尿液)、器官、组织、级分和从包括人的哺乳动物分离的细胞。生物样品还可以包括生物样品(包括组织)的切片(例如,器官或组织的切片部分)。生物样品还可以包括来自生物样品的提取物,例如,生物样品还含有来自生物流体(例如血液或尿液)的抗原的生物样品。生物样品可以是原核生物来源的或真核生物来源的(例如昆虫、原生动物、鸟、鱼、爬行动物)。在一些实施方案中,生物样品是哺乳动物(例如,大鼠、小鼠、牛、狗、驴、豚鼠或兔)。在某些实施方案中,生物样品是灵长类动物来源(例如,黑猩猩或人)。如本文所用,表述“纯化核酸”包括游离形式和/或结合形式(即与核酸结合分子复合的)的纯化核酸分子。如本文所用,“核酸捕获蛋白”包含至少一个核酸结合部分和至少一个(优选多于一个)聚合微管蛋白结合部分。如本文所用,表述“核酸”或“核酸分子”可包括适于在样品中纯化的任何形式的核酸,其以非排他性方式包括dna和rna(特别是基因组dna)、质粒dna以及pcr片段、cdna、mrna、mirna、sirna、以及寡核苷酸和修饰的核酸(例如pma或lma)。还可以从以下来源纯化病毒或细菌的rna和dna或核酸:人、动物或植物来源和/或未修饰的核酸;以及非天然存在和/或修饰的核酸,诸如包括核酸类似物和/或dna/rna混合物的核酸分子。优选地,本文考虑的核酸包括rna型的核酸;其可以包括修饰和未修饰的rna分子,诸如甲基化和非甲基化的rna。可以通过根据本发明的方法和工具纯化的核酸可以存在于体液(诸如血液、尿液、粪便、唾液、痰或其他体液)中;存在于生物来源(诸如组织、细胞(特别是动物细胞)、人细胞、植物细胞、细菌细胞等、器官(诸如肝、肾或肺等))中。此外,核酸可以获自载体材料(诸如拭子、巴氏涂片)和稳定培养基(诸如以商标销售的甲醇水溶液或以商标销售的液体基巴氏测试)、或其他液体(例如一般的果汁、水性样品或食品)。另外,核酸可以获自植物材料、细菌裂解液、石蜡包埋组织、水溶液或凝胶。如本文所用,“聚合微管蛋白结合部分”包含具有特异性结合聚合微管蛋白的能力的化合物(通常是肽、蛋白或核蛋白)。然而,所述部分也可以以非聚合形式结合微管蛋白。根据一个实施方案,“聚合微管蛋白结合部分”以其聚合形式结合微管蛋白的特异性高于以其非聚合形式结合微管蛋白的特异性,所述非聚合形式包括其单体形式和/或其异二聚体形式(对应于α/β微管蛋白异二聚体)。例如,聚合微管蛋白结合部分可以大部分或甚至完全结合聚合微管蛋白(诸如微管)。微管是整个细胞质中发现的细胞骨架的组成部分。微管是细胞质内结构网络(“细胞骨架”)的一部分。尽管微管还参与许多其他过程,微管细胞骨架的主要作用是机械载体。因此,微管仅是所谓的“微管细胞骨架”的一部分,因为后者还包括相关蛋白(诸如微管相关蛋白(map))以及其他组织结构(诸如中心体)。“聚合微管蛋白”或“聚合的微管蛋白”仅指单体微管蛋白的组装,或可替代地以规则的方式且具有不同的极性的微管蛋白的异二聚体的组装。微管蛋白的管状聚合物可以长至50微米,平均长度为25μm,并且高度动态。微管的外径通常为约24-25nm,而内径为约12nm。它们存在于真核细胞中,是由两种球形蛋白(α-微管蛋白和β-微管蛋白)的二聚体聚合形成。因此,表述“聚合微管蛋白”涵盖微管。因此,“微管”代表“聚合微管蛋白”的特定重排,其在真核细胞中生理发生,并与其他伙伴形成“微管细胞骨架”。通常将微管的生理组装描述为包括α-微管蛋白和β-微管蛋白异二聚体的调节组装的第一步,它们一起形成极化的原纤维。然后,据信原纤维作为圆柱体组装成所谓的微管。因此,微管通常被描述为α-和β-微管蛋白的二聚体的聚合物,其由围绕中空核心组装的13条原纤维组成。但是,应当注意,在现有技术中还描述了具有不同数量的原纤维的所谓的微管,诸如具有14或15条原纤维的微管。但是,这种变化或“原纤维转变”的生理意义仍不清楚。本领域技术人员知道微管蛋白是球蛋白小家族的几个成员之一。微管蛋白超家族包括五个不同的家族(α-、β-、γ-、δ-和ε-微管蛋白)以及第六个家族(ζ-微管蛋白),它们仅存在于动基体原生动物中。微管蛋白家族中最常见的成员是构成微管的蛋白质alpha-微管蛋白(α-微管蛋白)和beta-微管蛋白(β-微管蛋白)。对应于β-微管蛋白的微管末端称为正末端。对应于α-微管蛋白的微管末端称为负末端。因此,本发明的“聚合微管蛋白结合部分”可以包括α-微管蛋白和/或β-微管蛋白的结合部分和/或其组合,并且优选以其聚合形式而不是其单体形式或其异二聚体形式结合微管蛋白。如本领域已知的,微管蛋白的“异二聚体形式”对应于α/β微管蛋白异二聚体。因此,微管蛋白的聚合形式还对应于异二聚体的聚合物,其还对应于不止一种α/β微管蛋白的异二聚体。作为参考,人α-微管蛋白的序列为:seqidn°7。作为参考,人β-微管蛋白的序列为:seqidn°8。除非另有说明,否则“微管蛋白”是指聚合微管蛋白和非聚合微管蛋白。如本文所用,“亲和载体”或“固体载体”是指亲和纯化中的载体或基质,其包括与特异性配体共价或非共价结合的材料。因此,本发明还涉及与包含核酸结合部分和聚合微管蛋白结合部分的核酸捕获蛋白复合的聚合的微管蛋白在制备亲和载体中的用途。wo2016/012451a1和boca等的(probingproteininteractionsinlivingmammaliancellsonamicrotubulebench.scientificreports5,17304(2015))教导了使用微管结构和动力学检测真核细胞中相互作用的方法和工具。然而,那些文件完全没有提及体外纯化方法,特别是包括回收或收集纯化核酸的步骤,甚至很少提及适用于高通量测序的方法。发明人推测,体内募集到微管的核酸结合蛋白(即rna结合蛋白或rbp)也可以在体外从细胞裂解液中分离。为此,将表达tau-rbp的细胞的裂解液与羊脑微管一起温育。然后,沉淀与所述微管相互作用的核酸蛋白并(即通过rt-pcr)分析核酸含量(即rna含量)。令人惊讶地,现已发现,与不含核酸结合部分的融合蛋白相比,在存在包含核酸结合部分和聚合微管蛋白结合部分的核酸捕获蛋白的情况下,在这些微管沉淀中发现的回收的核酸(即rna)的量急剧增加;并且纯化核酸的回收本身特别有效。该纯化方法还特别适合于高通量测序和/或在用于鉴定或比较一组样品(即细胞裂解液)中核酸含量的诊断方法的情况下。不希望受到理论的束缚,发明人认为,聚合微管蛋白(即,以微管的形式)因此提供了优于已知的替代性固体载体和方法的核酸纯化的许多优点。首先,聚合微管蛋白(即微管)为诱饵蛋白提供了与核酸复合的大表面,该表面由于其尺寸(直径为25nm,长度为十分之一微米)而优于可商购的珠/颗粒。如果我们在典型的哺乳动物细胞(如hela细胞)中考虑100个10μm长的微管,则微管表面大于30μm2,且在细胞(如神经元或肌肉细胞)中甚至可以更大。因此,如此大的表面可用于结合大量不饱和的诱饵(如果诱饵需要在微管上相互作用的表面大到10nm2,实际上,理论上超过300万个诱饵拷贝/细胞可以锚定至微管)。这显著高于转染的哺乳动物细胞中典型的过表达蛋白质的数量(对于大多数蛋白质,约10万个拷贝已经是很大的过表达)。其次,微管蛋白本身是本领域公知的蛋白质,其是可溶的并且可以以纯化或冻干的形式产生,并且也可以以重组或合成方式外源引入。第三,使用微管表面的优点在于其动态行为。微管本质上是高度动态的,并且在缩短和生长阶段之间永久交替。这种行为允许在解聚期间将诱饵与微管解离,并结合另一个微管或在微管蛋白重新聚合后结合另一个微管。在该时间间隔期间,诱饵从微管移开,然后能够捕获位于介质中而不是在微管附近的猎物。为此,也可以使用微管稳定药物(诸如紫杉醇)和破坏微管或解聚微管的药物(诸如诺考达唑、长春花碱、长春新碱、秋水仙碱、秋水仙胺、鬼臼毒素、力佐辛或长春瑞滨)。第四,聚合微管蛋白(即微管)是带负电荷的结构,化学性质也与核酸(即rna)共享。因此,在没有诱饵(诸如核酸捕获蛋白)的情况下,所述核酸与聚合微管蛋白的非特异性结合是较不利的,因此与其他亲和(固体)载体(例如寡聚dt珠)和/或通常用于免疫沉淀的那些相比,避免了高信号背景。因此,该方法通过(i)一方面在核酸结合部分和待纯化的核酸;和(ii)另一方面在聚合微管蛋白结合部分和聚合微管蛋白之间发生(优选可逆的)结合来定义。下文进一步详述了包含与核酸捕获蛋白复合的所述聚合微管蛋白或甚至由其组成的亲和载体;以及制备方法和适用于所述方法的特定试剂盒和/或核酸捕获蛋白。纯化和/或表征核酸分子的方法;及其试剂盒本发明涉及一种用于纯化样品中的核酸分子的方法,至少包括以下步骤:a)提供与一种或多种核酸捕获蛋白复合的聚合微管蛋白,所述核酸捕获蛋白与易于存在于样品中的核酸分子结合,其中所述核酸捕获蛋白包含核酸结合部分和微管蛋白结合部分;b)回收所述结合核酸分子的核酸捕获蛋白,从而纯化所述核酸分子。因此,根据第一目的,本发明涉及一种用于纯化样品中的核酸分子的方法,至少包括以下步骤:a)在有效条件下使所述样品与至少一种微管蛋白和一种或多种包含核酸结合部分和聚合微管蛋白结合部分的核酸捕获蛋白接触,以与结合所述待纯化核酸的所述核酸捕获蛋白复合形成聚合微管蛋白;和b)回收所述结合核酸分子的核酸捕获蛋白,从而纯化所述核酸分子。典型地,如先前所定义,微管蛋白以微管的形式聚合。因此,本发明涉及用于纯化样品中的核酸分子的所述方法,至少包括以下步骤:a)提供与一种或多种核酸捕获蛋白复合的微管,所述核酸捕获蛋白与易于存在于样品中的核酸分子结合,其中所述核酸捕获蛋白包含核酸结合部分和微管蛋白结合部分;b)回收所述结合核酸分子的核酸捕获蛋白,从而纯化所述核酸分子。因此,本发明进一步涉及一种用于纯化样品中的核酸分子的方法,至少包括以下步骤:a)在有效条件下使所述样品与至少一种微管蛋白和一种或多种包含核酸结合部分和微管结合部分的核酸捕获蛋白接触,以与结合所述待纯化核酸的所述核酸捕获蛋白复合形成微管;和b)回收所述结合核酸分子的核酸捕获蛋白,从而纯化所述核酸分子。待纯化的核酸分子优选是rna分子,并且核酸捕获蛋白是rna捕获蛋白。另外,根据一个特定的实施方案,在适合于微管蛋白聚合的条件下将核酸捕获蛋白固定于微管蛋白上。实际上,发明人认为,在聚合之前或聚合期间,聚合微管蛋白结合部分与微管蛋白的结合的发生可增加发生所述结合的可能性;并因此提高了核酸回收步骤的效率。换句话说,聚合微管蛋白结合部分可以在回收步骤之前与聚合微管蛋白(即微管)结合,或者在所述回收步骤之前与非聚合微管蛋白(即单体微管蛋白)结合。另外,本发明涉及如上所定义的方法,其包括使用微管解聚药物或冷暴露使微管蛋白解聚的至少一个步骤。为此目的,也可以使用破坏微管、解聚微管或分解微管的药物,诸如诺考达唑、长春花碱、长春新碱、秋水仙碱、秋水仙胺、鬼臼毒素、力佐辛或长春瑞滨。冷暴露是本领域已知的,并且通常涉及通过将微管暴露于低温来解聚微管的步骤。与冷暴露有关的方案在本领域中是已知的,例如在ochoaetal.(coldexposurerevealstwopopulationsofmicrotubulesinpulmonaryendothelia;am.j.physiol.lungcell.mol.physiol.;300:l132-l138;2011)中教导的。如上所定义的聚合和解聚步骤可以有利地随时间重复,从而导致聚合微管蛋白结合部分的结合和解离的交替阶段相随时间连续。鉴于以上情况,本文预期了至少四个非互相排斥的替代实施方案,其中:-在核酸结合部分和待纯化的核酸之间发生第一结合,并且在聚合微管蛋白结合部分和聚合微管蛋白之间发生第二结合;和/或-在聚合微管蛋白结合部分和聚合微管蛋白之间发生第一结合,并且在核酸结合部分和待纯化的核酸之间发生第二结合;和/或-在核酸结合部分和待纯化的核酸之间发生第一结合,并且在适于微管蛋白聚合的条件下,在聚合微管蛋白结合部分与微管蛋白之间发生第二结合;和/或-在适于微管蛋白聚合的条件下,在聚合微管蛋白结合部分和微管蛋白之间发生第一结合,并且在核酸结合部分和待纯化的核酸之间发生第二结合。本文公开的纯化核酸的方法还可以仅包括体外步骤,或者包括体内和体外步骤。因此,根据一个优选的实施方案,本文所公开的用于纯化核酸分子的方法包括至少一个体外步骤,其中一种或多种聚合微管蛋白或微管结合至聚合微管蛋白结合或微管结合部分。因此,使所述核酸与一种或多种核酸捕获蛋白和微管蛋白接触的步骤优选是体外步骤。根据一个具体实施方案,本发明涉及一种用于纯化上述核酸分子的方法,其中:-在固定于聚合微管蛋白上之前,将所述核酸捕获蛋白体外添加到所述样品中;或-样品包含表达所述核酸捕获蛋白的细胞,优选真核细胞;或其细胞裂解液。因此,根据一个实施方案,微管蛋白(以聚合或非聚合形式)可以内源存在于待从其纯化核酸的样品中。或者,微管蛋白也可以外源引入。根据另一个非互相排斥的实施方案,将聚合微管蛋白外源地添加至易于含有待纯化核酸的样品中;或易于含有所述核酸的样品包含表达所述微管蛋白的细胞(优选真核细胞);或其细胞裂解液。根据另一个非互相排斥的实施方案,易于含有所述核酸的样品包含表达所述核酸捕获蛋白的细胞(优选真核细胞);或其细胞裂解液。根据另一个非互相排斥的实施方案,提供核酸捕获蛋白的步骤包括在细胞(优选真核细胞)中表达所述一种或多种核酸捕获蛋白。因此,根据一个实施方案,用于纯化核酸的方法还包括至少以下步骤:a0)在真核细胞中表达一种或多种核酸捕获蛋白,a1)由步骤a0)的真核细胞制备细胞裂解液,a2)使步骤a1)获得的细胞裂解液中含有的核酸捕获蛋白与聚合微管蛋白和核酸分子接触,从而提供聚合微管蛋白与结合待纯化核酸的核酸捕获蛋白的复合。因此,根据所述实施方案,用于纯化核酸的方法还包括至少以下步骤:a0)在真核细胞中表达一种或多种核酸捕获蛋白,a1)由步骤a0)的真核细胞制备细胞裂解液,a2)使步骤a1)获得的细胞裂解液中含有的核酸捕获蛋白与聚合微管蛋白和核酸分子接触,b)回收所述结合核酸分子的核酸捕获蛋白,从而纯化所述核酸分子。以非排他性的方式,优选地通过离心或超离心来实现回收所述结合核酸分子的核酸捕获蛋白的步骤。或者,可以通过聚合微管蛋白的沉淀来实现回收步骤;特别是通过免疫沉淀。可以通过使聚合微管蛋白与结合固体载体(即微珠)的第二聚合微管蛋白结合部分(即抗体)结合的步骤获得这种免疫沉淀。根据一个实施方案,回收步骤由至少一个(优选多个)离心和/或沉淀和/或免疫沉淀步骤组成。根据一个非互相排斥的实施方案,纯化核酸的方法包括收集与核酸捕获蛋白复合的核酸分子的进一步步骤。因此,根据一个具体实施方案,本发明涉及一种用于纯化样品中的核酸分子的方法,包括至少以下步骤:a)提供与一种或多种与易于存在于样品中的核酸分子结合的核酸捕获蛋白复合的聚合微管蛋白,其中所述核酸捕获蛋白包含核酸结合部分和聚合微管蛋白结合部分;b)回收所述结合核酸分子的核酸捕获蛋白;c)收集结合核酸捕获蛋白的核酸分子,从而纯化所述核酸分子。因此,根据所述具体实施方案,本发明涉及一种用于纯化样品中的核酸分子的方法,包括至少以下步骤:a)在有效条件下使所述样品与至少一种微管蛋白和一种或多种包含核酸结合部分和聚合微管蛋白结合部分的核酸捕获蛋白接触,以与结合所述待纯化核酸的所述核酸捕获蛋白复合形成聚合微管蛋白;b)回收所述结合核酸分子的核酸捕获蛋白;c)收集结合核酸捕获蛋白的核酸分子,从而纯化所述核酸分子。根据一个非互相排斥的实施方案,用于纯化核酸的方法包括表征(优选测序)纯化的核酸分子的进一步步骤。因此,如上文所定义的本发明还涉及一种用于纯化核酸、用于表征(优选测序)所述核酸的方法。根据一个实施方案,本发明涉及一种表征(优选测序)样品中的核酸分子的方法,至少包括以下步骤:a)提供与一种或多种与易于存在于样品中的核酸分子结合的核酸捕获蛋白复合的聚合微管蛋白,其中所述核酸捕获蛋白包含核酸结合部分和聚合微管蛋白结合部分;b)回收所述结合核酸分子的核酸捕获蛋白,从而纯化所述核酸分子;c)表征(优选测序)所述纯化的核酸分子。因此,根据所述实施方案,本发明涉及一种表征(优选测序)样品中的核酸分子的方法,至少包括以下步骤:a)在有效条件下使所述样品与至少一种微管蛋白和一种或多种包含核酸结合部分和聚合微管蛋白结合部分的核酸捕获蛋白接触,以与结合所述待纯化核酸的所述核酸捕获蛋白复合形成聚合微管蛋白;b)回收所述结合核酸分子的核酸捕获蛋白,从而纯化所述核酸分子;c)表征(优选测序)所述纯化的核酸分子。根据一个非互相排斥的实施方案,用于表征核酸的方法包括收集与核酸捕获蛋白复合的核酸分子的进一步步骤。因此,根据一个具体实施方案,本发明还涉及一种表征(优选测序)样品中的核酸分子的方法,至少包括以下步骤:a)提供与一种或多种与易于存在于样品中的核酸分子结合的核酸捕获蛋白复合的聚合微管蛋白,其中所述核酸捕获蛋白包含核酸结合部分和聚合微管蛋白结合部分;b)回收与核酸分子复合结合的核酸捕获蛋白;c)收集结合核酸捕获蛋白的核酸分子,从而纯化所述核酸分子;d)表征(优选测序)纯化的核酸分子。因此,根据所述具体实施方案,本发明涉及一种表征(优选测序)样品中的核酸分子的方法,至少包括以下步骤:a)在有效条件下使所述样品与至少一种微管蛋白和一种或多种包含核酸结合部分和聚合微管蛋白结合部分的核酸捕获蛋白接触,以与结合所述待纯化核酸的所述核酸捕获蛋白复合形成聚合微管蛋白;b)回收所述结合核酸分子的核酸捕获蛋白,c)收集与一种或多种核酸捕获蛋白复合的核酸分子,从而纯化所述核酸分子;d)表征(优选测序)纯化的核酸分子。有利地,可以在用于比较两个样品之间的靶核酸分子的量的方法中考虑用于纯化和/或表征以上定义的核酸分子的任何方法;例如用于诊断和/或测定给定核酸组相对于参考的表达。因此,根据另一个目的,本发明涉及一种用于比较两个样品之间的靶核酸分子的量的方法,至少包括以下步骤:a)通过使用选择的核酸捕获蛋白对第一样品施加上述定义的方法,以获得纯化的靶核酸分子的第一集合,b)通过使用与步骤a)中使用的相同的选择的核酸捕获分子对第二样品施加上述定义的方法,以获得纯化的靶核酸分子的第二集合,和c)测定分别包含在纯化的靶核酸分子的第一集合和纯化的靶核酸分子的第二集合中的靶核酸分子的量。有利地,用于比较两个样品之间的靶核酸分子的量的方法还可以包括表征(优选测序)回收和/或收集的核酸分子的步骤。还可以考虑将核酸捕获蛋白、和/或包含用于表达核酸捕获蛋白的表达盒的载体、和/或表达核酸捕获蛋白的细胞、和/或冻干或纯化的微管蛋白以试剂盒的形式用于纯化核酸分子和/或用于制备用于纯化核酸分子的亲和载体。因此,根据一个实施方案,本发明还涉及一种用于纯化核酸分子和/或用于制备用于纯化核酸分子的亲和载体的试剂盒,其包含:a)至少一种核酸捕获蛋白,和/或包含用于表达核酸捕获蛋白的表达盒的载体,和/或表达核酸捕获蛋白的细胞(优选真核细胞);和b)冻干或纯化的微管蛋白;其特征在于所述核酸捕获蛋白包含核酸结合部分和聚合微管蛋白结合部分。本发明的载体可以包括一种或多种可选择标记。可选择标记是被引入细胞,特别是培养中的细菌或细胞中的标记基因,其赋予适于人工选择的性状。根据优选的实施方案,表达盒编码包含聚合微管蛋白结合部分的核酸捕获蛋白,所述聚合微管蛋白结合部分包含一个或多个衍生自本发明的微管相关蛋白的微管结合域(mbd)。根据最优选的实施方案,表达盒编码包含一个或多个衍生自序列为seqidn°10的蛋白质tau的微管结合域(mbd)的聚合微管蛋白结合部分。适合在真核细胞中表达的载体的实例包括pef-dest51质粒。制备亲和载体的方法一种制备用于纯化样品中所含核酸分子的亲和载体的方法,包括将一种或多种核酸捕获蛋白固定于聚合微管蛋白上的体外步骤;其中所述核酸捕获蛋白包含核酸结合部分和聚合微管蛋白结合部分,从而制备用于纯化核酸分子的所述亲和载体。另外,本文预期了至少两个用于制备所述亲和(固体)载体的非互相排斥的替代实施方案,其中:-将一种或多种核酸捕获蛋白固定于聚合微管蛋白上;和/或-在适合微管蛋白聚合的条件下将一种或多种核酸捕获蛋白固定于微管蛋白上。根据一个实施方案,根据所述方法制备的亲和载体进一步被认为是本发明的一部分。根据一个实施方案,本发明还涉及用于纯化核酸分子的亲和载体,所述核酸分子包含固定于重组或合成的聚合微管蛋白上的核酸捕获蛋白,其中所述核酸捕获蛋白包含核酸结合部分和聚合微管蛋白结合部分。所述核酸捕获蛋白可以与所述聚合微管蛋白共价结合或非共价结合。根据一个实施方案,亲和载体可以包含固定于所述重组或合成的聚合微管蛋白上的多个不同的核酸捕获蛋白。例如,亲和载体可包含固定于重组或合成的聚合微管蛋白上的核酸捕获蛋白,其中将所述聚合微管蛋白本身固定于固体载体上。可能的基质包括但不限于玻璃和改性或功能化玻璃;塑料(包括丙烯酸树脂、聚苯乙烯以及苯乙烯与其他材料的共聚物、聚丙烯、聚乙烯、聚丁烯、聚氨酯、teflontm等);多糖;尼龙或硝化纤维;陶瓷;树脂;二氧化硅或二氧化硅基材料,包括硅和改性硅;碳;金属;无机玻璃;塑料;光纤束以及各种其他聚合物。在一些实施方案中,固体载体包含适于固定的图案化表面。“图案化表面”是指固体载体的暴露层之中或之上的不同区域的排列。核酸捕获蛋白如之前所定义,“核酸捕获蛋白”包含至少一个核酸结合部分和至少一个(优选多于一个)聚合微管蛋白结合部分。聚合微管蛋白结合部分可包含一个或多于一个的微管结合域。“微管结合域”(mbd)涉及负责与聚合微管蛋白(特别是微管)的结合的微管结合蛋白的一个或多个片段。尽管“微管结合蛋白”(map)也可以是聚合微管蛋白结合蛋白和/或微管结合蛋白,但表达“微管结合域”(mbd)是指能够特异性且直接结合微管的结构域。由于相同的原因,“聚合微管蛋白结合部分”是指特异性且直接结合聚合微管蛋白的部分。因此,mbd可包含导致微管结合蛋白与微管结合的所有可能的氨基酸序列。作为参考,本发明的微管结合域可以衍生自tau蛋白,诸如tau同种型2(登录号:np_005901.2),其包括序列seqidn°1,其包括序列seqidn°11-14。本发明的微管结合域也可以衍生自map1a蛋白(登录号:np_002364),其包括序列seqidn°2。本发明的微管结合域也可以衍生自map2蛋白(登录号:np_002365),其包括序列seqidn°3。本发明的微管结合域也可以衍生自map4蛋白(登录号:aaa67361),其包括序列seqidn°4。本发明的微管结合域也可以衍生自map6蛋白(登录号:np_149052),其包括序列seqidn°5。本发明的微管结合域也可以衍生自eb1蛋白(登录号:np_036457),其包括序列seqidn°6。因此,本发明的微管结合域可以选自下组:序列seqidn°1和seqidn°11-14的tau、序列seqidn°2的map1a、序列seqidn°3的map2,序列seqidn°4的map4,序列seqidn°5的map6,序列seqidn°6的eb-1和/或衍生自微管相关蛋白的任何微管结合域和片段,及其组合。鉴定蛋白质中聚合微管蛋白结合部分和/或微管结合域的方法已经在本领域中有所报道。参阅以下供参考:cravchiketal.;identificationofanovelmicrotubule-bindingdomaininmicrotubule-associatedprotein1a(map1a).jcellsci,107(pt3),661-72,1994。以下进一步提供测定假定的微管结合域的序列的测定法:提议的测试氨基酸序列是否为具有boolean答案的“微管结合域”的程序是基于通过光学显微镜在使用直接(荧光标签,诸如gfp)或间接标记(抗体)的表达测试的氨基酸序列的细胞中出现微管样图案。例如,spastin(登录号:np055761)是一种微管切割蛋白,当在388处的赖氨酸突变为精氨酸(k388r)以防止微管切割时,其可与微管牢固结合。这样的氨基酸序列可以被认为是“微管结合域”。参阅以下供参考:erricoetal.;spastin,theproteinmutatedinautosomaldominanthereditaryspasticparaplegia,isinvolvedinmicrotubuledynamics,hummolgenet,11,153–163,2002。微管结合域(mbp)通常以串联和/或作为重复序列被发现。例如,tau蛋白是一种高度可溶性的微管相关蛋白(map),已在人中发现了至少六个同种型,并且在其羧基末端可包含三个或四个微管结合域。例如,最长的tau同种型包含四个推定的微管结合域(aa:243-274;275-305;306-336和337-368。登录号np_005901.2),分别为序列seqidn°11-14。但是,tau的侧翼区域也加强了其与微管的结合。参阅以下供参考:trinczeketal.,domainsoftauprotein,differentialphosphorylation,anddynamicinstabilityofmicrotubules.molbiolcell,6(12),1887-902。因此,在不脱离本发明范围的情况下,也可以包括这种侧翼区域作为微管结合域的附加部分。上述聚合微管蛋白结合部分和核酸结合部分通常为多肽或其片段;所述多肽优选是天然存在的多肽。根据一个实施方案,核酸捕获蛋白可以包括包含一个以上的微管结合域(mbd)的聚合微管蛋白结合部分,和至少一个核酸结合部分。根据一个非互相排斥的实施方案,包含在核酸捕获蛋白中的聚合微管蛋白结合部分包含存在于选自下组的蛋白中的一个或多个微管结合域(mbd):tau、map1a、map2、map4、map6和eb1。因此,聚合微管蛋白结合部分优选包含多个微管结合结构域,其包括串联和/或重复序列形式的微管结合域,其还包括至少两个、至少三个或甚至至少四个微管结合域。这些结构域也可以通过接头分开,以改进其与微管的结合。微管结合域可以相同或不同。特别地,它们可以是相同的微管结合蛋白的一部分,或来自不同的微管结合蛋白。优选地,它们是相同的微管结合蛋白的一部分。根据一个示例性的实施方案,聚合微管蛋白结合部分包括至少一个与微管结合的tau片段,其还包括至少一个tau微管结合域,诸如序列seqidn°1,seqidn°11,seqidn°12,seqidn°13和/或seqidn°14的taumbd,及其组合。根据另一非互相排斥实施方案,包含在核酸捕获蛋白中的核酸结合部分包含一个或多个选自下组的核酸结合域:tdp43、fus、taf15、nf45/nf90、ddx6、hnnrpa1、dhx36、fmrp、hud、hnrnpl、hur、g3bp1、lin28a、lin28b、ago、hur、mettl3、mettl14、fto、alkbh、ythdf1–3、pabp1和ybx1。适用于本发明的rna结合蛋白(rbp)的实例以非穷举的方式示于下表1中。表1:rna结合蛋白(rbp)的实例还考虑了上述核酸结合部分和聚合微管蛋白结合部分的功能同源物,其包括与参考序列具有至少20%氨基酸同一性的多肽。如本文所用,与参考序列具有至少20%氨基酸同一性的多肽序列涵盖与所述参考序列具有至少21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%和99%氨基酸同一性的序列。在本发明的范围内,两条多肽之间的“同一性百分比”是指在最佳比对后获得的待比较的两条多肽序列之间相同氨基酸残基的百分比,该百分比纯粹是统计的,并且是两条多肽序列之间的差异沿其长度随机分布。通常,两条多肽序列的比较通过将序列最佳对齐后比较序列来进行,所述比较可以通过片段或使用“比对窗口”来进行。通过使用比较软件blast-p进行用于比较的序列的最佳对齐。原则上,通过比较两个最佳对齐的序列来测定两条氨基酸序列之间的同一性百分比,其中比较的核酸序列与参考序列相比可以具有增加或缺失,以使两条多肽序列之间最佳对齐。通过测定两条序列之间,优选两条完整序列之间的氨基酸残基相同的位置数目,将相同位置的数目除以比对窗口中的位置总数,再乘以100获得两条序列之间的同一性百分比。还清楚地预期了核酸结合部分和聚合微管蛋白结合部分的所有可能的组合。相互作用的障碍可以是由于聚合微管蛋白表面的接近,当与聚合微管蛋白结合部分融合时核酸结合部分的可及性降低。为了使核酸结合部分对样品中待纯化核酸的可及性最大化,可将诱饵附着至突起结构域(projectiondomain),该突起结构域优选为无结构尾,从而允许微管或聚合微管蛋白表面与核酸之间具有纳米级的间隔。因此,核酸捕获蛋白可以进一步包含位于核酸结合部分和聚合微管蛋白结合部分之间的一个接头(l)区。接头(l)区通常是非结构化结构域,特别是允许聚合微管蛋白表面和目标核酸之间具有纳米级间隔的非结构化结构域,这对于增加核酸结合部分和聚合微管蛋白结合部分的可及性至关重要。接头区的实例是本领域已知的。在微管相关蛋白(map)(诸如map2或tau)中发现了突起结构域,并且它们参与微管捆扎并参与测定微管之间的间隔。优选地,为了使核酸结合部分对核酸的可及性最大化,将核酸结合部分连接至接头区,该接头区来自map的突起结构域,诸如tau或其片段。本发明的“突起结构域”可以包含tau的n末端片段或由其组成。根据具体的实施方案,本发明的“突起结构域”是序列seqidn°9或其片段的tau突起结构域。接头区或突起结构域的长度可以变化,其包括如上定义的长度为1-150个氨基酸的任何区域或结构域,其包括长度为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23,24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47,48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71,72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95,96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114,115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132,133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149和150个氨基酸。当核酸捕获蛋白包含(i)包含一个或多个微管结合结构域的聚合微管蛋白结合部分和(ii)突起结构域时,优选两个部分是相同的蛋白,特别是相同的微管相关蛋白,诸如tau的一部分。核酸捕获蛋白部分可以包含或不包含可检测部分,诸如荧光蛋白。有利地,核酸捕获蛋白可以在其n末端或c末端部分进一步包含如上定义的任何可检测部分,诸如可以使用荧光显微镜检测的荧光标记。以非限制性方式,可检测部分可以是荧光蛋白,诸如选自下组的蛋白:gfp、yfp、xfp、rfp、cfp、dsred和mcherry。具体实施方式a.材料和方法a1.1)制备编码tau-rbp的质粒使用之前在(bocaetal.probingproteininteractionsinlivingmammaliancellsonamicrotubulebench.scientificreports5,17304(2015))中所述的门控策略工程化导致tau-rfp-rbps和tau-gfp-rbps哺乳动物表达的载体。插入以下rbp的人序列:tdp-43、g3bp1、hur、fus、yb-1、lin28a。使用含有paci和asci限制性位点的引物,通过pcr扩增了tau-rfp-tdp-43构建体(tdp-43δrbd,270-414aa;以及tdp-43δlcd,1-277aa),并将其克隆入含有rfp-tau盒的“骨架输入质粒”。然后,使用lr反应将两个tdp(1-277aa或270-414aa)-rfp-tau盒转移到pdest表达载体中(参见表2)。表2:质粒表达载体rbp登录号tau-rfp-tdp43pef-dest51np_031401.1tau-rfp-fuspef-dest51np_004951.1tau-rfp-yb1pef-dest51np_004550.2tau-rfp-hurpef-dest51np_001410tau-rfp-g3bp1pef-dest51np_005745.1tau-rfp-lin28apef-dest51np_078950.1tau-gfp-tdp43pef-dest51np_031401.1tau-gfp-yb1pef-dest51np_004550.2tau-gfp-g3bp1pef-dest51np_005745.1gfp-yb1pegfp-c3np_004550.2gfp-hurpegfp-c3np_001410a2.核酸纯化,然后进行rt-pcr分析将106个hek293t细胞(来源:atcc;标识符:crl-3216)铺板在6孔板中,并用tau-rfp-rbp表达质粒和lipofectamine2000tm试剂(invitrogen)转染。转染后24小时,将细胞置于冰上30min,然后在200μl裂解缓冲液(50mmtrishcl[ph7.0]、50mmnacl、1mmedta、0.05%脱氧胆酸钠、1%tritonx-100、0.1%sds、1mmpmsf、蛋白酶和rnase抑制剂)中裂解。从羊脑中纯化微管蛋白。通过分光光度法在278nm下使用1.2mg-1×cm2的消光系数来测定微管蛋白浓度。通过将冰冷的比色杯(1cm光路)置于37℃的ptiquantamaster2000-4恒温分光荧光计中来引发微管蛋白聚合反应。然后,通过在370nm处90°光散射立即监测微管组装的动力学。然后,微管经紫杉醇稳定化(5μm紫杉醇,40μm微管蛋白)。将细胞裂解液在16℃下以20,000×g离心1h,并收集上清液。将10μl微管溶液添加到200μl细胞上清液中,在16℃下孵育15分钟,然后以20,000×g于16℃下离心30分钟。将微管沉淀重悬于100μl裂解缓冲液中,并再次以20,000×g离心30分钟。丢弃上清液后,用tri-reagent(molecularresearchcenter,inc)从沉淀中纯化rna。通过uv光谱法(nanodrop)评估rna的质量。使用impromii逆转录酶和qpcrmastermix在7500appliedbiosytemstm模块上进行rt-pcr反应。将通过微管沉淀获得的rna定量结果与从全细胞裂解液中获得的rna定量结果进行比较。对于经典ip分析,在上述条件下裂解了表达所示gfp-rbp的hek细胞。使用与微管沉淀中分离rna相同的缓冲液中的proteingkit(invitrogen)来施加共同免疫沉淀测定法,但保温时间除外(此处在冷室中过夜)。如上所述进行rt-pcr分析。b.结果为了将hur、g3bp1和yb-1限制在微管上,将它们融合到微管相关蛋白tau(图1a)和rfp或gfp标记上。因此,融合蛋白是将mrna带到微管上的核酸捕获蛋白。tau对聚合微管蛋白的亲和力高于对游离微管蛋白的亲和力,这有利于其存在于微管上而不是在细胞质中。此外,其非结构化的n末端作为间隔基来保留蛋白功能。为了纯化与核酸捕获蛋白复合的rna分子,我们认为可以在体外从细胞裂解液中分离出带到微管上的rna。为此,将表达核酸捕获蛋白的细胞的裂解液在16℃以20,000×g离心1小时,并收集上清液。然后,将上清液与羊脑微管一起孵育(图1b),并在16℃以20,000×g离心30分钟。或者,可以在有利于内源性微管蛋白聚合的条件下或在添加外源性微管蛋白后孵育上清液(图1c),然后在16℃以20,000×g离心30分钟。根据图1b中所述的方案纯化与微管相互作用的核糖核蛋白(rnp),并通过rt-pcr分析沉淀的mrna含量。与单独的tau-rfp相比,在存在tau-rfp-rbp融合的情况下,在这些微管沉淀中发现的mrna量急剧增加。对数十种mrna进行rt-pcr分析,包括编码gapdh和肌动蛋白的那些,作为丰富的mrna对照。作为对照,我们从仅表达tau-rfp的细胞的细胞裂解液中检测到了较低含量的mrna。相反,在表达tau-rfp-yb-1或tau-rfp-g3bp1的细胞中,mrna的含量显著增加(ct值较低,图2a)。此外,tau-rfp-yb-1或tau-rfp-hur优先结合特定的mrna,这可以反映保留的特异性。为了进一步探讨这一点,我们将这些富集与通过经典的免疫沉淀获得那些以及从表达gfp-rbp的细胞获得的抗gfp抗体进行了比较。尽管有一些差异(图2b和c),定量显示了两种方法对于hur和yb-1的相似特征。因而,我们可以合理地假设,尽管tau融合和微管邻近,但rbp与mrna的结合及其特异性得到了全面的保护。同样,图3展示了tau-rfp-yb-1构建体,该构建体在hek293细胞中表达,并通过与微管在16℃以20,000×g共沉淀30分钟来纯化。悬浮tau-rfp-yb-1,并用rnase处理以去除细胞rna。将tau-rfp-yb-1与微管共沉淀后,去除rnase。最后,在与微管共沉淀后,使用纯化的tau-rfp-yb-1捕获mrna(此处为合成荧光素酶mrna)。该结果表明,tau-rfp-yb-1构建体的纯化不会损害其体外结合mrna以及与微管共沉淀的能力。序列表seqidn°1.tau微管结合序列:151-400,登录号:np_005901.2):iatprgaappgqkgqanatripaktppapktppssgeppksgdrsgysspgspgtpgsrsrtpslptpptrepkkvavvrtppkspssaksrlqtapvpmpdlknvkskigstenlkhqpgggkvqiinkkldlsnvqskcgskdnikhvpgggsvqivykpvdlskvtskcgslgnihhkpgggqvevksekldfkdrvqskigsldnithvpgggnkkiethkltfrenakaktdhgaeivykspvvsseqidn°2.map1a(aa:282-630,登录号:np_002364):qnkilegleklrhldflrypvatqkdlasgavptnlkpskikqradskeslkattktavsklakreevveegakearselakelaktekkakessekppekpakpervktessealkaekrklikdkvgkkhlkekiskleekkdkekkeikkerkelkkdegrkeekkdakkeekrkdtkpelkkiskpdlkpftpevrktlykakvpgrvkidrsrairgekelssepqtppaqkgtvplptisghrelvlsspedltqdfeemkreerallaeqrdtglgdkpfpldtaeegppstaiqgtppsvpglgqeehvmkekelvpevpeeqgskdrgldsgaeteeekdtweekkqreseqidn°3.map2(aa:1519-1828,登录号:np_002365):fkqakdkvsdgvtkspekrsslprpssilpprrgvsgdrdensfslnssisssarrttrsepirragksgtstpttpgstaitpgtppsyssrtpgtpgtpsyprtphtpgtpksailvpsekkvaiirtppkspatpkqlrlinqplpdlknvkskigstdnikyqpkggqvqivtkkidlshvtskcgslknirhrpgggrvkiesvkldfkekaqakvgsldnahhvpgggnvkidsqklnfrehakarvdhgaeiitqspgrssvasprrlsnvsssgsinllespqlatlaedvtaalakqglseqidn°4.map4(aa:923-1084,登录号:aaa67361):latntsapdlknvrskvgstenikhqpgggrakvekkteaaattrkpesnavtktagpiasaqkqpagkvqivskkvsyshiqskcgskdnikhvpgggnvqiqnkkvdiskvsskcgskanikhkpgggdvkiesqklnfkekaqakvgsldnvghlpaggseqidn°5.map6(aa:118-321,登录号:np_149052):svmrqdyrawkvqrpepscrprseyqpsdapferetqyqkdfrawplprrgdhpwipkpvqisaasqasapilgapkrrpqsqerwpvqaaaeareqeaapggagglaagkasgaderdtrrkagpawivrraeglgheqtplpaaqaqvqatgpeagrgraaadalnrqireevasavsssyrnefrawtdikpvkpikakpseqidn°6.eb1(aa:124-268,登录号:np_036457):ydpvaarqgqetavapslvapalnkpkkpltsssaapqrpistqrtaaapkagpgvvrknpgvgngddeaaelmqqvnvlkltvedlekerdfyfgklrnielicqenegendpvlqrivdilyatdegfvipdeggpqeeqeeyseqidn°7.alpha微管蛋白(登录号:aaa91576):mrecisihvgqagvqignacwelyclehgiqpdgqmpsdktigggddsfntffsetgagkhvpravfvdleptvidevrtgtyrqlfhpeqlitgkedaannyarghytigkeiidlvldrirkladqctrlqgflvfhsfgggtgsgftsllmerlsvdygkksklefsiypapqvstavvepynsiltthttlehsdcafmvdneaiydicrrnldierptytnlnrlisqivssitaslrfdgalnvdltefqtnlvpyprihfplatyapvisaekayheqlsvaditnacfepanqmvkcdpghgkymaccllyrgdvvpkdvnaaiatiktkrtiqfvdwcptgfkvginyqpptvvpggdlakvqravcmlsnttaiaeawarldhkfdlmyakrafvhwyvgegmeegefsearedmaalekdyeevgvdsvegegeeegeeyseqidn°8.beta微管蛋白(aa:124-268,登录号:aab59507):mreivhiqagqcgnqigakfwevisdehgidptgtyhgdsdlqldrisvyyneatggkyvprailvdlepgtmdsvrsgpfgqifrpdnfvfgqsgagnnwakghytegaelvdsvldvvrkeaescdclqgfqlthslgggtgsgmgtlliskireeypdrimntfsvvpspkvsdtvvepynatlsvhqlventdetycidnealydicfrtlrlttptygdlnhlvsgtmecvttclrfpgqlnadlrklavnmvpfprlhffmpgfapltsrgsqqyraltvpdltqqvfdaknmmaacdprhgryltvaavfrgrmsmkevdeqmlnvqnknssyfvewipnnvktavcdipprglkmavtfignstaiqelfkriseqftamfrrkaflhwytgegmdemefteaesnmndlvseyqqyqdataeeeedfgeeaeeeaseqidn°9.tau突起结构域(aa:1-150,登录号:np_005901.2):maeprqefevmedhagtyglgdrkdqggytmhqdqegdtdaglkesplqtptedgseepgsetsdakstptaedvtaplvdegapgkqaaaqphteipegttaeeagigdtpsledeaaghvtqarmvskskdgtgsddkkakgadgktkseqidn°10.tau(登录号:np_005901.2):maeprqefevmedhagtyglgdrkdqggytmhqdqegdtdaglkesplqtptedgseepgsetsdakstptaedvtaplvdegapgkqaaaqphteipegttaeeagigdtpsledeaaghvtqarmvskskdgtgsddkkakgadgktkiatprgaappgqkgqanatripaktppapktppssgeppksgdrsgysspgspgtpgsrsrtpslptpptrepkkvavvrtppkspssaksrlqtapvpmpdlknvkskigstenlkhqpgggkvqiinkkldlsnvqskcgskdnikhvpgggsvqivykpvdlskvtskcgslgnihhkpgggqvevksekldfkdrvqskigsldnithvpgggnkkiethkltfrenakaktdhgaeivykspvvsgdtsprhlsnvsstgsidmvdspqlatladevsaslakqglseqidn°11.taumbd1aa:243-274:lqtapvpmpdlknvkskigstenlkhqpgggkseqidn°12.taumbd2aa:275-305:vqiinkkldlsnvqskcgskdnikhvpgggsseqidn°13.taumbd3aa:306-336:vqivykpvdlskvtskcgslgnihhkpgggqseqidn°14.taumbd4aa:337-368:vevksekldfkdrvqskigsldnithvpgggn当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1