一种昆虫细胞培养基及其制备方法与流程
本发明涉及生物制药
技术领域:
,具体涉及一种昆虫细胞培养基及其制备方法。
背景技术:
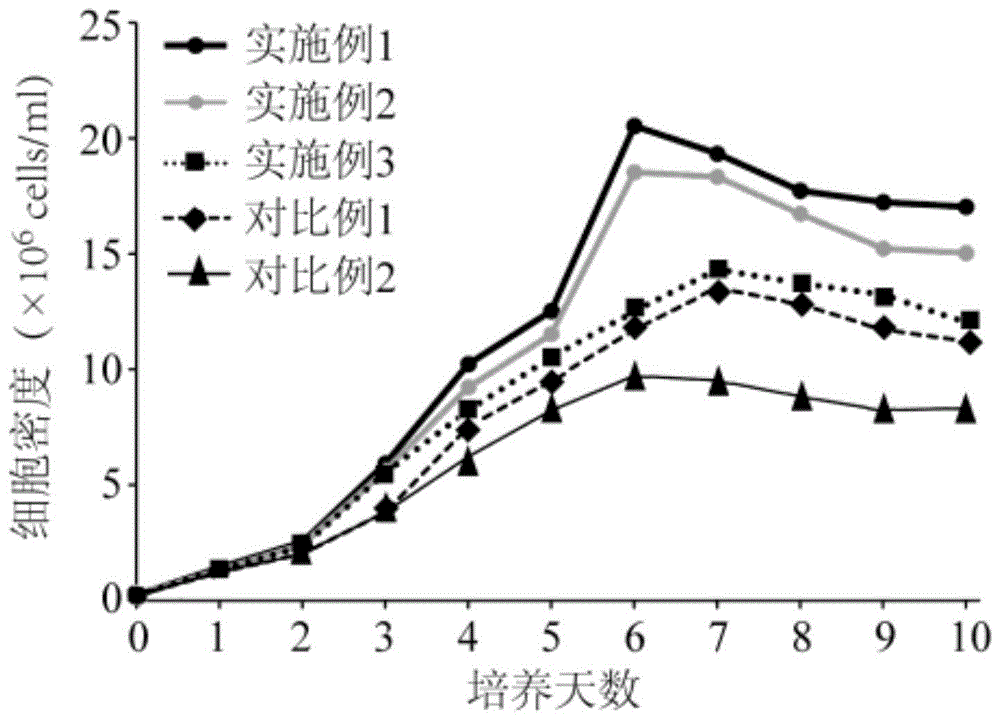
:昆虫细胞表达系统是重组蛋白生产的一种重要表达系统,以杆状病毒为载体,昆虫细胞表达系统已经被广泛应用于重组蛋白的表达,此外,昆虫细胞表达系统还是表达病毒样颗粒疫苗的最佳系统,已成功开发了多种人用和动物用疫苗。常用的昆虫细胞有sf-9细胞和highfive细胞,常用于杆状病毒表达系统的重组蛋白表达。传统的商业化昆虫细胞培养基需要添加大量的血清或血清白蛋白用于辅助细胞生长。但培养基添加血清存在血清价格昂贵、易被支原体及病毒污染、血清批次不一致等缺点;此外血清中含有大量的蛋白质不利于重组蛋白的下游分离纯化,造成重组蛋白的回收率和纯度较低,不能满足下游的需求。总体而言,培养基添加蛋白成分,一方面增加培养基成本,另外一方面给下游蛋白纯化带来困难,用无血清无蛋白培养基培养昆虫细胞成为规模化培养的趋势。目前虽然已经开发出一些用于培养昆虫细胞的无血清培养基,但这些培养基往往添加有蛋白成分,导致成本过高,下游蛋白纯化困难,并且不能适用于昆虫细胞的悬浮培养基。申请公布号为cn105255811a、cn106434526a的发明专利公布了一种适合昆虫细胞生长的无血清无动物源培养基添加物的制备方法,但培养基含有重组胰岛素蛋白,增加培养基成本并且为下游的重组蛋白的纯化带来困难。申请公布号为cn101988047a的培养基不适用于细胞悬浮培养,且培养的细胞密度低。公开号为cn1498267a所述培养基含有大量进口的水解乳白蛋白和酵母提取物,显著的提高了成本。技术实现要素:为了克服现有技术的缺陷,本发明的目的是提供一种支持昆虫细胞高密度生长、蛋白表达量高的无血清无蛋白无动物源添加物的昆虫细胞培养基。同时,本发明还在于提供一种昆虫细胞培养基的制备方法。为了实现上述目的,本发明采用的技术方案如下:一种昆虫细胞培养基,其有效成分包括氨基酸、维生素、无机盐、碳源、脂类物质和功能添加剂;其中功能添加剂包括腐胺、抗坏血酸磷酸酯镁、乙醇胺、次黄嘌呤、酵母提取物、棉籽水解物、丙酸钠、泊洛沙姆188、柠檬酸铁、柠檬酸钠、丙酮酸钠。可选的,上述培养基中功能添加剂各组分的浓度为:腐胺0.15~0.6mg/l、抗坏血酸磷酸酯镁0.5~3mg/l、乙醇胺3.5~10.0mg/l、次黄嘌呤3.5~10.5mg/l、酵母提取物3000~8000mg/l、棉籽水解物1000~3000mg/l、丙酸钠90~900mg/l、泊洛沙姆1881000~2500mg/l、柠檬酸铁50~150mg/l、柠檬酸钠70~200mg/l、丙酮酸钠600~1800mg/l。可选的,上述培养基中氨基酸包括甘氨酸、丙氨酸、精氨酸盐酸盐、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、组氨酸、异亮氨酸。亮氨酸、赖氨酸盐酸盐、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸二钠盐、缬氨酸、β-丙氨酸;进一步的,培养基中氨基酸各组分的质量体积浓度为:甘氨酸250~650mg/l、丙氨酸150~370mg/l、精氨酸盐酸盐400~885mg/l、天冬酰胺150~600mg/l、天冬氨酸150~600mg/l、半胱氨酸20~75mg/l、谷氨酸200~600mg/l、谷氨酰胺300~800mg/l、组氨酸1500~3500mg/l、异亮氨酸20~75mg/l、亮氨酸50~150mg/l、赖氨酸盐酸盐350~850mg/l、蛋氨酸25~75mg/l、苯丙氨酸100~175mg/l、脯氨酸250~400mg/l、丝氨酸450~600mg/l、苏氨酸100~250mg/l、色氨酸50~150mg/l、酪氨酸二钠盐30~80mg/l、缬氨酸70~150mg/l、β-丙氨酸150~300mg/l。可选的,上述培养基中维生素包括维生素h、d-泛酸钙、叶酸、烟酸、对氨基苯酸、维生素b6、维生素b2、维生素b1、i-肌醇、硫辛酸、维生素b12、烟酰胺、维生素c、维生素e、氯化胆碱;进一步的,培养基中维生素各组分的质量体积浓度为:维生素h0.02~0.08mg/l、d-泛酸钙0.3~1.0mg/l、叶酸0.03~0.1mg/l、烟酸0.03~0.1mg/l、对氨基苯酸0.03~0.1mg/l、、维生素b60.03~0.1mg/l、维生素b20.03~0.1mg/l、维生素b10.03~0.1mg/l、i-肌醇0.03~0.1mg/l、硫辛酸0.2~0.6mg/l、维生素b120.03~0.1mg/l、烟酰胺0.03~0.1mg/l、维生素c0.03~0.1mg/l、维生素e0.025~0.08mg/l、氯化胆碱0.3~1.0mg/l。可选的,上述培养基中无机盐包括kcl、nahco3、mgcl2、mgso4、mgcl2、cacl2、nah2po4;进一步的,培养基中无机盐各组分的质量体积浓度为:kcl1500~3000mg/l、nahco3200~600mg/l、mgcl2800~1500mg/l、mgso4600~1800mg/l、cacl2200~800mg/l、nah2po4500~1500mg/l。可选的,上述培养基中碳源包括海藻糖、蔗糖、琥珀酸、富马酸、果糖、d-葡萄糖、α-酮戊二酸;上述培养基中碳源各组分的质量体积浓度为:海藻糖50~150mg/l、蔗糖10000~35000mg/l、琥珀酸500~1000mg/l、富马酸25~80mg/l、果糖200~800mg/l、d-葡萄糖200~1000mg/l、α-酮戊二酸200~800mg/l。可选的,上述培养基中脂类物质包括亚麻酸、孕酮、亚油酸、胆固醇、花生四烯酸;其中培养基中脂类物质各组分的质量体积浓度为:亚麻酸0.03~0.1mg/l、孕酮0.03~0.1mg/l、亚油酸0.04~0.24mg/l、胆固醇2~7.5mg/l、花生四烯酸0.001~0.008mg/l。上述培养基能够应用于昆虫细胞悬浮培养,在合适的生长条件下(27℃,100rpm)培养细胞6-8天。相比传统和市售昆虫细胞培养基,本发明昆虫细胞培养基,以腐胺、抗坏血酸磷酸酯镁、乙醇胺、次黄嘌呤、酵母提取物、棉籽水解物、丙酸钠、泊洛沙姆188、柠檬酸铁、柠檬酸钠、丙酮酸钠作为复配的功能添加剂,各功能添加剂相互之间协同配合作用,并与培养基中的氨基酸、维生素、无机盐、脂类物质和碳源相互补充和配合作用,提高培养基在应用于昆虫细胞悬浮培养过程中细胞存活率、活细胞密度和蛋白表达量;进一步的,本发明培养基中包括多组分复配的氨基酸、多组分复配的维生素、多组分复配的碳源、多组分复配的脂类物质、多组分复配的无机盐和多组分复配的碳源,并进一步优化各组分的浓度含量,平衡各组分在培养基中发挥的功效(尤其是复配的氨基酸、复配的维生素、复配的脂类物质和复配的碳源),使各组分相互直接能够发挥协同增效作用,在培养基中不含有血清、蛋白和动物源添加剂的情况下进一步提高培养基在昆虫细胞悬浮培养应用过程中细胞存活率、活细胞密度和蛋白表达量,适合重组蛋白和疫苗的生产,克服传统无血清无蛋白无动物源添加物培养基活细胞密度低、蛋白表达量低的技术缺陷。同时,本发明公开的培养基无血清、无蛋白,能避免添加血清带来的潜在风险及利于下游重组蛋白的纯化;同时培养基不含动物源添加物,适合生物药物的生产。上述培养基的制备方法,包括按照各组分的用量称取各组分加入水中定容混合搅拌均匀后,依次调节ph、渗透压,除菌后即得所述的培养基。进一步可选的,上述培养基的制备方法还包括首先将氨基酸、维生素、无机盐、碳源、脂类物质和功能添加剂按照其成分组分和含量分别配置成浓缩液,其中氨基酸配置成10倍浓缩液、维生素配置成200倍浓缩液、脂类物质配置成100倍浓缩液、碳源、无机盐和功能添加剂分别配置成1倍溶液。进一步可选的,采用5n的naoh调节ph至6.2;用koh调节渗透压至355~385mosm/l;用0.22μm的过滤膜除菌。上述培养基的制备方法,操作简便,易于控制,适于工业化推广应用。附图说明附图1在不同培养基的sf-9细胞活细胞密度比较图。附图2在不同培养基的sf-9细胞细胞存活率比较图。附图3在不同培养基的蛋白表达量比较图。具体实施方式下面通过具体实施例对本发明的技术方案进行详细说明。实施例1本实施例提供一种无血清无蛋白昆虫细胞培养基,其有效成分由氨基酸、无机盐、维生素、脂类物质、碳源和功能添加剂组成;各组分的具体组成及含量如下表1~6所示:表1氨基酸成分在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)甘氨酸650赖氨酸盐酸盐625.0丙氨酸225.0蛋氨酸50.0精氨酸盐酸盐700.0苯丙氨酸150天冬酰胺350.0脯氨酸350天冬氨酸350.0丝氨酸550.0半胱氨酸28.68苏氨酸175.0谷氨酸600色氨酸100谷氨酰胺600酪氨酸二钠盐62.14组氨酸2500缬氨酸100异亮氨酸50β-丙氨酸200亮氨酸75.0表2维生素成分在每升培养基中的含量表3脂类成分在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)亚麻酸0.08亚油酸0.168孕酮0.08胆固醇5.0花生四烯酸0.002表4无机盐成分在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)kcl2800nah2po41031.0nahco3350mgso41358.0mgcl21070cacl2500表5碳源在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)富马酸55.0果糖400d-葡萄糖700α-酮戊二酸370海藻糖100蔗糖26680.0琥珀酸670表6其他的成分在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)酵母提取物5000抗坏血酸磷酸酯镁2.5丙酸钠900次黄嘌呤6.80kolliphorp1882000乙醇胺7.5腐胺0.324棉籽水解物3000柠檬酸铁100柠檬酸钠147.05丙酮酸钠1100实施例2本实施例提供一种无血清无蛋白昆虫细胞培养基,其有效成分由氨基酸、无机盐、维生素、脂类物质、碳源和功能添加剂组成;各组分的具体组成及含量如下表7~12所示:表7氨基酸成分在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)甘氨酸250赖氨酸盐酸盐850丙氨酸370.0蛋氨酸75精氨酸盐酸盐400.0苯丙氨酸100天冬酰胺150.0脯氨酸250天冬氨酸600.0丝氨酸600半胱氨酸75苏氨酸100谷氨酸200色氨酸50谷氨酰胺800酪氨酸二钠盐80组氨酸1500缬氨酸70异亮氨酸75β-丙氨酸150亮氨酸50表8维生素成分在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)维生素h0.08i-肌醇0.1d-泛酸钙0.3硫辛酸0.2叶酸0.1维生素b120.03烟酸0.1烟酰胺0.03对氨基苯酸0.1维生素c0.03维生素b60.03维生素e0.08维生素b20.03氯化胆碱1.0维生素b10.03表9脂类成分在每升培养基中的含量表10无机盐成分在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)kcl1500nah2po4500nahco3600mgso41800mgcl2800cacl2200表11碳水化合物在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)富马酸25果糖800d-葡萄糖200α-酮戊二酸200海藻糖150蔗糖10000琥珀酸500表12其他成分在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)酵母提取物3000抗坏血酸磷酸酯镁0.5丙酸钠90次黄嘌呤10.5kolliphorp1881000乙醇胺10.0腐胺0.15棉籽水解物1000柠檬酸铁50柠檬酸钠70丙酮酸钠1800实施例3本实施例提供一种无血清无蛋白昆虫细胞培养基,其有效成分由氨基酸、无机盐、维生素、脂类物质、碳源和功能添加剂组成;各组分的具体组成及含量如下表13~18所示:表13氨基酸成分在每升培养基中的含量表14维生素成分在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)维生素h0.02i-肌醇0.03d-泛酸钙1.0硫辛酸0.6叶酸0.03维生素b120.1烟酸0.03烟酰胺0.1对氨基苯酸0.03维生素c0.1维生素b60.1维生素e0.025维生素b20.1氯化胆碱0.3维生素b10.1表15脂类成分在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)亚麻酸0.03亚油酸0.04孕酮0.1胆固醇7.5花生四烯酸0.008表16无机盐成分在每升培养基中的含量表17碳水化合物在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)富马酸80果糖200d-葡萄糖1000α-酮戊二酸800海藻糖50琥珀酸1000蔗糖35000表18其他成分在每升培养基中的含量名称含量(mg/l)名称含量(mg/l)酵母提取物8000抗坏血酸磷酸酯镁3丙酸钠150次黄嘌呤3.5kolliphorp1883000乙醇胺3.5腐胺0.6棉籽水解物2000柠檬酸铁150柠檬酸钠200丙酮酸钠600上述实施例1~3提供的无血清无蛋白昆虫细胞培养基的具体制备方法为,包括以下操作步骤:1):将无血清培养基中不同组分配置成不同的浓缩液,按各组分的成分组成和含量分别配置10倍的氨基酸浓缩液、200倍维生素浓缩液、100倍脂类物质浓缩液、1倍碳源溶液、1倍无机盐溶液、1倍功能添加剂浓度;2):将步骤1)配置的各组分溶液按照1倍的用量加入1l的烧杯中并混匀,再加入去离子水定容至980ml;3):用5n的naoh调节ph至6.2;4):用koh调节渗透压至355~385mosm/l;5):用0.22μm的过滤膜除菌,即完成。对比例1本对比例的细胞培养基为商品化培养基sf-900tmiiisfm(购自thermofisherscientific公司)。对比例2本对比例的细胞培养基与实施例1的不同之处在于,采用同等浓度的丁酸钠替代丙酸钠,其余成分及含量同实施例1。试验例1将实施例1-3和对比例1~2的无血清培养基应用于sf9昆虫细胞悬浮培养,以5×105cells/ml细胞密度接种,在125ml的振荡培养瓶中分别加入30ml培养基,放入27℃的振荡培养箱中,以每分钟120转摇床培养6天,每天取样用trypanblue血球计数法记录活细胞密度(×105cells/ml)和细胞存活率(%),结果见图1和图2。由图1和图2可知,sf9昆虫细胞在本发明的细胞培养基的生长数量和增殖速率均高于对比例1、对比例2的细胞培养基,细胞活性与对比例1的细胞培养基接近。因此本发明的细胞培养能够很好地促进细胞的生长增殖。试验例2本试验例中研究人protocadherin-7(pcdh7)在不同培养基中的表达1、含pcdh7外源基因表达载体的构建(1)合成基因序列根据genbank号为np_002580.2的pcdh7基因序列,5′端和3′端分别引入bamhi、xhoi酶切位点,为了使表达的蛋白便于纯化在终止密码子前添加了6×组氨酸标签,具体由通用生物基因(安徽)有限公司完成。(2)构建含pcdh7基因序列的表达载体用bamhi/xhoi双酶切引物人工合成的pcdh7基因序列,同时用bamhi/xhoi双酶切pfastbac1载体dna。pcdh7基因的双酶切体系为:pcdh7基因序列片段10μl(1μg/μl),10×nebuffer2.13μl,bamhi/xhoi酶(10u/μl)各1.0μl,补足水至30μl;酶切条件为:37℃,酶切3min。质粒的双酶切体系为:质粒5μl(1μg/μl),10×nebuffer2.12μl,bamhi/xhoi(10u/μl)各0.5μl,补足水至20μl;酶切条件为:37℃,酶切3min。琼脂糖凝胶电泳鉴定酶切结果,凝胶回收酶切后的pcdh7序列片段和线形质粒dna。取酶切后的pcdh7基因序列分别和线形质粒dna(摩尔比5:1),使用neb公司tm的连接试剂盒,25℃连接5min。将连接产物加入到大肠杆菌(e.coli)xl-10-gold感受态细胞,进行pcr鉴定,选择阳性克隆,碱裂解法小提质粒pfastbac1-pcdh7-his,并送公司测序。将测序正确的质粒转化e.colidh10bac感受态细胞,在含x-gal和iptg的lb平板上进行蓝白斑筛选,37℃倒置培养48h后,挑取大而圆的白色单菌扩大培养,用bacmid提取试剂盒提取杆状病毒黏粒bacmid-pcdh7-his。(3)细胞转染及杆状病毒的扩增用脂质体cellfection将重组质粒bacmid-pcdh7-his转染至1.0×106个昆虫细胞sf9中,转染后72h,收集发生明显细胞病变的细胞培养上清,离心,收集上清,作为病毒液p1。用p1病毒感染1.8×107个sf9细胞,以获得p2病毒,并通过相同方法得到p3病毒。(4)pcdh7-his蛋白的表达、纯化及分析用p3病毒感染sf9细胞,分别培养在实施例1~3、对比例1~2不同的无血清培养基中,悬浮培养六天后,收集sf9细胞,表达产物经sds-page分离后,转印至硝酸纤维素膜上,用5%脱脂奶粉室温封闭1h;加入鼠抗his单克隆抗体,室温结合1h;去除一抗,加入ap标记的羊抗鼠igg,室温结合1.5h;nbt、bcip显色法显色,进行westernblot检测。将收集的被病毒感染的sf9细胞重悬于裂解缓冲液(20mmol/ltris-hcl,ph8.0;1000mmol/lnacl;10mmol/l咪唑)中,高压破碎,20000×g离心15min,收集上清,用ni-nta亲和层析柱纯化,洗脱液elutebuffer(20mmol/ltris-hcl,ph8.0;1000mmol/lnacl;300mmol/l咪唑)洗脱,收集洗脱液,用12%sdspage分析。结果如图3所示,本发明实施例1、实施例2、实施例3、对比例1和对比例2培养基中pcdh7-his蛋白纯化后表达量分别为:3.254g/l、3.36g/l、3.47g/l、3.19g/l、2.68g/l;由此可见本发明的培养基中pcdh7-his蛋白水平明显高于对比例。最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1