一种蒽衍生物及其制备方法和应用与流程
本发明涉及有机发光材料领域,更具体的,涉及一种蒽衍生物及其制备方法和应用。
背景技术:
随着大屏幕智能手机、平板电脑以及可穿戴设备等高科技产品的兴起,传统的液晶显示材料越来越难满足移动终端对显示屏日益轻薄、低耗的需求。人类开始关注拥有柔软性更高、厚度更薄、功耗更低、可视角更广、色彩饱和度更高等优点的有机电致发光器件。其中oled器件对全彩显示,固态发光等显示技术具有决定性意义。截止目前,用于小分子有机电致发光电器件的蒽类发光材料虽然已有很多报道,但大多在聚集态下由于分子的平面结构会形成π-π堆积的情况,导致其荧光被猝灭,从而使其器件效率的降低。
以传统基团修饰的蒽类发光材料,由于其分子自身的电子传输和空穴传输能力一般,导致以其为发光层的器件载流子传输不平衡,器件性能不佳。且由于修饰基团与蒽基团之间过强的给电子或吸电子能力,导致修饰后的分子具有严重自身分子内电荷转移现象,使其发光红移从而色纯度不够,影响着材料的应用。中国专利cn108586367a公开了一种有机发光材料,该有机发光材料是非对称蒽与电子传输性能好的三嗪相连接结构,通过对含蒽衍生物结构进行修饰获得,但其制备的有机发光材料远未达到国际标准oled器件的深蓝发射(x+y<0.30)。中国专利cn101400643a公开了一种四苯基萘衍生物,在实施例中使用该专利公开的四苯基萘衍生物制备的各有机发光器件,在施加8.1v的正向电场的条件下,最高仅观察到3700尼特的蓝光发射。
因此,急需开发一种能同时兼具良好载流子传输能力及高蓝光色纯度的蒽类发光材料。
技术实现要素:
本发明为克服上述现有技术所述的难以兼顾发光材料的良好载流子传输能力及高蓝光色纯度的缺陷,提供一种蒽衍生物。该蒽衍生物可有效提高π电子离域,使得载流子注入和传输更加平衡,进而提高其荧光量子效率,在有机溶剂高效的发射深蓝光的同时,还可以实现固态薄膜聚集态高荧光量子效率。
本发明的另一目的在于提供上述蒽衍生物的制备方法。
本发明的又另一目的在于提供上述蒽衍生物作为发光材料在有机发光器件中的应用。
为解决上述技术问题,本发明采用的技术方案是:
一种蒽衍生物,其结构通式为式(ⅰ):
其中r为
所述蒽衍生物具有给体-π-受体结构;其中四苯基萘单元作为电子受体,蒽作为电子给体,可以避免由于强的电荷转移导致的效率下降现象。四苯基萘分子具有良好的电子传输性能和空穴传输能力,可以有效平衡蒽衍生物作为发光层的器件载流子注入和传输能力,其具有较高的色纯度。
本发明还保护上述蒽衍生物的制备方法,所述制备方法包括如下步骤:
将对溴-萘蒽或双对溴-蒽、四苯基萘硼酸与催化剂混合,在强碱存在的环境中、惰性气体的保护下,通过铃木反应(suzuki反应)制得含蒽衍生物混合液,通过萃取、纯化,得到含蒽衍生物。
所述催化剂为钯催化剂。
优选地,所述催化剂为四三苯基膦钯。
优选地,所述强碱为碳酸钾或碳酸钠。
在suzuki反应中,在碱存在条件下,有机硼化合物被碱活化为硼酸酯中间体,使得有机分子很容易从硼原子转移到钯原子上,构建出碳—碳单键。整个反应条件温和,副产物少,毒性低,原料化合物中的大量官能团能够不被破坏而稳定存在,因而具有高度的化学选择性。
优选地,所述对溴-萘蒽、四苯基萘-硼酸和催化剂的添加摩尔比为1:1~2:0.05~0.1。
更优选地,所述对溴-萘蒽、四苯基萘-硼酸和催化剂的添加摩尔比为1:1.5:0.07。
优选地,所述双对溴-蒽、四苯基萘-硼酸和催化剂的添加摩尔比为1:2~4:0.05~0.1。
更优选地,所述双对溴-蒽、四苯基萘-硼酸和催化剂的添加摩尔比为1:3:0.07。
优选地,所述suzuki反应的温度为80~95℃,反应时间为36~60℃。
更优选地,所述suzuki反应的温度为90℃,反应时间为48℃。
优选地,所述萃取使用的萃取剂为饱和食盐水和二氯甲烷。
优选地,所述纯化使用柱层析法,其中固定相为硅胶粉,洗脱剂为石油醚/二氯甲烷。
本发明还保护上述蒽衍生物作为发光材料在有机发光器件中的应用。
与现有技术相比,本发明的有益效果是:
本发明创造性地合成了一种蒽衍生物。该蒽衍生物借助蒽类材料与四苯基萘的优良特性,通过四苯基萘基团的引入使得载流子注入和传输更加平衡,并且平衡电子给体与受体间的电荷转移作用,实现固态薄膜聚集态高荧光量子效率的同时,还可以保持了其的深蓝发射,合成了兼具良好载流子传输能力及聚集态下高荧光量子产率的有机发光小分子。所述蒽衍生物的制备方法简单、便捷、可大规模批量制备,应用于工业化生产。该蒽衍生物可作为发光材料广泛应用于有机发光器件,特别是稳定高效深蓝有机电致发光器件。
附图说明
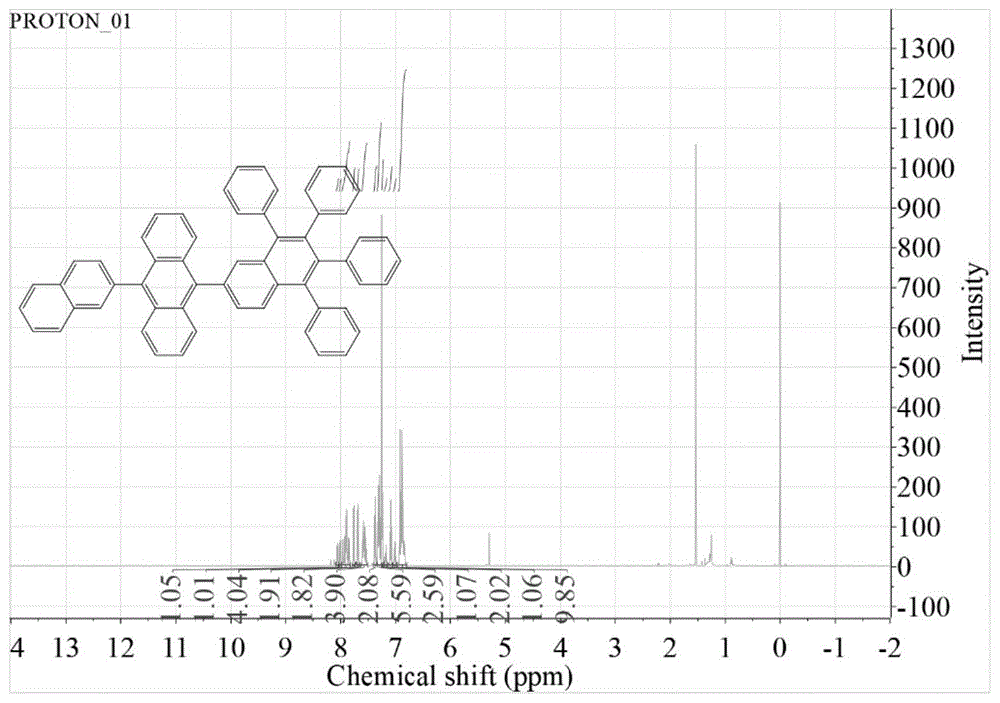
图1为实施例1制备的蒽衍生物an-tna1的超导核磁共振仪测试的分子氢谱。
图2为实施例2制备的蒽衍生物an-tna2的超导核磁共振仪测试的分子氢谱。
图3为岛津uv-2700紫外可见分光光度计测得的an-tna1及an-tna2在二氯甲烷溶液下的吸收图谱。
图4为爱丁堡fls980在激发波长为350nm下测得an-tna1及an-tna2在二氯甲烷下的荧光发射图谱。
图5为岛津uv-2700紫外可见分光光度计测得的an-tna1及an-tna2薄膜状态下的归一化吸收图谱。
图6为爱丁堡fl980瞬态稳态荧光磷光光谱仪在激发波长为350nm下测得an-tna1及an-tna2薄膜状态下的归一化荧光发射图谱。
图7为photoresearchpr745光谱扫描仪测得以an-tna1及an-tna2分别作为oled发光层器件的电致发光图谱。
图8为photoresearchpr745光谱扫描仪测得以an-tna1及an-tna2分别作为oled发光层器件的外量子产率及亮度关系图谱。
具体实施方式
下面结合具体实施方式对本发明作进一步的说明。
实施例中的原料均可通过市售得到;
除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
实施例1
实施例1提供一种蒽衍生物,该蒽衍生物的制备方法如下:
将对溴-萘蒽(1.15g,3mmol)、四苯基萘硼酸(2.51g,4.5mmol)和四三苯基膦钯(0.16g,0.21mmol)加入100ml的两颈烧瓶中,将烧瓶在真空下抽空并在干燥氮气中置换三次;
加入60ml四氢呋喃和8ml饱和的k2co3水溶液,在90℃下加热回流搅拌反应48小时,得到混合溶液;
使用饱和食盐水和二氯甲烷萃取上述混合溶液,减压蒸馏,获得黑色固体,通过柱层析法对其纯化,其中固定相为硅胶粉,洗脱剂为石油醚/二氯甲烷,得到蒽衍生物an-tna1,共1.0g,产率80%。
该反应过程如下:
实施例2
实施例2提供一种蒽衍生物,该蒽衍生物的制备方法如下:
将双对溴蒽(1.01g,3mmol)、四苯基萘硼酸(5.02g,9mmol)和四三苯基膦钯(0.16g,0.21mmol)加入100ml的两颈烧瓶中,将烧瓶在真空下抽空并在干燥氮气中置换三次;
加入60ml四氢呋喃和8ml饱和的k2co3水溶液,在90℃下加热回流搅拌反应48小时,得到混合溶液;
使用饱和食盐水和二氯甲烷萃取上述混合溶液,减压蒸馏,获得黑色固体;通过柱层析法对其纯化,其中固定相为硅胶粉,洗脱剂为石油醚/二氯甲烷,得到蒽衍生物an-tna2,共1.69g,产率66.7%。
该反应过程如下:
实施例3
实施例3提供一种蒽衍生物,其制备方法与实施例1的区别在于:四苯基萘硼酸的添加量为3mmol,四三苯基膦钯的添加量为0.15mmol。
实施例4
实施例4提供一种蒽衍生物,其制备方法与实施例1的区别在于:四苯基萘硼酸的添加量为6mmol,四三苯基膦钯的添加量为0.3mmol。
实施例5
实施例5提供一种蒽衍生物,其制备方法与实施例2的区别在于:四苯基萘硼酸的添加量为6mmol,四三苯基膦钯的添加量为0.15mmol。
实施例6
实施例6提供一种蒽衍生物,其制备方法与实施例2的区别在于:四苯基萘硼酸的添加量为12mmol,四三苯基膦钯的添加量为0.3mmol。
应用测试
选取实施例1、实施例2制备的蒽衍生物进行应用测试。
测试方法如下:
化合物结构检测:超导核磁共振仪布鲁克400mhz检测得到分子氢谱,溶剂为氘代dmso;
吸收光强度:使用岛津uv-2700紫外可见分光光度计检测蒽衍生物an-tna1和an-tna2在二氯甲烷溶液下的吸收图谱,以及an-tna1和an-tna2薄膜状态下的归一化吸收图谱;
发射光强度:使用爱丁堡fls980在激发波长为350nm下检测蒽衍生物an-tna1和an-tna2在二氯甲烷下的荧光发射图谱,以及an-tna1和an-tna2薄膜状态下的归一化荧光发射图谱;
电致发光性能:蒽衍生物an-tna1和an-tna2分别用作oled发光层器件,使用photoresearchpr745光谱扫描仪检测得到电致发光图谱;
外量子产率(eqe):蒽衍生物an-tna1和an-tna2分别用作oled发光层器件,使用photoresearchpr745光谱扫描仪检测其eqe及亮度关系图谱。
测试结果如下:
蒽衍生物an-tna1的分子氢谱如图1所示,蒽衍生物an-tna2的分子氢谱如图2所示,可以看出:
an-tna1的分子氢谱特征波数(ppm)为1hnmr(600mhz,chloroform-d)δ8.06(dd,j=8.3,5.6hz,1h),8.03–7.98(m,1h),7.98–7.83(m,4h),7.79–7.73(m,2h),7.69(dd,j=8.0,1.6hz,2h),7.63–7.51(m,4h),7.40–7.34(m,2h),7.34–7.26(m,6h),7.25–7.22(m,2h),7.17(t,j=1.7hz,1h),7.09(t,j=7.6hz,2h),7.04–6.98(m,1h),6.96–6.80(m,10h);
an-tna2的分子氢谱特征波数(ppm)为1hnmr(400mhz,dmso-d6)δ7.76–7.65(m,2h),7.63–7.57(m,4h),7.57–7.47(m,3h),7.45–7.36(m,7h),7.35(s,2h),7.26(s,7h),7.23(s,2h),7.10(d,j=7.2hz,4h),7.01(dd,j=12.6,7.7hz,9h),6.92(dd,j=15.6,7.2hz,10h),6.86(d,j=6.5hz,4h)。
各波峰能与蒽及四苯基基萘的氢原子一一对应,数量合理,这表明实施例1、2制备的四苯基萘取代的蒽衍生物an-tna1和an-tna2均结构单一。
蒽衍生物an-tna1和an-tna2的发光性能如图3和图4所示,箭头指的是曲线读取的纵坐标的方向,采用归一化方法读取吸收强度与发射强度。其最大吸收峰都位于350~425nm内,表现出典型的蒽衍生物的三重峰吸收;其发射波长分别为424及447nm,表明其发射的处于深蓝区。其在溶液中的绝对荧光量子产率可以达到将近100%,表明其在溶液下具有极高的荧光量子产率,可以应用于高效深蓝有机电致发光器件。
蒽衍生物an-tna1和an-tna2在聚集态下的发光性能如图5和图6所示,箭头指的是曲线读取的纵坐标的方向,读取吸收强度与发射强度。由图可知,其最大吸收峰都位于350~425nm内,表现出典型的蒽衍生物的三重峰吸收;其发射波长分别为444及452nm,显示出其在聚集状态下也可以实现深蓝发射,并且薄膜中的具有高的绝对荧光量子产率,表明其在聚集态下也能高效地发射荧光。
由于具有深蓝发射及高的荧光量子产率,将蒽衍生物an-tna1和an-tna2分别用作发光层的非掺杂oled器件,器件结构均为hat-cn(10nm)/tapc(50nm)/tcta(10nm)/eml(20nm)/tpbi(40nm)/lif(1nm)/al(100nm)。
oled器件电致发光图谱如图7所示,an-tna1和an-tna2的非掺杂器件的最大发射波长均为445nm,为标准深蓝发射,且半峰宽均仅为较小的68nm,表明其色纯度较高。cie色坐标分别为(0.15,0.09)、(0.15,0.11),均已经达到国际标准oled器件的深蓝发射(x+y<0.30)。表明使用an-tna1或an-tna2作发光层的非掺杂oled器件具有很高的色纯度。
oled器件的外量子产率(eqe)及亮度关系图谱如图8所示,以an-tna1、an-tna2为发光层的器件分别获得5.05%及4.27%的最大eqe,这表明了实施例1~2制备得到的四苯基萘取代的蒽衍生物在oled器件中具有良好的光电性质及载流子传输能力。使用an-tna1作为发光层的oled器件在低于8伏的电压驱动下,可以获得最大超过4000尼特(cd/m2)的亮度,在发光层的器件启动电压较低的条件下,显示出优异的亮度性能。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!