基于茚并噻吩给体D‑A‑π‑A型染料及其用途的制作方法
本发明涉及一种基于茚并噻吩给体D-A-π-A型染料及其用途。
背景技术:
伴随着人类工业文明的迅速发展,煤、石油和天然气等矿物资源日益枯竭,由此引发的能源危机和环境污染已成为亟待解决的严重问题。因此人们迫切需要寻找其他新的可替代能源。染料敏化太阳能电池(B.O’Regan,M.Nature,1991,353,737-740),因其低成本,具有潜在的实用价值。
染料敏化太阳电池(DSSC)通常由半导体氧化物纳米多孔膜,染料敏化剂,氧化还原电解质和Pt电极等组成,其中宽光谱、高摩尔消光系数、低成本的染料敏化剂是整个DSSC系统的核心部分。迄今为止光电转换效率最好的光敏染料是联吡啶钌络合物(超过12%),由于钌为稀有金属、其价格比较昂贵,且制备过程较复杂,限制了其商业化应用。
因此,寻找低成本、易于制备、且具有良好应用性能的非贵金属有机太阳电池敏化材料成为本领域研究人员关注的热点。同时,也成为本发明需要解决的技术问题。
技术实现要素:
本发明的发明人以茚并噻吩作为给体单元,并对该给体单元进行化学修饰(即一端连接供电子基团作为给体,另一端连接不同的共轭单元和吸电子基团,用来吸附在TiO2上)后获得一类基于茚并噻吩给体D-A-π-A型染料。经实验证明:本发明的发明人设计及制备的基于茚并噻吩给体D-A-π-A型染料具有独特的光电化学性能,可用作染料敏化太阳能电池的光敏化剂。
此外,本发明的发明人公开的基于茚并噻吩给体D-A-π-A型染料具有易于制备和低成本(较联吡啶钌络合物而言)等优点,具备商业化应用前景。
本发明一个目的在于,提供一种基于茚并噻吩给体D-A-π-A型染料。
本发明所述的基于茚并噻吩给体D-A-π-A型染料,其为式Ⅰ所示化合物:
式Ⅰ中,R1,R2和R3分别独立选自:氢(H),苯基或由C1~C8烷氧基取代的苯基中一种;R4,R5,R8和R9分别独立选自:C1~C8直链或支链的烷基中一种;R6和R7分别独立选自:H或卤素(F、Cl、Br或I)中一种;X为N或CH;n为0或1;A为含N或/和S的5~6元杂环基,或由苯基取代的含N或/和S的5~6元杂环基(A与母环:为“并”的关系);
其中,所述5~6元杂环基的杂原子数为1~3的整数。
本发明另一个目的在于,揭示上述基于茚并噻吩给体D-A-π-A型染料的一种用途,即:式Ⅰ所示化合物作为染料敏化太阳能电池的光敏剂的应用。
此外,本发明还有一个目的在于,提供一种制备上述式Ⅰ所示化合物的方法。所述方法包括如下步骤:
(1)由二苯胺(起始原料)经溴化反应,得到三溴二苯胺(式Ⅱ所示化合物)的步骤;
(2)式Ⅱ所示化合物与R1B(OH)2,R2B(OH)2或/和R3B(OH)2经Suzuki偶联反应,得到式Ⅲ所示化合物的步骤;
(3)式Ⅲ所示化合物与茚并噻吩单元经Buchwald–Hartwig偶联反应,得得到式Ⅳ所示化合物;及式Ⅳ所示化合物成盐,得到式Ⅴ所示化合物的步骤;
(4)由式Ⅵ所示化合物与环戊二噻吩锡盐经stille偶联,得到单取代中间体,然后将该单取代中间体与三氯氧磷经Bouveault反应,得到醛基中间体(式Ⅶ所示化合物)的步骤;
(5)式Ⅶ所示化合物与式Ⅴ所示化合物经stille偶联反应,得到式Ⅷ所示化合物的步骤;及,
(6)式Ⅷ所示化合物与氰基乙酸经Knoevenagel缩合反应,得目标产物(式Ⅰ所示化合物)的步骤。
其中:R1~R9,X,A及n的定义与前文所述相同;所述茚并噻吩单元的制备,请参见(C.Hyeju,S.Minkyung,S.Kihyung,K.Moon-Sung,K.Yungjin,K.Jaejung,J.Mater.Chem.A,2014,2,12931-12939)。所述环戊二噻吩锡盐:由环戊二噻吩(市售品)按现有技术成锡盐后得到。
附图说明
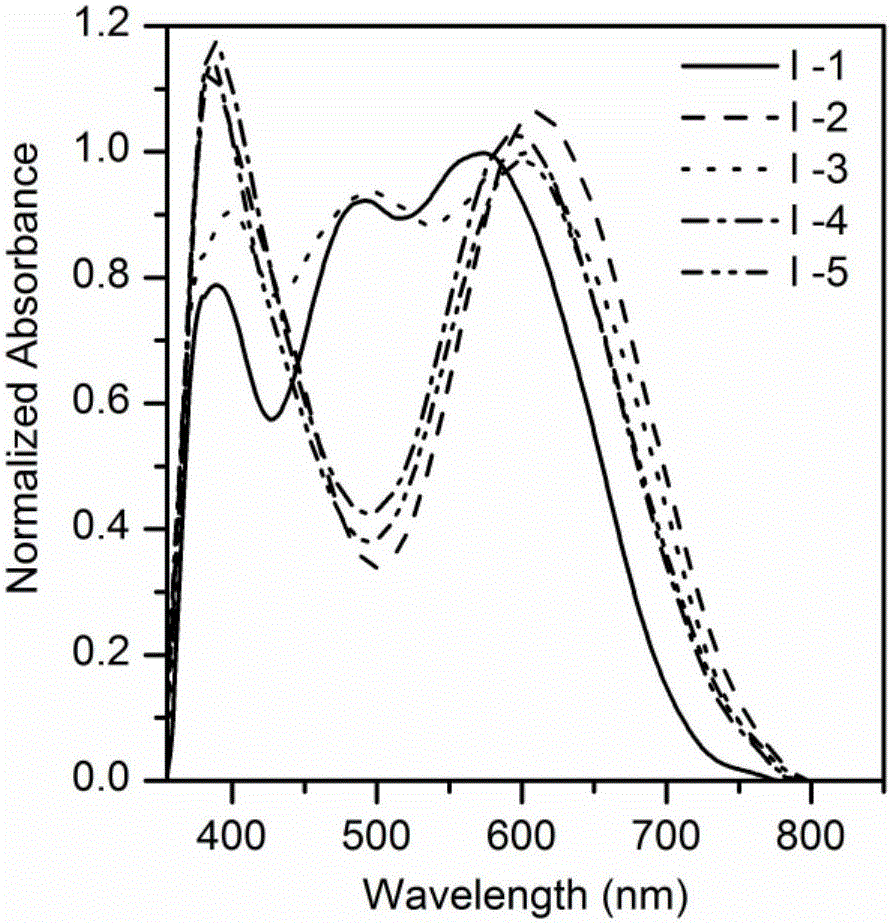
图1.为由实施例1~5制备的化合物Ⅰ-1~化合物Ⅰ-5在二氯甲烷中的紫外-可见吸收谱图;
其中:横坐标表示的是波长(单位为纳米),纵坐标表示的是摩尔消光系数(单位为升每摩尔每厘米)。
图2.为化合物Ⅰ-1~化合物Ⅰ-5在二氧化钛膜上的归一化紫外-可见吸收谱图;
其中:横坐标表示的是波长(单位为纳米),纵坐标表示的是吸光度(单位为1)。
图3.为化合物Ⅰ-1~化合物Ⅰ-5作为光敏化剂的太阳能电池的I-V曲线;
其中:横坐标表示的是电压(单位为伏),纵坐标表示的是电流密度(单位为毫安每平方厘米)。
图4.为化合物Ⅰ-1~化合物Ⅰ-5作为光敏化剂的太阳能电池的IPCE曲线;
其中:横坐标表示的是波长(单位为纳米),纵坐标表示的是单色光转化效率(单位为百分比)。
具体实施方式
在本发明一个优选的技术方案中,R1,R2和R3分别独立选自:C1~C8烷氧基取代的苯基中一种;
进一步优选的技术方案是:R1,R2和R3均选自:C8烷氧基取代的苯基中一种;
更进一步优选的技术方案是:R1,R2和R3均为(其中,曲线标记处为取代位,下同)。
在本发明另一个优选的技术方案中,A为含N的6元杂环基,有苯基取代的含N的6元杂环基,或含N和S的5元杂环基;
其中,所述5元或6元杂环基的杂原子数为2或3。
进一步优选的技术方案是:A为有苯基取代的含N的6元杂环基,或含N和S的5元杂环基;
其中,所述5元或6元杂环基的杂原子数为2或3。
更进一步优选的技术方案是:A为:
本发明提供一种制备上述式Ⅰ所示化合物的方法,具体包括如下步骤:
(1)在有惰性气体存在的条件下,将二苯胺、N-溴代丁二酰亚胺(NBS)和非质子极性有机溶剂(如N,N-二甲基甲酰胺(DMF)或四氢呋喃(THF)等)置于反应器中,在室温状态至少保持15小时,得到三溴二苯胺(式Ⅱ所示化合物);
(2)在有催化剂[如Pd(PPh3)4等]和惰性气体存在及碱性条件下,将式Ⅱ所示化合物与R1B(OH)2,R2B(OH)2或/和R3B(OH)2,及非质子极性有机溶剂(THF)置于反应器中,在室温状态至少保持15小时,得到式Ⅲ所示化合物;
(3)式Ⅲ所示化合物与茚并噻吩单元经Buchwald–Hartwig偶联反应,得得到式Ⅳ所示化合物;及,
在-78℃和惰性气体存在的条件下,将式Ⅳ所示化合物和正丁基锂置于非质子极性溶剂[如THF]中,于-78℃搅拌保持1小时后,在加入三甲基氯化锡,再搅拌半小时后,于常温搅拌3小时,得到式Ⅴ所示化合物;
(4)在有催化剂[如Pd2(dba)3等]和惰性气体存在及中性条件下,将式Ⅵ所示化合物与环戊二噻吩锡盐置于极性有机溶剂(如甲苯等)中,在回流状态至少保持10小时,冷却、蒸除所用溶剂,剩余物用二氯甲烷溶解,水洗,用无水硫酸钠干燥二氯甲烷层,旋干,硅胶柱层析,得到单取代中间体;
在有惰性气体存在的条件下,将所得单取代中间体,三氯氧磷(POCl3)和非质子极性溶剂(如DMF等)置于反应器中,于60℃状态至少保持4小时,得到式Ⅶ所示化合物;
(5)在有惰性气体及催化剂[如Pd(PPh3)2Cl2等]存在条件下,式Ⅶ所示化合物与式Ⅴ所示化合物经stille偶联反应,得到式Ⅷ所示化合物;及,
(6)式Ⅷ所示化合物与氰基乙酸经Knoevenagel缩合反应,得到目标产物(式Ⅰ所示化合物)。
本发明提供的基于茚并噻吩给体D-A-π-A型染料在制备染料敏化太阳能电池的光敏剂中的应用,包括染料敏化太阳能电池的结构、制备步骤和电池性能测试:
(1)染料敏化太阳能电池的结构:
染料敏化太阳能电池主要由光阳极、光阴极及它们的基板和电解质组成;光阳极与光阴极基板的材料为导电玻璃,上面覆有导电膜的透明玻璃;光阳极基板工作区域一侧涂有纳米多孔TiO2薄膜,并浸渍有基于茚并噻吩给体D-A-π-A型染料;光阴极基板工作区域一侧镀有Pt催化剂层;光阳极和光阴极相对间隔设置,周边用密封材料密封形成密闭的腔体,腔体内填充有电解质。
(2)染料敏化太阳能电池的制作步骤如下:
a.清洗导电玻璃:将FTO导电玻璃割成1.2×1.8cm2,依次用玻璃清洗剂、清水、丙酮、二次水、乙醇洗涤,吹干,待用。
b.镀铂电极:导电玻璃四周用胶布粘住,导电面朝上,在导电玻璃滴2滴氯铂酸的异丙醇溶液(2×10-4M),旋涂,红外灯烘干后,400℃烘15min,待冷却后,在适当的位置打一个孔,备用。
c.染料(即分别由实施例1~5所制备的化合物)溶液的配制:用二氯甲烷溶液配制3×10-4M的染料溶液。
d.光阳极的制备:通过丝网印刷在FTO导电玻璃上刷一层TiO2浆料,125℃烘6分钟,冷却后,再涂一层,125℃烘6min,一共涂三层,然后缓慢升温至450℃烘15min,再升温至500℃烘15min,冷却至室温后,用0.04M的TiCl4水溶液室温处理12h,分别用二次水洗、乙醇洗涤,450℃烘30min,冷却后将其泡入染料溶液(即由步骤c配制)中。12h后取出,用浸泡染料所用溶剂洗涤,吹干。
e.电解质的配制:用无水处理过的乙腈溶剂配制含有0.05M的I2、0.1M的LiI、0.6M的甲基丙基咪唑、0.5M的对叔丁基吡啶的溶液。
f.电池的封装:在吸附了染料的TiO2膜的周围贴上热固型胶带密封圈,对电极的导电面朝内盖在TiO2膜上,小孔处在TiO2膜和热固型胶带密封圈的间隙处,用电池封装机加热加压封装;在小孔里注入电解质,真空抽出电池工作区域的气泡,使电解质充分填充在两个电极的空腔中,最后密封,制得染料敏化太阳能电池。
(3)电池性能测试:从电池的光阳极和光阴极分别引出导线,接到电池性能测试装置上,
电池的工作面积通过一个孔面积为0.25cm2的黑胶布确定,用太阳光模拟器(91160型,Newport,USA)模拟太阳光,将光强调节至100mW/cm2,测得的光电转换效率为4.03-8.83%,短路电流为9.49~15.29mA/cm2,开路电压为0.648-0.782mV,填充因子为0.65~0.74(详见实施例9)。
下面通过实施例对本发明做进一步阐述,其目的仅在于更好理解本发明的内容。因此,所举之例不限制本发明的保护范围。
实施例1
在100mL三口圆底烧瓶中加入483mg(1mmol)二溴喹喔啉(式Ⅵ-1所示化合物)、35mg(0.05mmol)双三苯基膦二氯化钯和30mL甲苯,50℃下,滴加0.5mL(1.1mmol)环戊二噻吩锡盐的甲苯溶液,80℃搅拌过夜,旋干甲苯溶剂,用二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=3/1至2/1,得到321mg橙红色固体(式Ⅵ-1a所示化合物),产率42.3%。
1H NMR(CDCl3,400MHz),δ:8.03(d,1H,J=8Hz),7.97-7.94(m,1H),7.79(s,1H),7.74-7.67(m,4H),7.44-7.35(m,6H),7.18(d,1H,J=4Hz),6.97-6.96(m,1H),1.98-1.87(m,4H),1.39-1.25(m,2H),1.01-0.89(m,16H),0.77-0.70(m,6H),0.64-0.58(m,6H).
在100mL三口圆底烧瓶中加入380mg(0.5mmol)式Ⅵ-1a所示化合物、0.05mL(0.55mmol)三氯氧磷和30mL和N,N-二甲基甲酰胺,加热至50℃反应4h,冷却至室温,倒入冰水中,二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=2/1至1/1,得到318mg橙色固体(式Ⅶ-1所示化合物),产率81%。
1H NMR(CDCl3,400MHz),δ:9.85(s,1H),8.07(d,1H,J=8Hz),8.01-7.98(m,1H),7.80(s,1H),7.72-7.67(m,4H),7.59(d,1H,J=4Hz),7.47-7.35(m,6H),2.02-1.96(m,4H),1.01-0.90(m,18H),0.76-0.73(m,3H),0.66-0.59(m,9H).
在250mL三口圆底烧瓶中加入5g(29.6mmol)二苯胺和13.33g(73.92mmol)NBS,避光,加100mL的DMF溶解,搅拌反应18h,将反应液倒入水中析出固体,过滤,甲醇洗涤,干燥,得到2.59g产物(式Ⅱ-1所示化合物),产率27%。
1H NMR(CDCl3,400MHz),δ:7.83(d,2H,J=12Hz),7.43(d,1H,J=12Hz),7.39(d,2H,J=8Hz),7.18(d,1H,J=8Hz),6.97(d,2H,J=8Hz).
在100mL三口烧瓶中加入0.53g(1.62mmol)式Ⅱ-1所示化合物、5mL的2M K2CO3、15mL的THF,再加200mg(0.17mmol)Pd(PPh3)4,氩气保护下,加热回流0.5h,注入10mLTHF溶解的2.14g(5.67mmol)2,4-双((2-乙基己基)氧基))苯硼酸溶液,回流过夜,停止加热,冷却至室温,旋掉THF,剩余物用DCM溶解,水洗,DCM层用无水Na2SO4干燥,旋干,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=4/1至2/1,得到945mg无色液体(式Ⅲ-1所示),产率70%。
1H NMR(CDCl3,400MHz),δ:7.50(d,3H,J=12Hz),7.45(d,2H,J=8Hz),7.36(d,1H,J=8Hz),7.32-7.27(m,2H),7.08(d,2H,J=8Hz).6.72(s,1H),6.69(d,1H,J=8Hz),6.65-6.60(m,4H),4.00-3.93(m,12H),1.85-1.73(m,6H),1.58-1.49(m,12H),1.45-1.29(m,36H),1.06-0.90(m,36H).
在100mL三口烧瓶中加入4.15g(3.56mmol)式Ⅲ-1所示化合物、1g(4.27mmol)6-溴-4,4-二甲基-4H-茚并[1,2-b]噻吩、50mL甲苯,再加46mg(0.05mmol)Pd2(dba)3、1.35g(12.1mmol)叔丁醇钾、0.1mL三叔丁基膦,氩气保护下,加热回流10h,停止加热,冷却至室温,旋掉甲苯,DCM溶解,水洗,有机层无水Na2SO4干燥,旋干,硅胶柱层析,展开剂为体积比PE/DCM=5/1至2/1,得到2.5g淡黄色液体(式Ⅳ-1所示化合物),产率68%。
1H NMR(CDCl3,400MHz),δ:7.35(d,1H,J=8Hz),7.22(d,2H,J=4Hz),7.18(m,2H),7.13(d,1H,J=8Hz),7.09(d,1H,J=8Hz),7.04-6.96(m,4H),6.84(d,2H,J=8Hz),6.77(s,1H),6.55(s,1H),6.53(s,1H),6.50-6.47(m,2H),6.18(d,1H,J=8Hz),6.10(s,1H),3.83-3.79(m,8H),3.61(d,2H,J=4Hz),3.38(s,2H),1.34-1.30(m,12H),1.26-1.22(m,12H),1.18-1.14(m,36H),0.81-0.72(m,36H).
在100mL史莱克管中加入800mg(0.78mmol)式Ⅳ-1所示化合物和20mL四氢呋喃,氩气保护下,-78℃搅拌15min,打入0.48mL(1.16mmol)正丁基锂,搅拌反应1h,再打入0.25g(0.93mmol)三甲基氯化锡的THF溶液,搅拌反应30min,再常温反应3h,用水萃取,旋干溶剂得到黄色液体(式Ⅴ-1所示化合物)。
在100mL三口圆底烧瓶中加入158mg(0.2mmol)式Ⅶ-1所示化合物、35mg(0.05mmol)双三苯基膦二氯化钯和25mL甲苯,50℃下,滴加0.25mmol式Ⅴ-1所示化合物的甲苯溶液,80℃搅拌过夜,旋干甲苯溶剂,用二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=2/1至1/1,得到151mg绿色固体(式Ⅷ-1所示化合物),产率36.5%。
1H NMR(CDCl3,400MHz),δ:9.79(s,1H),8.32(d,1H,J=8Hz),8.23-8.19(m,1H),8.14(d,1H,J=4Hz),7.97(d,1H,J=4Hz),7.91-7.88(m,1H),7.71-7.67(m,4H),7.42-7.40(m,1H),7.37-7.35(m,4H),7.32(d,3H,J=4Hz),7.22(d,3H,J=8Hz),7.19(s,1H),7.10(d,1H,J=4Hz),7.08(d,1H,J=4Hz),6.93(d,1H,J=8Hz),6.88(d,2H,J=12Hz),6.81(s,1H),6.64(d,1H,J=8Hz),6.55-6.53(m,2H),6.50-6.45(m,2H),6.18(d,1H,J=4Hz),6.11(s,1H),3.83-3.80(m,8H),3.59(d,2H,J=4Hz),3.40(s,2H),2.04-2.00(m,4H),1.42-1.33(m,12H),1.27-1.21(m,24H),1.19-1.12(m,24H),0.84-0.77(m,24H),0.75-0.69(m,21H),0.67-0.59(m,12H),0.53-0.50(m,9H).
在50mL单口烧瓶中加入104mg(0.05mmol)式Ⅷ-1所示化合物、85mg(1mmol)氰基乙酸、154mg(2mmol)醋酸铵和12mL醋酸,氩气保护下,加热回流12小时,冷却至室温,倒入水中析出大量固体,过滤,干燥,硅胶柱层析,展开剂为二氯甲烷到体积比二氯甲烷/甲醇=20/1,得到91.6mg蓝色固体(式Ⅰ-1所示化合物),产率85.6%。
1H NMR(CO(CD)3,400MHz),δ:8.31(s,1H),8.24(s,1H),8.10(d,2H,J=16Hz),7.89(d,1H,J=8Hz),7.83(d,1H,J=12Hz),7.65-7.62(m,4H),7.36(d,2H,J=12Hz),7.31-7.26(m,7H),7.19-7.15(m,4H),7.08-7.03(m,2H),6.87(d,2H,J=8Hz),6.78(s,1H),6.61(d,1H,J=8Hz),6.50(d,2H,J=4Hz),6.44-6.40(m,2H),6.14(d,1H,J=8Hz),6.07(s,1H),3.78-3.74(m,8H),3.54(s,2H),3.36(s,2H),1.58-1.50(m,4H),1.34-1.27(m,12H),1.23-1.16(m,24H),1.14-1.07(m,24H),0.80-0.73(m,27H),0.71-0.59(m,30H),0.52-0.47(m,9H).
13C NMR(CDCl3,400MHz),166.65,159.87,159.64,159.61,158.57,157.30,157.19,156.99,152.41,152.11,149.10,146.48,146.18,143.74,143.52,139.95,138.41,138.38,136.28,136.04,135.01,134.50,131.05,130.93,130.89,130.78,130.64,129.74,129.51,129.35,129.33,129.13,127.91,127.62,123.45,123.35,122.77,122.70,121.39,120.63,119.48,119.45,117.30,116.78,105.16,104.09,100.27,99.26,70.64,70.54,70.24,70.03,45.81,39.52,39.49,39.40,30.67,30.62,30.53,29.75,29.71,29.18,29.09,29.06,29.00,26.15,24.11,23.96,23.91,23.83,23.14,23.12,23.10,23.08,23.02,14.21,14.18,14.15,11.28,11.21,11.19,11.13.
HRMS(m/z):[M+H]+理论值(Calcd for):C140H179N4S3O8 2140.2885;实验值(Found):2140.2881。
实施例2
在100mL三口圆底烧瓶中加入484mg(1mmol)5,8-二溴-2,3-二苯基吡啶并[3,4-B]吡嗪、35mg(0.05mmol)双三苯基膦二氯化钯和35mL甲苯,50℃下,滴加0.5mL(1.1mmol)环戊二噻吩锡盐的甲苯溶液,85℃搅拌过夜,旋干甲苯溶剂,用二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=2/1至1/1,得到667mg红色固体(式Ⅵ-2a所示化合物),产率87.6%。
1H NMR(CDCl3,400MHz),δ:8.79(s,1H),8.53(m,1H),7.61(d,4H,J=8Hz),7.39-7.29(m,6H),7.18(d,1H,J=4Hz),6.91(d,1H,J=4Hz),1.93-1.79(m,4H),1.35-1.18(m,5H),0.91-0.77(m,14H),0.67-0.64(m,5H),0.71-0.58(m,6H),0.53-0.50(m,6H).
在100mL三口圆底烧瓶中加入380.6mg(0.5mmol)式Ⅵ-2a所示化合物、0.05mL(0.55mmol)三氯氧磷和25mL的N,N-二甲基甲酰胺,加热至50℃反应4h,冷却至室温,倒入冰水中,二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=2/1至1/1,得到361mg红色固体(式Ⅶ-2所示化合物),产率91.5%。
1H NMR(CDCl3,400MHz),δ:9.87(s,1H),8.93(m,1H),8.61(d,1H,J=4Hz),7.71-7.67(m,4H),7.61(d,1H,J=4Hz),7.50-7.44(m,4H),7.41-7.37(m,2H),2.04-1.97(m,4H),1.29-1.25(m,5H),1.01-0.90(m,12H),0.74-0.71(m,5H),0.63-0.58(m,8H).
在100mL三口圆底烧瓶中加入157.8mg(0.2mmol)式Ⅶ-2所示化合物、35mg(0.05mmol)双三苯基膦二氯化钯和35mL甲苯,50℃下,滴加0.25mmol式Ⅴ-1所示化合物的甲苯溶液,90℃搅拌过夜,旋干甲苯溶剂,用二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=1/1至1/2,得到176.6mg绿色固体(式Ⅷ-2所示化合物),产率42.6%。
1H NMR(CDCl3,400MHz),δ:9.87(s,1H),9.16(s,1H),8.60(d,1H,J=8Hz),7.87(s,1H),7.79-7.76(m,2H),7.75-7.72(m,2H),7.61(d,1H,J=4Hz),7.54(d,1H,J=8Hz),7.50-7.44(m,5H),7.42-7.37(m,5H),7.30(d,2H,J=8Hz),7.16(d,1H,J=8Hz),7.02(d,3H,J=12Hz),6.91(s,1H),6.75(d,1H,J=8Hz),6.56-6.51(m,4H),6.24(d,1H,J=8Hz),6.09(s,1H),3.89-3.83(m,8H),3.67-3.63(m,2H),3.44(s,2H),2.05-1.97(m,4H),1.58(s,6H),1.38-1.32(m,24H),1.29-1.23(m,24H),0.97-0.84(m,51H),0.77-0.74(m,12H),0.64-0.59(m,9H).
在50mL单口烧瓶中加入124.4mg(0.06mmol)式Ⅷ-2所示化合物、85mg(1mmol)氰基乙酸、154mg(2mmol)醋酸铵和20mL醋酸,氩气保护下,加热回流12小时,冷却至室温,倒入水中析出大量固体,过滤,干燥,硅胶柱层析,展开剂为二氯甲烷到体积比为二氯甲烷/甲醇=20/1,得到105.3mg蓝色固体(式Ⅰ-2所示化合物),产率82%。
1H NMR(CO(CD)3,400MHz),δ:9.11(s,1H),8.50(d,1H,J=4Hz),8.27(s,1H),7.82(s,1H),7.70(d,2H,J=8Hz),7.67-7.65(m,2H),7.48-7.40(m,6H),7.37-7.33(m,4H),7.31(d,2H,J=8Hz),7.24-7.21(m,3H),7.09(d,1H,J=8Hz),6.95(d,2H,J=12Hz),6.84(s,1H),6.69(d,1H,J=8Hz),6.48-6.44(m,4H),6.17(d,1H,J=8Hz),6.02(s,1H),3.84-3.75(m,8H),3.58(s,2H),3.36(s,2H),1.96-1.93(m,4H),1.30-1.24(m,24H),1.21-1.19(m,36H),0.90-0.85(m,24H),0.81-0.77(m,21H),0.70-0.66(m,12H),0.57-0.53(m,9H).
13C NMR(CDCl3,400MHz),178.42,167.25,162.18,158.77,158.56,158.50,156.22,156.10,155.90,145.55,138.61,137.09,136.98,135.92,135.59,135.22,133.84,133.37,133.28,129.96,129.71,129.70,129.55,129.46,129.12,128.89,128.86,128.79,128.73,128.67,128.64,128.40,127.64,127.34,126.50,124.50,122.39,122.31,120.30,115.80,104.05,102.95,99.17,98.15,92.32,69.55,69.47,69.09,52.92,44.50,42.19,42.14,38.44,38.42,38.35,38.30,34.37,33.13,32.94,30.90,29.60,29.54,29.45,28.67,28.65,28.64,28.57,28.42,28.34,28.23,28.10,28.05,28.03,27.99,27.92,27.39,26.36,25.15,23.68,23.01,22.87,22.76,22.06,22.04,22.02,22.01,21.88,21.76,21.71,21.67,13.13,13.10,13.06,13.02,12.94,10.25,10.20,10.12,10.09,10.06,9.57.
HRMS(m/z):[M+H]+理论值(Calcd for):C139H178N5S3O8 2141.2838;实验值(Found):2141.1890。
实施例3
在100mL三口圆底烧瓶中加入292mg(1mmol)5,8-二溴苯并噻二唑、35mg(0.05mmol)双三苯基膦二氯化钯和40mL甲苯,50℃下,滴加0.5mL(1.1mmol)环戊二噻吩锡盐的甲苯溶液,85℃搅拌过夜,旋干甲苯溶剂,用二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=3/1至2/1,得到218.6mg橙红色固体(式Ⅵ-3a所示化合物),产率35.6%。
1H NMR(CDCl3,400MHz),δ:8.32(s,1H),7.89(m,1H),7.54(s,1H),7.04(d,1H,J=4Hz),6.76(d,1H,J=4Hz),1.85-1.72(m,4H),1.27-1.12(m,5H),0.98-0.75(m,14H),0.69-0.66(m,5H),0.62-0.58(m,6H),0.51-0.48(m,6H).
在100mL三口圆底烧瓶中加入307mg(0.5mmol)式Ⅵ-3a所示化合物、0.05mL(0.55mmol)三氯氧磷和40mL N,N-二甲基甲酰胺,加热至65℃反应4h,冷却至室温,倒入冰水中,二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=3/1至2/1,得到273.9mg橙红色固体(式Ⅶ-3所示化合物),产率85.3%。
1H NMR(CDCl3,400MHz),δ:9.67(s,1H),8.04(m,1H),7.67(d,1H,J=4Hz),6.87-6.84(m,2H),1.96-1.88(m,4H),1.31-1.17(m,5H),1.09-0.94(m,12H),0.81-0.75(m,5H),0.59-0.54(m,8H).
在100mL三口圆底烧瓶中加入128.4mg(0.2mmol)式Ⅶ-3所示化合物、35mg(0.05mmol)双三苯基膦二氯化钯和25mL甲苯,55℃下,滴加0.25mmol式Ⅴ-1所示化合物的甲苯溶液,80℃搅拌过夜,旋干甲苯溶剂,用二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=3/1至1/1,得到155.2mg绿色固体(式Ⅷ-3所示化合物),产率40.3%。
1H NMR(CDCl3,400MHz),δ:9.81(s,1H),8.24(d,1H,J=8Hz),8.21-8.17(m,1H),8.07(d,1H,J=4Hz),7.93(d,1H,J=4Hz),7.89-7.86(m,1H),7.58-7.53(m,4H),7.38-7.35(m,1H),7.25(d,1H,J=4Hz),7.15(s,1H),7.07(d,1H,J=4Hz),6.91(d,1H,J=8Hz),6.85(d,2H,J=12Hz),6.76(s,1H),6.59(d,1H,J=8Hz),6.54-6.51(m,2H),6.45-6.41(m,2H),6.14(d,1H,J=4Hz),6.09(s,1H),3.79-3.75(m,8H),3.54(d,2H,J=4Hz),3.43(s,2H),1.98-1.94(m,4H),1.45-1.38(m,12H),1.30-1.22(m,24H),1.17-1.10(m,24H),0.82-0.75(m,24H),0.73-0.67(m,21H),0.65-0.58(m,12H),0.52-0.48(m,9H).
在50mL单口烧瓶中加入96.3mg(0.05mmol)式Ⅷ-3所示化合物、85mg(1mmol)氰基乙酸、154mg(2mmol)醋酸铵和12mL醋酸,氩气保护下,加热回流12小时。冷却至室温,倒入水中析出大量固体,过滤,干燥,硅胶柱层析,展开剂为二氯甲烷到体积比二氯甲烷/甲醇=20/1,得到86.7mg蓝色固体(化合物Ⅰ-3),产率87%。
1H NMR(CO(CD)3,400MHz),δ:8.29(s,1H),8.18(s,1H),8.05(d,2H,J=8Hz),7.87(d,1H,J=4Hz),7.74(d,1H,J=8Hz),7.58-7.54(m,4H),7.25(d,2H,J=8Hz),7.18(d,1H,J=4Hz),7.05-6.99(m,2H),6.85(d,2H,J=4Hz),6.71(s,1H),6.58(d,1H,J=4Hz),6.48(d,2H,J=8Hz),6.38-6.33(m,2H),6.17(d,1H,J=4Hz),6.05(s,1H),3.81-3.76(m,8H),3.50(s,2H),3.41(s,2H),1.87-1.83(m,4H),1.32-1.26(m,12H),1.21-1.16(m,24H),1.09-1.02(m,24H),0.83-0.75(m,27H),0.70-0.61(m,30H),0.55-0.49(m,9H).
13C NMR(CDCl3,400MHz),167.55,160.83,160.43,159.76,158.55,157.60,157.41,156.59,153.21,152.41,148.12,147.28,146.58,144.74,143.62,139.85,138.61,138.48,137.08,136.64,135.21,134.64,132.35,131.43,130.94,130.80,130.34,129.88,129.61,129.45,129.23,129.04,128.61,127.56,124.75,123.65,123.07,122.35,121.62,120.36,119.78,119.35,117.36,116.58,106.56,102.39,100.51,99.56,71.44,70.84,70.44,70.13,44.81,41.52,40.49,39.63,33.87,32.67,31.43,30.75,30.41,29.78,29.39,29.16,29.06,25.17,24.43,23.98,23.48,23.26,23.19,23.14,23.07,23.00,15.31,14.78,14.55,13.28,12.21,11.69,11.23.
HRMS(m/z):[M+H]+理论值(Calcd for):C126H169N4S4O8 1994.1823;实验值(Found):1994.1839。
实施例4
在100mL三口圆底烧瓶中加入327.8mg(1mmol)4,7-二溴5,6-二氟苯并噻二唑、35mg(0.05mmol)双三苯基膦二氯化钯和30mL甲苯,50℃下,滴加0.5mL(1.1mmol)环戊二噻吩锡盐的甲苯溶液,85℃搅拌过夜,旋干甲苯溶剂,用二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=4/1至2/1,得到199.6mg橙红色固体(式Ⅵ-4a所示化合物),产率30.7%。
1H NMR(CDCl3,400MHz),δ:7.56(d,1H,J=4Hz),7.06-7.03(m,2H),1.67-1.63(m,4H),1.22-1.15(m,5H),0.89-0.78(m,14H),0.72-0.68(m,5H),0.61-0.57(m,6H),0.50-0.47(m,6H).
在100mL三口圆底烧瓶中加入325mg(0.5mmol)式Ⅵ-4a所示化合物、0.05mL(0.55mmol)三氯氧磷和40mL N,N-二甲基甲酰胺,加热至55℃反应4h,冷却至室温,倒入冰水中,二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=3/1至1/1,得到280mg橙色固体(式Ⅶ-4所示化合物),产率82.6%。
1H NMR(CDCl3,400MHz),δ:9.82(s,1H),7.55(s,1H),7.03(s,1H),1.62-1.59(m,4H),1.21-1.16(m,5H),1.03-0.97(m,12H),0.77-0.66(m,5H),0.52-0.49(m,8H).
在100mL三口圆底烧瓶中加入135.6mg(0.2mmol)式Ⅶ-4所示化合物、35mg(0.05mmol)双三苯基膦二氯化钯和25mL甲苯,55℃下,滴加0.25mmol式Ⅴ-1所示化合物的甲苯溶液,85℃搅拌过夜,旋干甲苯溶剂,用二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=2/1至1/1,得到144.4mg绿色固体(式Ⅷ-4所示化合物),产率36.8%。
1H NMR(CDCl3,400MHz),δ:9.84(s,1H),8.03(d,1H,J=4Hz),7.92(d,1H,J=4Hz),7.88-7.84(m,1H),7.59(s,1H),7.45-7.41(m,4H),7.27(d,1H,J=4Hz),7.16(d,1H,J=4Hz),7.05(s,1H),6.95(d,1H,J=4Hz),6.88(d,2H,J=8Hz),6.72(s,1H),6.61(d,1H,J=8Hz),6.57-6.55(m,2H),6.42-6.38(m,2H),6.16(d,1H,J=4Hz),6.06(s,1H),3.84-3.80(m,8H),3.49(d,2H,J=4Hz),3.38(s,2H),1.87-1.85(m,4H),1.43-1.36(m,12H),1.32-1.21(m,24H),1.18-1.12(m,24H),0.88-0.79(m,24H),0.75-0.69(m,21H),0.66-0.54(m,12H),0.50-0.47(m,9H).
在50mL单口烧瓶中加入98.1mg(0.05mmol)式Ⅷ-4所示化合物、85mg(1mmol)氰基乙酸、154mg(2mmol)醋酸铵和24mL醋酸,氩气保护下,加热回流12小时。冷却至室温,倒入水中析出大量固体,过滤,干燥,硅胶柱层析,展开剂为二氯甲烷到体积比二氯甲烷/甲醇=20/1,得到83.2mg蓝色固体(式Ⅰ-4所示化合物Ⅰ-4),产率82%。
1H NMR(CO(CD)3,400MHz),δ:8.22(s,1H),8.14(s,1H),7.83(s,1H),7.35(d,2H,J=4Hz),7.19-7.15(m,3H),7.12-7.04(m,4H),6.90-6.85(m,3H),6.82(s,1H),6.57(d,1H,J=8Hz),6.51(s,2H),6.44-6.39(m,2H),6.13(d,1H,J=8Hz),6.07(s,1H),3.77(s,8H),3.55(s,2H),3.38(s,2H),1.66-1.59(m,4H),1.41-1.35(m,12H),1.27-1.21(m,24H),1.13-1.07(m,24H),0.91-0.83(m,27H),0.75-0.64(m,30H),0.52-0.48(m,9H).
13C NMR(CDCl3,400MHz),183.19,159.83,159.58,157.80,157.25,157.13,156.94,148.65,143.63,141.28,136.22,135.84,135.02,134.40,131.06,130.98,130.72,130.58,129.73,129.69,129.49,128.86,127.54,123.35,123.27,105.09,104.00,100.20,99.17,70.51,45.73,39.49,39.35,30.58,29.72,29.14,29.00,28.96,24.06,23.91,23.10,23.07,23.06,23.03,22.97,14.16,14.13,14.09,11.23,11.17,11.13,11.07.
HRMS(m/z):[M+H]+理论值(Calcd for):C126H167F2N4S4O8 2030.1635;实验值(Found):2030.1648。
实施例5
在100mL三口圆底烧瓶中加入292.8mg(1mmol)4,7-二溴-[1,2,5]噻二唑并[3,4-c]吡啶、35mg(0.05mmol)双三苯基膦二氯化钯和40mL甲苯,50℃下,滴加0.5mL(1.1mmol)环戊二噻吩锡盐的甲苯溶液,85℃搅拌过夜,旋干甲苯溶剂,用二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=3/1至1/1,得到490.9mg红色固体(式Ⅵ-5a所示化合物),产率79.8%。
1H NMR(CDCl3,400MHz),δ:8.75(s,1H),7.55-7.52(m,2H),7.04(d,1H,J=4Hz),1.82-1.74(m,4H),1.25-1.18(m,5H),0.96-0.73(m,14H),0.71-0.65(m,5H),0.60-0.55(m,6H),0.52-0.49(m,6H).
在100mL三口圆底烧瓶中加入307.6mg(0.5mmol)式Ⅵ-5a所示化合物、0.05mL(0.55mmol)三氯氧磷和35mL N,N-二甲基甲酰胺,加热至60℃反应4h,冷却至室温,倒入冰水中,二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=2/1至1/1,得到287.4mg红色固体(式Ⅶ-5所示化合物),产率89.5%。
1H NMR(CDCl3,400MHz),δ:9.87(s,1H),8.73(s,1H),7.57-7.53(m,2H),7.06(d,1H,J=4Hz),1.80-1.76(m,4H),1.22-1.17(m,5H),0.93-0.78(m,14H),0.69-0.63(m,5H),0.58-0.54(m,6H),0.50-0.47(m,6H).
在100mL三口圆底烧瓶中加入128.6mg(0.2mmol)式Ⅶ-5所示化合物、35mg(0.05mmol)双三苯基膦二氯化钯和25mL甲苯,55℃下,滴加0.25mmol式Ⅴ-1所示化合物的甲苯溶液,80℃搅拌过夜,旋干甲苯溶剂,用二氯甲烷萃取,无水硫酸镁干燥,旋干溶剂,硅胶柱层析,干法上样,展开剂为体积比PE/DCM=1/1至2/1,得到152.6mg绿色固体(式Ⅷ-5所示化合物),产率39.6%。
1H NMR(CDCl3,400MHz),δ:9.89(s,1H),8.75(s,1H),8.19-8.16(m,1H),8.03(d,1H,J=4Hz),7.95(d,1H,J=4Hz),7.84-7.82(m,1H),7.56-7.52(m,2H),7.42-7.38(m,1H),7.23(d,1H,J=4Hz),7.12(s,1H),7.09(d,1H,J=4Hz),7.04(d,1H,J=4Hz),6.93(d,1H,J=8Hz),6.86(d,2H,J=8Hz),6.70(s,1H),6.61(d,1H,J=8Hz),6.52-6.49(m,2H),6.44-6.38(m,2H),6.11(d,1H,J=4Hz),6.05(s,1H),3.83-3.77(m,8H),3.52(d,2H,J=4Hz),3.44(s,2H),1.65-1.59(m,4H),1.43-1.36(m,12H),1.28-1.21(m,24H),1.15-1.08(m,24H),0.87-0.78(m,24H),0.72-0.68(m,21H),0.63-0.56(m,12H),0.50-0.46(m,9H).
在50mL单口烧瓶中加入96.4mg(0.05mmol)式Ⅷ-5所示化合物、85mg(1mmol)氰基乙酸、154mg(2mmol)醋酸铵和30mL醋酸,氩气保护下,加热回流12小时。冷却至室温,倒入水中析出大量固体,过滤,干燥,硅胶柱层析,展开剂为二氯甲烷到体积比二氯甲烷/甲醇=20/1,得到84.4mg蓝色固体(式Ⅰ-5所示化合物),产率84.6%。
1H NMR(CO(CD)3,400MHz),δ:8.74(s,1H),8.24(s,1H),8.18-8.14(m,1H),8.05(d,1H,J=4Hz),7.91(d,1H,J=4Hz),7.78-7.76(m,1H),7.55-7.53(m,2H),7.41-7.37(m,1H),7.24(d,1H,J=4Hz),7.11(s,1H),7.07(d,1H,J=4Hz),7.02(d,1H,J=4Hz),6.95(d,1H,J=4Hz),6.83(d,2H,J=8Hz),6.74(s,1H),6.58(d,1H,J=8Hz),6.51-6.48(m,2H),6.42-6.39(m,2H),6.10(d,1H,J=4Hz),6.03(s,1H),3.85-3.78(m,8H),3.55(d,2H,J=4Hz),3.46(s,2H),1.62-1.57(m,4H),1.40-1.32(m,12H),1.26-1.20(m,24H),1.17-1.12(m,24H),0.91-0.82(m,24H),0.76-0.69(m,21H),0.65-0.59(m,12H),0.53-0.50(m,9H).
13C NMR(CDCl3,400MHz),159.81,159.60,159.54,157.26,157.15,156.89,152.90,146.50,146.32,143.63,138.41,137.19,136.27,135.01,134.51,130.85,130.79,130.66,130.28,129.73,129.43,128.83,128.30,123.46,123.37,121.29,121.21,119.86,116.97,105.11,104.03,100.21,99.10,70.51,45.47,39.53,39.42,39.34,30.60,29.73,29.17,29.02,28.99,24.07,23.92,23.13,23.10,23.04,23.02,22.91,14.17,14.10,14.07,11.22,11.19,11.14,11.06.
HRMS(m/z):[M+H]+理论值(Calcd for):C125H168N5S4O8 1995.1776;实验值(Found):1995.1763
实施例6
分别由实施例1~5制备的化合物Ⅰ-1,化合物Ⅰ-2,化合物Ⅰ-3,化合物Ⅰ-4和化合物Ⅰ-5在二氯甲烷溶液中和二氧化钛膜上的紫外-可见吸收光谱的紫外-可见吸收光谱(Varian Cary 500)如图1、图2所示,摩尔消光系数、最大吸收波长如表1所示:
表1
实施例7
对分别由实施例1~5制备的化合物Ⅰ-1,化合物Ⅰ-2,化合物Ⅰ-3,化合物Ⅰ-4和化合物Ⅰ-5在THF溶液中进行电化学测试,估算HOMO和LUMO能级。使用标准的三电极体系(即铂工作电极),铂丝辅助电极和甘汞(SCE)参比电极,支持电解质是六氟磷酸四丁基胺,扫描速度为50mV/s,经电化学工作站Versastat II(Princeton Applied Research)进行电化学测试。
HOMO由相对于标准氢电极的氧化电位确定;LUMO=HOMO-E0-0。六个化合物的能级数据如表2所示:
表2
实施例8
染料敏化太阳能电池的制作:
a.清洗导电玻璃:将FTO导电玻璃割成1.2×1.8cm2,依次用玻璃清洗剂、清水、丙酮、二次水、乙醇洗涤,吹干,待用。
b.镀铂电极:导电玻璃四周用胶布粘住,导电面朝上,在导电玻璃滴2滴氯铂酸的异丙醇溶液(2×10-4M),旋涂,红外灯烘干后,400℃烘15min,待冷却后,在适当的位置打一个孔,备用。
c.染料(即分别由实施例1~5所制备的化合物)溶液的配制:用二氯甲烷溶液配制3×10-4M的染料溶液。
d.光阳极的制备:通过丝网印刷在FTO导电玻璃上刷一层TiO2浆料,125℃烘6分钟,冷却后,再涂一层,125℃烘6min,一共涂三层,然后缓慢升温至450℃烘15min,再升温至500℃烘15min,冷却至室温后,用0.04M的TiCl4水溶液室温处理12h,分别用二次水洗、乙醇洗涤,450℃烘30min,冷却后将其泡入染料溶液(即由步骤c配制)中。12h后取出,用浸泡染料所用溶剂洗涤,吹干。
e.电解质的配制:用无水处理过的乙腈溶剂配制含有0.05M I2、0.1M LiI、0.6M甲基丙基咪唑、0.5M对叔丁基吡啶的溶液。
f.电池的封装:在吸附了染料的TiO2膜的周围贴上热固型胶带密封圈,对电极的导电面朝内盖在TiO2膜上,小孔处在TiO2膜和热固型胶带密封圈的间隙处,用电池封装机加热加压封装;在小孔里注入电解质,真空抽出电池工作区域的气泡,使电解质充分填充在两个电极的空腔中,最后密封,制得染料敏化太阳能电池。
实施例9
染料敏化太阳能电池性能的测试
将按照实施例8中的电池制备步骤,以Ⅰ-1为敏化染料组装的电池从光阳极和光阴极分别引出导线,接到电池性能测试装置上,电池的工作面积为0.25cm2,用太阳光模拟器模拟太阳光,将光强度调节至100mW/cm2测得的光电转化效率为8.83%,短路电流为15.29mA/cm2,开路电压为782mV,填充因子为0.74,测得的电池放电曲线如图3所示。将实施例2~5中合成的化合物作为敏化染料,按照实施例8中的电池制备步骤,组装成电池,然后按照Ⅰ-1染料的测试步骤测试染料敏化太阳能电池的性能,测得的光电转换效率为4.41-7.17%,短路电流为9.32-16.73mA/cm2,开路电压为0.648-0.736mV,填充因子为0.65~0.73。测得的电池放电曲线如图3所示,所得数据如表3所示:
表3
实施例10
对化合物Ⅰ-1,化合物Ⅰ-2,化合物Ⅰ-3,化合物Ⅰ-4和化合物Ⅰ-5的单色光电转换效率(IPCE)的测量,采用实施例9中的电池作为样品,测得IPCE曲线如图4所示。最大IPCE值及最大IPCE处的波长数据列于表4。
表4
- 还没有人留言评论。精彩留言会获得点赞!
- 6,7,8,9‑四氢‑5H‑苯并[7]轮烯‑2‑烷基胺类化合物及其用途的制造方法与工艺
- 用于PHOLED的具有氮杂‑二苯并噻吩或氮杂‑二苯并呋喃核的新材料的制造方法与工艺
- 多孔ZSM‑5沸石与γ‑Al2O3复合材料的合成及制备加氢脱硫催化剂的制造方法与工艺
- 一种含有氟噻虫砜和五氟虫腙的杀虫组合物的制造方法与工艺
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 苯并噻二唑胺的制造方法与工艺
- 用于有机电致发光器件的材料的制造方法与工艺
- 用于有机电致发光器件的材料的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺