一种稀土掺杂的氮氧化物红色发光体及照明器件的制作方法
本发明涉及一种发光体,具体涉及一种稀土掺杂的氮氧化物红色发光体,及其制备方法、照明器件及照明器件的制备方法。
背景技术:
发光二极管(LED)具有高效、节能、安全、寿命长等特点,是公认的第四代照明方案。LED白光的实现方式有三种:第一种方式是单独使用红色、绿色和/或蓝色LED芯片混合成白光,该方案由于要使用到两种或三种LED芯片,其驱动电流、使用寿命、发光效率等均不相同,因此器件的结构比较复杂,难以实现商品化;第二种方式是蓝光芯片和黄色发光体(或黄色与红色发光体的混合物)相结合使用,该方式是目前市场上最经济可行的LED照明方案,特别是LED白光照明,该方法由日本Nichia公司申请了专利JP 8-198585。由于YAG发光体的发光谱带中缺少红光部分,使得由此制备的LED白光显色性较差。为了获得较高显色性,在前述方案中加入红色发光体或者使用绿色发光体和橙红色发光体;第三种方式是紫外或近紫外和红绿蓝三种发光体结合使用,由于制造稳定的紫外或近紫外芯片的技术还存在很多问题,目前该方案并未获得大量商品化。
按照化学组成分类,橙红色发光体有硫化物体系、硅酸盐体系和氮(氧)化物体系三种。硫化物体系的橙红色发光体具有较高的发光效率和发光亮度,但其化学、物理性质并不稳定,遇水容易分解并释放H2S气体,容易对环境造成污染,同时由于基质发生了化学反应,导致光效下降,在LED运行时一般温度会达到100℃甚至更高的温度,硫化物体系也会分解。硅酸盐体系的橙红色发光体,其合成所用的基质材料SiO2便宜易得,发光体材料本身对热稳定,是高显色LED的首选封装原材料之一。韩国化学研究所公开了一种化学式为Sr3-xSiO5:Eu2+x的橙黄色硅酸盐发光体,Intematix披露了一种基于铝硅酸盐的橙红色发光体,湖南信多利新材料有限公司发明了一种基于分子式结构BaSrSiO3:Eu2+的橙红色硅酸盐发光体,罗维鸿等人提出了一种具有立方石榴石结构的硅酸盐黄色-橙黄色发光体Mg2Me2+0.5Ln3Si2.5O12-2yNyFy。以上文献使用了硅酸盐体系的发光体,但由于硅酸盐本身对酸、水不稳定,使得硅酸盐在LED的使用中,例如在封装时使用酸性硅酮粘合剂时,或者在湿度较大的条件下使用时容易失效。氮(氧)化物体系的橙色-橙红色发光体,如Sr2Si5N8,(Ca,Sr)SiAlN3等具有良好的性能,和蓝光LED相匹配,同时其光衰可以和YAG发光体相吻合,是制造高显色性LED器件中较为重要的红色发光体,但其也有制备工艺复杂、设备要求高、销售价格高等缺点。
技术实现要素:
因此,本发明的目的在于克服现有技术中的不足之处,提供了一种原料价格低廉、转换效率高并且可发射红光的稀土掺杂的氮氧化物红色发光体,及其制备方法、照明器件及照明器件的制备方法。
为实现上述目的,本发明提供了一种稀土掺杂的氮氧化物红色发光体,所述氮氧化物红色发光体由通式I表示:
Ba1-x-yMySiON4/3:REx (I)
其中,M选自Mg、Ca、Sr、Be、Zn和Cd中的一种或多种,RE为含有Eu的一种或多种稀土元素,x、y各自独立地为:0<x≤0.2,0≤y≤1。
根据本发明的氮氧化物红色发光体,其中,M为Ca和Sr中的一种或两种。优选地,M为Ca。
根据本发明的氮氧化物红色发光体,其中,RE为Eu,或者为Eu及选自Ce、Sm、La、Pr、Tb和Gd中的一种或多种,优选为Eu或者Eu及Gd。最优选为Eu。
根据本发明的氮氧化物红色发光体,其中,0<x≤0.2,0≤y≤0.2。。x为掺杂的稀土元素,其值应大于0,例如可以为0~0.2、0~0.15、0~0.12、0~0.1、0~0.08、0~0.05、0~0.02、0~0.01、0~0.008、或0~0.001(均不含0值)。y可以为0,例如可以为0~0.2、0~0.15、0~0.1、0~0.08、0~0.05、0~0.02、0~0.01、或0~0.005;y也可以大于0,例如可以为不含0值的前述各范围。
优选地,所述氮氧化物红色发光体在激发源的照射下发射580nm~710nm波长范围的红光。
更优选地,所述激发源发射350nm~530nm波长范围的近紫外光、蓝光和/或绿光。
本发明还提供了一种制备上述氮氧化物红色发光体的方法,该方法包括以下步骤:
(1)按照所述氮氧化物红色发光体的化学计量比分别称取含Ba的化合物、含M的化合物、含RE的化合物、Si3N4、反应助熔剂,粉碎并混合均匀,得到原料混合物;和
(2)将原料混合物在无氧气氛下进行固相反应,筛分产物,即得到所述氮氧化物红色发光体。承载原料混合物的容器可以是本领域常用的坩埚,例如高纯钼坩埚。
根据本发明的制备方法,其中,所述含Ba的化合物选自含Ba的氧化物、氮化物、碳酸盐、硝酸盐和其他在高温条件下可分解出BaO的化合物中的一种或多种。例如可以为BaCO3等。所述含M的化合物选自含M的氧化物、氮化物、碳酸盐、硝酸盐和其他在高温条件下可分解出MO的化合物中的一种或多种。例如可以为SrCO3、CaCO3等。所述含RE的化合物为含RE的氧化物,例如可以为Eu2O3等。所述反应助熔剂为一种或多种的M的卤化物;其中:
所述反应助熔剂优选为CaF2、BaF2和MgCl2中的一种或多种,和/或,
所述反应助熔剂优选占原料混合物总质量的0.05~20%,更优选为0.3~17%,例如为0.36~16.7%。
根据本发明的制备方法,其中,步骤(1)采用高能球磨法粉碎原料并混合均匀。粉碎混合的时间优选为0.5~3小时,例如可以为40分钟。例如可以使用高能球磨机来实现高能球磨法粉碎原料并混合均匀的操作。更为具体地,可以使用高能球磨机先将原料进行粉碎,粉碎后的原材料具有更高的反应活性,而且使用高能球磨机对原料粉碎的同时可进行混合。由于原料颗粒体积小且混合均匀,降低了能耗和对设备的要求。而且,在上述条件下烧制所得的发光体颗粒体积小,可以直接使用,避免了常规生产设备中还需对产物进行粉碎的后处理步骤,从而也有效避免了粉碎过程对产物造成的表面损伤和亮度损失。
根据本发明的制备方法,其中,步骤(2)中的固相反应的温度为1000~1650℃,优选1150~1550℃,时间为2~12小时。例如,可以在1000~1150℃下保温2小时,然后在1550~1650℃下保温5小时,即总时间可以为7小时。
步骤(2)中的所述无氧气氛为还原性气氛或惰性气体气氛。所述还原性气氛可以为H2/N2气,例如含5%H2的H2/N2气。所述惰性气体气氛可以为氮气气氛或氩气气氛等,和/或,
步骤(2)中的筛分为除去产物中粒径为1μm以下的颗粒。可以使用一般的振动筛分仪进行筛分操作。
本发明还提供了一种照明器件的制备方法,其中,该方法使用:本发明提供的稀土掺杂的氮氧化物红色发光体或按照本发明提供的方法而制备的稀土掺杂的氮氧化物红色发光体。
本发明还提供了一种照明器件,其包括激发源和发光体,其中,所述发光体含有本发明提供的稀土掺杂的氮氧化物红色发光体或按照本发明提供的方法而制备的稀土掺杂的氮氧化物红色发光体。
其中,所述发光体优选还含有黄色发光体。所述黄色发光体更优选为YAG(Yttrium Aluminate Garnet,钇铝石榴石)黄色发光体。
所述激发源优选为发射近紫外光、蓝光和/或绿光的LED;
所述激发源优选为发射350nm~530nm波长范围的光的LED;和/或
所述照明器件优选由LED芯片、YAG黄色发光体和本发明的稀土掺杂的氮氧化物红色发光体构成的三层结构组成。
本发明的氮氧化物红色发光体在之前未见任何报道,是一种全新的氮氧化物红色发光体。其采用的原料可以为价格较为低廉的碱土金属氧化物、碳酸盐、硝酸盐或在高温下可分解出碱土金属氧化物的化合物、稀土氧化物、Si3N4等,可降低该红色发光体及其照明器件(如LED照明器件)的制造成本。
而且,本发明的氮氧化物红色发光体在350nm~530nm的近紫外光、蓝光和/或绿光辐照下可被有效激发,转换效率高,并且可发射580nm~710nm波长范围之间的红光。该红色发光体可用于LED封装,有利于提高白光LED的显色性,尤其可提高LED器件的R9值。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
图1示出了本发明实施例12的氮氧化物红色发光体(Ba0.88Ca0.08Si)3O3N4:Eu0.04的激发光谱,图中纵坐标为任意单位,横坐标为波长/nm;
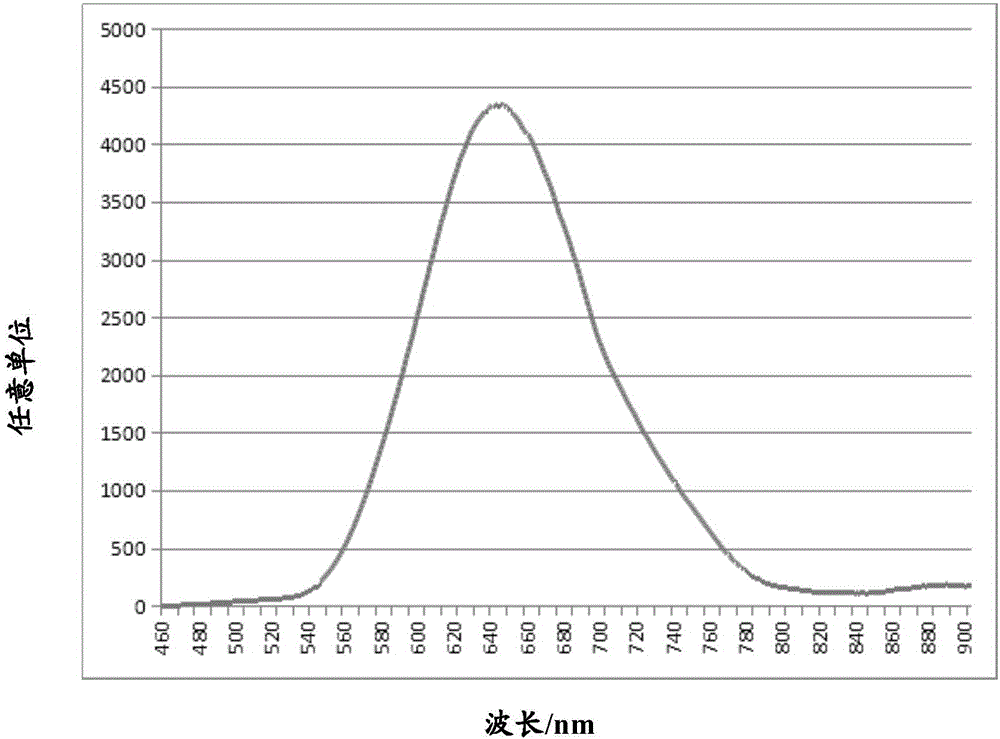
图2示出了本发明实施例12的氮氧化物红色发光体(Ba0.88Ca0.08Si)3O3N4:Eu0.04的发射光谱(激发波长460nm),图中纵坐标为任意单位,横坐标为波长/nm。
具体实施方式
下面通过具体的实施例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细具体地说明之用,而不应理解为用于以任何形式限制本发明。
本部分对本发明试验中所使用到的材料以及试验方法进行一般性的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。本领域技术人员清楚,在上下文中,如果未特别说明,本发明所用材料和操作方法是本领域公知的。
以下实施例中使用的试剂和仪器如下:
BaCO3、SrCO3、CaCO3、Si3N4、Eu2O3,纯度>99.9%,购自国药集团化学试剂北京有限公司;
CaF2,分析纯,购自国药集团化学试剂北京有限公司;
高能球磨机,型号PMUW,购自南京驰顺科技发展有限公司。
振动筛分仪,可购自英国Endecotts或德国Retsch等公司。
X射线衍射仪,为布鲁克D8X射线衍射仪。
荧光光谱仪,为日立公司的H-4500;测试方法为:激发光谱200-400nm,发射光谱460-900nm,扫描补偿1nm。
实施例1
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.999SiON4/3:Eu0.001的化学计量比分别称取BaCO3 15.77g,Si3N43.74g,Eu2O3 0.04g,反应助熔剂CaF2 0.07(0.36%)g,将上述原料置入高能球磨机中粉碎混合40分钟,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1000℃保温2小时,然后温度升至1550℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.999SiON4/3:Eu0.001。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例2
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.98SiON4/3:Eu0.02的化学计量比分别称取BaCO3 15.47g,Si3N43.74g,Eu2O3 0.84g,反应助熔剂CaF2 0.20g(1%),将上述原料置入高能球磨机中粉碎混合40分钟,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1000℃保温2小时,然后温度升至1550℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.98SiON4/3:Eu0.02。。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例3
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.92SiON4/3:Eu0.08的化学计量比分别称取BaCO3 14.52g,Si3N43.74g,Eu2O3 3.38g,反应助熔剂CaF2 1.08g(4.8%),将上述原料置入高能球磨机中粉碎混合40分钟,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1000℃保温2小时,然后温度升至1550℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.92SiON4/3:Eu0.08。。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例4
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.88SiON4/3:Eu0.12的化学计量比分别称取BaCO3 13.89g,Si3N43.74g,Eu2O3 5.07g,反应助熔剂CaF2 2.27g(9.1%),将上述原料置入高能球磨机中粉碎混合40分钟,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1000℃保温2小时,然后温度升至1550℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.88SiON4/3:Eu0.12。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例5
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.80SiON4/3:Eu0.2的化学计量比分别称取BaCO3 12.63g,Si3N43.74g,Eu2O3 8.45g,反应助熔剂CaF2 4.96g(16.7%),将上述原料置入高能球磨机中粉碎混合40分钟,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1000℃保温2小时,然后温度升至1550℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.80SiON4/3:Eu0.2。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例6
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.987Sr0.005SiON4/3:Eu0.008的化学计量比分别称取BaCO3 15.58g,SrCO3 0.06g,Si3N4 3.74g,Eu2O3 0.34g,反应助熔剂BaF2 0.16g(0.8%),将上述原料置入高能球磨机中粉碎混合40分钟,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1000℃保温2小时,然后温度升至1650℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.987Sr0.005SiON4/3:Eu0.008。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例7
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.95Sr0.04SiON4/3:Eu0.01的化学计量比分别称取BaCO3 15.00g,SrCO30.47g,Si3N4 3.74g,Eu2O3 0.42g,反应助熔剂BaF2 0.39g(2%),将上述原料置入高能球磨机中粉碎混合40分钟,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1000℃保温2小时,然后温度升至1650℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.95Sr0.04SiON4/3:Eu0.01。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例8
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.88Sr0.10SiON4/3:Eu0.02的化学计量比分别称取BaCO3 13.89g,SrCO31.18g,Si3N4 3.74g,Eu2O3 0.84g,反应助熔剂BaF2 0.56g(2.8%),将上述原料置入高能球磨机中粉碎混合30分钟(0.5小时),过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1000℃保温2小时,然后温度升至1650℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.88Sr0.10SiON4/3:Eu0.02。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例9
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.82Sr0.15SiON4/3:Eu0.03的化学计量比分别称取BaCO3 12.95g,SrCO31.77g,Si3N4 3.74g,Eu2O3 1.27g,反应助熔剂BaF2 2.96g(13%),将上述原料置入高能球磨机中粉碎混合3小时,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1000℃保温2小时,然后温度升至1650℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.82Sr0.15SiON4/3:Eu0.03。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例10
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.76Sr0.20SiON4/3:Eu0.04的化学计量比分别称取BaCO3 12.00g,SrCO32.36g,Si3N4 3.74g,Eu2O3 1.69g,反应助熔剂BaF2 3.96g(16.7%),将上述原料置入高能球磨机中粉碎混合40分钟,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1000℃保温2小时,然后温度升至1650℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.76Sr0.20SiON4/3:Eu0.04。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例11
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.987Ca0.005SiON4/3:Eu0.008的化学计量比分别称取BaCO3 15.58g,CaCO3 0.04g,Si3N4 3.74g,Eu2O3 0.34g,反应助熔剂MgCl2 0.08g(0.4%),将上述原料置入高能球磨机中粉碎混合40分钟,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1150℃保温2小时,然后温度升至1550℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.987Ca0.005SiON4/3:Eu0.008。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例12
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.97Ca0.02SiON4/3:Eu0.01的化学计量比分别称取BaCO3 15.31g,CaCO30.16g,Si3N4 3.74g,Eu2O3 0.42g,反应助熔剂MgCl2 0.59g(3%),将上述原料置入高能球磨机中粉碎混合40分钟,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1150℃保温2小时,然后温度升至1550℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.97Ca0.02SiON4/3:Eu0.01。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例13
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.90Ca0.08SiON4/3:Eu0.02的化学计量比分别称取BaCO3 14.21g,CaCO30.64g,Si3N4 3.74g,Eu2O3 0.84g,反应助熔剂MgCl2 0.97g(4.8%),将上述原料置入高能球磨机中粉碎混合40分钟,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1150℃保温2小时,然后温度升至1550℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.90Ca0.08SiON4/3:Eu0.02。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例14
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.87Ca0.10SiON4/3:Eu0.03的化学计量比分别称取BaCO3 13.73g,CaCO30.80g,Si3N4 3.74g,Eu2O3 1.27g,反应助熔剂MgCl2 3.13g(13.8%),将上述原料置入高能球磨机中粉碎混合40分钟,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1150℃保温2小时,然后温度升至1550℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.87Ca0.10SiON4/3:Eu0.03。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
实施例15
本实施例用于说明本发明的氮氧化物红色发光体及其制备方法。
按照化学式Ba0.76Ca0.20SiON4/3:Eu0.04的化学计量比分别称取BaCO3 12.00g,CaCO31.60g,Si3N4 3.74g,Eu2O3 1.69g,反应助熔剂MgCl2 3.80g(16.6%),将上述原料置入高能球磨机中粉碎混合40分钟,过筛,然后将原料混合物放入高纯钼坩埚中,在还原性气氛(含5%H2的H2/N2气)中,1150℃保温2小时,然后温度升至1550℃保温5小时,自然冷却至室温,将产物取出,用振动筛分仪进行筛分处理,除去粒径小于1μm的过细粉体,得到本发明的氮氧化物红色发光体。
采用X射线衍射方法,以X射线衍射仪对该氮氧化物红色发光体进行组成分析,确认该发光体的组成符合化学式Ba0.76Ca0.20SiON4/3:Eu0.04。
使用荧光光谱仪测得上述红色发光体在350nm~530nm波长范围的近紫外光、蓝光和/或绿光的辐照下可有效激发,在460nm的激发波长下可发射580nm~710nm波长范围的红光(发射波长及相对亮度见表1)。
表1实施例1~15的氮氧化物红色发光体的发射波长和相对亮度
实施例16
使用实施例12中获得的发光体与460nm芯片及YAG黄色发光体组成的发光器件可获得显色指数为92的发光器件。
作为对比,仅使用460nm芯片和YAG黄色发光体封装成发光器件,获得显色指数为69的发光器件,其显色指数明显低于采用本发明发光体的发光器件。
尽管本发明已进行了一定程度的描述,明显地,在不脱离本发明的精神和范围的条件下,可进行各个条件的适当变化。可以理解,本发明不限于所述实施方案,而归于权利要求的范围,其包括所述每个因素的等同替换。
- 还没有人留言评论。精彩留言会获得点赞!