一种乙烯‑乙烯醇共聚物高度亲水超滤膜的制备方法与流程
本发明属于膜材料制备技术领域,具体是指一种乙烯-乙烯醇共聚物(EVAL/EVOH,以下用EVAL表示)高度亲水超滤膜及其成膜工艺。
背景技术:
超滤是一种以压力差为推动力的膜分离技术,与传统的分离技术相比,具有分离效率高、能耗低和操作简便等优点,在水溶液的浓缩、分离、净化等领域得到广泛应用。当超滤膜处理水溶液时,其特点是溶液中的高分子、油滴、胶体、微生物等的大部分被截留,水及其它小分子透过膜。超滤运行过程中,减轻膜污染十分关键,其很大程度上有赖于膜表面的亲水程度(化工学报,2013,64(1):173-181)。因此,寻求良好的亲水膜材料并提高膜表面亲水程度是减轻膜污染的重要途径。
EVAL是含有亲水基团乙烯醇链段的共聚物,具有亲水性好、机械强度高、化学稳定性及耐热性好等优点,是一种良好的膜材料(Materials Chemistry and Physics,2002,73(1):1-5)。
Riyasudheen等(Desalination,2012,294:17–24)采用浸没凝胶法制备了EVAL超滤膜,静态接触角为75°,加入聚乙烯吡咯烷酮共混后,接触角降到55°。
郝长青等(天津工业大学学报,2016,35(1):1-5)采用热致相分离法制备了EVAL多孔膜,其静态接触角为49.8°±2.6°,铸膜液中共混入纳米二氧化硅后,接触角降到44.8°。
上述方法虽然都提高了膜的亲水性,但膜表面仍达不到高度亲水的要求,还有进一步提高其亲水性的必要。
董春华等(化工学报,2007,58(6):1501-1506)将聚砜超滤膜置于丙烯酸、磷酸和四氯化锡的混合溶液中进行接枝改性,得到的亲水改性膜接触角为10°,抗蛋白性能优于未改性膜。该方法虽然提高了膜的亲水性和抗污染性能,但是酸溶液会造成膜面损坏,膜会部分溶解。
申请公开号CN105797432公开了“一种超亲水油水分离膜的制备方法”,该方法是:采用电沉积技术,将超亲水的Ni晶粒沉积于支撑网上,得到超亲水油水分离膜,该膜的接触角小于4°,具有良好的超亲水性。但是该方法不能实现规模化制备。
Gong等(Separation and Purification Technology,2014,122:32–40)以聚丙烯腈为基膜,通过层层自组装的方法制备出了用于渗透汽化的超亲水TiO2纳米杂化膜,紫外照射后,膜表面接触角由62°减小到3°,形成超亲水表面。此方法的特点是,膜的超亲水性是由光催化活性引起的,需要紫外照射设备,成本昂贵,改性过程复杂,紫外照射还会影响膜的性能。
以上方法是对膜进行亲水强化,有效提高了膜的亲水性,但也存在各自的缺陷。
材料表面的亲/疏水性由材料的表面能和材料的表面形貌共同决定。对于高表面能材料,表面越粗糙越亲水;对于低表面能材料,表面越粗糙越疏水。
基于上述思想,王志英、杨振生等(申请公开号CN101632903)提出了一种采用粗糙基底制备PVDF微孔膜的方法,将铸膜液刮制在具有微结构的基底上,采用非溶剂致相分离法制膜,膜的下表面呈现高度疏水性,透过通量大,较常规的采用光滑基底制膜,膜的机械性能并未降低。
杨振生、王志英等提出了一种高度疏水微孔膜的制备方法(申请公开号CN103272484),该方法采用固体模板辅助热致相分离法,将铸膜液均匀涂覆于呈现微结构特征的固体模板表面,通过热致相分离法制备微孔膜,依靠模板与相分离的协同作用,提高膜底面(微孔膜与矩形微结构模板相接触的面)的疏水性和其它膜性能,水接触角最高可达165°,透过性能高且机械性能优秀。
上述方法需要液态膜与微结构模板一同浸入凝胶剂中,即膜与微结构模板的接触贯穿于整个制膜过程。这种方法的不足体现在:(1)以固体模板为基底制膜,微孔膜面积受模板大小的制约;(2)间歇式操作,无法实现连续化制备;(3)凝胶化步骤中,与微结构模板接触的膜液不能发生瞬时相分离,固化成膜后,具有二重微纳结构的膜下表面是疏松结构,不是致密结构,即无法制备出呈现二重微纳结构表面的超滤膜。
技术实现要素:
本发明的目的为针对现有技术方法存在的不足,提供一种EVAL高度亲水超滤膜的制备方法。该方法为微辊轧协同浸没凝胶法,以连续传动的无纺布为基膜,于其上刮制铸膜液,通过半凝胶化-辊轧-完全凝胶化(方法一)或完全凝胶化-侵蚀-辊轧-完全凝胶化(方法二)制备得到高度亲水超滤膜,从而实现简捷高效、大面积、连续化、规模化制备。
本发明的技术方法为:
方法一:包括以下步骤:
(1)用刮刀将铸膜液刮制在无纺布上,在无纺布上形成厚度为50μm~500μm的膜液;
所述的铸膜液为乙烯-乙烯醇共聚物溶液,固含量为10wt%~25wt%,溶剂为混合溶剂;混合溶剂包括组分A和组分B,组分A在混合溶剂中的含量为60wt%~95wt%;
(2)将上步得到的涂布膜液的无纺布浸入15℃~60℃的半凝胶剂中,停留时间为15s~60s,得到半凝胶化膜;
所述的半凝胶剂为组分A的水溶液,组分A的含量为5wt%~40wt%;
(3)室温环境下,将上步得到的半凝胶化膜进行吹扫,吹扫气体为空气,气流速率为0.1m/s~1m/s,吹扫时间为10s~30s;
(4)将上步经过吹扫的膜通过压辊进行轧制,辊筒的传动线速度和布速相同;
(5)将上步经过轧制的膜浸入15℃~60℃的水中,停留时间为3min~10min,得到初生膜;再经后处理步骤,得到高度亲水超滤膜;
所述的步骤(1)-(5)为连续匀速传动过程,无纺布布速为1.0m/min~4.0m/min;
或者,方法二,包括以下步骤:
(1)用刮刀将铸膜液刮制在无纺布上,在无纺布上形成厚度为50μm~500μm的膜液;
(2)将上步得到的涂布膜液的无纺布浸入15℃~60℃的水中,停留时间为5min~10min,得到完全凝胶化膜;然后再经过侵蚀步骤,所述的侵蚀步骤为以下两种方法之一:
方法1)喷涂侵蚀:用25℃~45℃的侵蚀剂对完全凝胶化膜进行喷淋,喷淋时间为15s~30s,喷淋密度为0.05L/(m2·s)~0.45L/(m2·s);
或者,方法2)浸没侵蚀:完全凝胶化膜浸入25℃~45℃的侵蚀剂中,停留时间为10s~25s;
所述的侵蚀剂为组分A的水溶液,组分A的含量为75wt%~98wt%;或组分A和组分B的混合溶液,组分A的含量为40wt%~80wt%;
(3)将上步经过侵蚀步骤的膜进行吹扫,吹扫气体为空气,气流速率为0.1m/s~1m/s,吹扫时间为10s~30s;
(4)将上步经过吹扫的膜通过压辊进行轧制,辊筒的传动线速度和布速相同;
(5)将上步经过轧制的膜浸入15℃~60℃的水中,停留时间为2min~5min,得到初生膜;再经后处理步骤,得到高度亲水超滤膜;
所述的步骤(1)-(5)为连续匀速传动过程,无纺布布速为1.0m/min~4.0m/min。
所述的方案一或方案二中,组分A为二甲基亚砜、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺或N-甲基吡咯烷酮、环丁砜;组分B为正己醇、正庚醇、正辛醇、乙二醇、聚乙二醇或聚乙烯吡咯烷酮。
所述的方法一或方法二中,步骤(4)中的压辊由上下两根辊筒组成,两根辊筒之间的间距低于辊轧前的膜厚度10μm-30μm。下部的辊筒为表面光滑的圆筒;上部辊筒为表面具有微结构的圆筒,所述的微结构的尺度的数量级为101μm~102μm;微结构的半高宽截面,凹坑的投影面积占全部表面投影面积的分率为0.3~0.7。
所述的具有微结构的辊筒的微结构由喷射加工、电火花加工、超声加工、激光熔覆、激光雕刻或3D打印得到。
所述的方法一或方法二中,固含量优选15wt%~18wt%,混合溶剂中组分A的含量优选80wt%~92wt%。
所述的方法一中,半凝胶剂中组分A的含量优选10wt%~20wt%。
所述的方法二中,侵蚀剂优选为DMSo的水溶液,组分A的含量为85wt%~90wt%;或DMSo和EH的混合溶液,组分A的含量为60wt%~70wt%。
本发明的实质性特点为:
(1)采用液态膜的半凝胶化或完全凝胶化-侵蚀方式实现膜在辊轧之前的准备。半凝胶化方式可通过改变半凝胶剂组成、膜在半凝胶剂中的停留时间来控制膜的半凝胶化程度,以调控微结构辊筒模板的轧制效果。完全凝胶化-侵蚀方式可通过改变侵蚀剂的组成及侵蚀时间来控制膜表面受侵蚀程度,以调控微结构辊筒模板的轧制效果。
(2)通过辊轧操作,微结构辊筒模板的微米级结构被复制于膜表面;通过后续的凝胶化步骤使膜表面形成致密皮层,最终得到表面呈现微纳二重结构的高度亲水超滤膜。
(3)铸膜液与微结构辊筒模板的接触,无需贯穿于整个制膜过程的始终,只需在有限的轧制环节相接触,制膜过程由间歇操作变为连续操作。
与现有技术相比,本发明的有益效果为:
(1)依据本发明制备的EVAL高度亲水超滤膜与水的接触角CA介于9°~17°范围内,在0.1MPa过膜压差下的纯水通量≥200L/(m2.h),对牛血清蛋白的截留率≥90%,膜污染指数≤0.529,牛血清蛋白静态吸附量≤21μg.cm-2。
(2)制膜过程中,所采用的微结构模板为辊筒形态,解决了膜面积受模板大小限制的问题,可以使膜大面积制备。
(3)本发明制备过程在接近室温条件下进行,所采用的微结构模板—压辊的制备方法简单,辊轧流程简捷高效,故易于实现规模化、工业化制备。所制备的高度亲水超滤膜性能稳定,平行性好。
附图说明
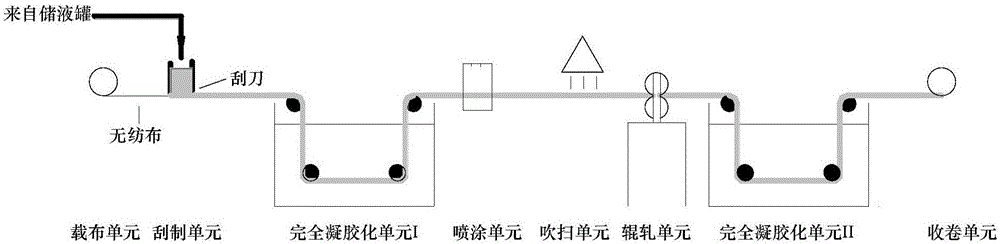
图1为方法一的工艺流程示意图。
图2为方法二中的喷涂侵蚀工艺流程示意图。
图3为方法二中的浸没侵蚀工艺流程示意图。
图4为辊轧部件的工作原理示意图。
图5为实施例1~实施例6的对照例—未经辊轧处理的EVAL膜的扫描电子显微镜(SEM)照片,其中图5a为表面,图5b为断面。
图6为实施例1制备的EVAL膜的SEM照片,其中图6a为表面,图6b为断面。
图7为实施例3制备的EVAL膜的SEM照片,其中图7a为表面,图7b为断面。
图8为实施例5制备的EVAL膜的SEM照片,其中图8a为表面,图8b为断面。
图9为实施例1~实施例6的对照例—未经辊轧处理的EVAL膜表面的水滴接触角状态图。
图10为实施例1制备的EVAL膜表面的水滴接触角状态图。
图11为实施例3制备的EVAL膜表面的水滴接触角状态图。
图12为实施例5制备的EVAL膜表面的水滴接触角状态图。
具体实施方式
本发明利用微辊轧协同浸没凝胶法,制备表面呈现微纳二重结构的超滤膜,来提高膜的亲水性、抗污染性以及其它膜性能。
本发明采用连续方式制备高度亲水超滤膜,包括铸膜液的准备、膜的制备及后处理三个环节。
本发明中,铸膜液准备环节是指按一定比例称取聚合物、混合溶剂置于溶解釜中,在50℃~80℃下搅拌3h~8h至聚合物溶解完全,之后将铸膜液经过滤装置送至温度为25℃~45℃储液罐中,静置脱泡3h~6h。
本发明中,铸膜液输送过程采用氮气增压方式输送,即利用氮气增大溶解釜、储液罐液面上方的压力,将铸膜液输送至下一个操作单元。
膜的制备环节可通过两种方法实现,包括方法一—依次经历①放布、②涂布、③半凝胶化、④吹扫、⑤辊轧、⑥完全凝胶化、⑦收卷各单元操作和方法二—依次经历①放布、②涂布、③完全凝胶化I-侵蚀、④吹扫、⑤辊轧、⑥完全凝胶化II、⑦收卷各单元操作。
方法一中的成膜工艺由载布单元、刮制单元、半凝胶化单元、吹扫单元、辊轧单元、完全凝胶化单元、收卷单元顺次组成,该工艺流程由图1详细表述。各单元由无纺布卷绕相连,其中载布单元和收卷单元提供动力,使整个成膜设备传动运转。方法二中的成膜工艺,载布单元、刮制单元、吹扫单元、辊轧单元、完全凝胶化单元、收卷单元与方法一相同,将半凝胶化单元替换为完全凝胶化I-喷涂单元或完全凝胶化I-浸没单元,分别由图2、图3详细表述。以上所述的设备单元均为公知设备,只有辊轧单元部件自行设计,是具有人工微结构的辊筒模板。
本发明中,后处理过程包括萃取和清洗两步。萃取是指将收卷后的膜用萃取剂萃取24h~48h,以去除膜中的残余有机溶剂,萃取温度为室温;萃取后用水清洗6h~12h,清洗温度为室温,最后自然晾干得到高度亲水超滤膜。
本发明中,聚合物为EVAL,型号为H171B,含量为10wt%~25wt%,优选15wt%~18wt%。
本发明中,混合溶剂中的组分A选择二甲基亚砜(DMSo,以下用DMSo表示),混合溶剂组分B选择正辛醇(EH,以下用EH表示),DMSo的含量为60wt%~95wt%,优选80wt%~92wt%。
本发明中,半凝胶剂为DMSo的水溶液,DMSo的含量为5wt%~40wt%,优选为10wt%~20wt%
本发明中,侵蚀剂为DMSo的水溶液,组分A的含量为75wt%~98wt%,优选85wt%~90wt%;或DMSo和EH的混合溶液,组分A的含量为40wt%~80wt%,优选60wt%~70wt%。
本发明中,萃取剂为乙醇(ET,以下用ET表示)、异丙醇、甲乙酮中的一种,或各自含量≥80wt%的水溶液。
本发明中,支撑物选择机械性能优良的无纺布,为上海天略新材料有限公司生产的TA3633聚酯无纺布(厚度为120μm)。
本发明中,辊筒间距低于辊轧前的膜厚度20μm(本发明中实施例的辊筒间距均为小于无纺布与膜总厚度的20μm。)。下部的辊筒为表面光滑的圆筒;上部辊筒为表面具有微结构的圆筒,由喷射加工处理得到。所述的微结构尺度的数量级为101μm~102μm;微结构的半高宽截面,凹坑的投影面积占全部表面投影面积的分率为0.3~0.7。本发明中,所述的辊筒材质为牌号316L的不锈钢,规格为φ100×5mm。上部辊筒制备方法为:利用表压为0.6MPa的压缩空气挟带320目棕刚玉石英砂,喷嘴倾斜30°,缓慢均匀喷射不锈钢管外表面30s。经压缩空气吹扫后用清水清洗,自然晾干后得到。此上部辊筒应用于以下所有实施例。
本发明中,膜表面、断面用型号为NanoSEM-450扫描电子显微镜观察;水接触角采用DSA20型光学动/静态接触角仪测量,每个样品膜上取五个测试点,计算其平均值;膜的透过性能和分离性能分别用纯水通量和膜对牛血清蛋白的截留率表征,测试装置采用实验室自制的错流过滤装置,操作压力为0.1MPa;膜的抗污染性能采用膜对牛血清蛋白质的静态吸附量和膜的总污染指数表征。
本发明中,微结构辊筒模板表面结构尺度的数量级为101μm~102μm,浸没凝胶法形成的相分离结构的数量级为10-2μm~10-1μm。基于此,选择微结构形貌及尺度,改变制膜条件,使得轧制得到的微结构尺度相当于浸没凝胶法得到的相分离结构的10~1000倍(优选10~100倍)时,膜表面将呈现微纳二重结构形貌。
下面结合附图对本发明的实施例作详细说明;本实施例以本发明技术方法为前提进行实施,给出了详尽的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
所述的步骤中,未专门表述相关操作温度的步骤均在室温下进行。
本发明中,每一个实施例的对照例为去除辊轧相关环节得到的EVAL超滤膜,即仅通过①放布、②涂布、⑥完全凝胶化、⑦收卷设备单元制备得到的膜。相关步骤中,对照例操作条件与实施例中操作条件一致。
实施例1
本实施例采用方法一制备。
铸膜液的准备:铸膜液总重1000g,其中型号为H171B的EVAL为160.0g(占铸膜液总重的16wt%),混合溶剂组分为DMSo和EH,共840g(DMSo含量为88wt%)。溶解釜温度为80℃,搅拌6h,储液罐温度为35℃,静置脱泡4h。
膜的制备:调节无纺布布速为1.5m/min,无纺布为上海天略公司生产的TA3631型聚酯无纺布(厚度为120μm,以下步骤及实施例同);在室温条件下刮制液态膜,液膜厚度为200μm;涂布膜液的无纺布浸入29℃的半凝胶剂中,停留时间为35s(所述的停留时间指无纺布经过溶液的时间,可通过调节相关设备的几何尺寸、无纺布布速、绕布方式来实现。以下步骤及其他实施例同),半凝胶剂为DMSo的水溶液(DMSo含量为10wt%),得到的膜厚度为302μm;经半凝胶化的膜在室温条件下吹扫,气流速率为0.5m/s,吹扫时间为20s;吹扫后经辊轧单元在室温条件下轧制,两辊筒间距为282μm,辊筒传动线速度与布速相同;轧制后的膜浸入29℃的水中,停留时间为5min,以实现完全凝胶化;经收卷单元收卷,收卷速度与布速相同,得到初生膜。
后处理:室温下对得到的初生膜萃取24h,萃取剂为ET,萃取后浸入水中清洗12h,最后自然晾干得到EVAL高度亲水超滤膜。
实施例的EVAL高度亲水超滤膜性能如下:膜厚260μm(其中TA3631聚酯无纺布厚度为120μm,以下实施例及对照例同),0.1MPa过膜压差下的纯水通量为251L/(m2.h),对牛血清蛋白的截留率为98%,牛血清蛋白静态吸附量为17μg·cm-2,膜污染指数为0.529。由图6电镜图可知该方法制备的膜表面具有粗糙结构,表明通过该方法,膜表面有效地复制了微结构辊筒模板的人工微结构,形成微纳二重结构,从而提高了膜表面的亲水性,水滴接触角为12°(图10)。
对照例的EVAL超滤膜性能如下:膜厚275μm,0.1MPa过膜压差下的纯水通量为174L/(m2.h),对牛血清蛋白的截留率为92%,牛血清蛋白静态吸附量为79μg·cm-2,膜污染指数为0.705。由图5电镜图可知该方法制备的膜表面仅为纳米尺度结构,并未形成微纳二重结构,水滴接触角为41°(如图9)。
与对照例相比,接触角降低了71%,0.1MPa过膜压差下的纯水通量提高了44%,对牛血清蛋白的截留率提高了7%,牛血清蛋白的静态吸附量降低了78%,膜污染指数降低了25%。
实施例2
本实施例采用方法一制备。
铸膜液的准备:同实施例1。
膜的制备:放布、涂布、吹扫、辊轧、完全凝胶化、收卷单元操作同实施例1。不同单元操作为半凝胶化单元:半凝胶剂为DMSo的水溶液(DMSo含量为20wt%),温度为29℃,停留时间为30s,形成的膜厚度为304μm。
后处理:同实施例1。
实施例的EVAL高度亲水超滤膜性能如下:膜厚256μm,水滴接触角为9°,0.1MPa过膜压差下的纯水通量为263L/(m2.h),对牛血清蛋白的截留率为95%,牛血清蛋白静态吸附量为13μg·cm-2,膜污染指数为0.479。
对照例的EVAL超滤膜性能如下:膜厚275μm,水滴接触角为41°,0.1MPa过膜压差下的纯水通量为174L/(m2.h),对牛血清蛋白的截留率为92%,牛血清蛋白静态吸附量为79μg·cm-2,膜污染指数为0.705。
与对照例相比,接触角降低了78%,0.1MPa过膜压差下的纯水通量提高了51%,对牛血清蛋白的截留率提高了3%,牛血清蛋白的静态吸附量降低了84%,膜污染指数降低了32%。
实施例3
本实施例采用方法二的喷涂侵蚀方法制备。
铸膜液的准备:铸膜液总重1000g,其中型号为H171B的EVAL为160.0g(占铸膜液总重的16wt%),混合溶剂组分为DMSo和EH,共840g(DMSo含量为88wt%)。溶解釜温度为80℃,搅拌6h,储液罐温度为35℃,静置脱泡4h。
膜的制备:调节无纺布布速为1.5m/min,无纺布为上海天略公司生产的TA3631型聚酯无纺布。在室温条件下刮制液态膜,液膜厚度为200μm;涂布膜液的无纺布浸入29℃的水中,停留时间为5min,以实现完全凝胶化;用35℃的侵蚀剂对完全凝胶化膜喷淋,喷淋时间为20s,喷淋密度为0.1L/(m2.s),侵蚀剂为DMSo的水溶液(DMSo含量为90wt%),得到的膜厚度为290μm;经侵蚀的膜在室温条件下吹扫,气流速率为0.5m/s,吹扫时间为20s;吹扫后经辊轧单元在室温条件下轧制,两辊筒间距为270μm,辊筒传动线速度与布速相同;轧制后的膜浸入29℃的水中,停留时间为5min,以实现完全凝胶化;经收卷单元收卷,收卷速度与布速相同,得到初生膜。
后处理:室温下对得到的初生膜萃取24h,萃取剂为ET,萃取后浸入水中清洗12h,最后自然晾干得到EVAL高度亲水超滤膜。
实施例的EVAL高度亲水超滤膜性能如下:膜厚249μm,0.1MPa过膜压差下的纯水通量为247L/(m2.h),对牛血清蛋白的截留率为94%,牛血清蛋白静态吸附量为19μg·cm-2,膜污染指数为0.493。由图7电镜图可知该方法制备的膜表面具有粗糙结构,表明通过该方法,膜表面有效地复制了微结构辊筒模板的人工微结构,形成微纳二重结构,从而提高了膜表面的亲水性,水滴接触角为15°(图11)。
对照例的EVAL超滤膜性能如下:膜厚275μm,0.1MPa过膜压差下的纯水通量为174L/(m2.h),对牛血清蛋白的截留率为92%,牛血清蛋白静态吸附量为79μg·cm-2,膜污染指数为0.705。由图5电镜图可知该方法制备的膜表面仅为纳米尺度结构,并未形成微纳二重结构,水滴接触角为41°(如图9)。
与对照例相比,接触角降低了63%,0.1MPa过膜压差下的纯水通量提高了42%,对牛血清蛋白的截留率提高了2%,牛血清蛋白的静态吸附量降低了76%,膜污染指数降低了30%。
实施例4
本实施例采用方法二的喷涂侵蚀方法制备。
铸膜液的准备:同实施例3。
膜的制备:放布、涂布、吹扫、辊轧、完全凝胶化、收卷单元操作同实施例3。不同单元操作为完全凝胶化I-侵蚀单元:侵蚀剂为DMSo和EH的混合溶液(DMSo含量为70wt%),温度为35℃,喷淋时间为25s,喷淋密度为0.1L/(m2.s),得到的膜厚度为287μm。
后处理:同实施例3。
实施例的EVAL高度亲水超滤膜性能如下:膜厚245μm,水接触角17°,0.1MPa过膜压差下的纯水通量为206L/(m2.h),对牛血清蛋白的截留率为96%,牛血清蛋白静态吸附量为21μg·cm-2,膜污染指数为0.519。
对照例的EVAL超滤膜性能如下:膜厚275μm,水接触角41°,0.1MPa过膜压差下的纯水通量为174L/(m2.h),对牛血清蛋白的截留率为92%,牛血清蛋白静态吸附量为79μg·cm-2,膜污染指数为0.705。
与对照例相比,接触角降低了59%,0.1MPa过膜压差下的纯水通量提高了18%,对牛血清蛋白的截留率提高了14%,牛血清蛋白的静态吸附量降低了73%,膜污染指数降低了26%。
实施例5
本实施例采用方法二的浸没侵蚀方法制备。
铸膜液的准备:铸膜液总重1000g,其中型号为H171B的EVAL为160.0g(占铸膜液总重的16wt%),混合溶剂组分为DMSo和EH,共840g(DMSo占88wt%)。溶解釜温度为80℃,搅拌6h,储液罐温度为35℃,静置脱泡4h。
膜的制备:调节无纺布布速为1.5m/min,无纺布为上海天略公司生产的TA3631型聚酯无纺布。在室温条件下刮制液态膜,液膜厚度为200μm;涂布膜液的无纺布浸入29℃的水中,停留时间为5min,实现完全凝胶化;经完全凝胶化的膜浸入35℃的侵蚀剂中,停留时间为20s,侵蚀剂为DMSo的水溶液(DMSo含量为86wt%),得到的膜厚度为283μm;经侵蚀的膜在室温条件下吹扫,气流速率为0.5m/s,吹扫时间为20s;吹扫后经辊轧单元在室温条件下轧制,两辊筒的间距为263μm,辊筒传动线速度与布速相同;轧制后的膜浸入29℃的水中,停留时间为5min,以实现完全凝胶化;经收卷单元收卷,收卷速度与布速相同,得到初生膜。
后处理:室温下对得到的初生膜萃取24h,萃取剂为ET,萃取后浸入水中清洗12h,最后自然晾干得到EVAL高度亲水超滤膜。
实施例的EVAL高度亲水超滤膜性能如下:膜厚241μm,0.1MPa过膜压差下的纯水通量为280L/(m2.h),对牛血清蛋白的截留率为95%,牛血清蛋白静态吸附量为16μg·cm-2,膜污染指数为0.494。由图8电镜图可知该方法制备的膜表面具有粗糙结构,表明通过该方法,膜表面有效地复制了微结构辊筒模板的人工微结构,形成微纳二重结构,从而提高了膜表面的亲水性,水滴接触角为10°(图12)。
对照例的EVAL超滤膜性能如下:膜厚275μm,0.1MPa过膜压差下的纯水通量为174L/(m2.h),对牛血清蛋白的截留率为92%,牛血清蛋白静态吸附量为79μg·cm-2,膜污染指数为0.705。由图5电镜图可知该方法制备的膜表面仅为纳米尺度结构,并未形成微纳二重结构,水滴接触角为41°(如图9)。
与对照例相比,接触角降低了76%,0.1MPa过膜压差下的纯水通量提高了38%,对牛血清蛋白的截留率提高了3%,牛血清蛋白的静态吸附量降低了80%,膜污染指数降低了30%。
实施例6
本实施例采用方法二的浸没侵蚀方法制备。
铸膜液的准备:同实施例5。
膜的制备:放布、涂布、吹扫、辊轧、完全凝胶化、收卷单元操作同实施例5,不同单元操作为完全凝胶化I-侵蚀:侵蚀剂为DMSo和EH的混合溶液(DMSo含量为65wt%),温度为35℃,停留时间为25s,得到的厚度为281μm的膜。
后处理:同实施例5。
实施例的EVAL高度亲水超滤膜性能如下:膜厚237μm,水接触角13°,0.1MPa过膜压差下的纯水通量为258L/(m2.h),对牛血清蛋白的截留率为97%,牛血清蛋白静态吸附量为21μg·cm-2,膜污染指数为0.504。
对照例的EVAL超滤膜性能如下:膜厚275μm,水接触角41°,0.1MPa过膜压差下的纯水通量为174L/(m2.h),对牛血清蛋白的截留率为92%,牛血清蛋白静态吸附量为79μg·cm-2,膜污染指数为0.705。
与对照例相比,接触角降低了68%,0.1MPa过膜压差下的纯水通量提高了48%,对牛血清蛋白的截留率提高了5%,牛血清蛋白的静态吸附量降低了73%,膜污染指数降低了29%。
本发明提出的EVAL高度亲水超滤膜及其成膜工艺,已通过实施例进行了描述,相关技术人员明显能在不脱离本发明的内容、精神和范围内对本文所述的内容进行改动或适当变更与组合来实现本发明。特别需要指出的是,所有相类似的替换和改动对本领域技术人员来说是显而易见的,他们都被视为包括在本发明的精神、范围和内容中。
本发明未尽事宜为公知技术。
- 还没有人留言评论。精彩留言会获得点赞!