一种快速合成纳米Fe3O4@NaA磁性功能吸附材料的方法与流程
本发明涉及fe3o4@naa磁性功能吸附材料合成技术领域,具体涉及一种快速合成纳米fe3o4@naa磁性功能吸附材料的方法。
背景技术:
naa是a型分子筛的一种。a型沸石分子筛是具有立方晶格的硅铝酸盐化合物,由硅氧四面体和铝氧四面体构成三维网络,在结构中有很多孔径均匀的孔道和排列整齐、比表面积较大的孔穴。这些孔穴能把比孔道直径小的分子吸附到内部中来,而把比孔道直径大的分子排斥在外,对性质不同的分子起到了筛分的作用。与其他分子筛相比,a型分子筛具有以下优点:(1)由于a型分子筛具有0.4nm的分子筛孔道,只允许nh3、h2o等尺寸较小的分子进入,因此对小分子或大分子具有很高的分离选择性;(2)由于a型分子筛具有低的硅铝比,晶体内表面具有很强的库仑场效应,具有强的亲水性能,由它构成的膜通过渗透汽化可以从高浓度的有机物中将水脱出,同时大小不同的分子也可以通过渗透汽化在膜上得到择形分离;(3)合成条件温和,避免了焙烧产生的缺陷,具有渗透性好、分离效率高等优点。
目前关于naa型分子筛合成的报道中大多采用水热晶化法,总结以前的各种合成方法,在合成过程中大多需要加入晶种、模板剂及催化剂来进行合成,且大多合成过程工艺复杂,晶化合成周期达5-15h,增加合成成本。
另外,现有技术的naa分子筛在进行污水处理后,naa分子筛与污水中的有机物或胶体仅为结合的状态,属于物理吸附,若不进行过滤的话,污水中还是存在有毒性的物质,而现有技术中并非所有的污水均能够进行过滤,例如湖泊中的污水,此时naa分子筛就无法与污水进行分离,此时污水中的有机物或胶体仍然积存于水体中,从而达不到提纯的目的,导致水体仍然处于污染状态。
技术实现要素:
为了解决现有技术中存在的不足,本发明提供的一种快速合成纳米fe3o4@naa磁性功能吸附材料的方法,本发明的磁性功能吸附材料fe3o4@naa制备过程中无需加入晶种及模板剂,同时本发明只需晶化3-4h即可合成,大大缩短了晶化时间,降低了分子筛的合成成本;且本发明制备得到的fe3o4@naa磁性功能吸附材料不仅具有naa的吸附作用,而且具有fe3o4的磁性功能,能够由污水中被带离出来,fe3o4@naa磁性功能吸附材料将分离回收作用与naa分子筛的催化性能集于一体,解决了分子筛的回收与重复利用的技术问题。
为解决上述技术问题,本发明采用如下技术方案:
一种快速合成纳米fe3o4@naa磁性功能吸附材料的方法,包括如下步骤:
(1)将称取的碱源溶解于去离子水中,待冷却至室温后加入铝源并混合均匀,并加热搅拌得到溶液a;
其中,碱源、铝源和去离子水的物质的量之比为1.8-2.2:0.9-1.2:3;
(4)称取纳米fe3o4,将纳米fe3o4加入氯仿中超声,直至得透明澄清的溶液b,再将溶液b加入至步骤(1)制备得到的溶液a中,得到反应凝胶c;
(5)称取硅源,将硅源加入至去离子水中,并搅拌均匀得到溶液d,然后在溶液d中加入步骤(2)制备得到的反应凝胶c,搅拌至形成反应凝胶e,然后将反应凝胶e加热晶化,再经抽滤、洗涤、干燥,得到磁性功能吸附材料fe3o4@naa;
其中,去离子水与步骤(1)的去离子水的质量比为1-2:3,硅源与碱源的物质的量之比为2:1,硅源与纳米fe3o4的质量比为1.53-12.24:100。
优选的,所述步骤(1)中的,铝盐为偏铝酸钠或硫酸铝,碱源为氢氧化钠或氢氧化钾。
优选的,所述步骤(3)中的硅源为硅溶胶或白炭黑。
优选的,所述步骤(1)中的加热搅拌条件为:先于室温下搅拌1-2h,然后升温至50-60℃继续搅拌4-6h。
优选的,所述步骤(2)中在200-300w条件下超声分散5-15min。
优选的,所述步骤(2)中纳米fe3o4的粒径为20-40nm。
优选的,所述步骤(3)中的搅拌时间为15分钟及以上。
优选的,所述步骤(3)中的晶化温度为80-90℃,晶化时间为3-4h。
优选的,所述步骤(3)中的干燥的条件为80-100℃干燥8-16h。
与现有技术相比,本发明的制备方法具有以下有益效果:
1、本发明提供的一种快速合成纳米fe3o4@naa磁性功能吸附材料的方法,具体公开了一种以硅溶胶为硅源,在无模板剂、无晶种、无添加剂条件下采用水热晶化法成功合成了结晶度较高的纳米fe3o4@naa磁性功能吸附材料,且本发明只需晶化3-4h即可合成,大大缩短了晶化时间,降低了分子筛的合成成本。
2、现有技术的naa分子筛在进行污水处理后,naa分子筛与污水中的有机物或胶体仅为结合的状态,属于物理吸附,若不进行过滤的话,污水中还是存在有毒性的物质,而现有技术中并非所有的污水均能够进行过滤,例如湖泊中的污水,此时naa分子筛就无法与污水进行分离,污水中的有机物或胶体仍然积存于水体中,从而达不到提纯的目的,导致水体仍然处于污染状态,本发明制备得到的fe3o4@naa磁性功能吸附材料不仅含有fe3o4的磁性功能,能够被磁铁由污水中带离出来,而且含有naa吸附材料,能够对污水中的胶体和有机物进行吸附,同时实现了晶化污水和与污水分离的技术目的。
3、本发明经过多次试验验证后得出:在50-60℃下搅拌4-6h的晶化条件下,得到的产物中na2o:sio2:al2o3:h2o的物质的量之比2:2:1:80为最优的配比,在na2o:sio2:al2o3:h2o的物质的量之比2:2:1:80的配比下能够以最快的速度合成纳米fe3o4@naa磁性功能吸附材料。
4、本发明在将吸附后的fe3o4@naa由污水中提出后,将fe3o4@naa进行升温,温度升高后的naa的孔道变大,使得吸附在naa中的胶体或有机物由naa分子筛中脱离出来,此时naa分子筛还可以投放至污水中,并对污水中的胶体或有机物进行二次吸附,从而实现了fe3o4@naa的重复利用,因此本发明制备得到的fe3o4@naa磁性功能吸附材料解决了现有技术的分子筛存在的无法回收与重复利用的技术难题。
附图说明
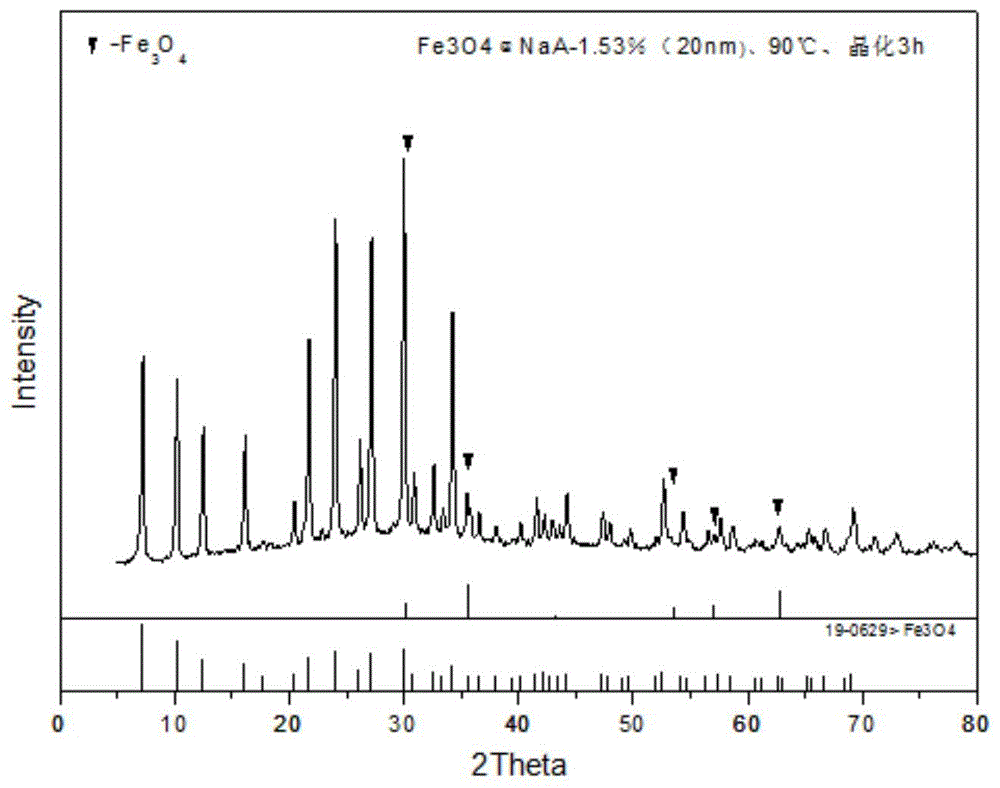
图1为本发明的实施例1所制备铁硅比为1.53:100所得fe3o4@naa磁性功能吸附材料的xrd图谱;
图2为本发明的实施例2所制备铁硅比为3.06:100所得fe3o4@naa磁性功能吸附材料的xrd图谱;
图3为本发明的实施例3所制备铁硅比为6.12:100所得fe3o4@naa磁性功能吸附材料的xrd图谱;
图4为本发明的实施例4所制备铁硅比为12.24:100所得fe3o4@naa磁性功能吸附材料的xrd图谱;
图5为本发明的实施例5所制备铁硅比为12.24:100所得fe3o4@naa磁性功能吸附材料的xrd图谱;
图6为本发明的晶化温度为90℃,晶化时间3h,铁制备铁硅比为1.53:100、3.06:100、6.12:100、12.24:100所得fe3o4@naa磁性功能吸附材料的磁性测试图。
具体实施方式
下面对发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。除非另有定义,下文中所用是的所有专业术语与本领域技术人员通常理解的含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。除非另有特别说明,本发明以下各实施例中用到的各种原料、试剂、仪器和设备均可通过市场购买得到或者通过现有方法制备得到,下面结合本发明实施例,用以较佳的实施例1-6及附图1-6配合详细的说明。
实施例1
一种快速合成纳米fe3o4@naa磁性功能吸附材料的方法,包括以下步骤:
分别称取1.69g氢氧化钠、15.22g去离子水、1.73g偏铝酸钠、1.27g硅溶胶、0.02g粒径为20nm的四氧化三铁、10ml氯仿;
(1)在10g去离子水加入1.69g氢氧化钠,待烧杯冷却,在搅拌的状态下加入1.73g偏铝酸钠,不断搅拌直至偏铝酸钠完全溶解,并用保鲜膜将装有混合液a的烧杯瓶口封住,放在机械搅拌器上室温下持续搅拌1h后升温至60℃搅拌4h,至溶液澄清,得到溶液a;
(2)将0.02g的粒径为20nm的纳米fe3o4溶解于10ml氯仿中,超声并搅拌5min,得溶液b;将溶液b加入溶液a中,得到反应凝胶c;
(3)将4.22g硅溶胶溶于5.22g去离子水中,并搅拌均匀得到溶液d,然后在溶液d中加入步骤(2)制备得到的反应凝胶c,搅拌至形成反应凝胶e,将搅拌磁子与反应凝胶e一起放入带有聚四氟乙烯内衬的不锈钢高压反应釜中后,将不锈钢高压反应釜拧紧,放入到干燥箱,在晶化温度为90℃的干燥箱中,晶化3h;晶化结束后,等反应釜冷却至室温,取出反应液,利用抽滤装置对反应液进行洗涤、抽滤,直至洗涤液达到中性,然后将抽滤后的样品放置恒温干燥箱内,在100℃下干燥12h,得到fe3o4@naa磁性功能吸附材料。
实施例2
本实施例明提供的一种快速合成纳米fe3o4@naa磁性功能吸附材料的方法,具体步骤与实施例1相同,不同之处仅在于所述步骤(1)中称取0.04g粒径为20nm的四氧化三铁,溶解于12ml氯仿中。
实施例3
本实施例明提供的一种快速合成纳米fe3o4@naa磁性功能吸附材料的方法,具体步骤与实施例1相同,不同之处仅在于所述步骤(1)中称取0.08g粒径为20nm的四氧化三铁,溶解于15ml氯仿中。
实施例4
本实施例明提供的一种快速合成纳米fe3o4@naa磁性功能吸附材料的方法,具体过程与实施例1相同,不同之处仅在于所述步骤(1)中称取0.16g粒径为20nm的四氧化三铁,溶解于28ml氯仿中。
实施例5
本实施例明提供的一种快速合成纳米fe3o4@naa磁性功能吸附材料的方法,具体过程与实施例4相同,不同之处仅在于所述步骤(4)中晶化温度为80℃,晶化时间为3h。
实施例6
一种快速合成纳米fe3o4@naa磁性功能吸附材料的方法,包括以下步骤:
分别称取1.8mol氢氧化钾、36mol去离子水、0.9mol硫酸铝、0.9mol白炭黑、0.018g粒径为30nm的四氧化三铁、12ml氯仿;
(1)在27mol去离子水加入1.8mol氢氧化钾,待烧杯冷却,在搅拌的状态下加入0.9mol硫酸铝,不断搅拌直至硫酸铝完全溶解,并用保鲜膜将装有混合液a的烧杯瓶口封住,放在机械搅拌器上室温下持续搅拌2h后升温至50℃搅拌6h,至溶液澄清,得到溶液a;
(2)将0.2g的粒径为30nm的纳米fe3o4溶解于12ml氯仿中,超声并搅拌15min,得溶液b;将溶液b加入溶液a中,得到反应凝胶c;
(3)将0.9mol白炭黑溶于9mol去离子水中,并搅拌均匀得到溶液d,然后在溶液d中加入步骤(2)制备得到的反应凝胶c,搅拌至形成反应凝胶e,将搅拌磁子与反应凝胶e一起放入带有聚四氟乙烯内衬的不锈钢高压反应釜中后,将不锈钢高压反应釜拧紧,放入到干燥箱,在晶化温度为80℃的干燥箱中,晶化4h;晶化结束后,等反应釜冷却至室温,取出反应液,利用抽滤装置对反应液进行洗涤、抽滤,直至洗涤液达到中性,然后将抽滤后的样品放置恒温干燥箱内,在80℃下干燥16h,得到fe3o4@naa磁性功能吸附材料。
本发明实施例1-实施例6制备得到的fe3o4@naa均具有优异的吸附性能和磁性,为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例1-5制备得到的fe3o4@naa磁性功能吸附材料使用的附图作简单地介绍。
一、对实施例1-5所制备的fe3o4@naa磁性功能吸附材料进行xrd表征分析:
图1是实施例1所制备铁硅比为1.53:100所得fe3o4@naa磁性功能吸附材料的xrd图谱。具体地,在干燥箱加热晶化的条件下,以偏铝酸钠为铝源,原料配比为2na2o:2sio2:al2o3:80h2o,晶化温度为90℃,3h所得样品xrd图。由图可知当90℃晶化3h时的xrd图与标准卡片xrd图基本一致,且未出现杂峰,表明本发明制备得到了fe3o4@naa磁性功能吸附材料。
图2是实施例2所制备铁硅比为3.06:100所得fe3o4@naa磁性功能吸附材料的xrd图谱。具体地,在干燥箱加热晶化的条件下,以偏铝酸钠为铝源,原料配比为2na2o:2sio2:al2o3:80h2o,晶化温度为90℃,3h所得样品xrd图。由图可知当90℃晶化3h时的xrd图中可以看出上方标有箭头的峰为fe3o4的出峰,而上方未标有箭头的峰为naa的出峰,且fe3o4未出现杂峰,表明本发明制备得到了fe3o4@naa磁性功能吸附材料。
图3是实施例3所制备铁硅比为6.12:100所得fe3o4@naa磁性功能吸附材料的xrd图谱。具体地,在干燥箱加热晶化的条件下,以偏铝酸钠为铝源,原料配比为2na2o:2sio2:al2o3:80h2o,晶化温度为90℃,3h所得样品xrd图。由图可知当90℃晶化3h时的xrd图与中可以看出上方标有箭头的峰为fe3o4的出峰,而上方未标有箭头的峰为naa的出峰,且fe3o4未出现杂峰,表明本发明制备得到了fe3o4@naa磁性功能吸附材料。
图4是实施例4所制备铁硅比为12.24:100所得fe3o4@naa磁性功能吸附材料的xrd图谱。具体地,在干燥箱加热晶化的条件下,以偏铝酸钠为铝源,原料配比为2na2o:2sio2:al2o3:80h2o,晶化温度为90℃,3h所得样品xrd图。由图可知当90℃晶化3h时的xrd图中可以看出上方标有箭头的峰为fe3o4的出峰,而上方未标有箭头的峰为naa的出峰,且fe3o4未出现杂峰,表明本发明制备得到了fe3o4@naa磁性功能吸附材料。
图5是实施例5所制备铁硅比为12.24:100所得fe3o4@naa磁性功能吸附材料的xrd图谱。具体地,在干燥箱加热晶化的条件下,以偏铝酸钠为铝源,原料配比为2na2o:2sio2:al2o3:80h2o,晶化温度为80℃,3h所得样品xrd图。由图可知当80℃晶化3h时的xrd图中可以看出上方标有箭头的峰为fe3o4的出峰,而上方未标有箭头的峰为naa的出峰,且fe3o4未出现杂峰,表明本发明制备得到了fe3o4@naa磁性功能吸附材料。
在干燥箱加热晶化的条件下,以偏铝酸钠为铝源,原料配比为2na2o:2sio2:al2o3:80h2o,图1-图5中都存在四氧化三铁的出峰,箭头表示四氧化三铁的主要衍射峰,且随实施例1-实施5中四氧化三铁的加入量逐渐增加,naa分子筛的衍射峰强逐渐减弱,四氧化三铁的衍射峰逐渐增强,说明四氧化三铁的加入抑制naa分子筛的生长,由图4可以看出,不仅含有四氧化三铁的主要衍射峰,而且含有naa的衍射峰,说明此时fe3o4@naa材料不仅含有fe3o4磁性材料,而且含有naa吸附材料,当四氧化三铁的加入量不小于0.02g,出现明显的本底上升现象,这是四氧化三铁导致的,图4与图5进行对比后,可以看出,实施例4的粒径为20nm的四氧化三铁颗粒在90℃下晶化3h比在80℃下晶化3h的naa峰出峰更加明显,此时naa的出峰较高,因此含量较高,naa的吸附性能较强,fe3o4@naa材料中的fe3o4的含量也较高,磁性较强,因此粒径为20nm的四氧化三铁在90℃下晶化3h得到的fe3o4@naa材料具有优异的吸附性能和磁性。
二、对实施例1-5所制备的fe3o4@naa磁性功能吸附材料进行磁性表征分析:
图6为晶化温度为90℃,晶化时间3h,铁制备铁硅比为1.53:100、3.06:100、6.12:100及12.24:100所得fe3o4@naa磁性功能吸附材料样品磁性测试图,fe3o4@naa磁性功能吸附材料的矫顽力以及比饱和磁化强度随着铁硅比的增加而增大,说明在逐渐增加fe3o4的量时,fe3o4@naa磁性功能材料中的fe3o4的含量逐渐增加,致使具有更加优异的磁性,且最后结果证明,在铁硅比为12.24:100的情况下,fe3o4@naa磁性功能吸附材料中不仅fe3o4具有优异的磁性性能,而且naa具有优异的吸附性能,而当铁硅比高于12.24:100的比例,fe3o4@naa磁性功能材料中的fe3o4的含量增大,naa的吸附性能变差,而当铁硅比低于12.24:100的比例,磁性功能材料中的fe3o4的含量低,在对污水处理后,对fe3o4@naa磁性功能材料通过磁性吸附的难度增加。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 还没有人留言评论。精彩留言会获得点赞!