一种外周血淋巴细胞微核的检测试剂盒及其检测方法与流程
本发明属于生物技术领域,具体涉及一种外周血淋巴细胞微核的检测试剂盒及其检测方法,特别涉及一种基于流式细胞仪检测外周血淋巴细胞微核的自动体外诊断试剂盒及其检测方法。
背景技术:
微核(micronucleus)形成的基础理论是正在复制的细胞由于出现染色体断裂或者纺锤装置功能异常而导致有丝分裂染色体分布紊乱,分裂后期这些染色体碎片或整条染色体遗留在细胞液中。目前,微核试验包括普通培养微核检测(MNT)和细胞胞质分裂阻滞微核检测(CBMNT)。
微核试验是遗传毒性试验的有效试验检测方法,其检测终点明确、计数简单、结果重复性好,可广泛的应用在不同的细胞类型且易于开展。微核试验为药品、食物添加剂、农药、化妆品等人们日常生活密切接触的化合物的安全性评价提供实验论据。同时在职业暴露人群遗传损害监测、工厂劳动者的职业微环境对健康的影响调查、接受化学疗法的患者的遗传损害调查、生态环境检测等方面广泛应用。常用两栖类和鱼类红细胞微核试验,对水生生态环境污染进行评价及监测,使用紫露草和蚕豆根尖微核试验对空气和水污染进行监测,人外周血淋巴细胞微核试验对放射工作人员进行健康监测等。
流式细胞术(flow cytometry,FCM)是20世纪60年代后期发展起来的一种在功能水平上对单细胞或其他生物粒子进行定量分析和分选的新技术。检测原理是荧光标记待测细胞并制成单细胞悬液,根据接收激光照射后液流内细胞的散色光信号和荧光信号分析细胞的物理化学特征,如细胞大小、被测细胞内部颗粒的信息等。
目前职业人群健康监护开展的微核检测项目是常规培养淋巴细胞微核试验。常规外周血淋巴细胞微核试验,步骤繁琐,包括外周血取样、接种、培养、制片、染色、镜检等步骤,采用人工制片、读片分析,容易受技术员主观因素、专业知识及经验的影响,同时工作量大。
技术实现要素:
本发明的一个目的是提供一种人外周血淋巴细胞微核的检测方法。
本发明提供的人外周血淋巴细胞微核的检测方法包括如下步骤:
(1)用红色荧光染料对离体的人外周血淋巴细胞进行染色,得到红色荧光染色后细胞;
(2)用裂解液对所述红色荧光染色后细胞进行一次裂解和染色,得到裂解和染色后细胞;
(3)流式细胞仪检测所述裂解和染色后细胞,根据荧光强度判断活细胞中含有微核的细胞;
所述裂解液中的溶质由氯化钠、柠檬酸钠、Triton X-114、Rnase和绿色荧光染料组成。
上述方法中,所述离体的人外周血淋巴细胞为用溶血素裂解全血培养物后得到的人外周血淋巴细胞;所述离体的人外周血淋巴细胞具体的获得方法如下:将待测人的外周血样本在淋巴细胞培养液中培养,将所述培养后细胞离心,弃上清液,收集沉淀;向所述沉淀中加入溶血素,裂解沉淀中的红细胞,离心,收集沉淀,即得到人外周血淋巴细胞。
上述方法中,所述红色荧光染料为EMA或7-AAD。
上述方法中,所述绿色荧光染料为DAPI、SYTOX Green或YO-PRO-1。
上述方法中,所述氯化钠、所述柠檬酸钠、所述Triton X-114、所述Rnase和所述绿色荧光染料的配比为(310-330)mg:(540-560)mg:(0.16-0.17)mg:0.688U:(4.2-4.5)mg。
上述方法中,所述红色荧光染料为EMA溶液。
上述方法中,所述绿色荧光染料为DAPI。
上述方法中,所述氯化钠、所述柠檬酸钠、所述Triton X-114、所述Rnase和所述DAPI的配比为321mg:550mg:0.165mg:0.688U:4.373mg。
上述方法中,
所述氯化钠在所述裂解液中的浓度为0.293-0.878mg/ml;
所述柠檬酸钠在所述裂解液中的浓度为0.588-1.176mg/ml;
所述Triton X-114在所述裂解液中的浓度为0.214-0.322μg/ml;
所述DAPI在所述裂解液中的浓度为0.2-0.5μg/ml;
所述RNase在所述裂解液中的浓度为1.0-1.5μg/ml;
所述EMA溶液中EMA的浓度为0.10-0.25mg/ml。
上述方法中,
所述氯化钠在所述裂解液中的浓度为0.579mg/ml;
所述柠檬酸钠在所述裂解液中的浓度为0.991mg/ml;
所述Triton X-114在所述裂解液中的浓度为0.297μg/ml;
所述DAPI在所述裂解液中的浓度为0.4μg/ml;
所述RNase在所述裂解液中的浓度为1.239μg/ml;
所述EMA溶液中EMA的浓度为0.125mg/ml。
本发明的另一个目的是提供一种用于检测人外周血淋巴细胞微核的试剂盒。
本发明提供的用于检测人外周血淋巴细胞微核的试剂盒,包括上述红色荧光染料、上述裂解液、溶血素和阳性标准品。
上述试剂盒中,所述阳性标准品的制备方法如下:取正常健康人外周血1ml,Co601Gy/s的剂量率进行辐照,辐照30s后,用淋巴细胞培养液培养72h,经低渗预固定后,得到辐照后的淋巴细胞,即为阳性标准品。
本发明的最后一个目的是提供上述方法或上述试剂盒的新用途。
本发明提供了上述方法或上述试剂盒在检测或辅助检测在人外周血淋巴细胞微核率中的应用。
本发明还提供了上述方法或上述试剂盒在检测和/或监护人群健康中的应用。
本发明的流式细胞仪的微核自动化检测能显著提高检测效率和通量,同时保证了分析结果的客观性。具体体现在:
1、流式体外微核检测最大的优势是检测速度快,能在短时间内完成多个样本的检测。流式完成一个试验样本仅需要2~3min,检测速度比人工读片快至少40~100倍;且较其他自动化检测方法如计算机图像分析系统、激光扫描细胞仪检测速度更快,能在极短的时间检测大量样品,节省早期化合物遗传毒性初筛的时间及人力。显微镜检测技术和图像分析技术一般检测1000~2000个细胞,而流式细胞仪能检测不少于5000个细胞,故流式适用于弱遗传毒性化合物及低剂量强微核诱导剂的微核检测。
2、数据的采集具有客观性。流式细胞仪检测通过设定阈值减少细胞碎片和其他小颗粒性物质的干扰,且操作者可以根据试验的具体情况调整阈值的大小。同时,可设置逻辑门选择分析的对象,排除其他不必要的干扰。
3、可减少试验室内或试验室间的差异。检测微核时,在同一实验室和不同的实验室之间采用相同的质控标准,通过调整光电倍增管电压使溶剂对照组细胞G1期核荧光信号出现在同一通道,从而保证试验的平行一致性;也可通过设置明确的荧光信号强度定义微核,保证不同实验室间微核检测区域一致而增加分析结果的客观性。
本发明针对现有的人淋巴细胞微核检测方法中存在的步骤繁琐,主观性强等问题,提供了一套诊断试剂以及利用流式细胞仪检测外周血淋巴细胞微核的方法,本发明的诊断试剂主要由溶血素、核酸染料、破膜试剂和阳性对照物组成。本发明利用溶血素裂解红细胞得到淋巴细胞,更加符合健康人群临床检测的实际需要,与分离淋巴细胞后培养,再检测微核相比,简化了试验步骤,节约了成本,降低了技术难度。本发明的人外周血淋巴细胞微核体外诊断试剂只需要一种裂解液和一次裂解,裂解后溶液澄清透亮。且本发明的裂解液中的DAPI可以染色活细胞,使得裂解和染色显得容易,提高了灵敏度。通过实验证明:本发明的人外周血淋巴细胞微核体外诊断试剂和方法快速、准确,在保证实验结果客观和真实的前提下,不仅降低了检测成本,而且实验还具有可重复性,可广泛应用于临床诊断监测健康人群的职业暴露遗传损伤,肿瘤病人康复检测遗传损伤和细胞遗传科学研究需要。
附图说明
图1为EMA染料和DAPI染料对正常细胞、微核细胞、坏死细胞和凋亡细胞的染色原理图。
图2为基于流式细胞仪利用本发明的试剂盒检测人外周血淋巴细胞微核的流程。
图3为以BD流式细胞仪的CellQuestTM为例,针对本发明的试剂盒流式检测模板。
图4为通过本试剂盒的流式细胞仪方法检测到的外周血细胞微核率与对照组(常规方法检测同一份标本)得到的外周血细胞微核率的比较。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的试剂和材料的购买厂家和货号如表1所示:
表1、试剂和材料的购买厂家和货号
下述实施例中的淋巴细胞培养液是将500ml RPMI1640细胞培养基、100μl青霉素-链霉素溶液(100×)和20mg植物血凝素(PHA,终浓度为40μg/mL)混匀得到的培养基,该培养基在发明专利授权公告号CN 103409370B中公开过。
实施例1、一种外周血淋巴细胞微核的检测试剂盒及其检测方法
一、外周血淋巴细胞微核的检测试剂盒及其检测方法
(一)外周血淋巴细胞微核的检测试剂盒
本发明的外周血淋巴细胞微核的检测试剂盒包括:溶血素、核酸染料、破膜试剂和阳性对照物。
1、溶血素
将10×溶血素用去离子水稀释成1×工作液(1×溶血素),按照200μl全血加入1ml工作液的量(即全血:1×工作液的体积比为1:5)裂解全血培养的红细胞。
2、核酸染料
为了区分坏死细胞、凋亡小体、碎片和微核,消除假阳性结果,本发明将溴化乙锭单氮化物(exponential moving average,EMA)作为坏死细胞的核酸试剂(坏死或凋亡细胞的细胞膜不完整,EMA即可进入细胞);将DAPI作为所有核酸物质的核酸染料,来对待检测淋巴细胞进行连续染色。其中,EMA染料可以通过坏死和凋亡的细胞膜对坏死细胞、凋亡细胞和细胞碎片进行染色,而DAPI利用低渗和离子去垢剂破膜,对所有的核酸物质均染色,从而使得坏死和凋亡的细胞与正常细胞和微核细胞呈现不同染色(实验原理如图1所示),最后通过圈门排除双染的细胞即可得到正常细胞和微核细胞,同时根据荧光信号的强弱即可判断主核和微核,并根据流式细胞仪提供的统计数据得出微核细胞率(‰)。
3、破膜试剂
本发明的破膜试剂为裂解液,裂解液的组成、浓度及用量如表2所示。
裂解液是将0.55ml的溶液Ⅰ、2.2μl的浓度为100μg/ml DAPI溶液(DAPI溶液的溶剂为1×PBS)(10×PBS用去离子水稀释成1×工作液(1×PBS))和2.75μl的浓度为250μg/ml的RNase溶液(RNase溶液的溶剂为1×PBS)混匀得到的溶液。其中,溶液Ⅰ是将氯化钠、柠檬酸钠和Triton X-114混匀后得到的溶液,各物质在溶液Ⅰ中的浓度分别为:0.584mg/ml氯化钠、1mg/ml柠檬酸钠、0.3μg/ml Triton X-114。
从另一个角度说,裂解液是由溶质和溶剂组成,溶剂为PBS,溶质由氯化钠、柠檬酸钠、Triton X-114、绿色荧光染料DAPI和RNase组成。各溶质在裂解液中的浓度如下:氯化钠在裂解液中的浓度为0.579mg/ml;柠檬酸钠在裂解液中的浓度为0.991mg/ml;Triton X-114在裂解液中浓度为0.297μg/ml;DAPI在裂解液中的浓度为0.4μg/ml;RNase在裂解液中的浓度为1.239μg/ml。
表2、各溶液的组成、浓度及用量
4、阳性对照
本发明试剂盒中的阳性对照标准品的制备方法如下:正常健康人外周血1ml,Co601Gy/s的剂量率进行辐照,辐照30s后,用淋巴细胞培养液培养72h,经低渗预固定后,得到辐照后的淋巴细胞(辐照后的淋巴细胞经过常规培养,制片,显微镜镜检的方法验证该细胞确实为含有微核的细胞)并将其作为阳性对照(阳性标准品)。辐照后的淋巴细胞非常适用于优化每天的FCM检测状态,即调节光电倍增管电压和荧光补偿等,从而降低实验室内外部FCM检测结果的差异。
(二)利用流式细胞仪检测外周血淋巴细胞微核的方法
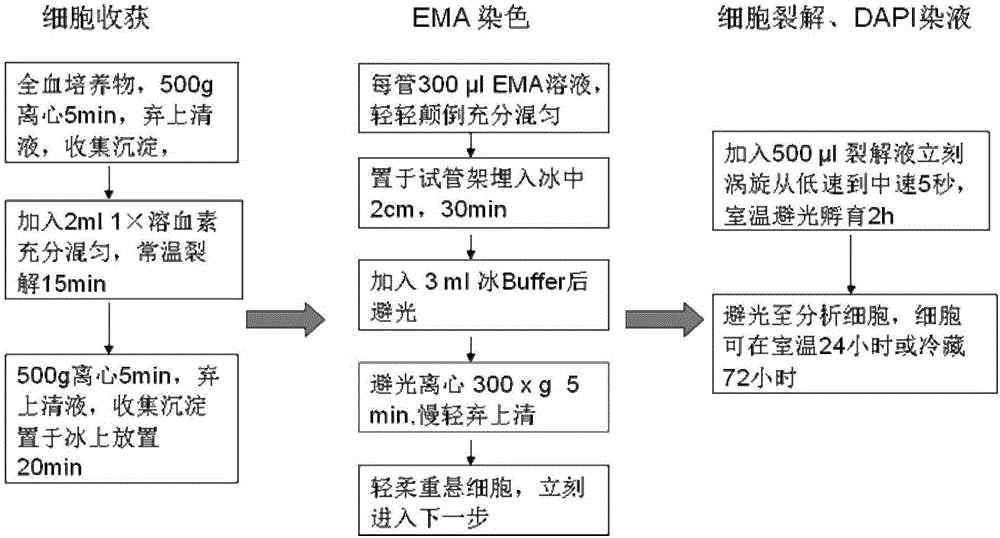
利用流式细胞仪检测外周血淋巴细胞微核的流程图如图2所示。具体步骤如下:
1、细胞培养与红细胞裂解
(1)将0.4ml肝素钠抗凝外周血样本(来源于深圳市职业病防治院健康监护科健康体检)加入4ml的淋巴细胞培养液中培养,37℃恒温培养箱培养68-72h,在培养结束前24h,加入不同浓度的丝裂霉素C,浓度分别为0μg/ml、0.03μg/ml、0.10μg/ml、0.50μg/ml和1.00μg/ml。
(2)将培养后的细胞转移到15ml离心管,500g离心5min,弃上清液,收集沉淀(约1ml),向沉淀中加入2ml 1×溶血素充分混匀,裂解全血培养的红细胞,常温裂解15min。
(3)500g离心5min,弃上清液,收集沉淀,得到外周血单个核细胞(PBMC)并将其置于冰上放置20min。
2、细胞EMA染色
(1)用300μl的EMA溶液对步骤1获得的沉淀进行染色,轻轻颠倒混匀,置于冰上EMA染色30min。
上述EMA溶液由溶剂和溶质组成的,溶剂为buffer溶液,EMA浓度为:0.125mg/ml。
上述Buffer溶液是将3.6ml ddH2O、0.4ml 10×PBS和0.08ml FBS混匀后得到的溶液。
(2)染色30min后,加入3ml的Buffer溶液,避光300g离心5min,弃上清液,收集沉淀,轻柔重悬细胞。
3、细胞裂解和DAPI染色
向步骤2获得的细胞中加入0.5ml裂解液,加入后立即涡旋(低速到中速5s),在室温下避光孵育2h,得到裂解后细胞,该步骤主要对细胞进行裂解并对细胞中的核酸物质进行染色。
4、细胞微核率的检测
流式细胞仪检测裂解后的细胞的微核率,首先通过FSC和SSC去除粘连体,然后剔除EMA染色的死细胞,再经过裂解、DAPI染色活细胞,最后根据荧光量的大小区分含有微核的细胞和正常细胞。流式细胞仪参数如表3所示,具体检测步骤如下:
(1)去除粘连体
调整裂解后的细胞浓度为5×106~1×107/ml后转移至流式管中,上样,调整电压,FSC,SSC画出待检测的外周血淋巴细胞群P1门,FL1-W(荧光峰宽度)去除粘连体,如图3-PlotA所示。
(2)去除死细胞、碎片和假阳性细胞
调整合适的FL1电压(DAPI)和定义合适的门(表3中的门P1),以排除死细胞、碎片和假阳性细胞(由于EMA染料可以通过坏死和凋亡的细胞膜对坏死细胞、凋亡细胞和细胞碎片进行染色,此处即去除EMA阳性细胞),并收获符合要求的活细胞(即DAPI阳性和EMA阴性的细胞),设置收获10000到20000个细胞核(DAPI阳性和EMA阴性的细胞核)。如图3-PlotB、PlotC、PlotD所示。
(3)获得微核细胞并计算细胞微核率
根据活细胞中荧光量的大小区分含有微核的细胞和正常细胞。分群划门,筛选出荧光强度与阳性标准品荧光强度相同的细胞为含有微核的细胞,并计算微核细胞率,微核细胞率为落在MN区域(图3-PlotE中的MN)的细胞数/细胞核区域(图3-PlotE中Nuclei)的细胞数×1000,其中,落在MN区域的细胞为活细胞中含有微核的细胞的个数,落在Nuclei区域的细胞为活细胞个数(DAPI阳性和EMA阴性的细胞个数)。
本发明的方法计算得到的微核细胞率如下:当丝裂霉素C浓度为0μg/ml时,微核率为2.55±0.26‰;当丝裂霉素C浓度为0.03μg/ml时,细胞微核率为6.98±0.51‰;当丝裂霉素C浓度为0.10μg/ml时,细胞微核率为11.85±0.80‰;当丝裂霉素C浓度为0.50μg/ml时,细胞微核率为9.07±0.42‰。
表3、流式细胞仪的参数
二、外周血淋巴细胞微核的常规检测方法
0.4ml肝素钠抗凝外周血加入4ml的淋巴细胞培养液的培养瓶中培养,37℃恒温培养箱培养68-72h,在培养结束前24h,加入不同浓度的丝裂霉素C,浓度分别为0μg/ml、0.03μg/ml、0.10μg/ml、0.50μg/ml和1.00μg/ml。分别经过低渗、固定、离心分离得到淋巴细胞(附:每份微核标本需固定液10ml,3%乙酸10ml),并计算微核率,微核率‰=(微核数/细胞核数)×1000。具体步骤如下:
1、配固定液(冰醋酸:甲醇=1:3)和3%乙酸(冰醋酸:双蒸水=3:97);
2、离心管编号,将0.4ml外周血与4ml淋巴细胞培养液混匀得到的淋巴细胞培养液全部倒入离心管,加0.075mol/L KCl低渗液4.5ml,打匀,静置约2-3min,加固定液1ml,打匀,1200转/min离心10min;
3、弃上清液,留底液约0.3ml,轻打匀,加3%乙酸9ml,打匀,室温静置约10min,1200转/min离心10min;
4、弃上清液,留底液约0.3ml,轻打匀,加固定液9ml,打匀,室温静置约30min,1200转/min离心10min;
5、弃上清液,留底液约0.2ml,轻打匀,滴片。
6、每块玻片需瑞氏-姬姆萨复合染液2.5ml,瑞氏-姬姆萨复合染液配制:每100ml磷酸缓冲液(0.067M KH2PO4与0.067M Na2HPO4按1:1配制)中加入姬姆萨原液5ml、瑞氏原液2.5ml。
上述常规方法计算得到的微核细胞率如下:当丝裂霉素C浓度为0μg/ml时,微核率为1.70±0.21‰;当丝裂霉素C浓度为0.03μg/ml时,细胞微核率为4.98±0.25‰;当丝裂霉素C浓度为0.10μg/ml时,细胞微核率为10.92±0.98‰;当丝裂霉素C浓度为0.50μg/ml时,细胞微核率为9.07±0.35‰。
三、微核检测效率
用Spss19.0软件对上述两种方法获得的微核细胞率进行t-test分析,配对t检验,结果表明本发明的方法和常规方法对同一样本的细胞微核率检测结果没有统计学差异(图4),本发明的流式检测微核细胞率的方法可以达到常规微核检测的水平。
- 还没有人留言评论。精彩留言会获得点赞!